Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.1 Lima jan./mar. 2019
http://dx.doi.org/10.15381/rivep.v30i1.15778
ARTÍCULO DE REVISIÓN
Actualización en dermatosis autoinmunes en caninos caracterizadas por pústulas, vesículas y ampollas: anatomopatología y diagnóstico
Update on autoimmune dermatoses in canines characterized by pustules, vesicles and blisters: anatomopathology and diagnosis
C. Sieben1,2,3, M.A. Machuca3, G. Broglia1, A.R. Massone3
1 Hospital Escuela, Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata, Argentina
2 Becario, Universidad Nacional de La Plata, Argentina
3 Laboratorio de Patología Especial Veterinaria DR. B. Epstein, Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata, Argentina
4 E-mail: csieben@fcv.unlp.edu.ar
RESUMEN
El objetivo de la presente revisión fue realizar una actualización sobre los aspectos clínicos, histopatológicos y patogenia de las dermatosis autoinmunes que afectan a los caninos y que se caracterizan por pústulas, vesículas y ampollas como lesión primaria. Se consideran los aspectos clínicos y las características histopatológicas de las enfermedades que componen el complejo pénfigo y las enfermedades ampollares subepidérmicas autoinmunes. Además, se describen las técnicas inmunológicas utilizadas en el diagnóstico y la caracterización de este grupo de enfermedades.
Palabras clave: canino; dermatosis autoinmunes; complejo pénfigo; enfermedades ampollares subepidérmicas autoinmunes; inmunodiagnóstico
ABSTRACT
The aim of this revision was to update the clinical, histopathological and pathogenic aspects of autoimmune dermatoses that affect canines and that are characterized by pustules, vesicles and blisters as the primary lesion. The clinical aspects and the histopathological features of the diseases that are part of the pemphigus complex and the autoimmune subepidermal bullous diseases are considered. In addition, immunological techniques used in the diagnosis and characterization of this group of diseases are described.
Keywords: canine; autoimmune dermatoses; pemphigus complex; autoimmune subepidermal blistering diseases; immunodiagnostic
INTRODUCCIÓN
Las dermatosis de origen inmune se dividen en dermatosis por hipersensibilidad, autoinmunes y otras enfermedades inmunes de etiología diversa. Las dermatosis autoinmunes se presentan cuando el sistema inmune no puede tolerarse a sí mismo (tolerancia inmunológica) y organiza una respuesta mediada por anticuerpos o linfocitos activados contra estructuras normales de la piel, generando daño (Miller et al., 2014). En el caso de las enfermedades inmunomediadas, el antígeno es ajeno al cuerpo, como sucede con fármacos, bacterias y virus que estimulan una reacción inmunológica (Miller et al., 2014).
Las enfermedades autoinmunes de la piel de caninos no son comunes y en la gran mayoría de los casos se desconoce el desencadenante de la producción de células T o B contra estructuras propias (autoantígenos) (Mauldin y Peters-Kennedy, 2016). Las dermatosis autoinmunes que presentan pústulas, vesículas y ampollas se dividen en dos grupos: el complejo pénfigo, integrado por el pénfigo foliáceo (PF), el pénfigo eritema-toso (PE), el pénfigo vulgar (PV) y el pénfigo paraneoplásico (PPN), y las denominadas enfermedades ampollares subepidérmicas autoinmunes (EASA), como el penfigoide bullosooampollar(PB),la epidermólisisbullosa adquirida (EBA), el penfigoide de las membranas mucosas (PMM), la epidermólisis ampollar de la unión (EAU) y la enfermedad IgA lineal (EAL) (Hargis y Myers, 2017).
ASPECTOS CLÍNICOS E HISTOPATOLÓGICOS
Complejo Pénfigo
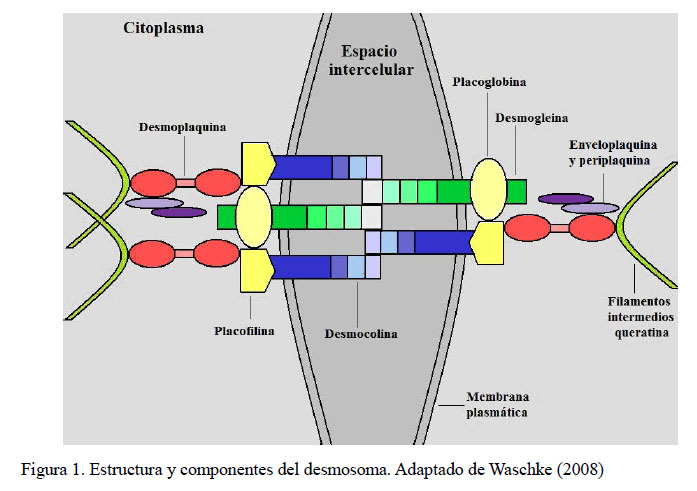
El complejo pénfigo abarca un grupo de enfermedades autoinmunes de la piel descrita en diversas especies (perro, gato, caballo, cabra, oveja, llama y mono), que se caracterizan por la pérdida de cohesión entre las células epidérmicas, fenómeno conocido como acantólisis (Burge et al., 1993; Gross et al., 2005; Peters et al., 2007; Hargis y Myers, 2017). Los desmosomas son estructuras intercelulares complejas fundamentales en la adhesión entre células y se encuentran en todos los epitelios (principalmente en epidermis e intestino) y también en el músculo cardíaco (Olivry y Linder, 2009; Ide et al., 2010). En el complejo pénfigo se observa una unión de autoanticuerpos (inmunoglobulinas) a los componentes del desmosoma, ocasionando su ruptura, dando lugar a la acantólisis y desorganización del citoesqueleto (Olivry y Linder, 2009).
Los desmosomas están formados por tres grandes familias de proteínas: las cadherinas transmembrana, las proteínas de la familia de armadillo y las plaquinas (Figura 1). Los miembros de la familia cadherina, las desmogleinas 1 a 4 (Dsg) y desmocolinas 1 a 3 (Dsc) son parte de la interfase adhesiva y sus colas citoplasmáticas proporcionan una plataforma de unión para la placoglobina (PG) y la placofilina (PFi), proteínas de la familia armadillo. Los miembros de la familia plaquinas, desmoplaquina 1 y 2 (DP), enveloplaquina (EP) y periplaquina (PP), se enlazan con los filamentos intermedios del citoesqueleto otorgándole mayor rigidez a la unión (Green y Simpson, 2007; Ellebrecht y Payne, 2014). En la patogenia del complejo pénfigo, la Dsg1, Dsg3 y Dsc1 son los principales autoantígenos. La Dsg1 y Dsc1 se encuentran en las capas más superficiales de la epidermis (estrato granuloso y espinoso), mientras que, la Dsg3 predomina en las capas basales y suprabasales de la epidermis (Miragliotta et al., 2005; Bizikova et al., 2012).
Se han descrito cuatro tipos de pénfigo en perros, los cuales se clasifican de acuerdo con las manifestaciones clínicas e histopatológicas en pénfigo foliáceo, pénfigo eritematoso, pénfigo vulgar y pénfigo paraneoplásico (Ide et al., 2010).
Pénfigo foliáceo
Es la enfermedad autoinmune más frecuente dentro del complejo pénfigo en caninos (Ihrke et al., 1985; Olivry, 2006, Olivry y Linder, 2009; Bizikova et al., 2012). Los primeros estudios reconocieron como antígeno a la Dsg1 (Olivry et al., 2006; Yabuzoe et al., 2009), posteriormente, en 2012 se propuso a la Dsc1 como el autoantígeno más importante en caninos con PF (Bizikova et al., 2012).
El PF presenta pústulas o vesiculopústulas que rápidamente evolucionan a erosiones y costras (Kuhl et al., 1994; Olivry y Linder, 2009; Miller et al., 2014). Las lesiones aparecen inicialmente en la región de la cara,principalmente en dorsal de la nariz, plano nasal, región infraorbitaria o bien periocular y pabellones auriculares (Ihrke et al., 1985; Olivry y Chan, 2001; Olivry, 2006). En estas áreas, la distribución es bilateral y simétrica (Ihrke et al., 1985; Olivry y Chan, 2001; Olivry, 2006; Olivry y Linder, 2009; Miller et al., 2014). En algunos casos se presenta una distribución generalizada, encontrándose lesiones en el cuerpo y en las almohadillas plantares (Ihrke et al., 1985; Olivry y Chan, 2001). Kawarai et al. (2015) describe un caso en el cual se asoció el cuadro clínico de PF con trombocitopenia inmunomediada.
Microscópicamente se observa acantólisis con presencia de pústulas y vesículas subcorneales, intragranulares o subgranulares (Olivry y Linder, 2009; Vaughan et al., 2010), tanto en la epidermis como en los folículos pilosos (Gross et al., 2005). En su interior, las pústulas, presentan principalmente neutrófilos y en menor cantidad eosinófilos. También se pueden observar grupos de células acantolíticas libres o adheridas a la pared de estas (Gross et al., 2005; Peters et al., 2007). Es frecuente encontrar abundantes neutrófilos en íntima relación con los queratinocitos acantolíticos, lo que sugiere que estos jugarían un papel auxiliar en la disociación de los queratinocitos (Yabuzoe et al., 2008). En dermis superficial se observa inflamación perivascular e intersticial acompañada de edema, ectasia vascular y congestión. El infiltrado inflamatorio está compuesto por neutrófilos y eosinófilos, que se entremezclan con un menor número de macrófagos, linfocitos y células plasmáticas (Gross et al., 2005).
Pénfigo eritematoso
El PE es una enfermedad cutánea que combina lesiones cutáneas pustulosas superficiales, similares a las del PF, con lesiones cutáneas nasales ulcerativas profundas que recuerdan a aquellas presentes en animales con lupus eritematoso discoide (LED) (Bhang et al., 2008; Olivry y Linder, 2009). El principal autoantígeno es la Dsg1 y secundariamente se reconoce a la PP (Olivry, 2006).
Las lesiones consisten en pústulas que evolucionan a úlceras, erosiones y costras. También pueden observarse áreas con despigmentación. La localización de las lesiones es en la cara, principalmente en la nariz y en los pabellones auriculares (Olivry, 2006; Bedolla et al., 2009; Miller et al., 2014).
Microscópicamente se observan pústulas acantolíticas neutrofílicas y eosinofílicas intragranulares y subcorneales en la piel, similares a las observadas en el PF. En la unión de la dermis con la epidermis se evidencia un infiltrado de células mononucleares, células plasmáticas, neutrófilos y eosinófilos, denominado dermatitis liquenoide de interfase. Esta lesión recuerda a las descriptas en el LED (Gonsalves-Hubers, 2005; Olivry, 2006).
Pénfigo vulgar
El PV es una enfermedad autoinmune severa y poco frecuente de la piel de caninos que se caracteriza por la formación de vesículas, ampollas y, posteriormente, úlceras en uniones mucocutáneas o exclusivamente en mucosas (Gross et al., 2005). En el PV de las mucosas, el autoantígeno es la Dsg3 (Olivry et al., 2003; Nishifuji et al., 2007), mientras que en el PV de ubicación mucocutáneo se ha detectado a la Dsg1 en combinación con Dsg3 (Nishifuji et al., 2007). Los autoanticuerpos en la epidermis o epitelio de la mucosa se unen a la Dsg3, originando acantólisis suprabasal (Gross et al., 2005). Otros autores citan también a la PG como participante en la formación de las lesiones (Caldelari et al., 2001).
Las lesiones primarias consisten en vesículas y ampollas que evolucionan rápidamente a erosiones y úlceras irregulares (Olivry y Linder, 2009). Las lesiones se presentan inicialmente en la mucosa oral y uniones mucocutáneas. También se han descrito lesiones en la región axilar e inguinal (Olivry y Linder, 2009; Miller et al., 2014). El lecho ungueal puede estar afectado presentando paroniquia ulcerativa y onicomadesis (Gross et al., 2005; Miller et al., 2014). En los animales afectados suele verse el signo de Nikolsky positivo (Olivry y Linder, 2009; Miller et al., 2014). Los pacientes con enfermedad severa pueden presentar signos sistémicos como letargia, anorexia y pérdida de peso (Olivry y Linder, 2009).
Microscópicamente, las lesiones más tempranas consisten en espongiosis epidérmica y vacuolización suprabasal (Olivry y Chan, 2001), mientras que las lesiones tardías se caracterizan por acantólisis suprabasal y la formación de vesículas suprabasales (Femiano, 2007) con células acantolíticas libres (Gross et al., 2005). Las células basales se mantienen unidas a la zona de membrana basal como una hilera de «lápidas» (Gross et al., 2005; Miller et al., 2014). La separación epitelial también puede producirse en el infundíbulo folicular y sus anexos glandulares (Olivry y Chan, 2001). Se describe, además, una forma alopécica, menos frecuente, donde la separación suprabasal se limita al istmo y segmentos inferiores del folículo piloso, sin que se observe acantólisis suprabasal de la epidermis (Olivry y Jackson, 2001a). El infiltrado inflamatorio en dermis puede ser perivascular superficial, intersticial o liquenoide (Olivry y Jackson, 2001b; Gross et al., 2005).
Pénfigo paraneoplásico
El PPN es una enfermedad autoinmune severa y poco frecuente, caracterizada por la formación de ampollas asociada a enfermedades neoplásicas (Olivry et al., 2000a; Elmore et al., 2005; Gross et al., 2005). Las pruebas inmunológicas revelan auto-anticuerpos IgG circulantes contra la Dsg3 y contra las plaquinas EP, PP y DP 1 y 2 (de Bruin et al., 1999; Elmore et al., 2005).
El PPN se caracteriza por la formación de ampollas y erosiones localizadas principalmente en las mucosas o uniones mucocutáneas (Olivry et al., 2000a). Los signos sistémicos consisten en hipertermia, letargia y depresión (Olivry y Linder, 2009). La literatura solo reporta tres casos en perros seniles con un timoma, un linfoma tímico metastático y un sarcoma indiferenciado (Olivry y Linder, 2009).
Microscópicamente, las lesiones de PPN exhiben una combinación de acantólisis suprabasal, como ocurre en el PV, y dermatitis de interfase con queratinocitos apoptóticos (Olivry et al., 2000a; Elmore et al., 2005). En menor medida, pústulas intraepidérmicas con queratinocitos libres como en el PF (Gross et al., 2005). La acantólisis no es siempre suprabasal como en el PV, sino que afecta también al estrato espinoso inferior, dejando múltiples capas de queratinocitos en el piso de la separación. Puede haber satelitosis linfocítica de los queratinocitos apoptóticos. La dermis contiene un infiltrado mononuclear mixto de linfocitos, macrófagos, células plasmáticas y neutrófilos (Gross et al., 2005).
Enfermedades Ampollares Subepidérmicas Autoinmunes
Las EASA son un grupo de enfermedades de la piel que afectan a diversas especies (caninos, felinos, equinos, porcinos y bovinos) y se encuentran asociadas con la presencia de autoanticuerpos dirigidos contra los componentes de la unión dermoepidérmica (unión D-E) (Favot et al., 2003). Abarca un grupo de entidades que muestran diferencias en los signos clínicos, características microscópicas y respuesta al tratamiento (Olivry y Dunston, 2010). En todas ellas se producen separaciones o hendiduras, dando lugar a la formación de vesículas o ampollas subepidérmicas (Miller et al., 2014).
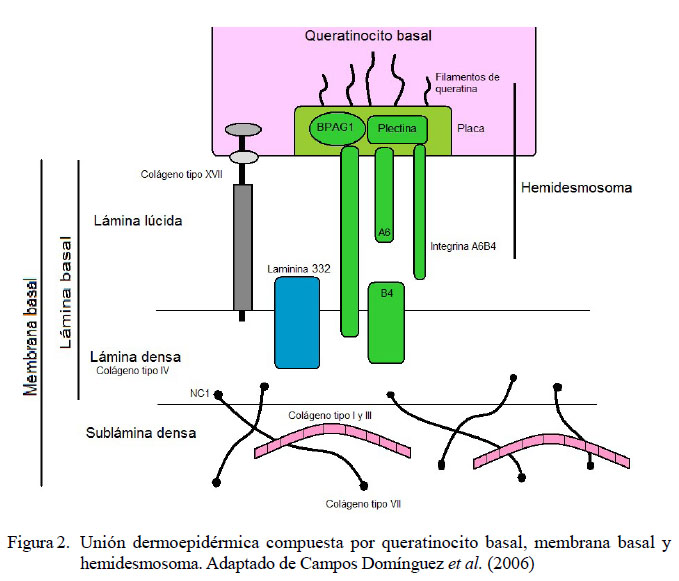
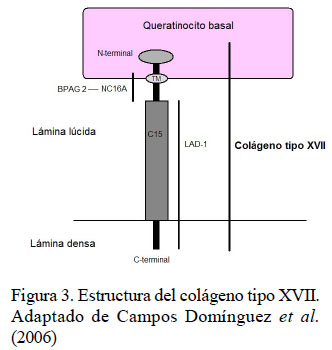
La unión D-E esta conformada por los queratinocitos basales, la membrana basal y sus estructuras de anclaje, los hemidesmosomas. Los queratinocitos basales presentan un citoesqueleto con filamentos intermedios de queratina que se conectan con la membrana basal a través de los hemidesmosomas. La membrana basal se subdivide en la lámina basal compuesta por la lámina lúcida y la lámina densa, conformada principalmente por laminina 332 y colágeno tipo IV y la sublámina densa que se localiza en la interfase entre la lámina densa y la dermis papilar. Contienen estructuras denominadas fibrillas y placas de anclaje junto a proteínas fibrilares dérmicas (colágeno tipo I, III y VII) (Figura 2). Los hemidesmosomas son estructuras con función de anclaje y señalización celular que están situados en la membrana plasmática basal de los queratinocitos basales. Las proteínas fundamentales del hemidesmosoma son colágeno XVII (Figura 3), plectina, antígeno penfigoide bulloso tipo 1 (BPAG1/BP230) e integrina α6β4 (Figura 2) (Campos Domínguez et al., 2006).
Dentro de este grupo de enfermedades se incluyen el penfigoide bulloso, la epidermólisis bullosa adquirida, el penfigoide de las membranas mucosas, la epidermólisis ampollar de la unión adquirida y la enfermedad IgA lineal.
Penfigoide bulloso o ampollar
El PB es un proceso autoinmune poco frecuente. Las lesiones consisten en vesículas y bullas, que progresan a erosiones, úlceras y costras (Iwasaki et al., 1995; Olivry y Chan, 2001). Se localizan en la cabeza, pabellones auriculares y región del dorso y, con menos frecuencia, en las mucosas o las uniones mucocutáneas. Las lesiones progresan y se produce la cicatrización, aunque con frecuencia, se desarrollan nuevas vesículas y ampollas dentro de la cicatriz (Gross et al., 2005). Los autoanticuerpos, en caninos, son IgG dirigidos contra el antígeno penfigoide bulloso 2 (BPAG2), sección extracelular no colágena (NC16A) del colágeno XVII (Figura 3) (Olivry et al., 2000b; Olivry y Chan, 2001; Miller et al., 2014).
Microscópicamente se observan pequeñas a grandes vesículas o bullas en la piel que desarrollan en la unión D-E con la consiguiente formación de hendiduras. Estas lesiones pueden extenderse al infundíbulo folicular (Gross et al., 2005). En el interior de la bulla se pueden observar abundantes eosinófilos y neutrófilos, a menudo mezclados con fibrina (Olivry y Chan, 2001; Gross et al., 2005). En estas lesiones no hay acantólisis. El infiltrado inflamatorio en dermis es mixto, compuesto por eosinófilos, neutrófilos y células mononucleares, variando desde leve a marcado, de ubicación perivascular y liquenoide respectivamente (Gross et al., 2005; Miller et al., 2014).
Epidermólisis bullosa o ampollar adquirida
La EBA al igual que otras EASA, fue clasificada como PB hasta 1995 (Hill et al., 2008). Se caracteriza por la formación de bullas asociadas con autoanticuerpos dirigidos contra el colágeno tipo VII (dominio amino-terminal no colágeno NC1), componente principal de las fibrillas de anclaje dérmico (Figura 2) (Bizikova et al., 2015).
En los caninos con EBA se pueden presentar de forma generalizada (más común) o localizada (un solo caso reportado) (Olivry y Chan, 2001; Gross et al., 2005). En la forma generalizada, hay placas eritematosas y ronchas ubicadas en la región de la cara, axilar, abdominal e inguinal. Estas lesiones progresan a vesículas que se rompen y provocan ulceración. Se observa, además, erosiones en la mucosa oral y en las uniones mucocutáneas (Olivry y Chan, 2001; Olivry y Jackson, 2001b; Gross et al., 2005). El cuadro se acompaña de hipertermia, letargo, y depresión (Olivry y Chan, 2001; Olivry y Jackson, 2001b). Presenta bacteriemia estafilocócica, anemia y trombocitopenia (Olivry y Chan, 2001; Miller et al., 2014). En la presentación localizada, las lesiones se limitan a la región de la cabeza y el dorso (Olivry y Chan, 2001; Olivry y Jackson, 2001b).
Las lesiones microscópicas de EBA son similares en ambas formas de la enfermedad. Hay presencia de bullas subepidérmicas grandes y planas que incluso pueden contener sangre (Bizikova et al., 2015). Los neutrófilos se acumulan a lo largo de la base o dentro de la separación (Gross et al., 2005). En las lesiones más antiguas de la epidermis se observan úlceras (Olivry y Chan, 2001). En la dermis, la inflamación es de leve a moderada con neutrófilos, eosinófilos y un menor número de linfocitos y células plasmáticas, ubicándose en la dermis superficial o perianexal (Gross et al., 2005).
Penfigoide de las membranas mucosas
El PMM, antes llamado penfigoide cicatricial, es una enfermedad ampollar poco frecuente, subepidérmica que afecta las membranas mucosas, uniones mucocutáneas y, con mucho menor frecuencia, zonas de piel con pelo. El antígeno principal es el BPAG2,adicionalmente BPAG1, integrina α6β4, laminina 332 y, raramente, el colágeno tipo VII (Figuras 2 y 3) (Olivry et al., 2002; Miller et al., 2014; Tham et al., 2016).
Las lesiones de PMM son vesículas, erosiones y úlceras que se ubican principalmente en la mucosa de la cavidad oral (encías, paladar duro y lengua) y uniones mucocutáneas de la nariz, de los párpados, de los conductos auditivos, del ano y de los genitales externos (Olivry et al. 2001; Olivry y Jackson, 2001b; Tham et al., 2016). Inicialmente, algunos pacientes con PMM pueden presentar despigmentación de las uniones mucosas (Olivry et al., 2001).
Microscópicamente, las vesículas se observan en la unión D-E debajo de la epidermis intacta, al igual que en PB. Las vesículas o ampollas se encuentran generalmente desprovistas de células inflamatorias. En la dermis superficial hay infiltración de neutrófilos, eosinófilos y, con menor frecuencia, linfocitos y células plasmáticas. La inflamación se vuelve liquenoide en lesiones crónicas (Gross et al., 2005).
Epidermólisis ampollar de la unión adquirida
Es una variante de la EASA descrita previamente. Se observan autoanticuerpos IgG contra laminina 332 (Figura 2). Se observan vesículas y úlceras ubicadas en la mucosa oral, en las regiones de los miembros torácicos y pelvianos, pabellones auriculares y región de la nariz.Al microscopio se observan vesículas que solo contienen eritrocitos e inflamación neutrofílica subepidérmica (Miller et al., 2014).
Enfermedad IgA lineal
La EAL es una dermatosis autoinmune ampollosa subepidérmica poco frecuente. Los autoanticuerpos IgG e IgA se dirigen contra el autoantígeno LAD-1, el segmento extracelular del colágeno de tipo XVII procesado (Figura 3) (Olivry et al., 2000b). Los caninos con EAL presentan lesiones ulcerativas en la mucosa oral, la región de la cara y en las almohadillas plantares (Olivry y Chan, 2001). Se afectan también zonas de fricción como la región axilar e inguinal (Gross et al., 2005).
En la evaluación microscópica se observan vesículas subepidérmicas, con ausencia de células inflamatorias o con escasos neutrófilos (Olivry y Chan, 2001) y, en ocasiones, presencia de exudado fibrinoso. La inflamación dérmica por debajo de las ampollas es leve e incluye neutrófilos, linfocitos, células plasmáticas y macrófagos (Gross et al., 2005).
DIAGNÓSTICO
Los criterios diagnósticos de las enfermedades que componen el complejo pénfigo se basan en la anamnesis, el examen clínico y la histopatología (Bedolla et al., 2009).Asimismo, la aplicación de las técnicas de inmunofluorescencia directa (IFD) e inmunohistoquímica (IHQ) son utilizadas en el diagnóstico de pacientes con pénfigo. La IFD y la IHQ permiten identificar depósitos intercelulares de IgG, IgM y, frecuentemente, la fracción C3 del complemento (Bedolla et al., 2009). La inmunomarcación permite identificar estos depósitos rodeando los queratinocitos de las diferentes capas de la epidermis e infundíbulo folicular, como así también en la zona de interfase entre la epidermis y la dermis (Shinya et al., 1996; Bedolla et al., 2009). En los pacientes con PF, los depósitos se ubican en los estratos superficiales de la epidermis. En el PV y PPN, los depósitos se encuentran rodeando a los queratinocitos de la capa basal de la epidermis. Finalmente, en el PE se presenta una combinación de depósitos en las capas superficiales de la epidermis y en la zona de interfase, siendo estas ubicaciones similares a las observadas en pacientes con PF y LED respectivamente. (Shinya et al., 1996; Bedolla et al., 2009).
La aplicación de técnicas de inmunofluorescencia indirecta (IFI) son utilizadas para la detección de autoanticuerpos circulantes, ya sea en queratinocitos provenientes de cultivos celulares o en diferentes sustratos como piel o mucosas normales. Se ha demostrado que la sensibilidad de la prueba varía según el sustrato utilizado (Iwasaki, 1996; Olivry et al., 2003, 2009; Honda et al., 2004; Yabuzoe, 2009). Otras técnicas, como los ensayos inmunoenzimáticos (ELISA) se utilizan para detectar IgG circulante frente a Dsg3 en caninos con PF, PV Y PPN (Nishifuji et al., 2009). Las técnicas de inmunoprecipitación, inmunoblot y western blot también han sido utilizadas en el diagnóstico de PF, PV y PPN (Elmore et al., 2005; Nishifuji et al., 2007, 2009).
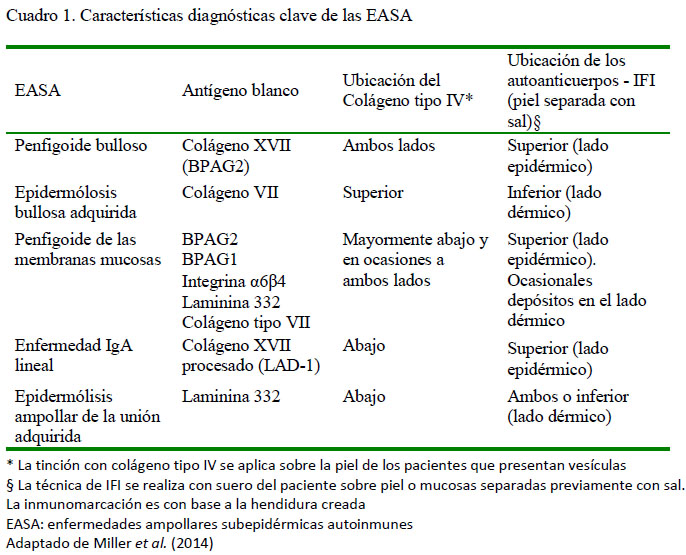
Para el diagnóstico de las EASA se utiliza la histopatología (Miller et al., 2014). Como técnicas complementarias se utiliza una técnica de IHQ que detecta la ubicación del colágeno tipo IV (Campos Domínguez et al., 2006). La inmunotinción del colágeno IV sobre la unión D-E debe realizarse sobre muestras de piel con lesiones vesiculares, pudiéndose visualizar el colágeno tipo IV en relación a la hendidura presente de manera de determinar el tipo de EASA presente (Campos Domínguez et al., 2006) (Cuadro 1).
Para la detección de uniones antígeno-anticuerpo pueden emplearse las técnicas de IFD e IHQ que ponen en evidencia depósitos de IgG, IgM o fracción C3 del complemento, los cuales tiene una distribución de tipo lineal en la unión D-E para todas las EASA (Iwasaki et al., 1995; Olivry et al., 1999; Favrot et al., 2003; Bizikova et al., 2015). Asimismo, en la EAL se observan depósitos de IgA (Olivry et al., 2000; Olivry y Chan, 2001). Otra técnica que puede utilizarse para la diferenciación de las EASA es la IFI sobre muestras de piel o mucosa normales sometidas a un tratamiento previo con sal (cloruro de sodio) lo que genera una hendidura artificial a nivel de la lámina lúcida (Cuadro 1). La técnica consiste en enfrentar el tejido con el suero problema a fin de poner en evidencia la localización de los depósitos de autoanticuerpos. Estos se van a unir a la parte superior (lado epidérmico y lámina lúcida), o a la parte inferior (lado dérmico y lámina densa), o bien combinados a ambos lados cuando hay varios antígenos presentes (Olivry et al., 2000; Hill et al., 2008; Olivry y Dunston, 2010; Miller et al., 2014). Por último, pueden detectarse autoanticuerpos no solo en piel, sino también en suero y orina, a través de técnicas de IFI, ELISA, immunoblot e inmunoprecipitación (Campos Domínguez et al., 2006). Las pruebas de anticuerpos antinucleares (ANA) y de Coombs también han sido utilizadas en el diagnóstico de EBA y LESA 1 (Olivry et al., 1999; Olivry et al., 2001).
Tradicionalmente, el diagnóstico de las enfermedades autoinmunes de la piel de caninos se ha realizado en base a los hallazgos clínicos e histopatológicos. En la actualidad y con el avance de la tecnología, nuevas técnicas inmunológicas permiten complementar el diagnóstico, y, en muchos casos, confirmarlo. La inmunodermatología ha experimentado, en los últimos años, un gran crecimiento. Se han logrado progresos relevantes en lo que se refiere a nuevos conocimientos y puesta a punto de técnicas de laboratorio cada vez más específicas. En Europa y EEUU se han logrado avances significativos en la patogenia y en el diagnóstico de las dermatosis autoinmunes por medio de la implementación de técnicas inmunológicas como la IFD y la IHQ y otras más complejas como la IFI, ELISA, inmunoprecipitación, inmunoblot y western blot. El uso de nuevas técnicas ha permitido reclasificar estas enfermedades que son histológicamente similares, pero que tienen una patogénesis diferente.
CONCLUSIONES
La presencia de lesiones como pústulas, vesículas y bullas, así como erosiones, úlceras y costras debe alertar al clínico sobre la posibilidad de estar frente a una dermatosis autoinmune. La primera aproximación al diagnóstico se realiza por medio de la histopatología. En las enfermedades que componen el complejo pénfigo, las pústulas y vesículas ubicadas en los diferentes estratos de la epidermis, junto a la presencia de acantólisis y queratinocitos acantolíticos, orientan hacia su diagnóstico. A diferencia de las enfermedades del complejo pénfigo, en las EASA es necesario contar con la presencia de vesículas y bullas a nivel de la unión D-E, encontrándose ausente la acantólisis y los queratinocitos acantolíticos. En la actualidad resulta indispensable la incorporación de técnicas inmunológicas que complementen el diagnóstico clínico e histopatológico con el fin de lograr una mejor clasificación y caracterización de este grupo de enfermedades, muchas veces, subdiagnosticadas. El uso de técnicas diagnósticas más complejas permite poner en evidencia cuales son los diferentes antígenos hacia los cuales se dirigen los autoanticuerpos propios de estas enfermedades.
LITERATURA CITADA
1. Bhang DH, Choi US, Jung YC, Kim MK, Choi EW, Seo KW, Kang MS, et al. 2008. Topical 0.03% tacrolimus for treatment of pemphigus erythematosus in a Korea Jindo dog. J Vet Med Sci 70: 415-417. doi: 10.1292/jvms.70.415 [ Links ]
2. Bedolla MA, Salas G, Constantino F. 2009. Diagnóstico inmunohistoquímico de dermatosis inmunomediadas en perros domésticos. Vet Méx 40: 181-189. [ Links ]
3. Bizikova P, Dean GA, Hashimoto T, Olivry T. 2012. Cloning and establishment of canine desmocollin-1 as a major autoantigen in canine pemphigus foliaceus. Vet Immunol Immunop 149: 197-207. doi: 10.1016/j.vetimm.2012.- 06.025 [ Links ]
4. Bizikova P, Linder KE, Wofford JA, Mamo LB, Dunston SM, Olivry T. 2015. Canine epidermolysis bullosa acquisita: a retrospective study of 20 cases. Vet Dermatol 26: 441-450. doi: 10.1111/vde.12255 [ Links ]
5. Burge SM, Wilson CL, Dean D, Wojnarowska F. 1993. An immunohistological study of desmosomal components in pemphigus. Brit J Dermatol 128: 363-370. doi: 10.1111/j.1365-2133.1993.- tb00192.x [ Links ]
6. Caldelari R, de Bruin A, Baumann D, Suter MM, Bierkamp C, Balmer V, Müller E. 2001. A central role for the armadillo protein plakoglobin in the autoimmune disease pemphigus vulgaris. J Cell Biol 153: 823-834. doi: 10.1083/ jcb.153.4.823 [ Links ]
7. Campos Domínguez M, Suárez R, Ochaita PL. 2006. Métodos diagnósticos en las enfermedades ampollosas subepidérmicas autoinmunes. Actas Dermosifiliogr 97: 485-502. doi: 10.1016/ S0001-7310(06)73450-0 [ Links ]
8. de Bruin A, Müller E, Wyder M, Anhalt GJ, Lemmens P, Suter MM. 1999. Periplakin and envoplakin are target antigens in canine and human paraneoplastic pemphigus. J Am Acad Dermatol 40: 682-685. doi: 10.1016/ S0190-9622(99)70147-7 [ Links ]
9. Ellebrecht CT, Payne AS. 2014. Plakop-hilins, desmogleins, and pemphigus: the tail wagging the dog. J Invest Dermatol 134: 874-876. doi: 10.1038/jid.2013.491 [ Links ]
10. Elmore SA, Basseches J, Anhalt GJ, Cullen JM, Olivry T. 2005. Paraneoplastic pemphigus in a dog with splenic sarcoma. Vet Pathol 42: 88-91. doi: 10.1354/vp.42-1-88 [ Links ]
11. Favrot C, Dunston SM, Paradis M, Olivry T. 2003. Isotype determination of circulating autoantibodies in canine autoimmune subepidermal blistering dermatoses. Vet Dermatol 14: 23-30. doi: 10.1046/j.1365-3164.2003.00320.x [ Links ]
12. Femiano F. 2007. Pemhpigus vulgaris: recent advances in our understanding of its pathogenesis. Minerva Stomatol 56: 215-223. [ Links ]
13. Gonsalves-Hubers T. 2005. Pemphigus erythematosus in a chow chow. Can Vet J 46: 925-927. [ Links ]
14. Green KJ, Simpson CL. 2007. Desmosomes: new perspectives on a classic. J Invest Dermatol 127: 2499-2515. doi: 10.1038/sj.jid.5701015 [ Links ]
15. Gross TL, Ihrke PJ, Walder EJ, Affolter VK. 2005. Skin diseases of the dog and cat. In: Clinical and histopathologic diagnosis. 2nd ed. Blackwell Publishing. p 13-43. [ Links ]
16. Hargis AM, Myers S. 2017. The integument. In: Zachary JF, McGavin MD (eds). Pathologic basis of veterinary disease. 6th ed. St. Louis, Missouri: Elsevier. p 1009-1146. [ Links ]
17. Hill PB, Boyer P, Lau P, Rybnicek J, Hargreaves J, Olivry T. 2008. Epidermolysis bullosa acquisita in a Great Dane. J Small Anim Pract 49: 89-94. doi: 10.1111/j.1748-5827.2007.00419.x [ Links ]
18. Honda R, Nishifuji K, Olivry T, White SD, Momoi Y, Iwasaki T. 2004. Detection of circulating autoantibodies using living keratinocyte staining on MCA-B1 method in dogs with pemphigus foliaceus. Res Vet Sci 77: 105-113. doi: 10.1016/j.rvsc.2004.03.009 [ Links ]
19. Ide K, Yamamoto W, Sato M, Yabuzoe A, Iwasaki T, Nishifuji K. 2010. Expression analysis of desmosomal components of the novel canine epidermal keratinocyte cell line (MSCEK). J Vet Med Sci 72: 1479-1482. doi: 10.1292/jvms.10-0089 [ Links ]
20. Ihrke PJ, Stannard AA, Ardans AA, Griffin CE. 1985. Pemphigus foliaceus in dogs: a review of 37 cases. J Am Vet Med Assoc 186: 59-66. [ Links ]
21. Iwasaki T, Olivry T, Lapiere JC, Chan LS, Peavey C, Liu YY, Jones JC, et al. 1995. Canine bullous pemphigoid (BP): identification of the 180-kd canine BP antigen by circulating autoantibodies. Vet Pathol 32: 387-393. doi: 10.1177/ 030098589503200407 [ Links ]
22. Iwasaki T, Shimizu M, Obata H, Ogata M, Nagata M, Yanai T, Kitagawa H, Sasaki Y. 1996. Effect of substrate on indirect immunofluorescence test for canine pemphigus foliaceus. Vet Pathol 33: 332-336. [ Links ]
23. Kawarai S, Hisasue M, Matsuura S, Ito T, Inoue Y, Neo S, Fujii Y, et al. 2015. Canine pemphigus foliaceus with concurrent immune-mediated thrombocytopenia. J Am Anim Hosp Assoc 51: 56-63. doi: 10.5326/JAAHA-MS-6044 [ Links ]
24. Kuhl KA, Shofer FS, Goldschmidt MH. 1994. Comparative histopathology of pemphigus foliaceus and superficial folliculitis in the dog. Vet Pathol 31:19- 27. doi: 10.1177/030098589403100103 [ Links ]
25. Mauldin EA, Peters-Kennedy J. 2016. Integumentary system. In: Jubb KVF, Kennedy PC, Palmer NC (eds). Pathology of domestic animals. 6th ed. St. Louis, Missouri: Elsevier. p 509-736. [ Links ]
26. Miller WH, Griffin CE, Campbell KL. 2014. Muller & Kirk: dermatología en pequeños animales. 3º ed. Buenos Aires: Intermédica. p 478-522. [ Links ]
27. Miragliotta V, Coli A, Ricciardi MP, Podesta A, Abramo F. 2005. Immunohistochemical analysis of the distribution of desmoglein 1 and 2 in the skin of dogs and cats. Am J Vet Res 66: 1931-1935. doi: 10.2460/ajvr.2005.- 66.1931 [ Links ]
28. Nishifuji K, Olivry T, Ishii K, Iwasaki T, Amangai M. 2007. IgG autoantibodies directed against desmoglein 3 cause dissociation of keratinocytes in canine pemphigus vulgaris and paraneoplastic pemphigus. Vet Immunol Immunop 117: 209-21. doi: 10.1016/j.vetimm.- 2007.02.004 [ Links ]
29. Nishifuji K, Tamura K, Konno H, Olivry T, Amagai M, Iwasaki T. 2009. Development of an enzyme-linked immunosorbent assay for detection of circulating IgG autoantibodies against canine desmoglein 3 in dogs with pemphigus. Vet Dermatol 20: 331-337. doi: 10.1111/j.1365-3164.2009.00806.x [ Links ]
30. Olivry T. 2006. A review of autoimmune skin diseases in domestic animals: I-superficial pemphigus. Vet Dermatol 17: 291-305. doi: 10.1111/j.1365- 3164.2006.00540.x [ Links ]
31. Olivry T, Chan LS, Xu L, Chace P, Dunston SM, Fahey M, Marinkovich MP. 1999. Novel feline autoimmune blistering disease resembling bullous pemphigoid in humans: IgG autoantibodies target the NC16A ectodomain of type XVII collagen (BP180/BPAG2). Vet Pathol 36: 328-335. doi: 10.1354/ vp.36-4-328 [ Links ]
32. Olivry T, Alhaidari Z, Ghohestani RF. 2000a. Anti-plakin and desmoglein autoantibodies in a dog with pemphigus vulgaris. Vet Pathol 37: 496-499. doi: 10.1354/vp.37-5-496 [ Links ]
33. Olivry T, Dunston SM, Fahey M, Nguyen N, Marinkovich MP. 2000b. Autoantibodies against the processed ectodomain of collagen XVII (BPAG2, BP180) define a canine homologue of linear IgA disease of humans. Vet Pathol 37: 302-309. doi: 10.1354/vp.37-4-302 [ Links ]
34. Olivry T, Chan LS. 2001. Autoimmune blistering dermatoses in domestic animals. Clin Dermatol 19: 750-760. doi: 10.1016/S0738-081X(00)00197-8 [ Links ]
35. Olivry T, Jackson HA. 2001a. An alopecic phenotype of canine pemphigus vulgaris? Brit J Dermatol 145:176-178. doi: 10.1046/j.1365-2133.2001.04311.x [ Links ]
36. Olivry T, Jackson HA. 2001b. Diagnosing new autoimmune blistering skin diseases of dogs and cats. Clin Tech Small An P 16: 225-229. doi: 10.1053/ svms.2001.26999 [ Links ]
37. Olivry T, Dunston SM, Schachter M, Xu L, Nguyen N, Marinkovich MP, Chan LS. 2001. A spontaneous canine model of mucous membrane (cicatricial) pemphigoid, an autoimmune blistering disease affecting mucosa and mucocutaneous junctions. J Autoimmun 16: 411-421. doi: 10.1006/jaut.2001.0510 [ Links ]
38. Olivry T, Dunston SM, Zhang G, Ghohestani RF. 2002. Laminin-5 is targeted by autoantibodies in feline mucous membrane (cicatricial) pemphigoid. Vet Immunol Immunop 88:123-129. doi: 10.1016/S0165-2427(02)00166-6 [ Links ]
39. Olivry T, Joubeh S, Dunston SM, Nishiyama T, Ghohestani RF. 2003. Desmoglein-3 is a target autoantigen in spontaneous canine pemphigus vulgaris. Exp Dermatol 12: 198-203. doi: 10.1046/ j.0906-6705.2002.072.x [ Links ]
40. Olivry T, LaVoy A, Dunston SM, Brown RS, Lennon EM, Warren SJ, Prisayanh P, et al. 2006. Desmoglein- 1 is a minor autoantigen in dogs with pemphigus foliaceus. Vet Immunol Immunop 110: 245-255. doi: 10.1016/ j.vetimm.2005.10.002 [ Links ]
41. Olivry T, Linder KE. 2009. Dermatoses affecting desmosomes in animals: a mechanistic review of acantholytic blistering skin diseases. Vet Dermatol 20: 313-326. doi: 10.1111/ j.1365-3164.2009.00821.x [ Links ]
42. Olivry T, Dunston SM, Walker RH, Alhaidari Z, Messinger L, Liu Z. 2009. Investigations on the nature and pathogenicity of circulating antikeratinocyte antibodies in dogs with pemphigus foliaceus. Vet Dermatol 20: 42-50. doi: 10.1111/j.1365-3164.2008.00723.x [ Links ]
43. Olivry T, Dunston SM. 2010. Usefulness of collagen IV immunostaining for diagnosis of canine epidermolysis bullosa acquisita. Vet Pathol 47: 565- 568. doi: 10.1177/0300985809359609 [ Links ]
44. Peters J, Scott DW, Erb HN, Miller WH. 2007. Comparative analysis of canine dermatophytosis and superficial pemphigus for the prevalence of dermatophytes and acantholytic keratinocytes: a histopathological and clinical retrospective study. Vet Dermatol 18: 234-240. doi: 10.1111/j.1365- 3164.2007.00599.x [ Links ]
45. Shinya K, Nomura K, Wada S, Morioka H, Umemura T. 1996. Pemphigus foliaceus with typical histological and immunohistological findings in a dog. J Vet Med Sci 58: 815- 817. doi: 10.1292/jvms.58.815 [ Links ]
46. Tham HL, Olivry T, Linder KE, Bizikova P. 2016. Mucous membrane pemphigoid in dogs: a retrospective study of 16 new cases. Vet Dermatol 27: 376- 394. doi: 10.1111/vde.12344 [ Links ]
47. Vaughan DF, Clay E, Hosgood GL, Bernstein JA. 2010. Clinical and histopathological features of pemphigus foliaceus with and without eosinophilic infiltrates: a retrospective evaluation of 40 dogs. Vet Dermatol 21:166-174. doi: 10.1111/j.1365-3164.2009.00775.x [ Links ]
48. Waschke J. 2008. The desmosome and pemphigus. Histochem Cell Biol 130: 21- 54. doi: 10.1007/s00418-008-0420-0 [ Links ]
49. Yabuzoe A, Nishifuji K, Sekiguchi M, Shimizu A, Momoi Y, Ishiko A, Iwasaki T. 2008. Neutrophils contact to plasma membrane of keratinocytes including desmosomal structure in canine pemphigus foliaceus. J Vet Med Sci 70: 807-812. doi: 10.1292/jvms.70.807 [ Links ]
50. Yabuzoe A, Shimizu A, Nishifuji K, Momoi Y, Ishiko A, Iwasaki T. 2009. Canine pemphigus foliaceus antigen is localized within desmosomes of keratinocyte. Vet Immunol Immunop 127: 57-64. doi: 10.1016/j.vetimm.2008.09.015 [ Links ]
Recibido: 10 de abril de 2018
Aceptado para publicación: 5 de enero de 2019