Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.2 Lima abr./jun. 2019
http://dx.doi.org/10.15381/rivep.v30i2.16132
ARTÍCULOS PRIMARIOS
Enterectomía yeyunal revestida con xenoinjerto de pericardio bovino en un modelo canino
Jejunal enterectomy covered with bovine pericardium xenograft in a canine model
Ceesar Nilthom Aguilar Guevara1,3, Gianfranco Espil Incil2, Natalia Soledad Gonzalez Gavidia2, Octavio Merino Minchán2, Cristina Tatiana García Barjoveanu1, Diego Pier Allcahuamán Matienzo1, Alfredo Delgado Castro1
1 Clínica de Animales Mayores, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
2 Laboratorio de Cirugía Veterinaria, Facultad de Ciencias Veterinarias, Universidad Nacional de Cajamarca, Perú
3 E-mail: ceniague@gmail.com
RESUMEN
El estudio tuvo como objetivo evaluar la alteración de los componentes celulares del lavado peritoneal y caracterizar la remodelación cicatricial, a nivel macro y microscópico, producida por el uso experimental del xenoinjerto de pericardio bovino (XPB) no tratado como revestimiento de la anastomosis término-terminal yeyunal en un modelo canino. Se trabajó con nueve caninos entre 4 y 6 años, de 15 a 30 kg de peso, sin discriminar por sexo. Se distribuyeron de forma aleatoria en tres grupos experimentales (A, B y C) de tres animales cada uno, a los que se les colocó un XPB no tratado como revestimiento de la enterectomía yeyunal. Se les realizó una segunda celiotomía a los 5, 10 y 30 días, respectivamente. Los resultados del análisis de los componentes celulares del fluido peritoneal evidenciaron un incremento significativo en linfocitos, macrófagos y eosinófilos a los 30 días del posoperatorio y en menor medida a los 10 y 5 días de la intervención. En la patología macroscópica, ninguno de los grupos denotó presencia de fugas, estenosis o abscesos, o signos de peritonitis ni se visualizó contracción o desplazamiento del XPB, pero fue evidente la adhesión del epiplón. La histopatología reveló una reacción a cuerpo extraño de mínima a moderada, pero totalmente compatible con la vida y casi superada a los 30 días del posoperatorio. Se concluye que la técnica de anastomosis término-terminal yeyunal en caninos revestida con XPB no tratado es viable y efectiva porque no genera infiltración celular severa frente a posibles antígenos celulares nocivos, ni procesos de calcificación; además, no altera las funciones de digestión, secreción y absorción intestinal.
Palabras clave: enterectomía; anastomosis yeyunal; xenoinjerto; pericardio bovino
ABSTRACT
The aim of this study was to evaluate the alteration of the cellular components of the peritoneal lavage and to characterize the cicatricial remodelling, at the macro and microscopic level, produced by the experimental use of bovine pericardium xenograft (XPB) not treated as a lining of the end to end-jejunal terminal anastomosis in a canine model. Nine canines between 4 and 6 years of age, 15-30 kg of weight, and both sexes were randomly distributed in three experimental groups (A, B and C) of three animals each, to which an untreated XPB was placed as a lining of the jejunal enterectomy. Each group underwent a second celiotomyat 5, 10 and 30 days post-surgery, respectively. The results of the analysis of the cellular components of the peritoneal fluid showed a significant increase in lymphocytes, macrophages and eosinophils 30 days after the surgery and to a lesser extent 10 and 5 days after the intervention. In the macroscopic pathology, none of the groups denoted the presence of leakage, stenosis, abscesses or signs of peritonitis, nor was visualization of contraction or displacement of the XPB, but adhesion of the omentum was evident. The histopathology revealed a reaction to a foreign body of minimal to moderate, but totally compatible with life and almost surpassed 30 days after the surgery. It is concluded that the technique of jejunal anastomosis in canines coated with untreated XPB is viable and effective because it does not generate severe cellular infiltration against possible harmful cellular antigens or calcification processes. In addition, it does not alter the functions of intestinal digestion, secretion and absorption.
Key words: enterectomy; jejunal anastomosis; xenograft; bovine pericardium
INTRODUCCIÓN
La cirugía del intestino delgado está indicada en casos de obstrucciones gastrointestinales, traumatismos, perforación, isquemia, posición anómala e infecciones (Fossum, 2012). Las fallas anastomóticas provocan complicaciones importantes tras una cirugía intestinal, entre las que se consideran las dehiscencias, fugas, fístulas y adherencias (Cueto et al., 2014; Testini et al., 2014). Una condición comúnmente diagnosticada y potencialmente mortal es la peritonitis séptica secundaria a la dehiscencia de la sutura, que ocurre entre los 3 y 6 días posteriores a la cirugía (Nelson y Couto, 2010; Thomovsky et al., 2014).
El diagnóstico citológico de la peritonitis séptica se basa en la identificación de neutrófilos tóxicos con bacterias intracelulares (Al-Rukibat et al., 2006), pero la falta de valores de referencia de líquido peritoneal posoperatorio hace difícil la interpretación de los resultados, dado que varían con el tipo y condiciones de la intervención quirúrgica (Nazifi et al., 2000). Así mismo, la evaluación del líquido peritoneal ayuda a diagnosticar la complicación posoperatoria antes de comprometer la vida del animal (Seabaugh et al., 2014).
Desde la década de 1970, el pericardio bovino ha sido uno de los materiales empleados para la fabricación de bioprótesis (Polak y Pitombo, 2011), el cual es tratado con glutaraldehído para eliminar células mesoteliales (Gauvin et al., 2013) y evitar el trasplante de proteínas o ADN en el receptor (Alves et al., 2010; Li et al., 2014). Sin embargo, se han reportado residuos citotóxicos que inducen la calcificación de las bioprótesis (Abolhoda et al., 1996). El pericardio bovino tiene buena aceptación en diferentes zonas anatómicas (Rendón et al., 2007; Gauvin et al., 2013). Debido a su fácil preparación y uso, se ha empleado para reparar defectos herniarios en diafragma, pared abdominal y pared torácica, así como en cirugía vascular; sin embargo, puede causar reacción de rechazo de tipo cuerpo extraño (Pérez et al., 2005).
El uso de la matriz de colágeno derivado del pericardio bovino como material de refuerzo para anastomosis colorrectales son seguras en caninos y puede ser beneficioso para disminuir las fallas en la línea de grapado (Cheung et al., 2015; Hagerman et al., 2007). Los datos experimentales muestran que las anastomosis mecánicas reforzadas con parche de pericardio bovino o submucosa del intestino delgado tienen mayor resistencia en comparación con las anastomosis no reforzadas, y han demostrado una mejoría en la cicatrización (Testini et al., 2014). El objetivo del presente estudio fue usar experimentalmente el xenoinjerto de pericardio bovino no tratado, como revestimiento de la línea de sutura de la anastomosis término-terminal yeyunal en un modelo canino, para evaluar la alteración de los componentes celulares del lavado peritoneal y caracterizar la reparación cicatricial macro y microscópica.
MATERIALES Y MÉTODOS
Se trabajó con nueve caninos mestizos callejeros, de ambos sexos, procedentes del Centro de Control de Zoonosis de la ciudad de Cajamarca, Perú, condenados a eutanasia, y clasificados como pacientes ASA 1, según los criterios de la Asociación Americana de Anestesiología (Jakobsson, 2015), conedadesde 4a6 añosypesode 15 a30kg. Se distribuyeron de forma aleatoria en tres grupos (A=3 para re-celiotomía a 5 días posoperatorio; B=3 para re-celiotomía a 10 días posoperatorio; C=3 para re-celiotomía a 30 días posoperatorio), a los que se les colocó un xenoinjerto de pericardio bovino (XPB) no tratado como revestimiento de la enterectomía yeyunal. Todos los caninos fueron desparasitados con praziquantel a dosis de 10 mg/kg p.v. 15 días antes de la intervención quirúrgica. La ingesta de alimentos sólidos y líquidos fue restringida 18 y 2 horas, respectivamente, antes de la inducción anestésica.
El presente estudio respetó los principios internacionales para la investigación biomédica que implican el uso de animales, aprobado por el Consejo de Organizaciones Internacionales de las Ciencias Médicas en Ginebra, 1985. El presente estudio tuvo como finalidad mejorar la salud y bienestar del hombre y de los animales usando un modelo animal canino, por lo que tuvo la necesidad de recurrir a la experimentación en animales vivos, no siendo posible su simulación in vitro.
Pericardio Bovino
El pericardio bovino fue recogido directamente de un centro de beneficio de bovinos. Los animales donantes tenían menos de seis años. Se realizó un recorte del pericardio con tijeras estériles, el cual se introdujo en un recipiente con suero fisiológico al 0.9% a temperatura ambiente (14 °C aproximadamente) (Aguilar et al., 2018).
Estrategia Anestésica
Se colocó una vía intravenosa (IV) de NaCl al 0.9% para la perfusión de los fármacos. La premedicación se realizó con ceftriaxona (30 mg/kg IV), acepromazina (0.03 mg/kg IV) y Tramadol (2 mg/kg IV). Para la inducción se utilizó diazepam (0.25 mg/kg IV) y ketamina (15 mg/kg IV). El mantenimiento anestésico se realizó mediante isoflurano en dosis de 1.4% de concentración alveolar mínima (CAM) en promedio.
Técnica Quirúrgica
El procedimiento se inició con una celiotomía, realizando una incisión de aproximadamente 5 cm de largo en la línea alba, a la altura del ombligo, evitando en todo momento el ingreso de sangre a la cavidad peritoneal. Posteriormente, se procedió a tomar la primera muestra de lavado intraperitoneal colocando 5 ml de suero fisiológico dentro de la cavidad abdominal con una jeringa estéril y con movimientos desde el exterior del abdomen se logró que este tome contacto con las paredes mesoteliales, colectándose luego con una jeringa de tuberculina estéril sin aguja y almacenado en un tubo con EDTA.
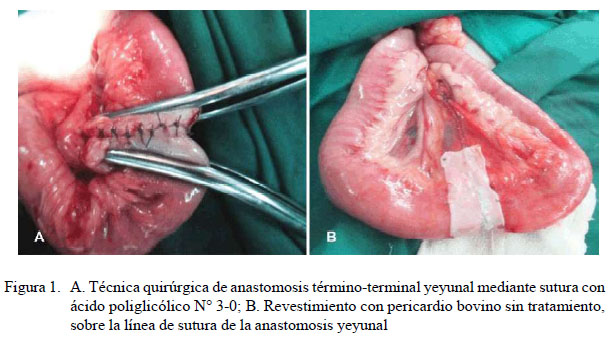
Luego de obtener la muestra, la cavidad abdominal fue inspeccionada para descartar patologías macroscópicas que pudieran alterar el desarrollo del estudio. Se exteriorizó un segmento del yeyuno y se procedió a la resección y posterior anastomosis término-terminal con sutura simple discontinua (Fossum, 2012). Se revistió la línea de sutura con un XPB, según lo descrito por Testini et al. (2014), pero con la variante de que el injerto no recibió tratamiento previo. Para esto, se hizo el recorte de un segmento de pericardio de 2 cm de ancho (Figura 1A) y de un largo correspondiente a la totalidad de la línea de sutura anastomótica. Al colocar el xenoinjerto se consideró que la serosa del intestino se encuentre en contacto con la cara externa del pericardio, fijándolo con material de sutura absorbible (ácido poliglicólico N° 3-0), según lo descrito por Aguilar et al. (2018). Finalmente, se recolocó el intestino intervenido para cerrar la cavidad abdominal según procedimientos estándares.
Posterior a la cirugía, se realizó la antibioticoterapia usando ceftriaxona en dosis de 30 mg/kg cada 12 horas por 3 días (Madison et al., 2008) en combinación con enrofloxacina por 3 días en dosis de 10 mg/kg p.v. cada 24 horas. La analgesia se logró mediante la aplicación de parches de fentanilo epidérmicos en dosis de 4 µg/kg/24 h. Se ofrecieron pequeños volúmenes de agua entre las 8 y 12 horas posteriores a la cirugía y alimento licuado entre las 12 a 24 horas. Se reintrodujeron a la dieta habitual de modo gradual entre las 48-72 horas después de la cirugía.
Toma de Muestras
En los días posteriores (5, 10 y 30 días para los grupos A, B y C, respectivamente) se realizó una re-celiotomía para evaluar macroscópicamente la cavidad abdominal, tomar una segunda muestra de lavado intraperitoneal y una muestra de intestino para histopatología. Para ello se tomaron las mismas precauciones de ayuno y restricción de agua, así como la misma estrategia anestésica y de abordaje quirúrgico. El lavado intraperitoneal se realizó usando la técnica descrita previamente. Las muestras histopatológicas se obtuvieron re-seccionando en su totalidad la zona anastomótica revestida con pericardio bovino, obteniendo de esta manera porciones de 4-5 cm de intestino que se fijaron con formaldehido al 10%. Los caninos fueron dados en adopción después de una nueva enterectomía y un periodo propicio de convalecencia.
Análisis de las Muestras
Se realizó la caracterización de las propiedades organolépticas de color, turbidez y olor del líquido peritoneal, según lo reportado por Sirois (2015). Para la evaluación microscópica se usó un analizador automatizado Rayto RT-7600S para hematología de 23 parámetros, para el recuento de células nucleadas. Asimismo, se analizaron los valores relativos (%) de cada componente celular obtenido a través del lavado peritoneal y se hizo una comparación por pares.
Análisis de Datos
Los datos se analizaron relacionando el recuento celular del líquido peritoneal de las muestras preoperatorias y postoperatorias en los grupos A, B y C, tomando el criterio de evaluación de Al-Rukibat et al. (2006) y de Sirois (2015). Los resultados del recuento celular fueron procesados con base a la comparación por pares dentro del análisis de varianza factorial para medidas repetidas empleando el programa estadístico SPSS v. 22, tomando el ajuste de Bonferroni (p<0.05).
RESULTADOS
Las muestras de lavado peritoneal pre y posquirúrgicas evidenciaron un rango de color que va desde rosado a rojizo claro. El color del fluido obtenido a los 5, 10 y 30 días (grupos A, B y C) del posquirúrgico no denotó cambios macroscópicos importantes; sin embargo, cabe resaltar que un canino del grupo C mostró un color rojo más oscuro frente a las demás muestras.
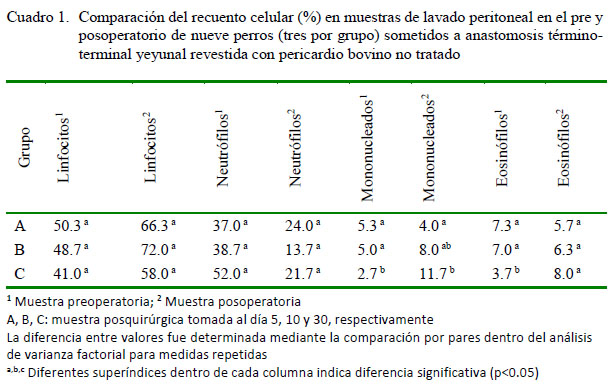
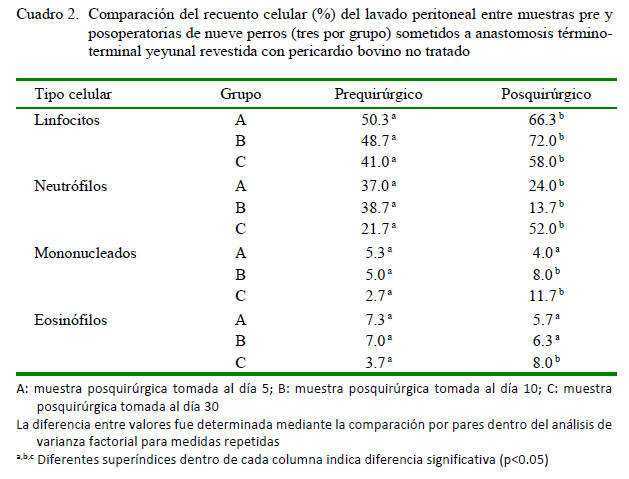
Los valores relativos (%) de cada componente celular obtenidos mediante el lavado peritoneal por grupo de estudio se presentan en el Cuadro 1 y según el momento de la cirugía en el Cuadro 2. No se analizó el recuento total de células nucleadas (RTCN) del lavado peritoneal debido a la dilución no controlada, propia de la metodología de muestreo.
No se encontraron diferencias estadísticamente significativas en la concentración de linfocitos y neutrófilos segmentados abastonados en las muestras preoperatorias (obtenidas a la hora cero del estudio) entre los grupos experimentales (A, B y C); lo que indica que los pacientes que participaron en los tres grupos tenían el mismo estándar celular al lavado peritoneal. Estos resultados fueron la base para evaluar los cambios producidos por la intervención quirúrgica propuesta para el presente estudio. Así mismo, en el posoperatorio, después de considerar los tiempos de muestreo, tampoco se encontraron diferencias significativas entre los grupos experimentales A, B y C, aunque con resultados incrementados respecto a los valores iniciales; excepto a nivel neutrófilos, que expresaron una tendencia a disminuir. Estos resultados demuestran que existe una repercusión de la celiotomía y de la técnica quirúrgica en los componentes celulares del fluido peritoneal.
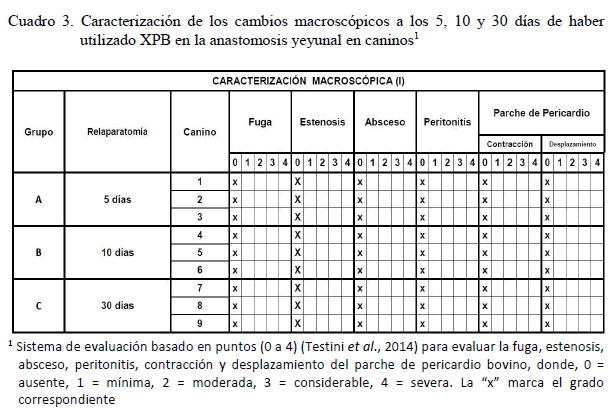
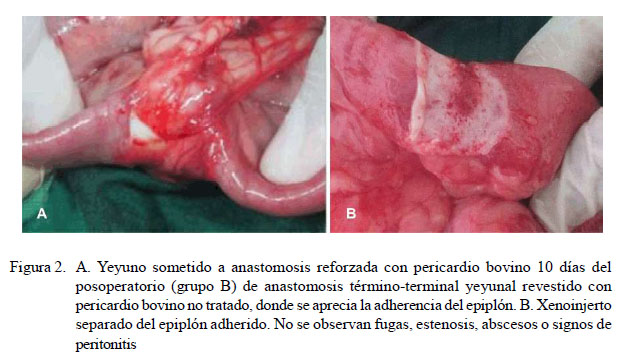
En ninguno de los casos se observó presencia de fugas, estenosis o abscesos en la línea de sutura anastomótica, así como signos de peritonitis, ni se visualizó contracción o desplazamiento del XPB (Cuadro 3). Por otro lado, fue evidente la adherencia del epiplón al xenoinjerto (Figura 2A).
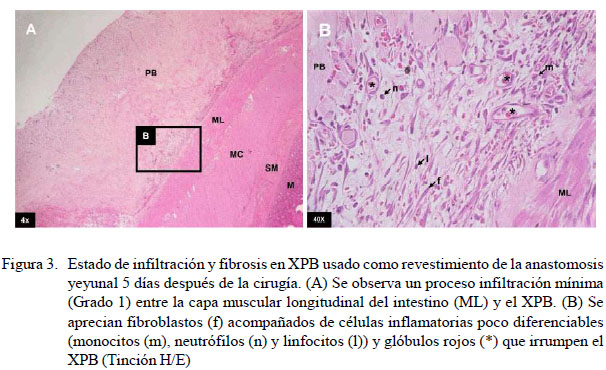
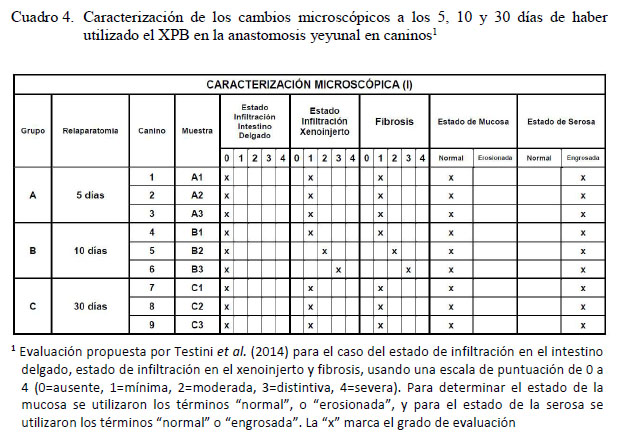
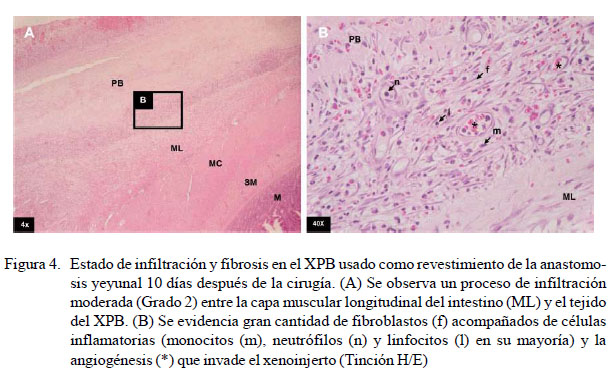
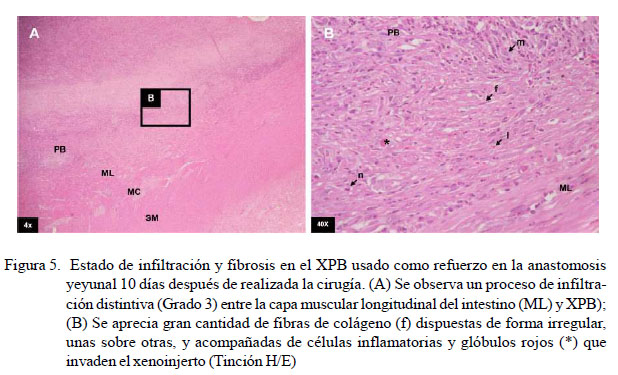
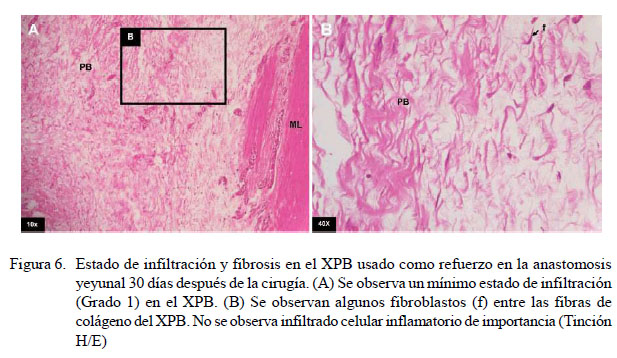
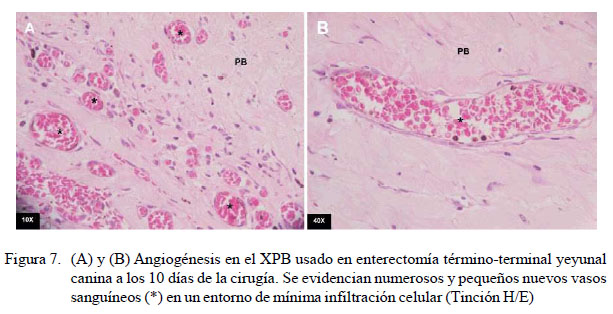
No se encontró infiltración celular en la pared intestinal en ninguno de los nueve caninos a la evaluación microscópica. En el xenoinjerto se evidenció mínima infiltración celular y fibrosis en el grupo A sometido a una segunda celiotomía 5 días posoperatorio (Figura 3). En el grupo B, los resultados fueron variables, observándose mínima, moderada y distintiva infiltración celular y fibrosis (Cuadro 4) (Figuras 4 y 5). En el grupo C, la infiltración celular y fibrosis fue mínima (Figura 6). Por otro lado, el estado de la mucosa fue normal en todos los pacientes, pero la serosa se notó fusionada al xenoinjerto por lo que se puede decir que estuvo engrosada en todos los casos, con angiogénesis evidente (Figura 7).
Se obtuvo un grado mínimo de infiltración celular en el XPB en el grupo A, conformado por polimorfonucleares que empiezan a rodear e invadir las fibras gruesas de colágeno del pericardio bovino, empezando de esta manera un proceso de cicatrización caracterizado por inflamación y fibrosis, con neoformación de vasos sanguíneos en la zona correspondiente a la unión entre el pericardio bovino y el tejido muscular del intestino.
En el grupo correspondiente a la celiotomía de 10 días posoperatorio, en el primer canino se pudo apreciar fibrosis e infiltración celular mínima (Grado 1) con las mismas características descritas anteriormente. Sin embargo, en el caso del segundo canino, se observó un moderado infiltrado celular inflamatorio (Grado 2), sobresaliendo una mayor cantidad de fibroblastos, pudiéndose apreciar que el tejido de granulación ocupa más espacio y con mayor cantidad de células polimorfonucleares invadiendo al XPB desde la periferia hacia el centro de este. En el tercer canino, se observó una distintiva infiltración celular y fibrosis (Grado 3) en el XPB, en su mayoría linfocitos, monocitos y neutrófilos, con una disposición irregular de fibroblastos y fibras de colágeno que irrumpen al xenoinjerto. Por tanto, a los 10 días de realizada la cirugía se presentó el mayor pico inflamatorio sobre el XPB, el cual se presenta de forma variable y que es superado satisfactoriamente a los 30 días de la cirugía.
Las muestras correspondientes al grupo C evidenciaron una mínima infiltración de polimorfonucleares y de algunos fibroblastos en el xenoinjerto (Grado 1), pudiendo diferenciarse dos estratos serosos, uno correspondiente a la remodelación cicatricial como resultado del proceso inflamatorio que ha tenido lugar en las primeras semanas, y el segundo conformado por XPB que aún permanece intacto, con grandes bandas de colágeno dispuestas unas sobre otras, lo que hace suponer que el proceso de fibrosis y remodelación tisular aún continúa.
DISCUSIÓN
Los resultados macroscópicos de color probablemente fueron alterados debido al ingreso de glóbulos rojos desde la línea de celiotomía (Lastimer, 2011; Thompson y Rebar, 2016); por tanto, la metodología usada para la evaluación macroscópica de color no representó utilidad diagnóstica.
Se considera que la densidad es la expresión de la alta celularidad, de posibles bacterias, así como de la presencia de fibrina y lípidos entre otros componentes (Lastimer, 2011). No obstante, el lavado peritoneal evidenció una baja densidad debida a la dilución empleada; sin embargo, al comprobarse los valores celulares relativos del fluido peritoneal no se hallaron cambios representativos de inviabilidad, a pesar de que se usó pericardio bovino sin tratamiento (que puede considerarse como un cuerpo «extraño»).
El análisis microscópico del fluido peritoneal es un procedimiento informativo repetible que ayuda a evaluar la gravedad de las lesiones abdominales (Nazifi et al., 2000; Radin y Wellman, 2010); sin embargo, la citología del fluido peritoneal puede alterarse por el curso clínico, la terapia antibiótica y la experiencia del técnico laboratorista (Levin et al., 2014). Se enfatiza que en este estudio todos los animales mantuvieron las mismas condiciones farmacológicas y alimenticias, como también se considera que toda celiotomía influye en los cambios celulares del lavado peritoneal.
El aumento significativo en el recuento linfocitario de los grupos experimentales A, B y C en el posoperatorio denotan que la técnica quirúrgica con XPB obtiene el pico más alto a los 10 días del posoperatorio, toda vez que los linfocitos son las células encargadas de reconocer antígenos extraños (Tizard, 2013; Trigo y Valero, 2004), ya que los xenoinjertos desencadenan una hipersensibilidad tipo IV en la que participan diferentes tipos de linfocitos. Los resultados, por otro lado, indican la viabilidad del XPB no tratado al ser compatible con la vida, pues no alteró la fisiología yeyunal de los caninos a la exploración física clínica, lo que concuerda con reportes hechos en equinos (Aguilar et al., 2018) y en cerdos con pericardio tratado (Testini et al., 2014). Estos hallazgos difieren de Guyton y Hall (2011), quienes mencionan que en los xenoinjertos ocurren reacciones inmunitarias que provocan muerte de las células del injerto entre 1 día y 5 semanas después del trasplante, a menos que se emplee un tratamiento específico para evitar las reacciones inmunitarias.
La significativa disminución de neutrófilos segmentados en posoperatorio en los tres grupos experimentales indica ausencia de reacción inflamatoria, infecciosa o ambas, dado que una inflamación se presenta con aumento de neutrófilos inmaduros (Núñez y Bouda, 2007). Esto demuestra que la técnica quirúrgica con xenoinjerto conlleva una apropiada curación, impartiendo fuerza a la herida y evitando fugas después de la sutura (Grimes et al., 2013); todo bajo las mismas condiciones de antibioticoterapia dado que el lavado peritoneal distó mucho de ser un exudado (Levin et al., 2004; Dempsey y Ewing, 2011).
El significativo incremento del recuento de macrófagos/monocitos de los grupos B y C en el posoperatorio indica que la técnica quirúrgica con XPB determinó este cambio, aunque a un nivel aceptable que permitió su viabilidad. Si bien es cierto los neutrófilos actúan como primera línea de defensa (Tizard, 2013), no garantizan la destrucción de todos los patógenos, por lo que los macrófagos/ monocitos actúan como un sistema de apoyo fagocitario tardío. Por otro lado, el significativo incremento posoperatorio de eosinófilos en el grupo C fue debido a la atracción de los sitios de desgranulación de los mastocitos (Tizard, 2013).
El presente estudio sugiere que el xenoinjerto de pericardio bovino (XPB) es un biomaterial no rechazado en el canino, a pesar de haber sido empleado sin tratamiento previo, a diferencia del parche de pericardio bovino usado por Hagerman et al. (2007) y Testini et al. (2014). Además, en el presente estudio no se evidenciaron a nivel histopatológico residuos citotóxicos ni calcificación a nivel del xenoinjerto, lo que difiere de lo mencionado por Abolhoda et al. (1996) y Mathapati et al. (2013) quienes proponen la necesidad de usar injertos procesados con glutaraldehído para evitar antígenos celulares nocivos.
Es importante resaltar la adhesión del epiplón sobre el XPB (Figura 3) en todos los caninos, a diferencia del uso de esta técnica quirúrgica en equinos (Aguilar et al., 2018). El epiplón es fácilmente separable del xenoinjerto mediante tracción luego de los primeros cinco días; sin embargo, trascurridos 30 días del posoperatorio la adhesión es tan fuerte que se tendría que separar a través de disección. El mecanismo para la adhesión del epiplón, según More et al. (2013) involucra la formación de exudado en el sitio de la lesión, donde la fibrina estimula la migración de leucocitos yel depósito de colágeno alrededor de la zona lesionada. Esto previno la adherencia de otras superficies serosas al xenoinjerto, evitando probables complicaciones.
La evaluación del peristaltismo intestinal en la zona de la cirugía reveló movimientos iguales al resto del intestino delgado, teniendo como parámetro de medición el correcto tránsito intestinal, sin limitación evidente en sus funciones de alimentación y nutrición, tal y como lo proponen Koenig y Cote (2006). Esto sugiere que el XPB no altera la fisiología del sistema nervioso entérico a nivel de los plexos de Meissner, Aüerbach y de las células intersticiales de Cajal reportadas por Romero et al. (2012), lo que se refleja en la evaluación microscópica (Cuadro 4).
Dado que el estado de la mucosa y serosa se encontraban bien conservados, se infiere que el XPB no afecta la estructura histológica normal del intestino, garantizando su fisiología. El xenoinjerto, fundamentalmente, cumple las funciones de refuerzo para garantizar la remodelación cicatricial de la línea anastomótica (Hagerman et al., 2007; Hosseini et al., 2009; Testini et al., 2014). Además, el proceso de angiogénesis a nivel microscópico en el XPB en los grupos A, B y C (Figura 9) evidencia excelente adaptabilidad sobre el tejido yeyunal canino, como inicio favorable del proceso de remodelación tisular.
Los resultados obtenidos a los 30 días posoperatorio en este estudio se pueden relacionar a los obtenidos por Testini et al. (2014), quien en su evaluación a 90 días posoperatorio encuentran un proceso moderado de fibrosis, así como un mínimo estado de infiltración en el XPB tratado. En ese sentido, según Gauvin et al. (2013), el lado seroso del pericardio porcino retiene más plaquetas en comparación con el pericardio bovino, lo que hace que la trombogenicidad aguda sea mayor en el pericardio porcino. Aunque no se planteó en la metodología evaluar la trombogenicidad, la evaluación histopatológica en diferentes tiempos constata una reacción a cuerpo extraño, pero que no constituye rechazo e inviabilidad.
CONCLUSIONES
-
La evaluación del fluido peritoneal de caninos sometidos a anastomosis término-terminal yeyunal revestida con xenoinjerto de pericardio bovino genera un incremento significativo, pero compatible con la vida del paciente, en el recuento de linfocitos, eosinófilos y macrófagos, específicamente a los 30 días posoperatorio, con una moderada reacción de hipersensibilidad y ausencia de proceso infeccioso.
-
La evaluación histopatológica de la técnica de anastomosis término-terminal yeyunal revestida con xenoinjerto de pericardio bovino en un modelo canino sugiere que es viable y efectiva, dado que no altera la microestructura normal del intestino y no permite la presencia de fugas, abscesos, estenosis ni signos de peritonitis.
LITERATURA CITADA
1. Abolhoda A, Yu S, Oyarzun J, Allen K, Mccormick J, Han S, Kemp F, et al. 1996. No-react detoxification process: a superior anticalcification method for bioprostheses. Ann Thorac Surg 62: 1724-1730. doi: 10.1016/S0003- 4975(96)00948-4 [ Links ]
2. Aguilar CN, Delgado A, Chavera A, Cueva M. 2018. Anastomosis yeyunal término-terminal con xenoinjerto de pericardio bovino en equinos. Rev Inv Vet Perú 29: 106-119. doi:10.15381/ rivep.v29i1.14190 [ Links ]
3. Al-Rukibat RK, Ismail ZA, Al-Majali AM, Al-Zghoul MB. 2006. Peritoneal fluid analysis in adult, nonpregnant Awassi sheep. Vet Clin Path 35: 215- 218. doi: 10.1111/j.1939-165X.2006.- tb00117.x [ Links ]
4. Alves EG, Rezende CM, Oliveira H, Borges N, Mantovani P, Lara J. 2010. Avaliação mecânica da placa de compósito de poli-hidroxibutirato e hidroxiapatita em modelos ósseos de gato. Arq Bras Med Vet Zoo 62: 1367- 1374. doi: 10.1590/S0102-09352010000- 600011 [ Links ]
5. Cheung DY, Duan B, Butcher JT. 2015. Current progress in tissue engineering of heart valves: multiscale problems, multiscale solutions. Expert Opin Biol Th 15: 1155-1172. doi: 10.1517/ 14712598.2015.1051527 [ Links ]
6. Cueto J, Barrientos T, Rodriguez E, Espinosa L, Palma J, Cojab J, Orozco T, et al. 2014. Further experimental studies on a biodegradable adhesive for protection of colorectal anastomosis. Arch Med Res 45: 331-336. doi: 10.1016/ j.arcmed.2014.03.007 [ Links ]
7. Dempsey SM, Ewing PJ. 2011. A review of the pathophysiology, classification, and analysis of canine and feline cavitary effusions. J Am Anim Hosp Assoc 47: 1-11. doi: 10.5326/ JAAHA-MS-5558 [ Links ]
8. Fossum TW. 2012. Small animal surgery. 5th ed. USA: Elsevier. 1640 p. [ Links ]
9. Gauvin R, Marinov G, Mehri Y, Klein J, Li B, Larouche D, Guzman R, et al. 2013. A comparative study of bovine and porcine pericardium to highlight their potential advantages to manufacture percutaneous cardiovascular implants. J Biomater Appl 28: 552-565. doi: 10.1177/ 0885328212465482 [ Links ]
10. Grimes J, Schmiedt C, Milovancev M, Radlinsky M, Cornell K. 2013. Efficacy of serosal patching in dogs with septic peritonitis. J Am Anim Hosp Assoc 49: 246-249. doi: 10.5326/JAAHA-MS-5870 [ Links ]
11. Guyton A, Hall J. 2011. Tratado de fisiología médica. 12th ed. España: Elsevier. 1115 p. [ Links ]
12. Hagerman G, Gaertner W, Ruth G, Potter M, Karulf R. 2007. Bovine pericardium buttress reinforces colorectal anastomoses in a canine model. Dis Colon Rectum 50: 1053-1060. doi: 10.1007/s10350-007-0212-y [ Links ]
13. Hosseini SV, Abbasi HR, Rezvani H, Vasei M, Ashraf MJ. 2009. Comparison between gallbladder serosal and mucosal patch in duodenal injuries repair in dogs. J Invest Surg 22: 148-153. doi: 10.1080/ 08941930802713068 [ Links ]
14. Jakobsson JG. 2015. Peer review report 2 on «ASA class is a reliable independent predictor of medical complications and mortality following surgery-an observational study». Int J Surg 13: 44. doi: 10.1016/j.ijsu.2015.- 06.006 [ Links ]
15. Koenig J, Cote N. 2006. Equine gastrointestinal motility-ileus and pharmacological modification. Can Vet J 47: 551-559. [ Links ]
16. Lastimer K. 2011. Duncan and Prase´s veterinary laboratory medicine: clinical pathology. 5th ed. USA: Wiley-Blackwell. 524 p. [ Links ]
17. Levin GM, Bonczynski JJ, Ludwig LL, Barton LJ, Loar AS. 2004. Lactate as a diagnostic test for septic peritoneal effusions in dogs and cats. J Am Anim Hosp Assoc 40: 364-371. doi: 10.5326/ 0400364 [ Links ]
18. Li L, Wang N, Jin X, Deng R, Nie S, Sun L, Wu Q, Wei Y, Gong C. 2014. Biodegradable and injectable in situ cross-linking chitosan-hyaluronic acidbased hydrogels for postoperative adhesion prevention. Biomaterials 35: 3903-3917. doi: 10.1016/j.biomaterials.- 2014.01.050 [ Links ]
19. Madison J, David A, Watson J, Elliott J. 2008. Antibacterial drugs. In: Small animal clinical pharmacology. London: Elsevier. p 148-185. [ Links ]
20. Mathapati S, Bishi DK, Guhathakurta S, Cherian KM, Venugopal JR, Ramakrishna S, Verma RS. 2013. Biomimetic acellular detoxified glutaraldehyde cross-linked bovine pericardium for tissue engineering. Mat Sci Eng C 3: 1561-1572. doi: 10.1016/ j.msec.2012.12.062 [ Links ]
21. More MM, Paz E, Cruz FÁ. 2013. Uso del pericardio porcino tratado con gluteraldehído en el tratamiento de los defectos de la pared abdominal: estudio experimental en ratas. Acta Med Peru 30: 91-96. [ Links ]
22. Nazifi S, Dehghani S, Barzegar MR. 2000. Evaluation of cellular and biochemical parameters of blood and peritoneal fluid following enterectomy in the goat. Small Ruminant Res 37: 65-71. doi: 10.1016/S0921-4488(99)00150-9 [ Links ]
23. Nelson WN, Couto CG. 2010. Medicina interna de pequeños animales. 4° ed. Barcelona: Elsevier. 1504 p. [ Links ]
24. Núñez L, Bouda J. 2007. Patología clínica veterinaria. 2° ed. México: UNAM. 334 p. [ Links ]
25. Pérez D, Sotres A, Olmos R, Villalba J. 2005. Uso del pericardio bovino tratado con glutaraldehído. Rev Instituto Nac Enferm Resp 18: 224-229. [ Links ]
26. Polak R, Pitombo RN. 2011. Care during freeze-drying of bovine pericardium tissue to be used as a biomaterial: a comparative study. Cryobiology 63: 61-66. doi: 10.1016/j.cryobiol.2011.05.001 [ Links ]
27. Radin MJ, Wellman ML. 2010. Interpretación de la citología canina y felina. Argentina: Nestlé Purina. 50 p. [ Links ]
28. Rendón J, Bustamante J, Zapata J, Medina S. 2007. Uso de pericardio bovino para la corrección de cardiopatías congénitas. Rev Colomb Cardiol 13 :246- 252. [ Links ]
29. Romero-Trujillo JO, Frank-Márquez N, Cervantes-Bustamante R, Cadena- León JF, Montijo-Barrios E, Zárate- Mondragón F, Cázares-Méndez JM, et al. 2012. Sistema nervioso entérico y motilidad gastrointestinal. Acta Pediátrica Méx 33: 207-214. [ Links ]
30. Seabaugh KA, Goodrich LR, Bohn AA, Morley PS, Hendrickson DA. 2014. A comparison of peritoneal fluid values in mares following bilateral laparoscopic ovariectomy using a vessel sealing and dividing device versus placement of two ligating loops. Vet J 202: 297-302. doi: 10.1016/j.tvjl.2014.-08.025 [ Links ]
31. Sirois M. 2015. Laboratory procedures for veterinary technicians. 6th ed. China: Elsevier. 448 p. [ Links ]
32. Testini M, Gurrado A, Portincasa P, Scacco S, Marzullo A, Piccinni G, Lissidini G, et al. 2014. Bovine pericardium patch wrapping intestinal anastomosis improves healing process and prevents leakage in a pig model. Plos One 9: e86627. doi: 10.1371/journal.- pone.0086627 [ Links ]
33. Thomovsky EJ, Johnson PA, Moore GE. 2014. Diagnostic accuracy of a urine reagent strip to identify bacterial peritonitis in dogs with ascites. Vet J 202: 640-642. doi: 10.1016/j.tvjl.2014.09.020 [ Links ]
34. Thompson C, Rebar A. 2016. Body cavity fluids. In: Canine and feline cytology. 3° ed. Elsevier. p 191-219. [ Links ]
35. Tizard I. 2013. Veterinary immunology. 9th ed. China: Saunders. 552 p. [ Links ]
36. Trigo A, Valero G. 2004. Patología general veterinaria. México: UNAM. 334 p. [ Links ]
Recibido: 25 de julio de 2018
Aceptado para publicación: 15 de enero de 2019