INTRODUCCIÓN
La crianza de camélidos sudamericanos (CSA) constituye una actividad productiva y económica de gran valor para la población altoandina en Perú. Su crianza representa el 70-80% del ingreso familiar anual (Portal Agrario, 2017). El uso de biotecnologías reproductivas en estas especies, como la in- seminación artificial (IA) con semen conge- lado, ha obtenido resultados desalentadores que aún no justifican su aplicación masiva. La dificultad en la colecta de semen de bue- na calidad, así como la alta viscosidad y baja concentración y motilidad seminal condiciona su evaluación y limita su manipulación para trabajos de criopreservación.
Los estudios sobre criopreservación de espermatozoides de alpaca muestran resultados variables y, en general, deficientes para su aplicación en campo obteniéndose entre 5 y 36% de motilidad pos-descongelación, entre 17 y 61% de integridad de la membrana plasmática y entre 21 y 93% de viabilidad e integridad acrosomal (Morton et al., 2007, 2010; Canorio, 2008; Rodríguez, 2009; Banda et al., 2010; Mancisidor, 2013; Terreros et al., 2015; Choez et al., 2017). Por consiguiente, se reportan bajos porcentajes de fertilidad (16%) utilizando la técnica de inseminación artificial (Pacheco et al., 2009).
La baja tasa de supervivencia de espermatozoides criopreservados de CSA podría estar relacionada a los agentes crioprotectores (ACPs). El glicerol, como ACP, ha venido usándose de manera masiva en diversos protocolos de criopreservación de semen de varias especies. Sin embargo, puede causar toxicidad y ser contraceptivo debido a su lenta permeabilidad en la membrana celular, por lo que es eliminado del semen en algunas especies antes de la IA (Holt, 2000; Watson, 2000). En alpacas se ha empleado glicerol al 2% (0.27 M) y 8% (1.16 M) (Santiani et al., 2005; Morton et al., 2007, 2010; Banda et al., 2010; Terreros et al., 2015; Choez et al., 2017) obteniéndose porcentajes bajos de motilidad pos-descongelación (entre 4 y 31%), los cuales son insuficientes para lograr tasas de preñez aceptables luego de la IA. En ese sentido, el empleo de crioprotectores alternativos como las amidas surge como tentativa por su menor peso molecular y, por lo tanto, causar menor daño osmótico en comparación con el glicerol.
En los últimos cinco años se ha venido empleando dimetilacetamida (DMA) y dimetilformamida (DMF) en estudios de criopreservación de semen de alpaca. Se ha obtenido entre 9 y 34% de motilidad pos-descongelación utilizando DMA al 3.5% (Mancisidor, 2013; Banda et al., 2010; Canorio, 2008), mientras que con DMF al 4 y 7% solo se ha logrado obtener 8 y 10% de motilidad luego del descongelamiento, respectivamente (Flores et al., 2015). Por otro lado, Carretero et al. (2014) obtuvo 23% de motilidad pos-descongelamiento en llamas empleando DMF al 7%. Debido a esta gran variabilidad, se requiere evaluar y comparar crioprotectores del grupo amida, DMA y DMF, a concentraciones distintas y bajo los mismos parámetros. Por ello, el objetivo del presente estudio fue determinar el efecto de dos tipos (dimetilacetamida y dimetilformamida) y tres concentraciones (1, 3.5 y 7%) de agentes crioprotectores sobre parámetros espermáticos durante el proceso de criopreservación de espermatozoides epididimarios de alpaca.
MATERIALES Y MÉTODOS
Lugar y Muestra de Estudio
El estudio se realizó en el Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos (Lima, Perú). Se emplearon 40 epidídimos de alpaca provenientes del camal municipal de Huancavelica.
Se utilizaron aquellos testículos con un peso mayor o igual a 10 g, longitud testicular mayor o igual a 3 cm, concentración espermática mayor o igual a 50 x 106 espermatozoides/ml y motilidad mayor o igual a 30%.
Espermatozoides Epididimarios
Inmediatamente después del sacrificio se colectaron ambos testículos y se colocaron en bolsas herméticas con NaCl 0.9% dentro de cajas de transporte a 5 ºC para su trasladado a Lima en las 20 horas siguientes. En el laboratorio se realizó la divulsión del testículo identificando y separando la cola del epidídimo. Se lavaron con PBS temperado (38 ºC) y se colocaron en una placa Petri. Se les adicionó 1.5 ml de un dilutor a base de leche descremada, yema de huevo y fructosa, descrito por Santiani et al. (2005). Posteriormente, con una hoja de bisturí, se realizaron cortes seriados sobre la superficie de la cola para la recuperación de espermatozoides.
Se utilizaron 10 µl de la suspensión para la evaluación de la motilidad y otros 10 µl para evaluar la concentración espermática. Asimismo, a la muestra se le añadió 1 ml del dilutor, consiguiendo un total de 2.5 ml que fueron distribuidos en seis alícuotas de 300 µl cada una.
Diseño Experimental
Se empleó un diseño factorial de 2x3 (dos crioprotectores: DMA y DMF x tres concentraciones: 1, 3.5 y 7%) y 40 repeticiones por tratamiento mediante el uso de 40 epidídimos. Una alícuota de 300 µl se utilizó en cada tratamiento y para alcanzar una concentración final de 1, 3.5 y 7% se adicionó 3, 10.5 y 21 µl de DMA y DMF a cada Eppendorf, respectivamente.
Criopreservación y Descongelamiento
Se colocaron las pajillas en un sistema automático de congelamiento (Cryobath, Cryologic, Australia) y utilizó el programa #7. Este programa inicia con una temperatura de 18 ºC, desciende hasta 5 ºC en un lapso de 90 min y hace una meseta a 5 ºC por 30 min, y a partir de allí la temperatura desciende hasta la congelación. Las pajillas congeladas fueron guardadas en el tanque de nitrógeno líquido a -196 ºC. La descongelación se realizó sumergiendo las pajillas en baño maría a 38 ºC por 1 min (Morton et al., 2007).
Evaluación de Espermatozoides
La motilidad de todas las muestras fue evaluada mediante microscopía (400x).
Para evaluar la viabilidad espermática se empleó el kit Sperm Viability (D3861Molecular Probes, Eugene, USA) que consta de dos componentes: Componente A (SYBR-14) y Componente B (PI). Asimismo, el potencial de membrana mitocondrial fue evaluado por Mitotracker Deep Red FM (M22426Molecular Probes, Eugene, USA). Para esta evaluación, las muestras primeramente fueron lavadas dos veces con 1 ml de PBS mediante centrifugación a 600 g por 8 min. El resultante fue resuspendido con 100 µl de PBS. Luego se agregaron los componentes en el siguiente orden: 0.5 µl de Solución Stock de SYBR-14 (20 µM), 0.5 µl de Mitotracker Deep Red FM (1 mM) y 0.5 µl de solución Stock de PI (2.4 mM). Las muestras fueron incubadas durante 10 min en oscuridad a 38 ºC.
Citometría de Flujo
Se utilizó un citómetro de flujo con analizador de imágenes FlowSight (Amnis, Seattle, USA) adquiriendo 10 000 eventos compatibles con espermatozoides mediante el programa INSPIRE v. 100.3.218.0 (Amnis, Seattle, USA). Para la identificación de espermatozoides se utilizaron gráficos Dotplot de campo claro versus relación de aspecto, así como la galería de imágenes para su verificación.
El láser de excitación de 488 nm fue utilizado para SYBR-14 y PI, mientras que MitoTracker Deep Red FM fue excitado por el láser de longitud de 642 nm. La fluorescencia emitida fue detectada por el canal 2 (Ch02: 505-560 nm) para SYBR-14, Canal 5 (Ch05: 642-740 nm) para PI y Canal 11 (Ch11: 642-740 nm) para MitoTracker Deep Red FM.
Se utilizó el software de análisis de datos IDEAS v. 6.2 (Amnis, Seattle, USA) el cual permitió utilizar diagramas de dispersión para SYBR-14 y PI, e histogramas para MitoTracker Deep Red FM. Se consideraron espermatozoides vivos con membrana plasmática intacta a los que presentaron fluorescencia verde marcado por el SYBR-14 (Figura 1A) y espermatozoides no viables (muertos) con membrana plasmática dañada a los que mostraron fluorescencia roja marcado por el PI (Figura 1B). Asimismo, se consideraron espermatozoides vivos con alto potencial de membrana mitocondrial (PMM) a los que mostraron fluorescencia roja en la pieza media.
Análisis Estadístico
Para evaluar el efecto de los tratamientos sobre los porcentajes de motilidad, viabilidad espermática y actividad mitocondrial, se utilizó un análisis de varianza para el diseño factorial 2x3 (dos crioprotectores x tres concentraciones), considerando como factores independientes el crioprotector, la concentración y la interacción crioprotector-concentración. Además, se utilizó la prueba de Tukey para determinar diferencias estadísticas entre medias de los tratamientos. Se empleó el paquete estadístico SPSS Statistics 22.0.
RESULTADOS
Los resultados obtenidos de motilidad pos-descongelamiento se encuentran en el Cuadro 1. El crioprotector DMA tuvo un mejor efecto que el DMF (14% vs 10%). Los mejores porcentajes de motilidad posdescongelamiento (14 y 15%) se obtuvieron a concentraciones de 1 y 3.5%, respectivamente, mientras que solo se obtuvo 7% de motilidad con la concentración de 7%. Por otro lado, no hubo efecto significativo por efecto de la interacción crioprotector-concentración (p=0.619).
Cuadro 1 Efecto de los crioprotectores dimetilacetamida (DMA) y dimetilformamida (DMF) en tres concentraciones (1, 3.5 y 7%) sobre la motilidad (%) pos-descongelación en espermatozoides epididimarios de alpacas1
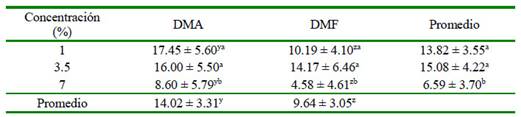
1 Los datos son presentados como promedios ± intervalo de confianza a,b Letras diferentes dentro de una columna indican diferencia significativa (p<0.05) y,z Letras diferentes dentro de una fila indican diferencia significativa (p<0.05)
Los resultados de viabilidad e integridad de la membrana plasmática pos-descongelación se encuentran en el Cuadro 2. El mayor porcentaje de viabilidad espermática (19%) se obtuvo con la concentración de 1%, siendo de 16 y 14% con las concentraciones de 3.5 y 7%, respectivamente. Por otro lado, no se encontró diferencia significativa entre crioprotectores (p=0.323) ni en la interacción crioprotector-concentración (p=0.347).
Cuadro 2 Efecto de los crioprotectores dimetilacetamida (DMA) y dimetilformamida (DMF) en tres concentraciones (1, 3.5 y 7%) sobre la viabilidad espermática (%) en espermatozoides epididimarios de alpacas1
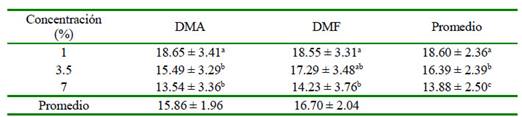
1 Los datos son presentados como promedios ± intervalo de confianza a,b,c Letras diferentes dentro de una columna indican diferencia significativa (p<0.05)
Los resultados obtenidos del PMM posdescongelación se presentan en el Cuadro 3. Las concentraciones de 1 y 3.5% de los crioprotectores presentaron los mejores resultados (19 y 17%, respectivamente) en comparación al 7% (14%). Por otro lado, no hubo efecto significativo por efecto del crioprotector utilizado (p=0.247) ni por efecto de la interacción crioprotector-concentración (p=0.355).
Cuadro 3 Efecto de dimetilacetamida (DMA) y dimetilformamida (DMF) en tres concentraciones (1, 3.5 y 7%) sobre el potencial de membrana mitocondrial (%) en espermatozoides epididimarios de alpacas1
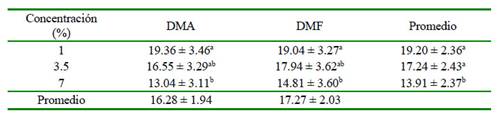
1 Los datos son presentados como promedios ± intervalo de confianza a,b Letras diferentes dentro de una columna indican diferencia significativa (p<0.05)
DISCUSIÓN
Este es el primer reporte que compara el efecto de dos amidas (DMA y DMF) en distintas concentraciones (1, 3.5 y 7%) en el proceso de criopreservación de espermatozoides de alpaca. Son escasos los estudios que emplean crioprotectores alternativos comparando concentraciones para esta especie, siendo más reciente el reporte de Canorio et al. (2015), quienes compararon DMA al 1.7, y 7%, y el estudio de Flores et al. (2015) utilizando DMF al 4 y 7%. Sin embargo, en otras especies, principalmente aves, se dispone de más reportes empleando alguna de estas amidas, tales como el descrito por Rakha et al. (2017), quienes compararon DMA al 4, 6, 8 y 10% en la criopreservación de semen de gallo (Gallus gallus murghi), obteniendo buenos resultados al 6%.
En el presente estudio, DMA presentó un mejor efecto que DMF en términos de motilidad pos-descongelación; resultados que coinciden con Santiani et al. (2016), quienes demostraron que DMA mostró mejores resultados de motilidad pos-descongelamiento sobre otros agentes crioprotectores durante el proceso de criopreservación de espermatozoides del Caballo Peruano de Paso. De manera similar, Seifi-Jamadi et al. (2017) resaltaron la eficacia de la DMA sobre el glicerol en la supervivencia de espermatozoides de caprinos. Esto basado en que DMA posee una capacidad de penetración a través del reordenamiento de lípidos y proteínas, así como el aumento de la fluidez de la membrana plasmática, que permiten una disminución en la formación de hielo dentro de la célula, previniendo su daño (Holt, 2000).
Concentraciones elevadas de DMA o DMF podrían resultar siendo tóxicas para el espermatozoide (Blanco et al., 2000), de allí que se requiere evaluar varias concentraciones bajo los mismos parámetros. Se determinó que las concentraciones de 1 y 3.5% permiten obtener mejores rangos de motilidad, viabilidad espermática y potencial de membrana mitocondrial que la concentración de 7% en la criopreservación de espermatozoides de alpaca, independientemente del tipo de crioprotector. Es decir, altas concentraciones no son toleradas en esta especie, como sucede en cerdos y ratones con concentraciones superiores al 3 y 1.75%, respectivamente. Estos resultados podrían explicar el uso de DMA al 3.5% en casi todos los reportes que se han realizado en alpacas con esta amida. Otros autores (Canorio, 2008; Rodríguez, 2009; Banda, 2010; Mancisidor, 2013) obtuvieron resultados similares (9-33%) al presente estudio respecto a motilidad pos-descongelación.
En otros estudios, no obstante, los mejores porcentajes de motilidad, viabilidad e integridad de la membrana plasmática se obtuvieron con concentraciones de 3.5 y 7% de DMA en comparación con 1.7% en la congelación de espermatozoides de alpaca (Canorio et al., 2015). Por su lado, Flores et al. (2015) empleando DMF al 4 y 7% no hallaron diferencia significativa entre ambas concentraciones respecto a la motilidad posdescongelamiento. Las diferencias encontradas con estos estudios podrían explicarse por las pruebas utilizadas para evaluar espermatozoides, tales como la citometría de flujo o el sistema de análisis ISAS utilizado por Flores et al. (2015), que poseen mayor sensibilidad y especificidad que el método convencional empleado por Canorio et al. (2015) (colorante eosina para determinar la viabilidad y la prueba hipoosmótica para determinar la integridad de la membrana plasmática). Además, se debe considerar los diluyentes empleados, así como la intensidad de los cambios inducidos por la criopreservación, lo cual es altamente específico de la especie (Massip et al., 2004; Blanco et al., 2011; Roushdy et al., 2014).
CONCLUSIONES
La dimetilacetamida (DMA) fue más efectiva en conservar la motilidad posdescongelación que la dimetilformamida (DMF).
Las concentraciones de 1 y 3.5% del crioprotector conservaron mejor la motilidad, viabilidad y potencial de membrana mitocondrial que la concentración de 7%, independientemente del tipo de crioprotector.












 uBio
uBio 


