INTRODUCCIÓN
El Perú es uno de los países pesqueros más ricos del mundo y uno de los principales exportadores a nivel mundial (Shimokawa, 2013). La actividad pesquera comprende las actividades de extracción y transformación de recursos hidrobiológicos como peces, moluscos, crustáceos y otras especies para el consumo humano directo (enlatado, fresco o congelado) e indirecto (harina y aceite de pescado). Cinco especies de pescado (bonito [Sarda chiliensis], merluza [Merluccius gayi peruanus], caballa [S. japonicus], perico [Coryphaena hippurus] y lisa [M. cephalus]) presentaron el mayor desembarque para el consumo fresco durante 2016 y 2017 (PRODUCE, 2016, 2017).
Los peces destinados al consumo se pueden encontrar infestados por especies parasitarias que pueden poner en riesgo la salud humana. La presencia de parásitos en productos de la pesca es inevitable y difícilmente controlada debido a que cohabitan en el mismo medio. Se han descrito numerosos parásitos en pescados de consumo, la mayoría solo deterioran la apariencia del pescado y devalúan su valor (Serrano-Martínez et al., 2017); sin embargo, existen otros tipos de parásitos de peces que son de importancia en la salud pública (Sánchez et al., 2016; Scholz y Kuchta, 2016).
Adenocephalus pacificus tiene importancia médica en el Perú y a nivel mundial. Ocasiona una enfermedad zoonótica y es el único agente causal de la difilobotriasis humana en el Perú (Tantaleán, 1993; Hernández-Orts et al., 2015; Kuchta et al., 2015; Sánchez et al., 2016; Scholz y Kuchta, 2016; Berger, 2017; Moore et al., 2017). Este parásito es endémico de las costas del Pacifico, por lo que la mayoría de los casos clínicos (>99%) son reportados en el Perú; sin embargo, existen casos recientes reportados en Europa que corroboran su distribución mundial y la importancia de prestar mayor atención a esta zoonosis emergente (Kutcha et al., 2014).
En el Perú, la difilobotriasis es adquirida por el consumo de peces marinos, portadores de larvas de cestodos de la familia Diphyllobothridae, crudos o insuficientemente cocidos en forma de «cebiche», «tiradito» o «chinguirito» (Tantaleán, 1993; Kuchta et al., 2015; Scholz y Kuchta, 2016). Diversos estudios demuestran la presencia de este cestodo en peces de interés comercial en el país (Chero et al., 2014a,b,c, 2016; SerranoMartínez et al., 2017), por lo que es importante mantener el constante control de calidad e inspección sanitaria de peces de consumo (Scholz y Kuchta, 2016).
Los principales factores de riesgo que incrementan la expansión mundial de los parásitos (incluido A. pacificus) incluyen las importaciones de pescado refrigerado o insuficientemente congelado, la alta demanda del consumo de pescado crudo o poco cocido y los viajes y migraciones de personas con infecciones parasitarias a otros países (Kutcha et al., 2015). El objetivo del presente estudio fue evaluar los descriptores ecológicos de A. pacificus en los peces de interés comercial en la costa del Perú.
MATERIALES Y MÉTODOS
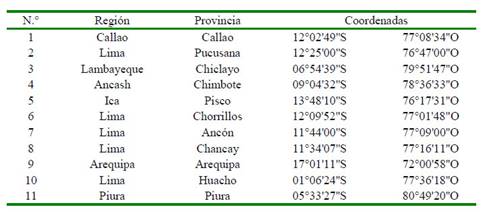
Se realizaron 49 muestreos en 11 zonas de muestreo de la costa peruana (Cuadro 1) en el periodo comprendido entre de marzo de 2016 y octubre de 2017. De estos. 31 muestreos se realizaron en 2016 y 18 muestreos en 2017.
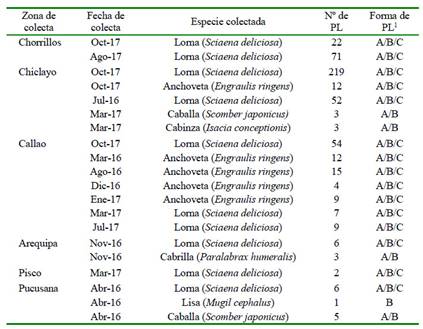
Se colectaron 12 017 pescados pertenecientes a 28 especies. De estos, 715 fueron en la Región Lima (Pucusana [134], Chorrillos [351], Ancón [85], Chancay [80], Huacho [65]) (Figura 1), 8251 en la Provincia Constitucional del Callao, 878 en Pisco, 1060 en Arequipa (1,060) (Figura 2), y 38 en Chimbote, 920 en Chiclayo y 155 en Piura (Figura 3).
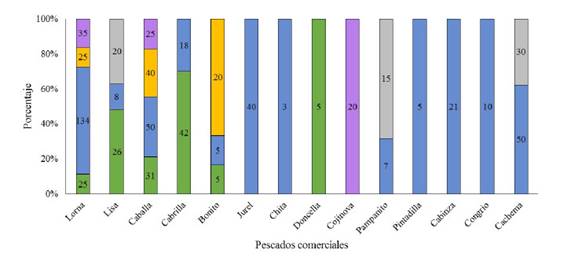
Figura 1.Especímenes colectados en la Región Lima (Pucusana, Chorrillos, Ancón, Chancay y Huacho): lorna (S. deliciosa), lisa (M. cephalus), caballa (S. japonicus), cabrilla (P. humeralis), bonito (S. chiliensis), jurel (T. murphyi), chita (Anisotremus scapularis), doncella (Hemanthias peruanus), cojinova (Seriolella violacea), pampanito (Trachinotus paitensis), pintadilla (Cheilodactylus variegatus), cabinza (I. conceptionis), congrio (Genypterus maculatus) y cachema (Cynoscion analis)
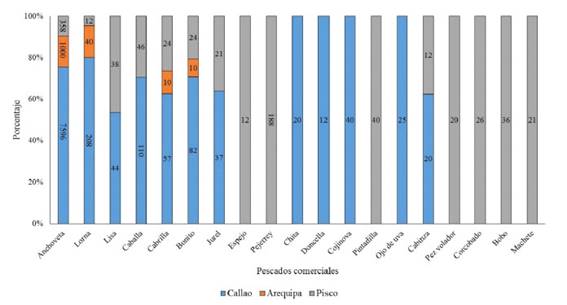
Figura 2 Especímenes colectados en la Provincia Constitucional del Callao y en las provincias de Pisco y Arequipa: anchoveta (E. ringens), lorna (S. deliciosa), lisa (M.cephalus), caballa (S. japonicus), cabrilla (P. humeralis), bonito (S. chiliensis), jurel (T. murphyi), espejo (Selene peruviana), pejerrey (Odontesthes regia), chita (A. scapularis), doncella (H. peruanus), cojinova (S. violacea), pintadilla (C. variegatus), ojo de uva (Hemilutjanus macrophthalmos), cabinza (I. conceptionis), pez volador (Cheilopogon heterurus), corcovado (Caranx lugubris), bobo (Joturus pichardi) y machete (Ethmidium maculatum).
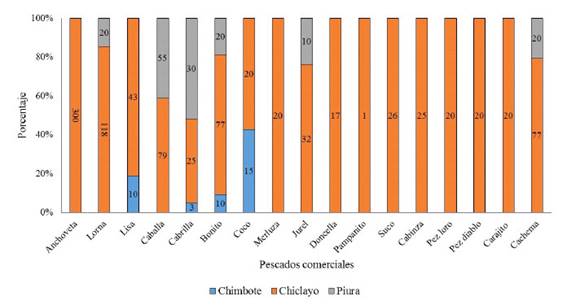
Figura 3 Especímenes colectados en las provincias de Chimbote, Chiclayo y Piura: anchoveta (E. ringens), lorna (S. deliciosa), lisa (M. cephalus), caballa (S. japonicus), cabrilla (P. humeralis), bonito (S. chiliensis), coco (Paralonchurus peruanus), merluza (M. gayi peruanus), jurel (T. murphyi), doncella (H. peruanus), pampanito (Trachinotus paitensis), cabinza (I. conceptionis), pez loro (Oplegnathus insignis), pez diablo (Scorpaena plumieri mystes), carajito (Diplectrum conceptione) y cachema (C. analis)
Los procedimientos de parasitología clásica (colecta, fijación e identificación de los plerocercoides [PLs]) fueron realizados en los laboratorios de la Dirección de Investigación, Desarrollo, Innovación y Transferencia Tecnológica (DIDITT) del Instituto Tecnológico de la Producción (ITP) y en el laboratorio de Parasitología en Fauna Silvestre y Zoonosis de la Universidad Nacional Mayor de San Marcos (UNMSM), Lima, Perú.
Los pescados fueron evaluados sobre una mesa de disección. La búsqueda de quistes de PLs de A. pacificus se realizó en la superficie de las vísceras. Los PLs extraídos se lavaron en solución salina al 0.85% y se identificaron mediante estereoscopio (Olympus®) y se fijaron con alcohol al 70%. La prevalencia, abundancia e intensidad media de los PLs fueron determinados acorde con los criterios de Margolis et al. (1982), Bush et al. (1997) y Zander (2001), respectivamente. Las fórmulas empeladas fueron:
Abundancia = N.° de parásitos colectados / N.° de hospederos de la muestra
Prevalencia = (N.°de hospederos infestados / N.°de hospederos examinados)*100
Intensidad media = (N.° de parásitos de una especie / N.° de especies infestadas con el parásito)
RESULTADOS
Los PLs encontrados presentaron las siguientes formas:
(A) Acorazonado: cuerpo cilíndrico, más o menos robusto, entre 6.5 y 7 mm de largo, superficie del cuerpo lisa, con 1 o 2 pequeñas constricciones en el cuerpo, color blanquecino, escólex grande, de borde anterior redondeado y botrias poco profundas (Figura 4a).
(B) Esférico: cuerpo cilíndrico, 12 a 13 mm de largo, color blanquecino, superficie del cuerpo con constricciones poco profundas, escólex con borde anterior redondeado y con botrias profundas (Figura 4b).
(C) Lanceolado: cuerpo cilíndrico, de superficie lisa, extremo anterior de forma triangular con el ápice redondeado. Posterior al escólex se presenta una dilatación del cuerpo, botrias grandes y profundas (Figura 4c).
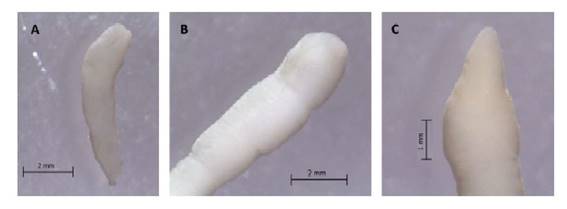
Figura 4 Formas de plerocercoides de Adenocephalus pacificus. A: Acorazonado, B: Esférico, C: Lanceolado
Se encontraron 220 peces parasitados, lo cual equivale al 2.04% de peces muestreados. Así mismo, se encontraron 515 parásitos. S. deliciosa fue la especie más parasitada con una prevalencia de 24.96% y presentó la mayor cantidad de PLs (448). Asimismo, E. ringens), M. cephalus, S. japonicus, P. humeralis y I. conceptionis presentaron prevalencias de 0.55, 0.56, 1.79, 1.53 y 3.95%, respectivamente (Cuadro 2).
Cuadro 2 Descriptores parasitológicos de pescados muestreados en el litoral del Perú durante el periodo marzo de 2016 y octubre de 2017
1 Plerocercoides
La abundancia parasitaria más baja se encontró en M. cephalus y E. ringens (0.006), mientras que la más alta se presentó en S. deliciosa (0.726). Con respecto a la carga parasitaria (presencia de PLs por hospedero), M. cephalus, S. japonicus, P. humeralis e I. conceptionis fueron infestadas con un PL. Así mismo, solo un espécimen de E. ringens presentó 2 PLs y S. deliciosa se encontró infestada con más de un PL. En algunos casos, esta infestación llego a 16 PLs en un solo hospedero (datos no presentados). Además, en E. ringens y S. deliciosa se presentaron las tres formas de PLs (A, B y C), en S. japonicus, P. humeralis e I. conceptionis se presentaron las formas A y B y en M. cephalus se presentó la forma B (Cuadro 3).
DISCUSIÓN
La especie con mayor infestación fue la lorna (S. deliciosa) con una prevalencia de 24.96%, siendo este reporte el más alto presentado hasta la fecha con respecto a esta especie en el Perú (Tantaleán, 1975; Llerena et al., 2001; Chero et al., 2014a; Chero, 2017). Además, es la prevalencia más alta en comparación con otras especies de peces, como el 23.30% en corvina (Cilus gilberti) encontrado por Chero et al. (2014c). Asimismo, la presencia de múltiples PLs, hasta 16 en un solo individuo y las tres formas de PLs en el mismo individuo, corresponde al primer reporte de esta particularidad en esta especie.
Este estudio es el primero en reportar la presencia de PLs de A. pacificus en lisa (M. cephalus), con una prevalencia de 0.56%, dado que no ha sido encontrada en otros estudios donde se ha evaluado esta especie (Tantaleán, 1975; Iannacone y Alvariño, 2009b; Cajachagua et al., 2012; VásquezRuiz y Jara-Campos, 2012; Chero et al., 2014b; Serrano-Martínez et al., 2017). Así mismo, este sería el primer reporte de la presencia de PLs de A. pacificus en el país en cabinza (I. conceptionis) con una prevalencia de 3.95%. Iannacone et al. (2015) hicieron un estudio en esta especie en una población de 123 individuos entre diciembre de 2010 y marzo de 2011, sin encontrar estos PLs, lo cual se podría deber a cambios en el ecosistema marino.
El 1.79% de prevalencia de A. pacificus encontrada en caballa (S. japonicus) fue similar al 1.7% reportado por Oliva et al. (2008). Por otro lado, Cabrera y Tantaleán (1995) y Cruces et al. (2014) no encontraron este parásito en esta especie. El 1.53% de prevalencia en cabrilla (P. humeralis) difiere del 3.5% reportado por Innacone y Alvariño (2009a), posiblemente debido al mayor tamaño de muestra (n=369) en ese estudio. En forma similar, el 0.56% de prevalencia en anchovetas (E. ringens) fue menor del 1.34% señalado por Céspedes-Chombo et al. (2017), posiblemente debido a diferencias en el tamaño de muestra entre dicho estudio (n=3420) y el presente trabajo (n=9254) y las épocas de muestreo. No obstante, en ambos estudios se hallaron 2 PLs en un individuo.
Los resultados evidencian una baja prevalencia de infestación por larvas PLs de A. pacificus en los peces marinos de la costa peruana. Tantaleán (1993) argumenta que el aumento de la carga parasitaria de A. pacificus podría depender del fenómeno El Niño y de la estacionalidad (verano). Si bien hay estudios realizados en épocas de fenómeno El Niño (Pérez et al., 1999; Oliva et al., 2008; Iannacone y Alvariño, 2009a) con prevalencias menores que en años en los que no se presenta este fenómeno, también se dispone de estudios (Vasquez-Ruiz y JaraCampos, 2012; Iannacone et al., 2010, 2012, 2015; Payes, 2013) realizados en años con presencia del fenómeno El Niño donde no se presentaron casos de A. pacificus. Esto podría ser debido a que estos estudios se realizaron en terminales pesqueros y no se conoce con exactitud la procedencia de los individuos y a la calidad de almacenamiento de estos. En el presente estudio, en 2016 (sin fenómeno El Niño) se reportó 104 PLs y en el 2017 (con fenómeno El Niño) se reportó 411 PLs, resultado que está acorde con lo reportado por Tantaleán (1993). No obstante, cabe señalar que el número de PLs por año no considera la estación ni huésped; en tanto que en este estudio , se puede ver en el Cuadro 3, que el número de PLs en verano es menor que en las estaciones de invierno en ambos años y en primavera en 2017.
Desde el punto de vista epidemiológico, este estudio aporta nuevos datos debido a que se evaluaron especies de peces que a la fecha no se habían estudiado. Entre estos, bobo (Joturus pichardi), carajito (Diplectrum conceptione), corcovado (Caranx lugubris), doncella (Hemanthias peruanus), espejo (Selene peruviana), ojo de uva (Hemilutjanus macrophthalmos), pejerrey (Odontesthes regia), pez diablo (Scorpaena plumieri mystes), pez loro (Oplegnathus insignis) y pez volador (Cheilopogon heterurus) son especies que no presentaron PLs de A. pacificus.
Se concluye que en los periodos del fenómeno El Niño es muy probable que la prevalencia de A. pacificus aumente en comparación con los años en los que no se presenta; pero en el presente estudio se ha demostrado que la estacionalidad no es relevante, y debe haber otras variables que estén influenciando en esta manifestación. Es así que se deben definir variables adicionales para determinar la particularidad que se expresa en años del Fenómeno El Niño. Por otro lado, es probable que haya infestación por más de un PL por hospedero, así como la presencia en el mismo hospedero de las tres formas de PLs reportadas en este estudio. Todos los PLs encontrados en este estudio pertenecen a A. pacificus. Es importante indicar, además, que se han hecho estudios moleculares de PLs obtenidos de peces marinos (colectados en este estudio) de la costa peruana, así como de adultos procedentes de humanos y lobos marinos (Mondragón, 2017; Marroquín, 2018; Londoñe et al., 2017a,b; 2018) que demuestran que los PLs corresponden a la especie A. pacificus.












 uBio
uBio