INTRODUCCIÓN
La producción acuícola mundial alcanzó 80 millones de toneladas (TM) de pescado en el año 2016, donde la maricultura representó el 35% (FAO, 2018). A nivel nacional, la maricultura produjo el 40% de la producción acuícola total durante 2016-2017; sin embargo, la piscicultura aún se encuentra en proceso de desarrollo a pesar de su amplia variedad de especies (PRODUCE, 2017).
Un recurso hidrobiológico marino de importancia comercial en el norte del Perú es el Centropomus sp, conocido comúnmente como robalo, que se distribuye desde Baja California Sur en México hasta Paita en Perú (Muhlia et al., 1994). Es considerado un candidato potencial para su producción intensiva, debido a su rápida adaptabilidad y buena calidad de carne, convirtiéndose en una alternativa rentable (Cerqueira y Tsuzuki, 2009; Ramos y Palas, 2013); sin embargo, tiene como limitantes la dificultad de producir juveniles en cantidades suficientes y la alta mortandad en la etapa larvaria (Souza et al., 2010). Gran parte de esta mortandad es asociada principalmente a enfermedades infecciosas bacterianas, las cuales proliferan debido al aumento de las condiciones de estrés (Austin, 2005; Peso-Echarri et al., 2012; Lafferty et al., 2015).
Para contrarrestar las enfermedades infecciosas, los antibióticos se han convertido en el tratamiento profiláctico y terapéutico más utilizado (Romero et al., 2012); sin embargo, su uso indiscriminado a largo plazo selecciona bacterias resistentes a drogas (multidrogo-resistentes) perjudicando la salud pública (Banerjee y Ray, 2017), además de afectar microorganismos de la microbiota nativa del hospedero, conllevando a la proliferación de patógenos oportunistas (Modi et al., 2014).
La microbiota es un ecosistema microbiano dinámico y complejo, que se encuentra asociado a la piel, branquias y tracto gastrointestinal, habita en forma estable e interacciona entre sí, autorregulando su concentración numérica (Nayak, 2010; Merrifield y Rodiles, 2015). Como parte de la microbiota se encuentran bacterias benéficas que participan en la inmunidad del hospedero (Lazado y Caipang, 2014), siendo sus funciones más resaltantes: 1) modulación del sistema inmune, 2) suministración de nutrientes, 3) producción de compuestos antagónicos frente a patógenos, y 4) producción de enzimas extracelulares, como proteasas y lipasas (Pirarat et al., 2011; Drider et al., 2016; Zorriehzahra et al., 2016).
Para la correcta selección de probióticos se requieren técnicas moleculares de vanguardia como la secuenciación de nueva generación (NGS) (Cui et al., 2017) que permiten analizar la biodiversidad de las comunidades microbianas presentes, así como también, una mejor comprensión de la relación entre los aislados y la microbiota total (Ju y Zhang, 2015; Oulas et al., 2015). Por lo tanto, conociendo la microbiota intestinal de los peces se pueden descubrir probióticos potenciales que reduzcan la aparición de enfermedades infecciosas y el uso de antibióticos (Wang et al., 2008). El presente estudio tuvo como objetivo caracterizar, mediante metagenómica, la composición de la microbiota intestinal nativa del robalo Centropomus sp e identificar bacterias con potencial probiótico.
MATERIALES Y MÉTODOS
Colección de la Muestra
Tres robalos de estado juvenil y aparentemente sanos fueron colectados de los distritos de Zarumilla (medio natural), Corrales (medio natural) y Puerto Pizaro (en cautiverio), localizados en la región Tumbes, Perú, y fueron codificados como R1, R2 y R3, respectivamente. Se procedió a la eutanasia con previa anestesia con eugenol. Se diseccionaron en condiciones asépticas y se colectó 1 g por pez de intestino libre de contenido intestinal en tubos de 2 ml con etanol absoluto. Finalmente, las muestras se trasladaron al laboratorio para estudios metagenómicos.
Aislamiento Bacteriano
Se realizó un frotis intestinal utilizando hisopos estériles y se colocaron en tubos de 2 ml con caldo Man Rogosa Sharpe (MRS). Las muestras se incubaron a temperatura ambiente durante 24 h. Posteriormente se realizaron diluciones seriadas (1:10, de 10-1 a 10-6) y se sembraron por esparcimiento en placas Petri con agar MRS. Las colonias fueron subcultivadas por el método de agotamiento hasta obtener colonias puras.
Antagonismo Bacteriano y Actividad Proteolítica
Las bacterias aisladas se enfrentaron a cuatro bacterias patógenas de peces (Plesiomonas shigelloides, Aeromonas hydrophila, Aeromonas veronii y Vibrio harveyi) utilizando el método de difusión en agar con modificaciones (Balcázar et al., 2008). Las bacterias patógenas se cultivaron en caldo Triptic Soy Broth (TSB) durante 24 h a 28 °C y luego se sembraron 100 µl de cada bacteria patógena en placas con Triptic Soy Agar (TSA) mediante el método de esparcimiento en superficie. Posteriormente, se realizaron pocillos en el agar con la ayuda de una pipeta Pasteur estéril y se agregaron 30 µl (5 x 108 unidades formadoras de colonia, UFC) de las bacterias aisladas. Finalmente, se incubaron a 28 °C durante 24 h. Las zonas de actividad inhibitoria fueron calculadas en milímetros (mm), considerándose positivas aquellas que mostraron una zona clara de inhibición.
La actividad proteolítica se evaluó en agar Skim Milk (5%), método adaptado de Reda et al (2017). Se sembraron 30 µl de cada bacteria potencialmente probiótica en sus respectivos pocillos y se incubaron a temperatura ambiente durante 24 h. Los aislados con actividades proteolíticas mostraron zonas transparentes alrededor.
Extracción de ADN y PCR
Se extrajo ADN metagenómico bacteriano a partir de 1 g de tejido intestinal utilizando el kit DNeasy PowerSoil(r) (Qiagen, Alemania), siguiendo las instrucciones del fabricante. Se extrajo ADN genómico bacteriano de los aislados utilizando el método CTAB (bromuro de hexadeciltrimetilamonio). La amplificación del gen 16S ARNr se hizo utilizando los cebadores universales 27F (5'-AGAGTTTAGTCMTG-GCTCAG-3') y 1492R (5'-GGYTACCTT-GTTACGACTT-3').
La reacción en cadena de la polimerasa (PCR) se realizó mediante las siguientes condiciones: un ciclo a 94 ºC durante 5 min, seguido de 35 ciclos a 94 ºC durante 30 s, 58 ºC durante 45 s, 7 ºC durante 1 min y 30 s, y un ciclo final de 72 ºC durante 6 min. Se verificaron los productos de PCR en un gel al 1.5% de agarosa teñido con bromuro de etidio.
RESULTADOS Y DISCUSIÓN
La microbiota intestinal es un factor importante en la nutrición e inmunidad de los peces, por lo que su estudio es primordial, especialmente en especies de gran valor comercial. La metagenómica, parte de la genómica que estudia el ADN global de una comunidad de microorganismos, permite también la caracterización de bacterias con propiedades benéficas conocidas comúnmente como probióticos (Tarnecki et al., 2017).
En el presente estudio se caracterizó la microbiota intestinal mediante NGS dirigida al gen 16S ARNr de tres individuos de robalo (dos de medio natural y uno de cautiverio).
La curva de rarefacción muestra el número de especies con relación al número de lecturas realizadas, donde las muestras R1 y R3 poseen una riqueza de alrededor de 220 especies y la muestra R2 de 120. La riqueza de especies estuvo relacionado al número de unidades taxonómicas operativas (OTUs, por sus siglas en inglés) establecido para cada muestra (Figura 1).
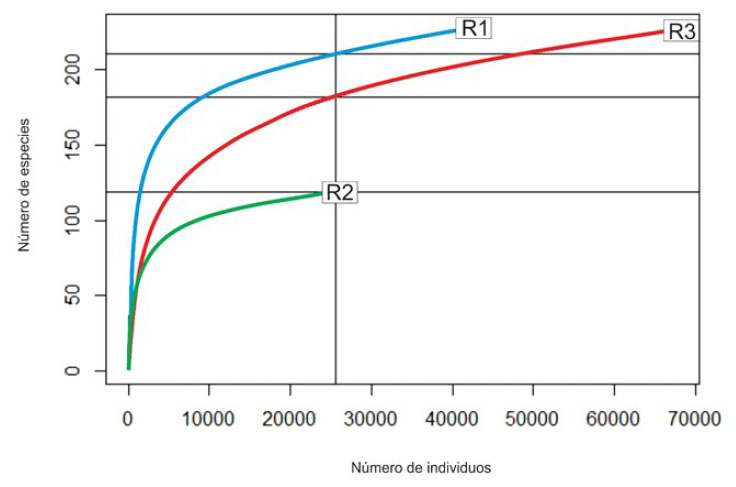
Figura 1 Curvas de rarefacción que muestran la diversidad de especies en las microbiotas intestinales de tres muestras de robalo (Centropomus sp) con relación al número de secuencias obtenidas
El estudio metagenómico de la muestra R1 mostró 11 géneros sobresalientes, de los cuales Rubritepida (17.94%) y Clostridium (37.91%) fueron los más dominantes. La muestra R2 presentó ocho géneros de los cuales resaltan Cetobacterium (12.44%) y Clostridium (32.16%). La muestra R3 presentó cuatro géneros sobresalientes en donde Photobacterium (49.24%) y Clostridium (36.53%) tuvieron mayor predominancia (Figura 2). Clostridium, del phylum Firmicutes, fue el género más dominante y estuvo presente en las tres muestras. Estudios recientes destacan que especies de los phylum Proteobacteria, Firmicutes, Actinobacteri, Fusobacteria, Bacteroidetes y Tenericutes son los más dominantes en el tracto gastrointestinal de los peces teleósteos (Llewellyn et al., 2014; do Vale Pereira et al., 2017).
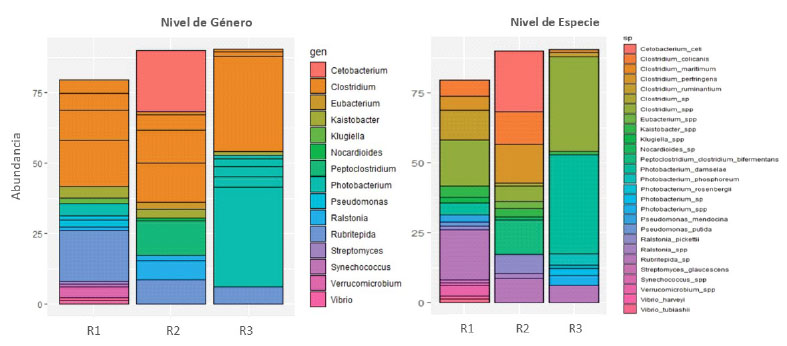
Figura 2 Composición taxonómica de la microbiota intestinal del robalo (Centropomus sp), Tumbes, Perú
Otros géneros sobresalientes fueron: Rubritepida, que requiere NaCl o sales marinas para su crecimiento. Es encontrado, además, en aguas termales saladas o lagos salinos. Este hallazgo tiene relación con el lugar de procedencia de las muestras, que son zonas estuarinas y de temperatura cálida. También se logró identificar Cetobacterium, que ha sido aislado a partir del intestino de peces como Oreochromis niloticus, Arapaima gigas, Cyprinus carpio y posee la capacidad de producir vitamina B12 (Ramírez et al., 2018), sugiriendo su rol en el metabolismo celular. Por otra parte, la abundancia relativa de especies de Clostridum en las muestras de robalo puede explicarse debido a su comportamiento simbionte con peces marinos hospederos (Clements et al., 2009), mientras que la presencia de Phtobacterium y Vibrio está relacionado al tipo de alimentación, y son encontrados comúnmente en peces carnívoros como Atlantic salmon, Salmo salar y Black rockcod, entre otros (Egerton et al., 2018).
Otros estudios mencionan que Photobacterium y Clostridium podrían ayudar a la digestión como también en la suplementación de ácidos grasos y vitaminas (Balcázar et al., 2006; Ray et al., 2012). Más allá de la simbiosis natural, algunas especies de Clostridium han sido utilizadas como probióticos en Oncorhynchus mykiss, incrementando la resistencia a vibriosis (Sakai et al., 1995); sin embargo, este género también está conformado por especies patógenas como C. botulinum, frecuentemente asociado a enfermedades en peces marinos.
La identificación molecular de los aislados mostró tres especies, incluyendo Klebsiella sp, dos cepas de Weisiella cibaria y Lactococcus sp. El género Klebsiella es conocido por ser responsable de una variedad de enfermedades en peces como Labeo rohita y Amphiprion nigripes (Gopi et al., 2016; Das et al., 2018). Por otro lado, cepas identificadas como Lactococcus sp y Weissella cibaria han sido reportadas como probióticos de uso común en la acuicultura. Heo et al. (2013) demostraron la capacidad probiótica de L. lactis en Paralichthys olivaceus, debido a la activación del sistema inmune. Por otro lado, W. cibaria ha sido aislada a partir del intestino de Salmo trutta y Salmo salar indicando que es un componente común de la microbiota intestinal de peces marinos (Al-Hisnawi et al., 2014); sin embargo, también ha sido aislada del intestino de peces de agua dulce (Maji y Mohanty et al., 2017). Su capacidad probiótica ha sido demostrada al reducir el número de bacterias patógenas y estimular la presencia de bacterias ácido lácticas (BAL) en la microbiota intestinal de Pseudoplatystoma sp (Mouriño et al., 2011).
La capacidad antagónica de BAL aislados del intestino de peces frente a patógenos bacterianos ha sido ampliamente demostrada. Además, se menciona que es la propiedad más importante de una bacteria con potencial probiótico (Banerjee y Ray, 2017). En el presente estudio, los aislados HE3B-3 Klebsiella sp, HE2C-4 W. cibaria, HE3C-4 cibaria y HE2C-1 Lactococcus sp demostraron su capacidad antagónica frente al menos una cepa patógena (Cuadro 1). Esto puede deberse a las propiedades que poseen las BAL para producir sustancias bactericidas como bacteriocinas, peróxido de hidrógeno y proteasas, entre otros (Zorriehzahra et al., 2016). Finalmente, Klebsiella sp y W. cibaria fueron las cepas con mejores capacidades antagónicas; no obstante, Klebsiella es considerada comúnmente un patógeno oportunista (Austin, 2005), mientras que W. cibaria es considerada como probiótico.
Cuadro 1 Actividad antagónica1 de aislados de intestino de robalo (Centropomus sp) frente a cuatro patógenos de peces (Tumbes, Perú)

1 '-' No evidenció formación de halos, '+' Halos de 4-8 mm, '++' Halos de 8-12 mm, '+++' Halos >12 mm
La microbiota cumple una función importante en la nutrición de los peces, y se debe principalmente a la producción de enzimas (Ray et al., 2012). En este estudio, los aislados HEB-3, HE2C-4, HE3C-4 y HE2C-1 fueron capaces de producir proteasas extracelulares demostradas en la formación de zonas transparentes alrededor de los pocillos en agar Skim Milk (5%)












 uBio
uBio 

