INTRODUCCIÓN
La trucha arcoíris (Oncorhynchus mykiss) es la principal especie dulceacuícola cultivada en el Perú, especialmente en Puno, Huancavelica y Junín (PRODUCE, 2017). La trucha es más susceptible a presentar enfermedades y alta mortalidad en los primeros estadios; es decir, en la etapa de alevinaje. Entre los patógenos más comunes se encuentra la bacteria Yersinia ruckeri (Flores, 2013). Esta es una bacteria Gram negativa, perteneciente a la familia Enterobacteriaceae. Afecta principalmente a salmónidos, siendo la especie más susceptible la trucha. Además, genera elevadas tasas de mortalidad, con más del 50% en muchos países, causando importantes pérdidas económicas en las granjas piscícolas (Flores, 2013).
Para el control de la yersiniosis se han usado diversos antibióticos, como oxitetraciclina, sulfadiazina en combinación con trimetropim, florfenicol, ácido oxolínico, flumequina y amoxicilina (Flores, 2013; Kumar et al., 2015). Dado el limitado espectro de antibióticos aprobados para uso en acuicultura, estos han ido generando resistencia a estos fármacos (Pandiyan et al., 2013). Por otro lado, en el Perú no existen vacunas comerciales disponibles, lo cual complica el control de este agente (Fernández, 2011; Bueno, 2012). Sin embargo, Cueva et al. (2016) desarrollaron en el país una vacuna experimental elaborada con aislados de Y. ruckeri, la cual ha tenido buenos resultados in vitro.
Dentro de este contexto, existen otras alternativas viables, tales como los probióticos; dado que el suministro de una dieta enriquecida con microorganismos probióticos proporciona una mejora del sistema inmune, asimilación de nutrientes y el desarrollo normal del pez, evitando infecciones bacterianas (Walter, 2012; Berdasco, 2016). Más aún, las bacterias benéficas extraídas del tracto digestivo de los peces tienen mayor facilidad de colonizar el tracto digestivo del hospedador (Henríquez, 2013; Muñoz, 2015).
Diversos estudios resaltan el uso de probióticos con un efecto antagónico frente a Y. ruckeri y otras bacterias que afectan el cultivo de trucha, tales como Lactobacillus spp, Lactococcus spp, y Bacillus spp (Balcázar et al., 2009; Burbank et al., 2012, Palíková et al., 2015). En el Perú son escasos los estudios sobre la microflora bacteriana de la trucha arcoíris o de aquellas con potencial benéfico frente a bacterias patógenas. Debido a esto, el objetivo de este estudio fue identificar bacterias nativas aisladas del tracto intestinal de trucha arcoíris con propiedades probióticas frente a Yersinia ruckeri.
MATERIALES Y MÉTODOS
Ubicación del Estudio
El estudio fue de tipo transversal. Los peces fueron donados por el Centro de Producción de Bienes y Servicios (CIPBS) de la Universidad Nacional del Altiplano (UNA), ubicado en el distrito de Chucuito, Puno, Perú, a una altitud de 3931 msnm. El procesamiento y toma de muestras, el análisis bacteriológico, la preparación de diluciones y el desafío in vitro se realizaron en el Laboratorio de Microbiología de la Facultad de Medicina Veterinaria y Zootecnia (FMVZ) de la UNA.
Peces
Se seleccionaron 48 truchas de estadios alevín y juvenil, aparentemente en buen estado de salud, con pesos promedio de 4 y 90 g y tallas promedio de 6 y 18.5 cm, respectivamente, provenientes del CIPBS. Los peces fueron trasladados al laboratorio, donde fueron anestesiados con eugenol (40-60 ppm) (Keeme et al., 1998). La eutanasia se realizó mediante el corte medular con un bisturí, entre el cerebro y la médula espinal (Rosenthal, 2013). Se hizo la apertura por el lado izquierdo de los especímenes, a partir de la línea lateral y el poro anal; de acuerdo con lo descrito por Ferguson (2006).
Aislamiento e Identificación de Colonias
Se hizo un corte del intestino delgado, entre la porción media y la porción posterior, se hizo un raspado de la mucosa del intestino con un ansa estéril y se procedió al sembrado por agotamiento en placa Petri con agar MRS (Man Rogosa Sharpe), e incubación a 28-30 °C durante 24-48 horas. Trascurrido el tiempo, se procedió a la observación macroscópica de las placas Petri y se seleccionaron las colonias con características de Lactobacillus (colonias pequeñas, blanquecinas cremosas) y Bacillus (colonias rizoides cremosas e irregulares).
Se hicieron tinciones Gram para determinar la morfología de las cepas con el apoyo de un microscopio de luz óptica (Leica ICC50 HD). Se seleccionaron las colonias Gram positivas de forma bacilar que eran compatibles con bacterias del género Lactobacillus y del género Bacillus. Estas cepas fueron sembradas e incubadas nuevamente a 28-30 °C durante 24-48 horas para purificar las colonias.
Efecto Inhibitorio frente a Y. ruckeri
La cepa patrón fue aislada de un brote de mortalidad en el Lago Titicaca, Perú, por el Laboratorio de Ictiopatología de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima y confirmada molecularmente por PCR. Para este estudio, la cepa fue reactivada y sembrada en agar tripticasa soya (TSA) y trasladada en menos de 24 h al laboratorio de la FMVZ-UNA.
Cada colonia aislada fue incubada a 2830 °C en tubos de ensayo conteniendo caldo MRS durante 24-48 horas y se procedió a realizar diluciones seriadas. Posteriormente, los ocho tubos de cada colonia fueron sembradas en placas Petri conteniendo Agar Plate Count e incubadas a 28-30 °C durante 24-48 horas, para luego realizar el conteo macroscópico de las colonias. Se seleccionar las placas que contenían 25-50 colonias. Se hicieron diluciones para obtener concentraciones de 1x107 UFC. En forma similar, la cepa de Y. ruckeri fue diluida para llegar a la misma concentración, tomando como referencia lo descrito por De Souza et al. (2010).
Los aislados identificados y caracterizados como Lactobacillus sp y Bacillus sp fueron sembrados en agar MRS e incubados a 28-30 °C durante 24-48 horas. Luego, utilizando un tubo de ensayo estéril se obtuvieron y retiraron discos de 9 mm de diámetro con agar MRS. Los discos fueron sobrepuestos en el medio de cultivo de agar McConkey sembrado con la cepa de Y. ruckeri (1x107 UFC) e incubados a 28-30 °C durante 24-48 horas, tomando como referencia a De Souza et al. (2010). Se realizaron tres repeticiones por cada bacteria aislada. Se consideraron como resultados inhibitorios aquellos discos que presentaron formaciones de halos mayores a 9 mm de diámetro.
RESULTADOS Y DISCUSIÓN
En el presente estudio, las muestras fueron tomadas de estanques un centro de cultivo, cuya fuente de agua proviene de un manantial y los peces son alimentados con una dieta comercial. De los 48 peces se pudo aislar cuatro bacterias ácido-lácticas (8.4%) de la porción del intestino medio posterior. De los aislados, tres fueron del género Lactobacillus y uno del género Bacillus (Figura 1)., Pond et al. (2006) describieron que la microbiota intestinal de la trucha arcoíris está compuesta principalmente por bacterias de los géneros Clostridium y Aeromonas. No obstante, es importante resaltar que, la composición microbiana del tracto intestinal de los peces depende principalmente de su ambiente y la composición bioquímica de su dieta (Wittwer, 2012).
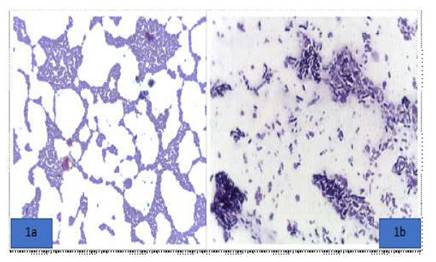
Figura 1 Colonias de bacterias aisladas del intestino delgado de trucha arcoíris (Oncorhynchus mykiss). 1a: Lactobacillus sp. 1b: Bacillus sp. Tinción Gram. 1000X
Los resultados obtenidos son congruentes con el trabajo de Muthukumar y Kandeepan (2015), quienes encontraron dos aislados de Bacillus spp, dos de Lactobacillus spp y uno de Macrococcus spp en peces de agua dulce, con alto potencial para adherirse a la mucosa intestinal y de inhibir el crecimiento de Aeromonas hydrophila. Asimismo, Balcázar et al. (2007) y Wittwer (2012) aislaron principalmente bacterias ácidolácticas (Lactobacillus) del tracto gastrointestinal de salmónidos, mientras que Henríquez (2013) logró aislar Lactobacillus spp y Bacillus spp en heces de salmón.
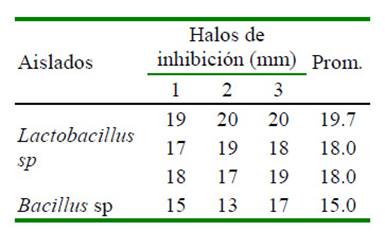
En el Cuadro 1 se observan los resultados de los halos de inhibición frente a Y. ruckeri, donde se considera que halos mayores a 9 mm de diámetro indican que existe inhibición del patógeno. Las cepas del género Lactobacillus son las que presentaron los mayores halos de inhibición, probablemente debido a que las bacterias ácido-lácticas (BAL) tienen la capacidad de producir ácidos orgánicos (ácido láctico y ácido acético), H O y, en algunos casos, bacteriocinas (Maji et al., 2016).
Cuadro 1 Halos de inhibición de Bacillus sp y Lactobacillus spp (tres repeticiones) frente a Yersinia ruckeri
Por otro lado, las bacterias Bacillus poseen capacidades de adhesión e inmunoestimulación, y son capaces de producir péptidos antibióticos, aminoácidos, vitaminas K y B12 y enzimas (Bagheri et al., 2008; Gisbert et al., 2014). En este sentido, Bagheri et al. (2008) y Adineh et al. (2013) reportaron que la suplementación con un probiótico comercial a base de Bacillus es beneficioso sobre el crecimiento y sobrevivencia en alevines de trucha, pues estimula la maduración del sistema digestivo.
Diversos estudios han señalado los efectos benéficos de administrar probióticos, como las bacterias aisladas en este estudio, para cultivo de peces (Jöborn et al., 1997; Robertson et al., 2000; Vásquez et al, 2005). Así mismo, Abbass (2010), Henríquez (2013) y Maji et al. (2016) señalaron que existe un consenso general sobre el beneficio de utilizar probióticos nativos extraídos de peces, dado que estos microorganismos se adhieren fácilmente a la pared intestinal y compiten con los microorganismos patógenos.
CONCLUSIONES
Se aislaron bacterias nativas de los géneros Lactobacillus y Bacillus del tracto intestinal de alevines y juveniles de la trucha arcoíris Oncorhynchus mykiss.
Los aislados de Lactobacillus sp y Bacillus sp mostraron inhibición in vitro frente a Yersinia ruckeri.












 uBio
uBio 

