INTRODUCCIÓN
La fluoxetina es un potente inhibidor selectivo de la recaptura de serotonina (ISRS) que actúa en el SNC, ampliamente utilizada en humanos, entre otros, para tratar depresión y trastorno obsesivo convulsivo (TOC) (Gram, 1994). Su empleo en perros se encuentra ampliamente documentado para el tratamiento de diversos tipos de agresividad, miedo y TOC (Fleischer et al., 2008). Esta droga se metaboliza, principalmente, por Ndesmetilación, dando lugar a la formación de norfluoxetina, metabolito que tiene mayor vida media y similar potencia que la fluoxetina (von Moltke et al., 1997). Esta metabolización se lleva a cabo a través de diversas isoenzimas del citocromo P450 (CYP450), siendo también capaz de inhibir su propia actividad. Estas características permiten asumir que la disposición de la droga y su metabolismo estereoselectivo están asociadas con diferentes respuestas, dependiendo de los polimorfismos que presenten las isoenzimas involucradas.
Diversos estudios han mostrado que las isoenzimas CYP2C9 y CYP2C19 juegan un importante rol en la N-desmetilación de la fluoxetina (Liu et al., 2001ab). A pesar del aumento en investigación sobre farmacogenética en humanos, existe una limitada investigación a este respecto en animales; no obstante, se han reportado diferencias raciales dentro de algunas especies domésticas como respuesta a sustancias exógenas y endógenas (Fleischer et al., 2008).
Teniendo en cuenta la importancia de conocer la correlación entre las características fenotípicas, genéticas y la respuesta a medicamentos, la Animal Pharmaceutics and Technology Focus Group de la American Association of Pharmaceutical Scientists (AAPS - www.aps.org), viene realizando trabajos sobre la fisiología y el metabolismo de distintas razas que podrían influir tanto en el uso de perros como en modelos animales, así como en el desarrollo de drogas para su uso en ellos.
De acuerdo con los antecedentes que evidencian la gran diversidad genética existente, no es sorprendente que haya diferencias metabólicas y fisiológicas que puedan influir no solo en la propensión a ciertas enfermedades, sino además, en la farmacocinética de diversas drogas y, por ende, en su respuesta farmacológica (Egenvall et al., 2000; Parker et al., 2007). Teniendo presente que se ha logrado establecer el mapa genómico para un número importante de razas (Ostrander y Wayne, 2005; Parker y Ostrander, 2005), junto con la evidencia de que las diferencias metabólicas entre razas afectarían la farmacocinética y farmacodinamia de las drogas, es prudente pensar que en el caso de la fluoxetina, la velocidad de absorción, el curso temporal de la concentración plasmática y, por ende, su biodisponibilidad, deberían mostrar diferencias al ser administrada entre razas de perro. Por lo tanto, el objetivo de este trabajo fue investigar posibles diferencias en el curso temporal de la fluoxetina entre dos razas de perros filogenéticamente distantes entre ellas,Akita inu y Pastor alemán.
MATERIALES Y MÉTODOS
Ubicación y Animales
El estudio se desarrolló en la ciudad de Viña del Mar, Región de Valparaíso, Chile, entre los años 2017 y 2019.
Como criterios de inclusión se consideraron a perros de las razas Akita inu y Pastor alemán, machos y hembras, entre 1 y 4 años de edad, intactos o castrados, con apropiada funcionalidad hepática y renal, alimentados con extruido que cumpliera con los requerimientos de la Asociación de Oficiales Americanos Controladores deAlimentos (AAFCO - por su sigla en inglés), ajustados al estándar de la raza de acuerdo a lo dispuesto por la Federación Cinológica Internacional (FCI), y con certificado de inscripción del Kennel Club de Chile. Además, no debían presentar trastornos de conducta, condición que debía ser evaluada por un médico veterinario especializado en etología clínica. Fueron excluidos del estudio perros que estuvieran recibiendo tratamiento farmacológico, que presentaran enfermedad renal o hepática, aguda o crónica, enfermedad digestiva, epilépticos, cardiópatas, diabéticos, con problemas de nutrición, dislipidemia, hipercatabólicos o con secuelas de una infección masiva, alérgicos al principio activo considerado en este estudio y hembras en celo.
Consideraciones Éticas
Una vez seleccionado el paciente, se sostuvo una entrevista presencial con el tutor responsable del perro, para invitarlo a participar de la investigación. Se le solicitó la firma de un consentimiento informado, documento ajustado a las recomendaciones de la Comisión Nacional de Investigación Científica y Tecnológica de Chile (CONICYT). Se consideraron, además, las indicaciones de la Ley 20.380 sobre protección de los animales (Ley 20.380, 2009). Asimismo, el proyecto fue aprobado por el Comité de Ética Científico Institucional, de la Universidad Santo Tomás (CEC - UST 05/2017).
Procedimiento
En una fase inicial y con base a los criterios indicados, se seleccionaron 10 perros Akita inu y 10 Pastor alemán. El tamaño de la muestra se determinó de acuerdo con las recomendaciones de la Food and Drug Administration (FDA, 2016) sobre estudios de bioequivalencia, donde se plantea que para que un estudio sea aceptado internacionalmente se requiere de un mínimo de seis individuos. Sin embargo, considerando la posibilidad de que durante el estudio ocurrieran bajas por muerte, enfermedad o retiro voluntario de la investigación por parte del tutor del perro, se incluyeron 10 individuos por cada grupo.
A cada perro se le realizó hemograma (hematocrito, recuento de eritrocitos, medición de hemoglobina, índices deWintrobe, recuento de reticulocitos [en caso de anemia], recuento de plaquetas y estudio microscópico de frotis), perfil bioquímico (proteínas totales, albúmina, creatinina, nitrógeno ureico en sangre [NUS], glucosa, fosfatasa alcalina [FA], alanina transaminasa [ALT], aspartato aminotransferasa [AST], gamma-glutamil transpeptidasa [GGT], bilirrubina total, bilirrubina indirecta, bilirrubina directa, Ca y P) y perfil lipídico (colesterol, triglicéridos, -lipoproteínas de alta densidad [HDL] y -lipoproteínas de baja densidad [LDH]). Las muestras fueron analizadas enuncontador hematológicoHumanCount30TS y en un analizador bioquímico automatizado Landwind LW C100.
En la segunda fase, una vez comprobada la elegibilidad de los perros, se indicó un ayuno de 12 horas pre-administración de fluoxetina (Prozac®) y de 6 horas pos-administración, a razón de 1 mg/kg vía oral en dosis única (DL50 en perros - 100 mg/kg). Posteriormente, se tomaron muestras de sangre en tubos sin anticoagulante al tiempo 0 (previo a la medicación) y 1, 2, 3, 6, 12, 24, 48 y 80 horas pos-administración. Las primeras siete muestras (0-24 horas) se obtuvieron con el paciente internado en el Hospital Escuela y las dos últimas en el domicilio de los pacientes. Las muestras fueron centrifugadas a 1800 g en centrífuga refrigerada, el plasma sanguíneo fue almacenado a -20 ºC hasta efectuar las determinaciones mediante cromatografía líquida de alta eficacia (HPLC).
Ffluoxetina y Norfluoxetina
Se realizó la prueba de aptitud del sistema HPLC en el Laboratorio de Ciencias Farmacéuticas de la Escuela de Química y Farmacia de la Universidad Andrés Bello, Viña del Mar, Chile. Los parámetros para evaluar, luego del análisis de una solución estándar en quintuplicado, fueron: tiempo de retención, factor de capacidad, platos teóricos, factor de asimetría y resolución.
Los estándares primarios de fluoxetina y norfluoxetina fueron adquiridos a Sigma® (USA). Las soluciones se prepararon en agua calidad Milli-Q. Las soluciones stock de las drogas y sus metabolitos fueron preparadas en metanol calidad HPLC, almacenadas a 20 °C y utilizadas en un plazo no mayor a un mes de su preparación.
Se utilizó un equipo HPLC Shimadzu (UFLC Prominence LC-20), con unidad desgasificadora (DGU-20 A 5R), unidad de entrega de solvente (LC-20AD), unidad de autosampler (SIL-20AC HT), horno (CTO20AC), lectores (SPD-20 AV /UV VIS detector y RID-10A / refractive index detection)y comunication bus module (CBM). La fase móvil utilizada fue la mezcla de acetonitrilo, agua y trietilamina en una proporción 480:500:20, ajustada a pH 4.7 con ácido fosfórico. Los análisis se realizaron en el laboratorio BioTecnos®, laboratorio asociado al Centro de Innovación de la Pontificia Universidad Católica de Valparaíso, Chile. Todas las muestras se analizaron por triplicado.
Disoluciones de trabajo
A partir de una disolución patrón de 1 mg/ml para cada compuesto, se prepararon soluciones de trabajo a concentraciones de 100 µg/ml en metanol. Estas fueron utilizadas para la elaboración diaria de las disoluciones necesarias para cubrir el rango de concentraciones estudiado.
Preparación de muestras de plasma
Para cada muestra de sangre se utilizó una alícuota de 1 ml, a la que se adicionó 80 µl de clomipramina (1 mg/l) como estándar interno. Se mezclaron durante 3 min con vortex, con 4 ml de solución acetonitrilo al 20% y se llevó a 10 ml con acetonitrilo (100%). La mezcla fue centrifugada a 1000 g durante 15 min y filtrada a través de filtros Milli-pore de 0.45 µm.
Validación de la técnica analítica
De acuerdo con las directrices de la FDA, se estudió la linealidad, repetibilidad y reproducibilidad, rendimiento, límite de cuantificación y supresión iónica (FDA, 2014). Se utilizó el programa estadístico R-studio para determinar el system suitability test y la linealidad del sistema.
Validación del Método Analítico
- Especificidad. Se realizaron pruebas cromatográficas para mostrar que los tiempos de retención del analito de inte rés no presentaba interferencias con las señales endógenas del plasma.
- Linealidad. El rango de concentracio nes de fluoxetina trabajado fue entre 10 y 300 ng/ml.
- Exactitud y precisión. Se obtuvo reali zando una cuantificación del analito en plasma fortificado con fluoxetina y clomipramina en concentraciones cono cidas. La relación de área se ingresó en la curva de calibración para obtener un valor para concentración. Este valor se comparó con el valor real de concentra ción. La medición se realizó por triplica do y en tres niveles de concentración (bajo, medio y alto). Para determinar la precisión del método se calculó el pro medio, desviación estándar (DE) y co eficiente de variación (CV) para cada punto.
- Límite de cuantificación (LOQ). Me nor punto del rango de concentración uti lizado para establecer la linealidad del método si la precisión del LOQ es me nor al 20% y la exactitud se encuentra dentro de un rango de ±20%.
- Recuperación del proceso de extrac ción. Se realizó cuantificación del analito en plasma y solución stock en concen traciones conocidas. Las muestras de plasma se sometieron al proceso de ex tracción descrito para el método. La medición se realizó por triplicado y en tres niveles de concentración (bajo, medio y alto). Se comparó la relación de área obtenida en las muestras de plasma respecto a las obtenidas en las muestras soluciones stock.
-Límite de detección. Menor cantidad de analito en una muestra que puede ser detectada, pero no necesariamente cuantificada con exactitud.
RESULTADOS Y DISCUSIÓN
Validación del Método Analítico
-Linealidad. Se encontró una alta correlación entre las razones de área de los picos de fluoxetina y clomipramina (Cuadro 1).
Cuadro 1 Coeficiente de regresión lineal entre fluoxetina y clomipramina, concentraciones de fluoxetina entre 10 y 300 ηg/ml Concentración (ng/ml)
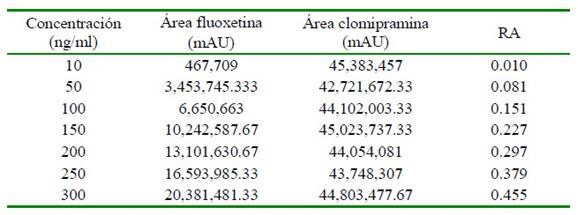
Los resultados muestran una alta correlación entre las razones de área de los picos de fluoxetina y clomipramina (estándar interno), como lo demuestra el coeficiente de regresión lineal obtenido: r=0.9995
-Exactitud y precisión. Los valores del coeficiente de variación fueron del orden del 2%.
-Límite de cuantificación. El LOQ fue de 10.53 ng/ml.
-Recuperación del proceso de extracción. Los valores obtenidos para el porcentaje de recuperación fueron, en promedio, de 75%.
-Límite de detección. Se alcanzó a los 3.36 ng/ml.
Análisis Sanguíneos
Se observaron diferencias significativas en 14 analitos (45.2%). En el hemograma, 72.7% de los analitos presentaron diferencias significativas entre razas (hemoglobina, hematocrito, VCM, CHCM, leucocitos, neutrófilos, monocitos y eosinófilos) (Cuadro 2); en el perfilbioquímico,ocurrióenel31.2%delosanalitos (globulina, relaciónal búmina/globulina, NUS y Ca) (Cuadro 3) y en el perfil lipídico solo se observó en el LDL (Cuadro 4).
Cuadro 2.Resultados del hemograma en perros de las razas Pastor Alemán y Akita inu
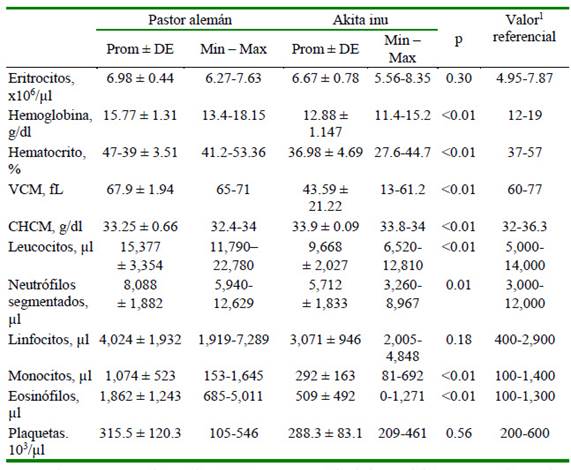
VCM: volumen corpuscular medio; CHCM: concentración de hemoglobina corpuscular media
Cuadro 3 Resultados del perfil bioquímico en perros de las razas Pastor Alemán y Akita inu
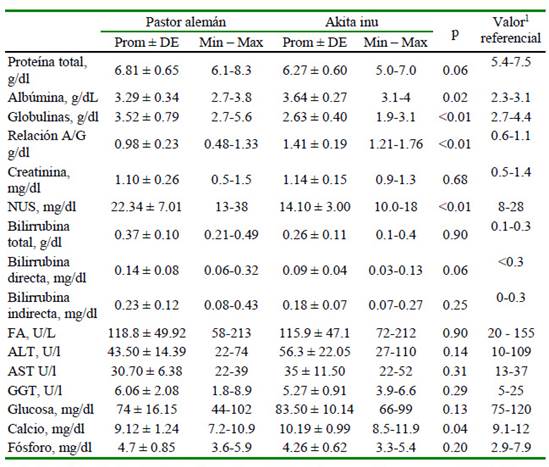
Relación A/G: relación albúmina /globulina; NUS: nitrógeno ureico en sangre; FA: fosfatasa alcalina; ALT: alanina transaminasa; AST: aspartato aminotransferasa; GGT: gamma-glutamil transpeptidasa
Cuadro 4 Resultados del perfil lipídico en perros de las razas Pastor Alemán y Akita inu
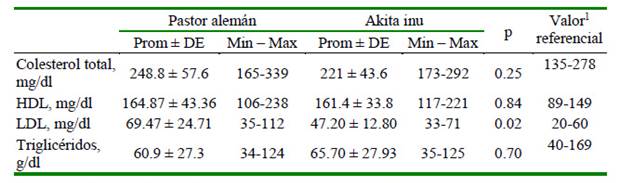
HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad
Los resultados reafirman la necesidad de desarrollar una línea de investigación respecto de los fenotipos bioquímicos para las diferentes razas de perro, ya que estas diferencias permiten presumir posibles diferencias en la farmacogenética. Estas divergencias interraciales coinciden con lo postulado por Infante et al. (2015), quienes explican que puede haber casos de no homogeneidad genética dentro del mismo grupo racial debido a los polimorfismos genéticos. Si se toman en cuenta estas diferencias, sería un paso más en los avances de la medicina veterinaria, considerando la evidencia de estudios que consideran diferencias entre razas, edad, sexo, estado reproductivo y tamaño del animal (Sharkey et al., 2009; Rosset et al., 2012; Lawrence et al., 2013; Brenten et al., 2016; Chang et al., 2016).
Tal y como lo plantean Lavoué et al. (2013), hay razas que se beneficiarían con intervalos de referencia específicos. Un ejemplo es el Akita inu y la microcitosis marcada observada en el estudio. Según Rizzi et al. (2010), de no conocerse las características bioquímicas de cada raza, los médicos veterinarios podrían realizar tratamientos farmacológicos para contrarrestar una anomalía que realmente no es tal. Otro ejemplo podría ser la monocitosis y eosinofilia en el 40 y 60% de los pastores alemanes, respectivamente, encontrados en el estudio, lo que sugeriría una característica de la raza, tomando en cuenta que la totalidad de los perros muestreados se encontraban clínicamente sanos al momento del estudio.
Análisis Cromatográfico
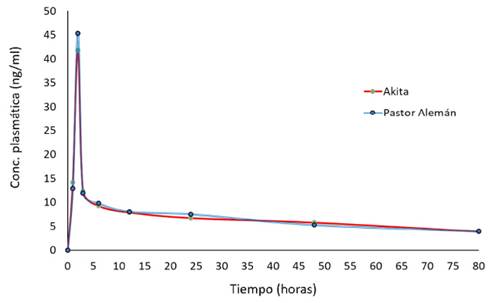
De los 20 perros incluidos en el estudio, solo 12 llegaron al final de la segunda etapa de la investigación y 11 la concluyeron satisfactoriamente. A través de análisis de los resultados analíticos de las concentraciones plasmáticas de fluoxetina por raza y por individuo se construyó la curva promedio de concentraciones plasmáticas de fluoxetina versus el tiempo transcurrido desde la administración del fármaco hasta las 80 horas.
Las concentraciones máximas se obtuvieron a las 2 horas en ambas razas (Cuadro 5, Figura 1), habiendo diferencia significativa entre razas (p<0.05). Este resultando es relevante, dado que, en la práctica clínica, las posologías son definidas indistintamente de la raza en la práctica clínica. De otra parte, considerando el límite de detección y de cuantificación del método, las concentraciones mínimas se observaron a las 80 horas en ambas razas.
Cuadro 5 Concentraciones plasmáticas de fluoxetina (promedio ± DE, ng/ml) por raza de perros
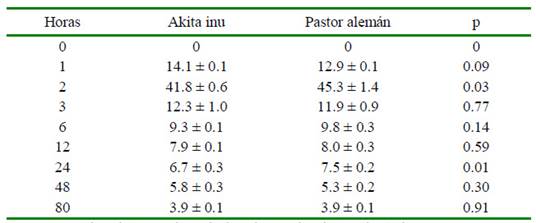
La concentración máxima se observó a las 2 horas y la mínima a las 80 horas
CONCLUSIONES
Se puede presumir que, debido a las diferencias en la curva temporal de fluoxetina, el manejo farmacológico debería ser diferente entre razas filogenéticamente diferentes.
A partir de los resultados observados, se debería prestar atención a la necesidad de actualizar los intervalos de referencia establecidos para la especie canina, especialmente, en grupos filogenéticos de razas de perros.












 uBio
uBio