INTRODUCCIÓN
Salmonella es una bacteria que puede causar salmonelosis no tifoidea en humanos, siendo la segunda causa de enfermedades esporádicas y brotes alimentarios en el Este de Europa (EFSA & ECDCD, 2017). En Colombia, según la información reportada por el Instituto Nacional de Colombia en 2018, fue la primera causa de brotes de origen alimentario (INS, 2018). Esta bacteria, al infectar animales de sangre caliente, puede contaminar los productos cárnicos, de allí que se le considera como un serio problema para la salud pública (Rönnqvist et al., 2018), donde los cerdos y los productos cárnicos son una fuente importante de salmonelosis.
La Autoridad Europea de Seguridad Alimentaria (EFSA) atribuye el 8.9% de los casos de salmonelosis humana al consumo de carne de cerdo (EFSA & ECDCD, 2016). En ciertos casos, el agua contaminada resulta ser el principal factor de riesgo para que los cerdos se infecten con Salmonella (Andres y Davies, 2015; Jensen et al., 2006; Gotter et al., 2012; Giraldo et al., 2019). La calidad del agua se puede mantener con el uso de compuestos clorados y ácidos orgánicos, entre otros; no obstante, pueden generar efectos adversos, tanto en la salud humana y animal como en el medio ambiente (Sedlak y von Gunten, 2011). Los agentes desinfectantes más empleados son los compuestos a base de cloro, dióxido de cloro o peróxido de hi-drógeno, siendo la eficacia de la desinfección dependiente del agua a ser tratada, la dosis del desinfectante y la frecuencia de su aplicación (Li et al., 2017).
El hipoclorito de sodio, el ácido peracético y el peróxido de hidrógeno son los principales productos empleados por la desinfección de las aguas. Entidades internacionales como la Organización de las Naciones Unidas para la Alimentación y laAgricultura (FAO, 2008) aceptó su implementación en granjas de animales. Estos agentes favorecen la disminución de la carga microbiana presente en las superficies de equipos y en procesos que incluyen agua (Li et al., 2017). Por otro lado, la FAO indica que el uso de desinfectantes a base de cloro no debe exceder concentraciones de 20-50 ppm al adicionarse al agua y el ácido peracético no puede exceder las 150 ppm, ya que es una sustancia corrosiva y comburente a concentraciones superiores al 10% (v/v) (FAO, 2008).
Los problemas que acarrean el uso de este tipo de sustancias químicas han llevado a la búsqueda e implementación de nuevas tecnologías, como los procesos de oxidación avanzada (POA), definidos como métodos de oxidación físico/químicos en fase acuosa, basados principalmente en la generación de especies reactivas de oxígeno con elevado poder oxidante, baja selectividad y elevada acción bactericida sobre diferentes tipos de microorganismos y estructuras de resistencias (Lydakis 2010; Guo et al., 2017a; Demirel et al., 2018). Esta tecnología podría ser una alternativa eficaz para disminuir el uso de compuestos químicos que pueden tener un efecto adverso para el ser humano y el medio ambiente.
Una de las tecnologías más utilizadas en los procesos de oxidación avanzada empleados para la inactivación de microorganismos es la fotólisis con luz ultravioleta (Moreno et al., 2016; Moreira et al., 2018; Hinds et al., 2019). La inactivación por fotólisis UV se realiza en cortos periodos de tiempo y es eficiente porque genera daños directos o indirectos sobre diferentes componentes celulares. Estos absorben la radiación UV generando un incremento en su energía (estado excitado), lo que ocasiona ruptura de enlaces y pérdidas de la integridad celular (fotólisis directa). En la fotólisis indirecta se producen radicales altamente reactivos o especies reactivas de oxígeno, que causan daños oxidativos a nivel de pared y peroxidación de fosfolípidos de membrana, así como de daños irreversibles en el ADN (Nelson et al., 2018). Esto es causado porque las bases purinas y pirimidinas absorben fuertemente la radiación ultravioleta promoviendo transiciones en las bases nitrogenadas que constituyen los nucleótidos, alteran la formación de enlaces, forman dímeros e hidratos que no son funcionales. Ambos tipos de dímeros alteran los procesos de transcripción de genes y de duplicación del ADN, ya que tanto la ADN polimerasa como la ARN polimerasa no son capaces de leer la hebra de ADN o ARN (Guo et al., 2017b; Butot et al., 2018; Nelson et al., 2018).
Por esta razón, el objetivo de este estudio fue evaluar tres tratamientos (UV254 nm, fotólisis UV254 nm con peróxido de hidrógeno H2O215 ppm y peróxido de hidrógeno H2O2 a 15 ppm), para la inactivación de Salmonella spp inoculada artificialmente y remoción de materia orgánica en agua provenientes de granjas porcícolas. Se espera determinar una alternativa a la desinfección química que se realiza de forma rutinaria en granjas alejadas de los grandes centros urbanos.
MATERIALES Y MÉTODOS
Muestreo y Caracterización del Agua
El muestreo se realizó en dos granjas porcícolas ubicadas en el departamento de Cundinamarca, Colombia. En cada granja se tomaron muestras del sitio de captación (punto de ingreso de agua a la granja) y punto de disposición (salida del agua en los corrales).
Se seleccionaron estos puntos por ser los lugares donde ingresa el agua a las granjas y el agua final de bebida de los cerdos. Para cada muestra se tomaron 5 L para realizar la determinación de pH, conductividad, demanda química de oxígeno en mg/l (DQO) (Standard Method 5220), nitratos en mgL-1 (Kit HACH 8039 para NO3), nitritos en mgL-1 (Kit HACH 8192 para nitritos) y detección de Salmonella spp usando el 3M™ Sistema de detección molecular (MDS), donde previamente se hizo filtración por membrana de acuerdo al método descrito por la American Public Health Association (A.P.H.A., 2017).
Cepa de Salmonella
En los ensayos se empleó una cepa de Salmonella spp previamente aislada de una granja porcícola (Giraldo et al., 2019). La bacteria se reactivó a partir del banco de cepas delLaboratoriodeMicrobiología deAlimentos, empleando caldo Infusión Cerebro Corazón (BHI) e incubando por 24 h a 35 °C.
Condiciones para el Proceso de Inactivación y Remoción de DQO
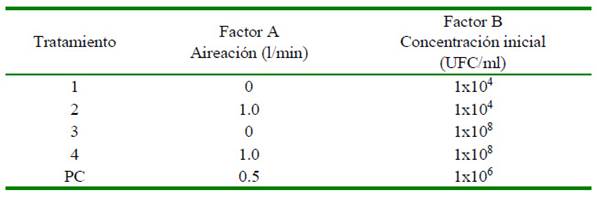
Para evaluar el efecto de la aireación y la concentración inicial del microorganismo que favorecen la inactivación por fotólisis, se realizó un diseño factorial de 2x2 con tres puntos centrales (PC) (Cuadro 1). Para tener mayor control del experimento, dado que en el agua de las granjas no se detectó Salmonella spp, el agua se esterilizó y se inoculó con una suspensión de Salmonella spp, que tenía una concentración de 1x108 UFC/ ml.Al finalizar el proceso, se realizó la dosificación del agua para tener las concentraciones a evaluar en el factor B y los puntos centrales. De esta forma se pudo evaluar la inactivación y el efecto de la carga de la materia orgánica presente en el agua y expresada como DQO.
Para el experimento, se utilizaron dos reactores cúbicos de 20x40x5 cm (ancho, largo y profundidad), divididos en dos secciones similares (20x20x5 cm). En cada sección se colocaron difusores de vidrio de aire de 19 cm2, con un diámetro interno de 2 mm y orificios de 1 mm separados cada 5 cm. Los reactores fueron colocados dentro de una caja hecha de láminas de metal galvanizado (60x50x30 cm). Posteriormente, se instalaron dos lámparas de luz ultravioleta con mercurio como gas inerte para tener una emisión máxima de 254 nm (Philips TUV 18, 15 W, longitud de onda 254 nm). Las lámparas se ubicaron sobre cada reactor, a 10 cm de distancia de cada uno (Blanco et al., 2018). En cada reactor se colocaron 500 ml de agua inoculada y las lámparas fueron encendidas durante 60 minutos; luego se retiró el agua, la cual fue utilizada para determinar el porcentaje de inactivación de Salmonella spp (Ecuación 1), la remoción de DQO (Ecuación 2) y el pH final.
donde, en la Ecuación 1, UFC/ml iniciales corresponden a los recuentos iniciales y UFC/ ml finales son los recuentos a los 10 minutos de exposición a la luz ultravioleta, y en la Ecuación 2, DQO inicial es la concentración en mg/l y DQO final es la concentración en mg/l final a los 10 minutos de exposición a la luz ultravioleta.
Cinéticas de Inactivación y Remoción a Escala de Reactor Fotolítico
De acuerdo con los resultados del diseño factorial se seleccionaron las condiciones para las cinéticas de inactivación y remoción, empleando el mismo reactor y el agua se re inoculó con Salmonella spp. Cada cinética se realizó por triplicado y se evaluaron tres tratamientos (T1: fotólisis UV254nm, T2: fotólisis UV254/H2O2 a15 ppm y T3:H2O2 a15 ppm(producto químico usado en la granja).
A cada uno de los reactores se adicionaron 1500 ml del agua re inoculada. Se tomaron muestras iniciales cada 15 segundos para el primer minuto, hasta completar 15 minutos. Se realizaron recuentos de las bacterias sobrevivientes en agar de xilosa, lisina, desoxicolato (XLD), se estimó el porcentaje de inactivación y se determinó la concentración final de DQO, NO3 y pH. Las concentraciones se transformaron a porcentaje de remoción siguiendo la metodología reportada por Blanco et al. (2018).
Análisis Estadístico
Para el diseño factorial 2x2 se realizó un análisis de varianza y análisis de regresión empleando el programa Desing Expert 6.0. Por otro lado, se realizó una comparación de medias entre tratamientos para seleccionar el mejor de los cuatro tratamientos, empleando una prueba de Tukey con un alfa 0.05 utilizando el programa SAS 9.0. Para las cinéticas de inactivación se realizó una comparación de medias entre tratamientos a los 15 minutos. Adicionalmente, se realizaron correlaciones entre las variables porcentaje de inactivación, remoción de DQO, NO3 y pH, empleando el programa SAS 9.0.
RESULTADOS
Caracterización del Agua Residual
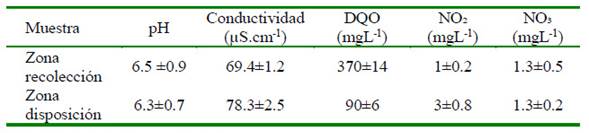
En las aguas obtenidas de las granjas no se detectó la presencia de Salmonella spp. Los resultados de los parámetros fisicoquímicos, del pH y de la conductividad estuvieron dentro de los rangos aceptables para aguas provenientes de acueductos veredales (Cuadro 2). Se detectaron concentraciones variables para DQO, NO2 y NO3, lo cual puede relacionarse con el origen del agua empleada para las granjas porcícolas, ya que en algunas regiones de Colombia no se utilizan el agua potable para la cría y levante de ganado porcino.
Condiciones que Favorecen el Proceso de Inactivación
El modelo de regresión porcentaje de inactivación de Salmonella spp fue significativo (R2 = 0.95; p=0.025). El factor que tuvo el porcentaje de contribución más alto fue la concentración inicial de Salmonella spp (B) con 96.02% y un valor de p=0.008. El factor aireación (A) y la interacción de AB no fueron significativos (Cuadro 3).
Cuadro 3 . Resultados del análisis de varianza y coeficientes de regresión para el diseño factorial 22 con tres puntos centrales
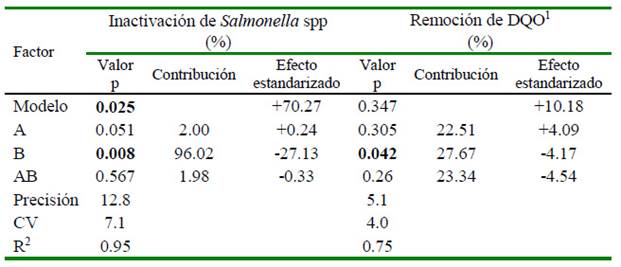
1 Demanda química de oxígeno
A: Kit HACH 8039; B: Concentración inicial (UFC/ml); AB: Interacción de los factores
En negrilla se presentan el modelo y los factores que fueron significativos con un valor de p<0.05
En el caso de la remoción de DQO el R2 del modelo fue de 0.75 (p=0.347), donde en forma similar, el factor significativo fue la concentración inicial (p=0.042). El factor Ay la interacciónAB tampoco fueron significativos (Cuadro 3).
En la Figura 1 se presentan los resultados para el porcentaje de inactivación de Salmonella spp, remoción de DQO y pH final en función de los cuatro tratamientos. Se observaron diferencias significativas entre tratamientos (p<0.0001) con respecto al
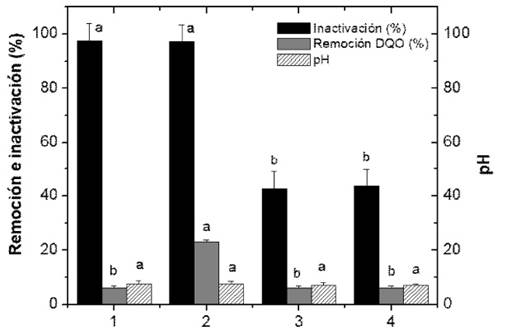
Figura 1 . Resultados obtenidos para el diseño factorial 22 con tres puntos centrales. Los resultados presentados en esta figura corresponden al promedio de tres réplicas con su respectiva desviación estándar. Las letras sobre las barras representan las diferencias significativas entre tratamientos
porcentaje de inactivación de Salmonella spp, siendo mejores en T1 (97.5 ± 2.0%) y T2 (97.3 ± 1.9%) con respecto a T3 (42.6 ± 1.1%) y T4 (43.7 ± 2.1%). Por otra parte, no se observaron diferencias significativas entre T1 y T2 ni entre T3 yT4 (Figura 1).
El mejor porcentaje de remoción de DQO se presentó en T2 (23 ± 2%), seguido por T3(6.5 ± 0.9%), T2(5.7 ± 0.5%) y T1(5.6 ± 0.4%), no habiendo diferencias significativas entre estos últimos (Figura 1). Los valores finales de pH oscilaron entre 7.1 ± 0.8 y 7.6 ± 0.5.
Cinéticas de Inactivación y Remoción a Escala de Reactor Fotolítico
El agua reinoculada con Salmonella spp tuvo un pH de 7.9, conductividad de 68.8 µS.cm-1, DQO 250 mg/l, nitritos 1.0 m/gl, nitratos 0.6 mg/l y una concentración inicial de Salmonella spp de 24x105 UFC/ml.
La inactivación de Salmonella spp por UV254 nm(T1) y UV254/H2O2 (T2)fue del 99.9 ± 2.4% a los 30 s de exposición a la luz ultravioleta sola yluzultravioleta con peróxido de hidrógeno. La inactivación con solo H2O2 no superó el 50% a los 15 min, siendo T1 y T2 significativamente diferente a T3 a los 30 s y a los 15 min (p<0.0001; Figura 2a). Por otro lado, al evaluar si presentaban procesos de reactivación al finalizar los tratamientos (15 min), se logró recuperar Salmonella spp en T2 y T3 con recuentos de 8 UFC/ml y 3x103 UFC/ml, respectivamente.
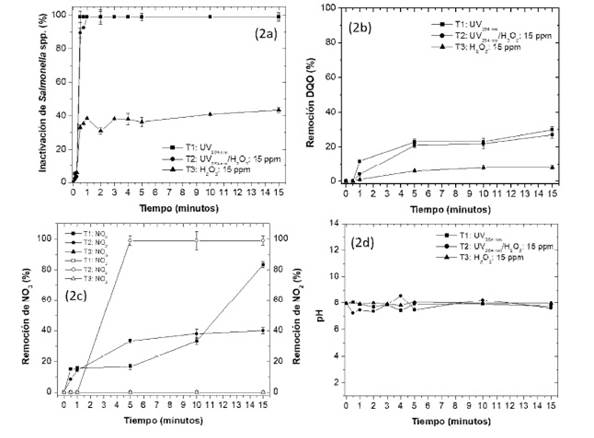
Figura 2 Cinéticas de inactivación para Salmonella spp y remoción de parámetros químicos en reactor fotolítico. (A) Porcentaje de inactivación de Salmonella spp (B) Porcentaje de remoción de DQO, (C) Remoción de NO3 y NO2 (%). (D) pH. Promedio ± DE de tres réplicas
La remoción de DQO (inicial 250 mg/l) se incrementó en función del tiempo en los tres tratamientos (Figura 2b). Sin embargo, los valores más altos fueron en T1 y T2 a los 15 min (30 ± 2% y 27 ± 3%, respectivamente), siendo significativamente superior (p<0.0001) que en T3 (8 ± 1%).
La remoción de NO3 solo se evidenció en T1 y T2 (inicial 0.6 mg/l), alcanzando porcentajes máximos de 83 ± 4% y 41 ± 1%, respectivamente, a los 15 minutos, siendo significativamente inferior menos en T3 (p<0.0001; Figura 2c). En relación con los NO2 (inicial 1 mg/l) solo hubo remoción en T2 (99 ± 5%) desde los 5 min, siendo significativamente en T1 y T3 (p<0.0001) (Figura 2c). Por otra parte, el pH (inicial 7.9) no presentó cambios significativos en el tiempo entre los tres tratamientos (Figura 2c).
DISCUSIÓN
Las muestras analizadas, si bien no se detectó Salmonella spp, se evidenció la presencia de bacterias de la familia Enterobacteriaceae (datos no mostrados). Las aguas analizadas provenían de acueductos veredales donde no se cuentan con todos los controles que se realizan en los acueductos municipales. Además, el uso de mangueras que reposan en el suelo y con acoples con materiales defectuosos favorecen la contaminación del agua. La presencia de DQO se relaciona con el contenido de materia y carbono orgánicos, los cuales deberían ser bajos (5.0 mg/l para carbono orgánico total si el sistema de potabilización es eficiente), corroborando que el agua empleada en las granjas no es potable (Resolución 2115 del 2007). Asimismo, las bacterias Enterobacteriaceae reducen el NO3 a NO2, bajo condiciones reducidas de oxígeno. Estos iones disueltos y la DQO son los responsables de la conduct-ividad inicial encontrada en estas aguas.
Al evidenciar que el agua presentó algunas alteraciones de tipo químico, se evaluó si con estas características y re inoculando el agua con Salmonella spp era factible implementar a escala de laboratorio tres tratamientos para la inactivación de esta bacteria y remoción de materia orgánica. El uso de luz ultravioleta de alta energía (254 nm) requiere de una serie de condiciones de operación (tipo y energía de las lámparas, concentración de oxígeno, concentración inicial del microorganismo, iones disueltos y pH, entre otros) para que el tratamiento sea eficiente en cortos periodos de tiempo (Moreno et al., 2016). En este sentido, se determinó que la concentración inicial de Salmonella spp tuvo un efecto significativo (p<0.005) sobre el porcentaje de inactivación, ya que se demuestra que a concentraciones bajas (1x104 UFC/ml) se favorece la inactivación (99.9% a los 10 min), en tanto que a concentraciones altas (1x108 UFC/ml) las bacterias actuaron como sólidos en suspensión y generaron turbidez en el agua. Bajo estas condiciones la radiación UV no penetra en forma eficiente y no todas las células absorben los fotones, responsables de iniciar el daño directo sobre los componentes celulares (ácidos nucleicos, lípidos, proteínas, entre otros) (Nelson et al., 2018; Hinds et al., 2019).
Por otro lado, la fotólisis indirecta mediada por las especies reactivas de oxígeno (ROS) también es afectada por la concentración inicial del microorganismo a inactivar. Al tener concentraciones altas, parte de ellas no son afectadas por las ROS que se producen en los primeros minutos de tratamiento y que son las responsables de iniciar el daño oxidativo a nivel de membrana. Hay una protección por apantallamiento entre células (las más cercana a la luz UV protegen a las que están en la parte más interna de la suspensión); además, las células afectadas por los radicales libres pueden generar procesos de auto recuperación (Benabbou et al., 2007; Butot et al., 2018). Esto también ha sido observado al evaluar la inactivación de Salmonella Enteritidis y Salmonella Typhimurium re inoculada en aguas de chiller provenientes de industria avícola (Hernández, 2012; Hernández et al., 2013). La inactivación de las bacterias fue de 99.9% cuando la concentración inicial no supera 1x104 UFC/ml; por el contrario, a concentración de 1x104 UFC/ml-6 y elevadas cargas de grasas y DQO, la inactivación fue inferior al 50% a los 5 min de exposición a la luz UV (Hernández 2012; Hernández et al., 2013).
Por otro lado, aunque la aireación no tuvo un efecto significativo sobre la inactivación (Cuadro 3), los datos sugieren que la inyección de aire al reactor contribuyó en menor proporción sobre la inactivación de Salmonella spp. La aireación de 1 L/min permitió que las células estuvieran en suspensión, no se sedimentaran y pudieran ser expuestas a la radiación UV. Además de esto, la inyección de aire aporta oxígeno al sistema que se necesita para la producción de ROS, radicales que son claves en las reacciones de oxidación, inactivación de microorganismos ymineralización de los compuestos hasta dióxido de carbono y agua (Demirel et al., 2018; Hinds et al., 2019).
Al realizar las cinéticas de inactivación y remoción para evaluar el UV254 nm (T1), UV254/H2O2(T2) y H2O2(T3)se encontró que la inactivación de Salmonella spp fue igual y eficiente desde los 30 s de exposición para T1 y T2 (99.9±2.4%). Dado que la disminución de la población se observó en menos de 1 min, se podría inferir que el proceso en T1 se inició por foto-inactivación directa de las células por la adsorción de los fotones de alta energía y continuó con la fotoinactivación indirecta vía radicales libres (Nelson et al., 2018; Hinds et al., 2019). Al combinarse los dos mecanismos de inactivación durante todo el tiempo de evaluación no se observó recuperación de las bacterias postratamiento, lo cual demuestra la eficiencia de la fotólisis de alta de energía sobre la inactivación de Salmonella spp.
En T2(UV254/H2O2), la inactivación de Salmonella spp se dio por la combinación de un proceso físico y químico; es decir, una inactivación directa e indirecta, asociadas con la luz UV y la presencia de H2O2, el cual incrementa la formación de ROS al descomponerse en presencia de luz UV para formar radicales hidroxilos (Guo et al., 2017b). Estos resultados coinciden con lo reportado por Koivunen y Heinonen-Tanski (2005), quienes observaron que al emplear fotólisis UV y aditivos químicos se incrementa la inactivación de S. Enteritidis si se compara con el solo uso de H2O2
Los resultados del T3 demostraron que el uso del H2O2 a 15 ppm no fue eficiente para eliminar la bacteria (40% a los 15 min). Guo et al. (2017) reportaron que el H2O2 es susceptible a la degradación por oxígeno, agua y materia orgánica en aguas frescas y a concentraciones de 1-2% (v/v). La baja eficiencia de inactivación obtenida en este estudio fue similar al estudio realizado por Hernández et al. (2013) quienes observaron que durante las cinéticas de inactivación con este compuesto la disminución de la población no superó el 5% a los 65 min de tratamiento al iniciar con una concentración de 1x106 UFC/mL de S. Typhimurium.
La remoción de DQO no fue tan elevada (30±2% y 27±3% para T1 y T2) como la inactivación de Salmonella spp (99.9%), sugiriendo que para la oxidación de la materia orgánica y mineralización hasta CO2 se requiere mayor tiempo de proceso. Por otro lado, se debe considerar que al realizarse la inactivación de Salmonella spp, se liberan componentes celulares que a su vez se convierten en materia orgánica potencialmente oxidable que podría ser eliminada si se incrementa el tiempo de proceso. Hernández et al. (2015) observaron que independiente de la composición química del agua, los tiempos para remover la DQO son más prolongados que los utilizados para inactivar bacterias, ya que fueron necesarias 14 horas de tratamiento para eliminar el carbono orgánico total y color y solamente 50 minutos para inactivar bacterias, cuando se utiliza solamente luz ultravioleta.
Al revisar la remoción de NO3 observada en T1, los resultados sugieren que se llevó a cabo la transformación foto-inducida de NO3 a NO2. Por esta razón, la concentración de NO3 disminuyó en función del tiempo y la concentración de NO2 incrementó (0% de remoción). En T2 también se observó remoción de NO3, pero en menor porcentaje, lo que podría relacionarse con una inhibición por la presencia de H2O2 o radicales libres que actúan sobre este compuesto que es más susceptible a la oxidación que un ion metálico (Gonzalez et al., 1996). Se ha demostrado que a través de procesos de fotólisis bajo condiciones de vacío y fotólisis tradicional se puede obtener la transformación de NO3, NO2 y se forman compuestos ROS que a su vez podrían potencializar la conversión oxidativa de otros compuestos (Gonzalez et al., 1996; Kim et al., 2014).
Un aspecto fundamental que debe considerarse cuando se emplean estos procesos es evaluar si las bacterias pueden generar procesos de reactivación. En el estudio se observó reactivación de Salmonella sppen T2 y T3, con valores de 8 UFC/ml y 3x103 UFC/ml, respectivamente. Esta bacteria tiene varios mecanismos de defensa que han evolucionado para protegerse del estrés oxidativo, como por ejemplo la activación de regulón soxR/S que está compuesto de al menos 10 genes con diferentes funciones como la neutralización de la superoxidación y absorción de compuestos oxidantes (Janssen et al., 2003). Adicionalmente, Salmonella spp induce mecanismos de reparación que le permite cambiar sus estructuras, de tal manera que pueden iniciar su proceso de duplicación. Se observó que después de 15 min de exposición al proceso de fotólisis UV recuperó su viabilidad y nuevamente crece formando colonias más pequeñas (Robertson et al., 2005). Asimismo, se ha encontrado que algunas cepas de Salmonella que toleran pH ácidos presentan una menor proporción de ácidos grasos insaturados en la membrana celular, lo que podría favorecer la reparación celular (Kang J y Kang D, 2019).
CONCLUSIONES
Los tratamientos T1: fotólisis UV254 nm y T2: fotólisis UV254/H2O 2 a 15 ppm fueron eficientes para el tratamiento del agua usada en granjas porcícolas re inoculadas con Salmonella spp, los cuáles podrían ser una alternativa para productores que no cuentan con un abastecimiento de agua adecuado en las granjas porcícolas
La fotólisis con UV eliminó el 99.9% de Salmonella spp, removió el 30% de la DQO presente y el 80% de la concentración de materia orgánica, siendo una mejor opción frente a los métodos convencionales.












 uBio
uBio