INTRODUCCIÓN
La explotación ovina representa el sustento económico de un gran sector de la población rural en el Perú. El ovino permite una rápida comercialización en forma de piel, lana, carne o abono, siendo una importante fuente de recursos económicos para el poblador rural (Ventocilla et al., 2009).
El último censo nacional agropecuario registró 9.5 millones de cabezas ovinas en el país, estando el 71% de la población nacional en las regiones de Puno, Cusco, Junín,Ancash, Huánuco, Huancavelica yAyacucho.Asimismo, el ovino criollo representa el 81% de la población total de ovinos (INEI, 2012). La raza Junín, primera raza desarrollada en el Perú, es de suma importancia como patrimonio regional. Son animales de doble propósito (lana y carne) y se caracteriza por su precocidad, rendimiento de carcasa de 45%, gran capacidad de adaptación (SAIS Tupac Amaru, 2015; Ventocilla et al., 2009). No obstante, la crianza del ovino se ve afectada, entre otros factores, por enfermedades como la brucelosis (Adone y Pasquali, 2013).
La brucelosis es una enfermedad infecciosa de tipo bacteriana, de carácter zoonótico, de amplia distribución geográfica y causante de grandes pérdidas económicas a los productores (Acha y Szyfres, 2001). Además, es causante de restricciones para el movimiento internacional de animales y sus subproductos (Godfroid et al., 2013; Smits, 2013; White et al., 2013). La brucelosis es producida por bacterias del género Brucella. La bacteria es gramnegativa, inmóvil, aerobia obligada de 0.5-0.7 µm de ancho por 0.6-1.5 µm de largo, con 55-58% de guanina-citosina en el ADN; no posee cápsula ni forma esporas (Freer y Castro-Arce, 2001; Castro et al., 2005; López, 2007).
El género Brucella incluye siete especies, las cuales fueron clasificadas según su-hospedero y características microbiológicas, bioquímicas y patogénicas. Así, se tiene a B. mellitensis, compuesta por los biotipos 1, 2 y 3, que afecta a ovinos, caprinos y raramente a porcinos y vacunos (Díaz, 2013; Smits, 2013); B. abortus, con los biotipos 1, 2, 3, 4, 5, 6 y 9, que afecta al ganado vacuno y ovino (Banai y Corbel, 2010); B. suis, conformada por los biotipos 1, 2, 3, 4 y 5; B. neotomae y B. maris, las cuales pertenecen al grupo de brucelas lisas; y B. canis y B. ovis, que pertenecen a las brucelas rugosas (Godfroid et al., 2013). Esta clasificación es con base al aspecto macroscópico que toman las colonias cultivadas; relacionado a la expresión del lipopolisacárido (LPS) en la superficie de las bacterias, siendo en las brucelas lisas el LPSS y en las rugosas el LPS-R. Los LPSs forman la membrana externa de la bacteria junto con fosfolípidos y lipoproteínas (Castro et al., 2005).
La vía de trasmisión puede ser vertical y horizontal. En la forma vertical, los fetos se infectan in utero; es decir, de madre a feto, presentando esta vía de transmisión un bajo índice de infección (2-5%), siendo la mayoría de neonatos contagiados a través del calostro (Grilló et al., 1997; Acha y Szyfres, 2001). En la forma horizontal, las principales vías de excreción de las bacterias son a través de los tejidos reproductivos (placenta, fetos y loquios de material abortado), leche, orina, secreción vaginal y semen, siendo las mucosas las principales vías de entrada, especialmente las mucosas orales, nasofaríngeas, conjuntivales y sexuales, o por laceraciones en la piel (Godfroid et al., 2013; CFSPH, 2018).
Ante estos antecedentes, el objetivo del presente estudio fue determinar la seroprevalencia de anticuerpos contra brucelas lisas en muestras obtenidas de ovinos de la SAIS Túpac Amaru, a fin de tomar las medidas correctivas necesarias para la propagación de la enfermedad.
MATERIALES Y MÉTODOS
Las muestras de sangre fueron colectadas de ovinos Junín de la SAIS Túpac Amaru, empresa cooperativa ubicada en la provincia de Jauja, departamento de Junín, Perú.
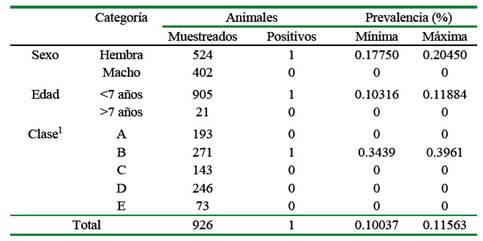
El tamaño mínimo de muestra con un nivel de confianza de 95%, error aceptado del 5%, tamaño de población total de 120 000 y prevalencia esperada de 2% (Russo et al., 2016) fue de 457 muestras. Sin embargo, por disponibilidad del kit diagnóstico y logística necesaria, se trabajaron 926 muestras.
Las muestras fueron tomadas de forma aleatoria de ovinos adultos, independientemente del sexo, edad y clase. Las muestras fueron centrifugadas dentro de las primeras 4 horas a 3000 g por 5 minutos para obtener el suero en el Laboratorio de Zootecnia de la Universidad Nacional DanielAlcides Carrión. Posteriormente fueron remitidas y almacenadas en criovales a -20 °C hasta su procesamiento en el Laboratorio de Microbiología de la Universidad Científica del Sur, Lima.
Para la determinación de anticuerpos contra Brucella spp se utilizó la técnica de ELISA indirecta (IDEXX Brucellosis Serum), siguiendo las recomendaciones del laboratorio fabricante. Este es un método rápido, simple, sensible y específico para detectar anticuerpos frente a Brucella de tipo lisas
(B. abortus, B. mellitensis y B. suis) en muestras de suero y plasma de rumiantes. Los resultados se determinaron con un espectrofotómetro a una longitud de onda de 450 nm. Ningún control positivo brindó una densidad óptica mayor a 0.6. Todas las diferencias entre los controles positivos y negativos fueron >3. Las placas se leyeron antes de las 2 h de la adición de la solución de frenado. Se consideró como resultado positivo a valores mayores a 120 de S/P, negativo si fueron menor a 110 y dudoso a valores entre 110 y 120.
RESULTADOS
El 0.108% (1/926) de los animales resultó seropositivo a anticuerpos contra Brucella de tipo lisas. La simulación estocástica beta-pert (@Risk) indicó una prevalencia mínima y máxima de 0.10037 y 0.11563%, respectivamente (Cuadro 1).
DISCUSIÓN
El presente estudio reporta una prevalencia mínima de 0.10037 y máxima de 0.11563% de anticuerpos contra Brucella de tipo lisas (Cuadro 1, Figura 1). Reportes de seroprevalencia de brucelosis en caprinos en la provincia del Callao indican 5.7% (10/175) para Rosa de Bengala y 4% (7/175) a la prueba confirmatoria de 2-mercaptoethanol y de 6.6% para el Callao y 7.2% para la zona de Ventanilla en el Callo (Taboada et al., 2005), mientras que en la provincia de Cañete (Lima) con la prueba de anillo en leche modificado se reporta 1.04% (Toledo et al., 2007). Reportes de seroprevalencia en pequeños rumiantes enAmérica Latina entre 2009 y 2003 varían entre 0 y 5.4% (Javitt et al., 2009; Beltrán-Saavedra et al., 2010; Agurto y Fernández, 2013), dependiendo de la especie, sistema de crianza, etc.
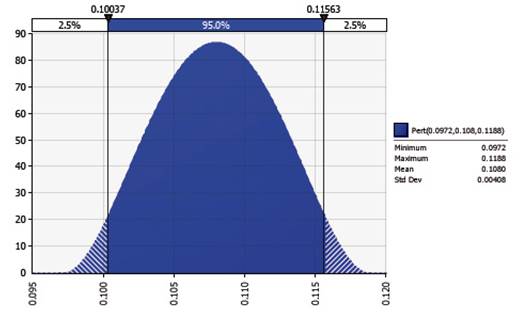
Figura 1 Simulación estocástica de distribución beta-pert (@Risk) para seroprevalencia de anticuerpos contra Brucella de tipo lisa en ovinos de raza Junín de la SAIS Túpac Amaru (n= 926)
El sistema de crianza de los animales del estudio favorece el buen estado de salud de los animales. No se introducen nuevos animales, no hay sobrepastoreo, ni estrés por hacinamiento que facilite la transmisión del patógeno (Acha y Szyfres, 2001); asimismo, la región del estudio presenta una baja prevalencia de brucelosis en comparación de otras regiones, como la costa del país (Taboada et al., 2005; SENASA, 2020). Sistemas de crianza extensiva, como en el presente estudio, son de menor riesgo por el escaso contacto con animales silvestres (Holt et al., 2011; Godfroid et al., 2013; Smits, 2013; Coelho et al., 2014), en comparación con animales que participan en ferias y exposiciones ganaderas (Benavides et al., 2010; Díaz, 2013).
El presente reporte muestra un índice de prevalencia muy bajo, de modo que no permite determinar grupos de riesgo o evaluar alguna variable. Se dispone de reportes que identifican la mayor susceptibilidad de determinadas razas para contraer la brucelosis (Manrique et al., 2010; Carrera et al., 2013), así como de tipos mestizos (Agurto y Fernándes, 2013); sin embargo, no hay estudios referidos a la raza Junín.












 uBio
uBio