INTRODUCCIÓN
Perkinsus spp es un parásito protozoario de moluscos marinos, asociado a nivel mundial con elevada mortalidad y pérdidas económicas significativas en el cultivo de moluscos (Moss et al., 2008). Siete especies han sido identificadas, siendo P. marinus y P. olseni de reporte obligatorio (OIE, 2018). La amplia distribución de este parásito se debe a la variedad de huéspedes que infecta y a su capacidad de persistir bajo condiciones ambientales estresantes (baja temperatura y diferentes concentraciones de salinidad, entre otras), representando una amenaza para el cultivo de moluscos marinos (Bower, 2018).
En estudios sobre la presencia de P. marinus en Crassostrea virginica en México, se reportaron prevalencias entre 7 y 70%, dependiendo de la época del año (Gullian-Klanian et al., 2008; Villanueva-Fonseca y Escobedo-Bonilla, 2013). Similarmente, en Connecticut, USA, se detectaron prevalencias entre 10 y 100% de P. marinus en esta especie de ostiones (Karolus et al., 2000).
Actualmente, para la detección de Perkinsus spp se emplean pruebas histológicas y de incubación en caldo fluido de tioglicolato (RFTM) (OIE, 2018), así como técnicas moleculares que son más sensibles y rápidas. En la PCR se utilizan cebadores específicos diseñados contra la región del espaciador transcrito interno (ITS) del ARN ribosómico, permitiendo identificar el parásito a nivel de especie (Audemard et al., 2004; Freire et al., 2009).
En un trabajo llevado a cabo en 2015 en la frontera entre Perú y Ecuador, se evaluó la presencia de Perkinsus spp en reproductores de Anadara tuberculosa «concha negra». Por microscopia electrónica, PCR y MALDI-TOF se detectó una prevalencia de 63.7% en animales moribundos (Pretell et al., 2017). A pesar de la importancia económica que tiene la concha de abanico para la acuicultura nacional y la elevada prevalencia de este parásito en países de América del Norte y del Sur, son escasos los estudios de detección de Perkinsus spp en el Perú. Es así que el objetivo del presente estudio fue evaluar la presencia de Perkinsus spp en conchas de abanico (Argopecten purpuratus), provenientes de la bahía de Samanco en Ancash, Perú, mediante un ensayo de PCR, a fin de conocer su estatus sanitario y poder adoptar medidas preventivas oportunas.
MATERIALES Y MÉTODOS
Animales
En total se analizaron 56 muestras de branquia de concha de abanico (Argopecten purpuratus), que forman parte del banco de muestras del Laboratorio de Parasitología de la Facultad de Veterinaria y Zootecnia de la Universidad Peruana Cayetano Heredia (Lima, Perú). Estas muestras fueron recolectadas entre enero y agosto de 2017 de centros de producción y ambiente natural situados en la Bahía de Samanco, Ancash, y seleccionadas en base a la observación de lesiones histológicas sugestivas de la presencia de Perkinsus spp (necrosis, infiltración hemocítica e hiperplasia epitelial) (Valera, 2018).
El número de muestras para analizar se estimó considerando un nivel de confianza de 95% y una prevalencia mínima esperada de 7% de 360 conchas de abanico (Gullian-Klanian et al., 2008). Muestras de tejido intestinal no fueron consideradas porque presentan inhibidores de PCR (OIE, 2017).
Extracción del ADN
Las muestras se encontraban preservadas en solución de Davidson y fueron limpiadas con agua destilada Se tomaron 50 mg de tejido de branquia de 2-3 conchas de abanico, que fueron trituradas en mortero y se tomaron 30 mg del homogenizado para la extracción de ADN a partir de 30 mg. La extracción del ADN se realizó con la prueba comercial Wizard® Genomic DNA Purification Kit (Promega, USA), según las indicaciones del fabricante. Se midió la concentración y pureza de todas las muestras en un espectrofotómetro NanoDrop considerando una concentración mínima de 10-100 ng y una pureza con una proporción de A260/280 mayor a 1.8 (Thermo Fisher Scientific, USA).
PCR Convencional
El PCR se realizó en julio del 2018 según el protocolo descrito por Casas et al. (2002), empleando los cebadores PerkITS85 (5' CCGCTTTGTTTGA 3') y PerkITS750 (5' ACATCAGGCCTTCTAATGATG 3'), que tienen como blanco una región del espaciador transcrito interno (ITS) (amplicón de 703 bp). Brevemente, la reacción de PCR fue realizada en termociclador (Eppendorf-Mastercycler), en volumen final de 25 μl, incluyendo buffer 2X Green Master Mix GoTaq® G2 (Promega, USA), 1 μl de cada cebador (10 pmol), 50 ng de ADN molde y agua ultra pura. Cada reacción empleó como controles positivos el ADN de P. beihaiensis y P. olseni, cedidos gentilmente por el Dr. Maximiano P. Dantas Neto, del Instituto de Ciencias Marinas - LABOMAR, Brasil. Como control negativo se empleó agua libre de DNAsas. Las reacciones del PCR convencional se llevaron a una denaturación inicial de 94 °C por 4 min, seguido de 35 ciclos de amplificación de 94 °C por 1 min, 55 °C por 1 min y 72 °C por 1 min y una extensión final de 72 °C por 10 min.
Los productos se corrieron en gel de agarosa 1%, en tampón TAE (Tris Acetato EDTA), junto al marcador de peso molecular InnuSTAR 100 bp Ladder Express (Analytik Jena, Alemania), a 90 V durante 1 h. Los amplificados fueron teñidos con bromuro de etidio (5 mg/ml), visualizados en transiluminador BioDoc-IT (Analytik Jea,Alemania) y fotodocumentados. Se analizó el límite de detección del PCR haciendo una dilución decimal seriada del DNA de P. olseni, a partir de una concentración inicial de 16.6 ng.
RESULTADOS
Las 56 muestras analizadas mediante PCR resultaron negativas a Perkinsus spp (Figura 1). La mínima cantidad deADN blanco detectable, mediante la presencia de un amplicón visible, fue de 1.63 ng, correspondiente a la dilución 10-1 del control positivo (P. olseni) (Figura 2).
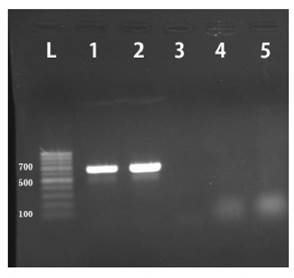
Figura 1 Detección de Perkinsus spp por PCR. Gel agarosa (1%), teñido con bromuro de etidio visto en transiluminador UV. Carril L: Marcador de peso molecular 100 bp; Carril 1: Control positivo P. beihaiensis; Carril 2: Control positivo P. olseni; Carriles 3, 4 y 5: muestras analizadas
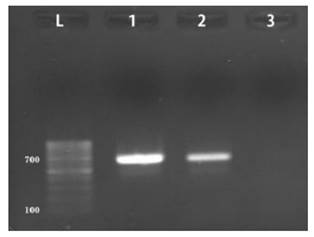
Figura 2 Límite de detección de Perkinsus spp por PCR. Gel agarosa (1%), teñido con bromuro de etidio, visto en transiluminador UV. Dilución seriada de control positivo (DNA de P. olseni). Carril L: Marcador de peso molecular 100 bp; Carril 1: Control positivo sin diluir; Carril 2: Dilución 10-1; Carril 3: Dilución 10-2
DISCUSIÓN
Los resultados negativos en las muestras analizadas estarían indicando ausencia de Perkinsus spp en la Bahía de Samanco, Ancash; al menos para el periodo en que fueron colectadas (año 2017).Al respecto, Pretell et al. (2017), reportaron bajas prevalencias de P. chesapeake en Anadara tuberculosa en medios naturales de Ecuador (3.7%) y Perú (5%). Por otro lado, Enríquez-Espinoza et al. (2015) reportaron 3.3% de prevalencia en Crassostrea gigas y C. fluctifraga, en la Bahía Kino de México, zona con antecedentes del protozoo. En el Perú no ha sido reportada la presencia de especies de Perkinsus en A. purpuratus; además, la Bahía de Samanco posee características ambientales diferentes a las zonas donde ha sido reportado (Valera, 2018).
Otra posible razón de los resultados negativos obtenidos en el PCR puede deberse a la selección de muestras con signos inespecíficos de infección por Perkinsus spp (infiltración hemocítica, necrosis y lesiones multifocales). Por esto, la detección microscópica no se puede utilizar como una técnica de confirmación diagnóstica y se debe acompañar de una técnica de mayor sensibilidad y especificidad, como el PCR (OIE, 2017).
Con relación a la susceptibilidad del huésped, Escobedo-Fregoso et al. (2017) señalan que la proliferación de Perkinsus spp en algunas especies de bivalvos es mayor que en otras, siendo la ostra oriental adulta (C. virginica) una de las más susceptibles a este parásito. Esto se debe a que los cultivos de esta especie se dan a temperaturas mayores de 20 °C y, en épocas de calor, la costa este de los Estados Unidos de Norteamérica puede alcanzar 26 °C o más, lo que favorece la proliferación de P. marinus. En ese sentido, Valera (2018) observó que durante los meses de verano de 2017, en la Bahía de Samanco, la temperatura varió entre 19.1 y 25.1 °C, y por debajo de 20 °C durante los meses de invierno. Esta variación en la temperatura limitaría la multiplicación de Perkinsus spp en esta región.












 uBio
uBio 

