INTRODUCCIÓN
El cuy (Cavia porcellus) es un mamífero roedor originario de la región andina de América. El Perú es considerado el mayor productor de carne de cuy en el mundo. Se estimó una producción de 21 103 toneladas de carne de cuy en 2017 y un consumo per cápita de 0.66 kg/hab/año (MINAGRI, 2019). Su crianza es mayormente bajo el sistema familiar o familiar-comercial, donde se suelen descuidar aspectos importantes como manejo, control sanitario, alimentación e higiene, entre otros, lo cual afecta los índices productivos y reproductivos (Matsuura et al., 2010; Meza et al., 2014; Morales, 2017).
El uso inadecuado de los antibióticos ha contribuido a la formación de resistencia antimicrobiana - RAM (Falcón et al., 2010; Matsuura et al., 2010; Morales, 2013). Ante el uso no controlado de antibióticos, las bacterias sufren modificaciones en su código genético que dificultan el tratamiento de infecciones en el humano y animales (OMS, 2018a). En la crianza de cuyes los antibióticos más utilizados son las quinolonas y las sulfamidas (Revelo et al., 2012).
La OIE ha desarrollado una lista de agentes antimicrobianos veterinarios de importancia crítica donde se encuentran sulfonamidas, quinolonas de primera generación y tetraciclinas, entre otros (OIE, 2018). La regulación del uso de medicamentos veterinarios está dada por organizaciones como la Comisión del Codex Alimentarius, la Organización de las Naciones Unidas (ONU) y la Administración de Medicamentos y Alimentos (Food and Drug Administration, FDA) de los estados Unidos, entre otras que pueden tener alcances nacionales, regionales, o mundiales (Lozano y Arias, 2008). Para fines de control y vigilancia, se ha establecido límites máximos residuales (LMR) en animales destinados para el consumo humano (Cancho et al., 2000; FAO, 2016); siendo 100 µg/kg el LMR para sulfamidas en músculo establecido por el Codex Alimentarius (FAO, 2018), así como también para hígado y riñón según la Unión Europea, mientras que la FDA no indica el LMR para dicho antibiótico (Talero-Pérez et al., 2014).
El Perú cuenta con una Ley de Inocuidad de Alimentos (D.L. N.° 1062), que regula los estándares de inocuidad (SNI, 2016). En 2016 el MINSA aprobó la «Norma sanitaria que establece los Límites Máximos de Residuos (LMR) de medicamentos veterinarios en alimentos de consumo humano», mediante la Resolución Ministerial N.° 372-2016 MINSA, la cual señala el valor de 100 µg/kg como LMR para todo el grupo de sulfona- midas; sin embargo, solo lo específica para músculo/piel en peces.
Existen diferentes técnicas disponibles para la detección de residuos de antibióticos en alimentos de origen animal, entre ellas las técnicas inmunológicas, tales como ELISA, radioinmunoensayo (RIA) y biosensores; así como técnicas cromatográficas de gases y líquido, y técnicas microbiológicas (Cerniglia y Kotarski, 2005; Toldrá y Reig, 2006). Ante esto, el presente trabajo tuvo como objetivo detectar residuos de sulfamidas en canales de cuy para expendio que sobrepasen los lí- mites máximos de residuos en el Valle del Mantaro, Junín.
MATERIALES Y MÉTODOS
Se tomaron muestras de canales de cuy que se encontraban a la venta en un merca- do del Valle del Mantaro, departamento de Junín, Perú, durante diciembre de 2020. En dicho mercado se realiza la venta de los animales vivos, así como también de las cana- les, las cuales son beneficiadas dentro del mismo mercado.
El número de muestras fue determina- do (n=306) mediante la fórmula para proporciones en poblaciones no finitas, consideran- do una confiabilidad de 95% y una frecuencia esperada de 27.4% (Ampuero-Riega y Morales-Cauti, 2021); sin embargo, se pro- cesaron 433 canales para disminuir el error estadístico.
Las canales fueron seleccionadas al azar durante la etapa de oreo. Se tomaron mues- tras de hígado, riñón y músculo durante cuatro semanas consecutivas. Cada órgano fue colocado en bolsas plásticas con cierre hermético y se llevaron al Laboratorio de Microbiología y Microscopia de la Universidad Científica del Sur en cajas térmicas con geles refrigerantes (4 °C).
Se utilizó la técnica microbiológica de difusión en agar Mueller Hinton, como cepa patrón a Bacillus subtilis ATCC 6633 y como control un disco comercial de sulfonamida 250 µg. Las muestras de hígado, riñón y músculo fueron trituradas en un mortero.
La cepa patrón fue sembrada con un hisopo estéril mediante el método del barrido en tres direcciones sobre el agar. En los orificios hechos en el agar con sacabocado de 2 mm se inocularon las muestras. Las placas Petri fueron incubadas por 24 h a 37 °C. La interpretación de los resultados se realizó mediante la medición de la zona de inhibición bacteriana para cada muestra y disco con- trol. Se consideró como resultado positivo a las muestras con zona de inhibición mayor o igual a 2 mm y como negativo a las zona de inhibición menores de 2 mm (Espitia, 2016).
Para la técnica serológica se seleccionaron por conveniencia muestras de 27 canales que presentaron halos de mayor zona de inhibición (n=81). De cada muestra se utilizó 3 g y fueron procesadas según las recomendaciones del MaxSignal® Sulfonamide ELISA Test Kit para la cuantificación de los niveles de sulfamidas existentes en las mues- tras. Para esto se utilizó un filtro de 450 nm en el Lector de ELISA. El análisis de absorbancia relativa y las concentraciones de sulfamida se realizó mediante el programa Veratox 3. Se consideraron resultados mayores de 100 µg/kg como muestras que sobrepasaron el límite máximo de residuos (Talero-Pérez et al., 2014; FAO, 2018).
RESULTADOS
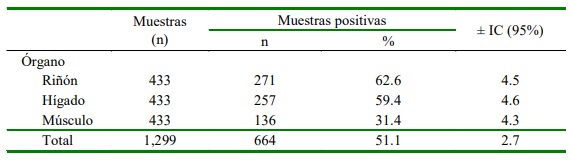
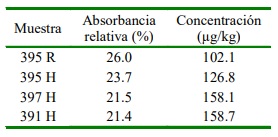
Se encontraron halos de inhibición alrededor del disco control de sulfonamida en 51.1% de las muestras (Cuadro 1). La prueba de ELISA indicó 4.9% (4/81) de muestras positivas a la presencia de residuos de sulfamida que sobrepasaron los límites máximos establecidos (Cuadro 2), con concentraciones entre 102.1 y 158.7 µg/kg (Cuadro 3).
Cuadro 1. Frecuencia de presentación de residuos de antibióticos en muestras de músculo, hígado y riñón en 433 canales de cuy en expendio en un mercado de Junín, Perú
DISCUSIÓN
Se evidenció la presencia de residuos de antibióticos mediante la técnica microbiológica en 51.1% (664/1299) de mues- tras tomadas de 433 canales de cuy (Cuadro 1). Esta frecuencia es casi el doble del 27.4% (337/1230) reportado por Ampuero-Riega y Morales-Cauti (2021), en tanto que Leyva- Molina et al. (2020) no encontraron mues- tras positivas en la misma zona del estudio dos años antes mediante la técnica microbiológica y 26.7% mediante la técnica de ELISA, sin que alguna muestra superara el LMR. Estas diferencias revelan el incremento de canales de cuy destinadas para el consumo humano con presencia de residuos de antibióticos, demostrando que aún no se implementan controles en la administración y seguimiento del uso de antibióticos, así como el respeto de 7-8 días de retiro de estos fármacos (Talero-Pérez et al., 2014). En este sentido, Revelo et al. (2012) en Colombia encontraron que el 60% de los productores de cuy no respetaba ningún tiempo de retiro para sulfamidas y solo el 20% lo realizaba a los 7 días (Revelo et al., 2012).
Cuadro 3 Concentración de sulfamida en muestras de órganos y tenidos de canales de cuy que sobrepasan el límite máximo de residuos (LMR) (100 µg/kg)
Este problema de salud pública no es exclusivo de la producción de cuyes, sino que también se presentan en otras especies. Así, en bovinos comercializados en Puno, Perú con 39.3% (133/338) (Aguilar, 2018) y en Guate- mala con 5% (Canet-Elgueta et al., 2018) y en pollos en Lima con 50-100% dependiendo del antibiótico (Azañero y Chiroque, 2010).
El órgano con mayor presencia de residuos de antibióticos fue el riñón con 62.6% (271/433) (Cuadro 1), resultados que coinciden con el estudio de Ampuero-Riega y Morales-Cauti (2021). Un estudio en México también concluyó que el riñón era el órgano con mayor frecuencia de residuos de antibiótico en canales bovinos (Espitia, 2016), lo cual se puede relacionar a la función que cumplen los riñones en la eliminación de antibióticos (Beltrán, 2004), aunque también se pueden eliminar a través de la leche, saliva, bilis y secreción prostática, pero en cantidades poco significativas (Pérez-Tallero e Iglesias, 2003).
La frecuencia de residuos de antibióticos en hígado fue de 59.4% (257/433) y de 31.4 % (136/433) en el caso del músculo. Estos resultados coinciden también con los descritos por Ujueta y Araque (2016), quienes concluyeron que el hígado (28.6%) y riñón (23.1%) presentaron las frecuencias más elevadas y similares para residuos de sulfametazina en comparación con músculo que presentó 1%.
La prueba de ELISA determinó que 4.9% (4/81) de muestras positivas (Cuadro 2) superaron los límites máximos de residuos de sulfamida establecidos en el Codex alimentarius (FAO, 2018), y la Unión Euro- pea (Talero-Pérez et al., 2014), lo que con- vierte a estas canales como no aptas para el consumo humano. Si bien la norma sanitaria peruana solo indica el LMR para sulfonamida en músculo de peces (MINSA, 2016), este valor es igual al establecido por diversas organizaciones a nivel internacional. Tres de las cuatro muestras que sobrepasan los LMR fueron de hígado y una de riñón (Cuadro 3).
Diversos estudios se han realizado para determinar presencia de residuos de antibióticos en diferentes especies; entre ellos, el de Barrios (2012) en músculo e hígado de pollos beneficiados en Tacna encontrando 65% (13/20) de muestras con residuos de sulfamida, aunque sin sobrepasar los LMR; Iza (2019) evaluó residuos de quinolonas y sulfamidas en carne de pollo en Quito mediante la técnica de ELISA, encontrando 20.6% (14/68) de muestras con residuos de quinolonas y 1.47% (1/68) superior a los LMR, mientras que para sulfamidas solo el 1.9% (1/84) de muestras presentaron residuos, pero ninguna por encima de los LMR. Si bien los estudios demuestran presencia de residuos de antibióticos, son muy pocas o ninguna muestra que llegan a sobrepasar los lí- mites máximos de residuos establecidos.
Existen técnicas con mayor sensibilidad y especificidad que el ELISA para la determinación de residuos de antibióticos, como la cromatografía líquida y la espectrofotometría de masa; sin embargo, son de alto costo y en ocasiones de poca disponibilidad (Blasco et al., 2007). El kit de ELISA presenta una sensibilidad de 100% a residuos de sulfamida y permite detectar hasta 1 µg/kg (PerkinElmer, 2019), lo cual resulta bastante útil al momento de identificar residuos y clasificar; en este caso, canales de cuy, como aptas o no para el consumo humano. Si bien la técnica microbiológica de difusión en agar resulta más económica y de desarrollo más sencillo, no permite discriminar las muestras como aptas para el consumo, por lo que ambas son complementarias.
El Servicio Nacional de Sanidad Agraria del Perú (SENASA) realiza monitoreos anuales de residuos químicos y otros contaminantes en alimentos agropecuarios primarios; sin embargo, el último reporte en el que se incluye a la carne de cuy (carne fresca) es de 2018, donde se evidenció que esta carne presentó el porcentaje más alto (20%) de muestras no conformes en comparación con otros alimentos de origen animal; es decir, presentan residuos de medicamentos veterinarios, plaguicidas químicos o sustancias activas (SENASA, 2019).
Actualmente, se viene buscando alter- nativas al uso de antibióticos como promotores de crecimiento en la crianza de cuyes, como el uso de jengibre 0.09% en Trujillo, Perú (Cruz, 2019), y suplementando con ácidos orgánicos (Vela y Morales-Cauti, 2020). Conociendo los efectos que puede generar el consumo de alimentos con residuos de antibióticos, tales como resistencia a los antimicrobianos (OMS, 2018b), así como también trastornos gastrointestinales o reacciones de hipersensibilidad (Lozano y Arias, 2008), mejorar el control en la crianza de cuy y realizar monitoreo continuos en diferentes zonas de expendio de carne de cuy es importante para prevenir y controlar la presencia de residuos que comprometan la inocuidad de la canal de cuy y pongan en riesgo la salud pública.












 uBio
uBio 


