INTRODUCCIÓN
En 2006 entró en vigor en la Comunidad Europea la normativa que prohíbe el uso de antibióticos promotores de crecimiento (APC) en la alimentación animal, con el fin de minimizar los riesgos sobre la salud del consumidor final (European Union, 2003). Ante esto, el sector avícola tuvo que implementar nuevas y mejores estrategias nutricionales y de control ambiental con el fin de reducir el impacto por el retiro de los APC en las parvadas (Da Costa et al., 2011). Es así como, en la última década, se intensificó el interés por encontrar alternativas al uso de los APC como lo son los ácidos orgánicos, enzimas y fitogénicos (Mandey y Sompie, 2021); asimismo, en los últimos años se ha destacado el uso de probióticos o cepas de microorganismos benéficos para mejorar el desempeño productivo de las aves comercia- les (Lee y Lillehoj, 2017).
Diferentes estudios muestran los efectos positivos de la administración de probióticos en la dieta de las aves sobre el rendimiento productivo, equilibrio de la microbiota intestinal, inmunoestimulación, síntesis de vitaminas, estimulación de enzimas digestivas, y protección frente a las toxinas de patógenos (Beski y Al-Sardary, 2015; Gao et al., 2017). Además, se trata de microorganismos inocuos, cuyos residuos metabólicos en la carne de las aves no significan un peligro para el consumo humano (Díaz-López et al., 2017). La selección de microorganismos candidatos cuyo comportamiento sea un indicador para su uso como potencial probiótico debe considerar criterios como el origen del hospedador, supervivencia bajo condiciones gástricas e intestinales, adherencia y colonización al epitelio intestinal, producción de sustancias antimicrobianas, seguridad, etc. (Markowiak y Slizewska, 2018).
Se han utilizado como probióticos diversas especies de microorganismos de los géneros Lactobacillus, Streptococcus, Bacillus, Bifidobacterium, Enterococcus, Pediococcus, Aspergillus, Candida y Saccharomyces, cuyo mecanismo de acción genera un efecto beneficioso sobre el rendimiento de las aves (Mikulski et al., 2012). Estos probióticos fermentan carbohidratos produciendo ácido láctico, acético y propiónico, provocando una disminución del pH en el intestino de las aves, logrando inhibir y controlar el crecimiento de enteropatógenos como Echerichia coli, Salmonella typhimurium, Campylobacter jejuni, Listeria sp y Clostridium perfringens (Murry et al., 2004). Sin embargo, la exigencia de nutrientes de estas especies probióticas, la producción limitada de sustancias bioactivas y la escasa estabilidad de algunos de ellos, sumado a la aparición de enfermedades emergentes y evidencias de resistencia microbiana, hacen necesario la búsqueda de nuevos probióticos que mejoren las características de los existentes (Tan et al., 2009).
Los actinomicetos son una de las familias de microorganismos más atractivas para la industria, debido a su capacidad de producir diversos y novedosos metabolitos secundarios. Aunque las Bifidobacterias han sido las actinobacterias más utilizadas como probiótico, especies de otros géneros como Streptomyces, Rhodococcus, Nocardiopsis y Oerskovia también se emplean como probióticos (Latha et al., 2016). Varios estudios sugieren que bacterias del género Streptomyces tienen efectos probióticos en la acuicultura mejorando la tasa de supervivencia, tasa de crecimiento, eficiencia de conversión alimenticia y previniendo infecciones intestinales (Aftabuddin et al., 2013). Sin embargo, existe poca información sobre la aplicación de actinomicetos como potenciales probióticos para la avicultura. Siendo así, el objetivo del presente estudio fue determinar el efecto de una formulación probiótica a base de un consorcio de actinomicetos en el rendimiento productivo e integridad intestinal de pollos de carne criados en condiciones experimentales hasta los 28 días de edad.
MATERIALES Y MÉTODOS
Lugar de Estudio y Animales
El estudio se llevó a cabo en el Laboratorio de Investigación en Nutrición y Alimentación de Aves (LINAA) de la Facultad de Zootecnia en la Universidad Nacional Agraria La Molina (UNALM), Lima, Perú.
Se emplearon 320 pollos de la Línea Cobb 500, machos, de un día de edad. Las aves fueron distribuidas al azar en 4 tratamientos (n=80) con 8 repeticiones de 10 pollos cada uno. La duración del ensayo fue de 28 días. Las aves fueron alojadas en dos jaulas metálicas de malla galvanizada (baterías) de cuatro pisos cada una y con cuatro divisiones por piso, las cuales estuvieron aprovisionados con comederos lineales laterales y bebederos lineales frontales tipo canaleta en la parte externa, piso emparrillado de alambre galvanizado cubierto con malla y bandeja metálica para la recolección de excretas.
Tratamientos
Los tratamientos fueron: T1, dieta basal (sin antibióticos promotores de crecimiento); T2, dieta basal + Performance T 25® (Tilosina a dosis de 200 g/t) + Salinocarb® (Salinomicina-Nicarbazina a dosis de 500 g/t) (ambos productos de Ilender Perú S.A.); T3, dieta basal + Calsporin® (Bacillus subtilis a dosis de 100 g/t) (Calpis America Inc.) y T4, dieta basal + consorcio de actinomicetos pertenecientes al género Streptomyces (100 g/ t). Las dietas cubrieron los requerimientos nutricionales de los pollos en todas las fases de su desarrollo. El alimento y el agua de bebida se suministraron a las aves ad libitum. Las dietas experimentales fueron formuladas siguiendo las especificaciones nutricionales de la Línea Cobb 500 (Cobb-Vantress, 2018). La composición y valor nutricional de las dietas basales se muestran en el Cuadro 1.
Cuadro 1 Composición nutricional de las dietas basales empleadas en el estudio
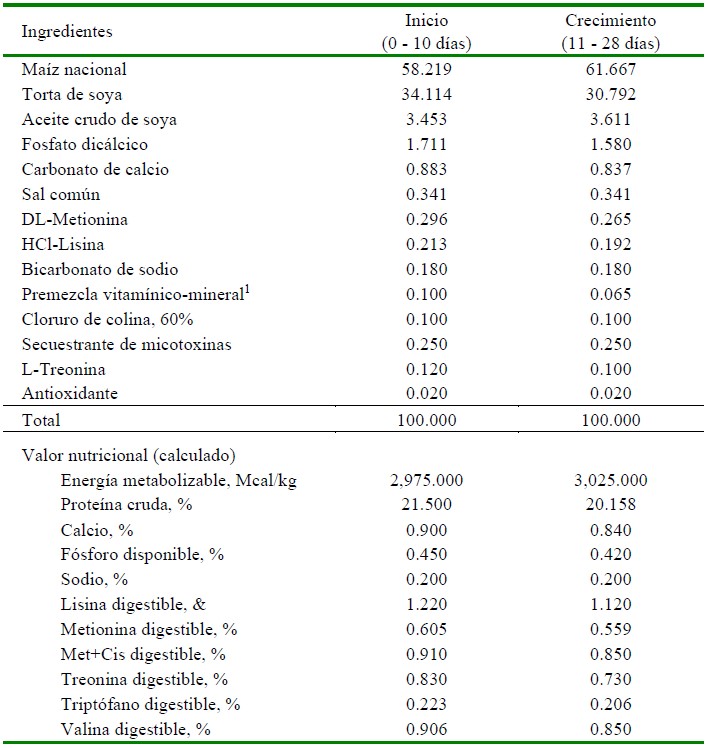
1 Contenido por kilogramo de producto: Vit. A: 12 000 000 UI; Vit. D3: 5 000 000 UI; Vit. E: 30 000 UI; Vit. K3: 3 g; Tiamina: 2 g; Riboflavina: 10 g; Piridoxina: 3 g; Vit. B12: 0.015 g; Ácido fólico: 2 g; Niacina: 30 g; Ácido pantoténico: 11 g; Biotina: 0.15 g; Zinc: 80 g; Hierro: 50 g; Manganeso: 80 g; Cobre: 12 g; Yodo: 1 g; Selenio: 0.30
El ensayo se dividió en dos fases: la primera, fase de inicio, de 1 a 10 días de edad y la segunda, fase de crecimiento, a partir del día 11 de edad hasta el final del estudio; proporcionándose a ambas una dieta basal a base de maíz y soya, complementadas con aminoácidos sintéticos y suplementadas con una premezcla de vitaminas y minerales. Las dietas experimentales fueron elaboradas en la Planta Piloto de Alimentos Balanceados de la UNALM.
La formulación probiótica fue procesada en el Laboratorio de Microbiología de la Empresa Ilender Perú S.A. y administrada a una dosis de 100 gramos por tonelada de alimento balanceado, conteniendo aproximadamente 1x108-1010 UFC/g de un consorcio de actinomicetos pertenecientes al género Streptomyces, aislados del tracto digestivo de gallinas criollas criadas en libertad, los cuales se encuentran en evaluación. El probiótico comercial que contuvo la cepa de Bacillus subtilis fue administrado en la misma dosis en la dieta, conteniendo 1x1010 UFC/g. Los probióticos y antibióticos promotores de crecimiento fueron incluidos en la dieta durante todo el período experimental.
Mediciones
Parámetros productivos
Peso vivo: El pesado de las aves se realizó el día de recepción y los días 7, 14, 21 y El pesaje se hizo en forma grupal en jabas de plástico, utilizando una balanza digital de plataforma con precisión de 0.01 g.
Ganancia de peso: La ganancia de peso semanal se obtuvo por la diferencia entre los pesos de una semana a otra, y la ganancia de peso acumulada estuvo representada por la diferencia entre el peso final y peso inicial.
Consumo de alimento: Se pesó el residuo de alimento semanal en los comederos de cada jaula. Al peso del alimento administrado durante la semana se le restó el peso del residuo de alimento, y el resultado se dividió entre el número de aves para obtener el consumo de alimento semanal y acumulado por ave.
Índice de conversión alimenticia (ICA): El ICA semanal fue obtenido al dividir el alimento consumido semanal entre la ganancia de peso semanal y el ICA acumulado mediante el alimento consumido por campaña dividido por la ganancia de peso final.
Mortalidad: Se registró la mortalidad diaria. Se realizó, además, la necropsia a todo animal que murió durante el estudio para determinar las causas de muerte.
Integridad intestinal
Se evaluó a nivel microscópico mediante histomorfometría. Se colectaron dos segmentos de 2 cm cada uno del intestino delgado por ave. El primer segmento a 2 cm de la salida del colédoco en el duodeno y el segundo en el yeyuno, a 8 cm antes del divertículo de Meckel. Las muestras fueron fijadas en frascos estériles con formol al 10% y remitidas a la Universidad Nacional Mayor de San Marcos, Lima. Las muestras fueron procesadas para el análisis histológico y los cortes fueron teñidos con hematoxilina-eosina (HxE) según procedimiento convencional. De cada segmento intestinal (duodeno y yeyuno) se realizaron un mínimo de 20 mediciones para determinar la longitud y ancho de las vellosidades, la profundidad de las criptas de Lieberkuhn y la relación entre longitud de vellosidad/profundidad de criptas. Se empleó un microscopio óptico de campo claro a 4X (Leica ICC50 W) y el programa LAS-EZ. Las medidas se expresaron en micras (µm). La longitud de las vellosidades se mide desde el área basal, coincidiendo con la porción superior de las criptas hasta su ápice. El ancho de las vellosidades fue medido en el punto medio de la longitud de estas y la profundidad de las criptas se mide desde la región basal de cada vellosidad hasta la parte basal superior de la musculatura lisa del intestino.
Peso relativo de órganos
Para el registro del peso de los órganos se tomó como muestra un ave por repetición por cada grupo experimental a los 21 y 28 días de edad. Los órganos fueron pesados en una balanza analítica con precisión de 0.01 g. El peso relativo del órgano fue expresado como el porcentaje relativo al total del peso corporal del ave correspondiente. Los órganos medidos fueron bursa, bazo, timo, hígado, páncreas e intestino. Para el pesado del intestino se tomó en consideración la unión con la molleja hasta 1 cm antes de llegar a la unión ileocecal e incluyendo el contenido intestinal.
Análisis Estadístico
Se empleó un Diseño Completamente al Azar con cuatro tratamientos y diez repeticiones por tratamiento. Para determinar diferencias significativas en las variables productivas (peso vivo, ganancia de peso, consumo de alimento, conversión alimenticia, porcentaje de mortalidad e ICA), así como de la histomorfometría intestinal (longitud y ancho de vellosidades, y profundidad de criptas de Lieberkuhn) se utilizó el análisis de varianza y la comparación de medias mediante la prueba de Duncan. Las variables de la evaluación macroscópica de la integridad intestinal fueron realizadas mediante la prueba no paramétrica de Kruskal-Wallis. Los datos se analizaron mediante el programa estadístico R considerando un nivel de significancia del 5%.
RESULTADOS
El resultado del comportamiento pro- ductivo se presenta en el Cuadro 2. Los tratamientos T3 y T4 (suplementados con probióticos) mejoraron significativamente el ICA en comparación al grupo T1 (control no tratado) (p<0.05) a los 14 días de edad, mientras que, no se observaron diferencias entre T3 y T4. Asimismo, T3 (dieta basal + Bacillus subtilis) mostró un mejor ICA respecto al T2 (dieta basal + tilosina + salinomicina / nicarbazina) (p<0.05). Por otro lado, no hubo diferencias entre tratamientos con respecto al peso corporal, ganancia de peso acumula- da, consumo de alimento acumulado y porcentaje de mortalidad.
Cuadro 2 Comportamiento productivo de pollos de carne1 suplementados con probióticos o promotores de crecimiento hasta los 28 días de edad
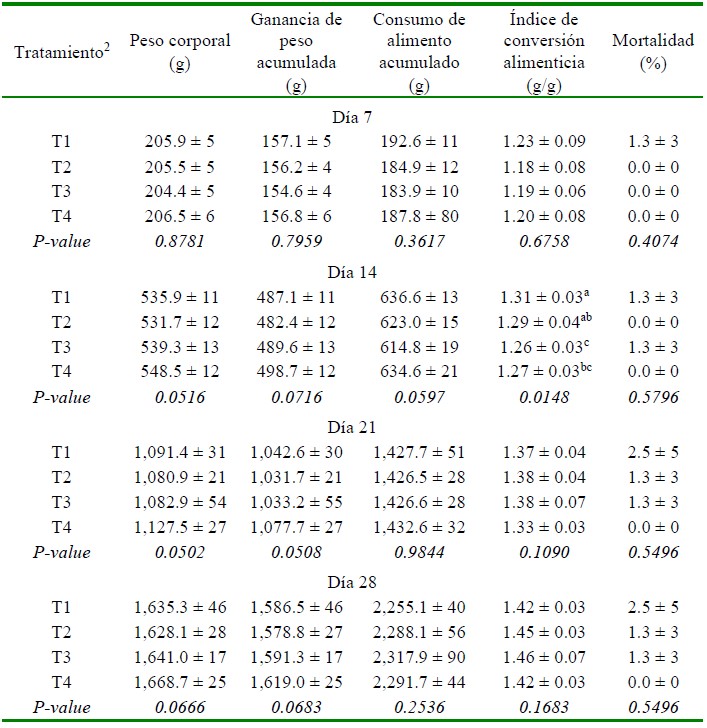
1 Valores son promedio +/- desviación estándar de ocho repeticiones por tratamiento.
2 T1: dieta basal (sin promotores de crecimiento); T2: dieta basal + tilosina + salinomicina / nicarbazina; T3: dieta basal + Bacillus subtilis; T4: dieta basal + consorcio de actinomicetos
a,b,c Superíndices diferentes dentro de columnas indican diferencias estadísticas (p<0.05)
No hubo diferencias en las variables productivas a los 21 días de edad por efecto de los tratamientos, aunque se puede resaltar que el grupo T4 (dieta basal + consorcio de actinomicetos) mostró una tendencia no significativa desde los 7 días de edad a presentar una mejor ICA. Por otro lado, los tratamientos no afectaron el comportamiento productivo a los 7 y 28 días de edad.
En el Cuadro 3 se presenta el efecto de los tratamientos dietarios sobre la morfometría intestinal (longitud y ancho de vellosidad, profundidad de cripta y la relación longitud de vellosidad: profundidad de cripta) en duodeno y yeyuno evaluados a los 21 y 28 días de edad.
Cuadro 3 Morfometría de duodeno y yeyuno en pollos de carne1 suplementados con probióticos o promotores de crecimiento a los 21 y 28 días de edad
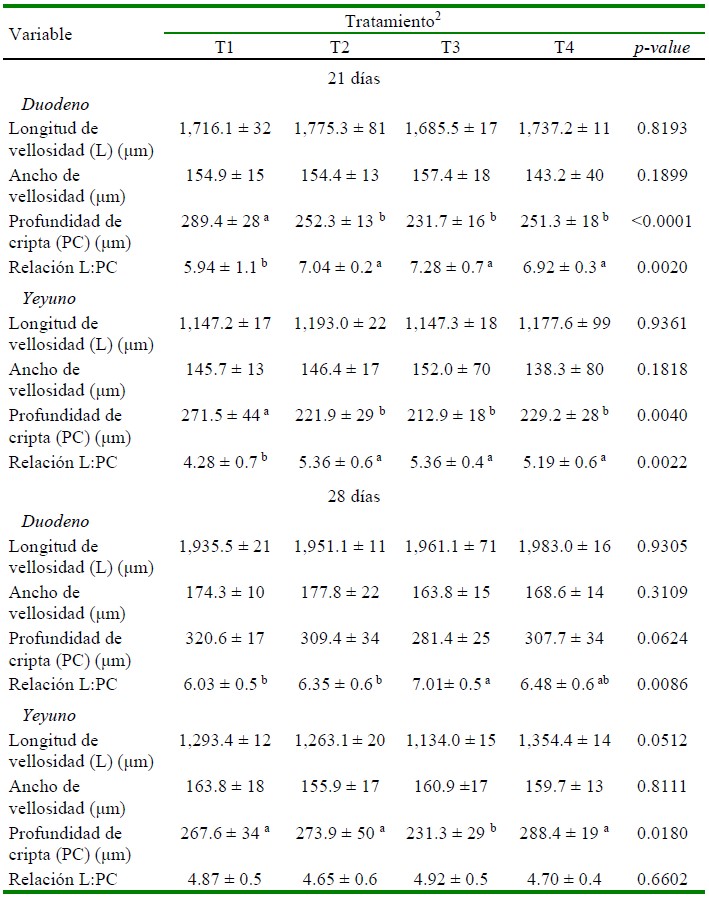
1 Valores son promedio +/- desviación estándar de ocho repeticiones por tratamiento.
2 T1: dieta basal (sin promotores de crecimiento); T2: dieta basal + tilosina + salinomicina / nicarbazina; T3: dieta basal + Bacillus subtilis; T4: dieta basal + consorcio de actinomicetos.
a,b,c Superíndices diferentes dentro de columnas indican diferencias estadísticas (p<0.05)
A los 21 días de edad, la Profundidad de cripta (PC) y la relación Longitud de vellosidad / Profundidad de cripta (L:PC) en duodeno y yeyuno de los grupos tratados fueron significativamente diferentes al grupo control (p<0.05). Los valores más bajos de PC correspondieron a los grupos T2, T3 y T4 en comparación con el grupo T1 control (p<0.05). Por otro lado, T2, T3 y T4 presentaron los mayores valores para la relación L:PC en comparación con el grupo control (p<0.05). A los 28 días, los mayores valores de L:PC en el duodeno correspondió a los grupos T3 y T4, pero solo T3 fue significativamente diferente a T1 y T2. Por otro lado, el valor más bajo de PC en el yeyuno correspondió al grupo T3 (p<0.05).
Los valores promedios de la longitud y ancho de vellosidad en el duodeno y yeyuno a los 21 y 28 días, la PC (en la porción del duodeno), y la relación L:PC (en la porción del yeyuno) a los 28 días de edad no fueron influenciados por los tratamientos administrados en las dietas (p>0.05).
No hubo diferencias significativas para los pesos relativos de los diferentes órganos entre tratamientos a los 21 y 28 días de edad de las aves (Cuadro 4), con excepción del peso relativo del bazo, que fue significativamente menor en los grupos T1 y T4 frente al grupo T2 (p<0.05)
Cuadro 4 Peso relativo de órganos (%) en pollos de carne1 suplementados con probióticos o promotores de crecimiento a los 21 y 28 días de edad
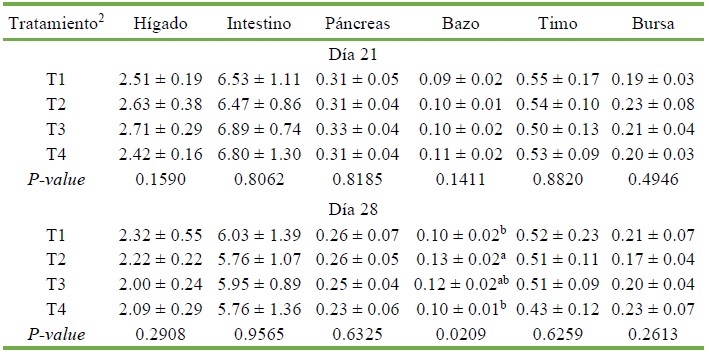
1 Valores son promedio +/- desviación estándar de ocho repeticiones por tratamiento.
2 T1: dieta basal (sin promotores de crecimiento); T2: dieta basal + tilosina + salinomicina / nicarbazina; T3: dieta basal + Bacillus subtilis; T4: dieta basal + consorcio de actinomicetos
a,b,c Superíndices diferentes dentro de columnas indican diferencias estadísticas (p<0.05)
DISCUSIÓN
El peso vivo a los 28 días de edad y la ganancia de peso fueron similares entre los tratamientos. En forma similar, la conversión alimenticia no se vio influenciada por los grupos experimentales a los 7, 21 y 28 días de edad (Cuadro 2). Resultados sobre el rendimiento productivo de pollos de carne empleando actinomicetos no han sido reportados; sin embargo, existen referencias en el uso de otros géneros de bacterias probióticas que guardan relación con los resultados del presente estudio. Al respecto, Olnood et al. (2015) incluyeron cepas probióticas de Lactobacillus en la dieta de pollos criados en baterías sin encontrar diferencias significativas para peso vivo y ganancia de peso en comparación con un grupo tratado con zinc bacitracina (50 mg/kg) y un grupo control no suplementado. Del mismo modo, Gunal et al. (2006) tampoco encontraron mejoras en ganancia de peso, consumo de alimento y conversión alimenticia de pollos de carne criados en baterías hasta los 42 días por la adición en la dieta al 0.1% de un consorcio de cepas probióticas (Lactobacillus spp, Streptococcus thermophilus, Aspergillus orizea, Bifidobacterium bifidum, Enterococcus faecium y Candida pintolepesii) en comparación al grupo tratado con flavomicina al 0.1% y un grupo control con dieta basal. Hallazgos similares también han sido reportados empleando diferentes cepas probióticas y bajo diversas condiciones experimentales (Fernandes et al., 2014; Abudabos et al., 2017; He et al., 2019).
El consumo de alimento no se vio influenciado por la adición de los probióticos en la dieta (Cuadro 2). Este resultado concuerda con los obtenidos por Wang et al. (2016) al incluir en la dieta cepas de Bacillus subtilis (3x105 UFC/g) frente al grupo control no suplementado y al grupo tratado con antimicrobianos comerciales, así como con el estudio de Kazemi et al. (2019), quienes suplementaron dos consorcios que contenían especies bacterianas de los géneros Lactobacillus, Bifidobacterium, Enterococcus, Streptococcus, Pediococcus y Bacillus, entre otros, frente a los grupos controles y tratados con avilamicina (150 g/t).
En el presente estudio tampoco se encontró diferencias significativas en mortalidad entre tratamientos (Cuadro 2), al igual que otros autores (Gunal et al., 2006; Stêczny y Kokoszyñski, 2020); sin embargo, son varios los estudios que han encontrado una influencia positiva en el control y reducción de la mortalidad por uso de probióticos (Huang et al., 2018; Menconi et al., 2020), relacionando este efecto con un posible mecanismo modulador de la microbiota intestinal y estimulación del sistema inmunológico en las aves.
En contraste con los hallazgos anteriores, los efectos benéficos del uso de probióticos en la dieta de pollos de carne sobre diferentes variables productivas han sido reportados. Así, Sen et al. (2012) encontraron una mejora significativa de la ganancia de peso, consumo de alimento y conversión alimenticia administrando 0.30 y 0.45% de una cepa de Bacillus subtilis en la dieta. Asimismo, Song et al. (2014) obtuvieron mejores ganancias de peso en pollos de engorde sometidos a condiciones de estrés calórico con una mezcla probiótica que contenía Bacillus licheniformis, Bacillus subtilis y Lactobacillus plantarum (1.5 g/kg). Entre los mecanismos bajo los cuales los probióticos ejercerían este efecto se encuentra la exclusión competitiva y modulación de la microbiota, incremento en el tamaño de las vellosidades intestinales, mantenimiento de la integridad de la barrera intestinal, estimulación del sistema inmune y secreción de mucina (Song et al., 2014; Beski y Al-Sardary, 2015).
Los rendimientos productivos similares entre los tratamientos evaluados podrían estar asociados a las condiciones medioambientales controladas. Se ha descrito que aves sanas alojadas en condiciones controladas, con una densidad adecuada y bien alimentadas no responden positivamente en términos productivos cuando se emplean promotores de crecimiento antibiótico, probióticos, ácidos orgánicos o fitogénicos frente a los grupos no tratados (Shiva et al., 2012; Olnood et al., 2015). Por otro lado, en este estudio, la con- centración del consorcio de actinomicetos fue alrededor de 108-1010 UFC/g, tasa de inclusión recomendada convencionalmente para aditivos probióticos comerciales en la dieta (108 UFC/g de producto). Es posible que concentraciones más altas del candidato a probiótico pueda ejercer una respuesta positiva más significativa sobre el crecimiento, especialmente si la presión de infección por bacterias patógenas, como Clostridium perfringens, es alta, aspecto que debe investigarse en futuros estudios.
El aumento de la longitud de las vellosidades significa un incremento en la función digestiva y una mayor absorción de nutrientes en el intestino debido al aumento de la superficie de absorción, lo que, consecuentemente, tiene un efecto beneficioso sobre el rendimiento productivo (Jamroz et al., 2005). Sin embargo, en el presente estudio no se encontraron diferencias significativas entre los grupos evaluados para la longitud de las vellosidades a nivel del duodeno y yeyuno (Cuadro 3), resultado similar al reportado por Shokryazdan et al. (2017), De Souza et al. (2018) y Li et al. (2019). No obstante, Gunal et al. (2006), al suplementar una mezcla de probióticos, y Forte et al. (2018) suplementando probióticos a base de Lactobacillus acidophilus D2/CSL incrementaron significativamente la longitud de las vellosidades en yeyuno e íleon a los 21 días de edad y en íleon a los 42 días de edad, respectivamente, en comparación con los grupos control. Asimismo, Calik et al. (2019) y Gorozabel et al. (2020) encontraron un incremento significativo en la longitud de las vellosidades en aves suplementadas con probióticos tanto en el alimento como en el agua de bebida respecto a los controles no tratados.
Awad et al. (2009) indicaron que el incremento en el ancho de la vellosidad se relaciona a una menor hiperplasia a nivel de células caliciformes y enterocitos, mejorando el sistema de absorción en el epitelio de revestimiento, pasando el nutriente directamente hacia la lámina propia, zona en donde se encuentran los capilares; sin embargo, esto no fue observado en el estudio (Cuadro 3).
La administración del consorcio de actinomicetos en la dieta disminuyó significativamente la profundidad de las criptas en duodeno y yeyuno a los 21 días de edad en comparación con el grupo control con una dieta basal (Cuadro 3), tal y como fue reportado por Chávez et al. (2016), quienes suplementaron con una cepa probiótica de Enterococcus faecium en el agua de bebida, así como con cepas probióticas de Lactobacillus acidophilus y Lactobacillus casei durante los 42 días de crianza. De manera similar, Al-Sultan et al. (2016) también registraron que la administración de probióticos disminuyó la profundidad de las criptas significativamente a los 42 días de edad en las diferentes secciones del intestino en comparación con el grupo suplementado con una dieta basal. En contraste, De Souza et al. (2018), Calik et al. (2019) y Gorozabel et al. (2020) reportaron que las aves suplementadas con diferentes cepas probióticas (Lactobacillus acidophilus, Bacillus subtilis, Bacillus amyloliquefaciens) incrementaron la profundidad de cripta en duodeno y yeyuno en comparación al grupo control, con o sin presencia de desafío con especies de Eimerias.
Una mayor profundidad de cripta es el resultado de un incremento en la actividad proliferativa celular para garantizar una adecuada reposición de células en la región apical de las vellosidades. Este evento puede suceder por un acortamiento de las vellosidades y las criptas más profundas pueden provocar una mala absorción de nutrientes, un aumento de la secreción en el tracto gastrointestinal y, por ende, un menor rendimiento productivo (Xu et al., 2003). En este sentido, cabe resaltar una posible relación entre una menor profundidad de criptas y los mejores resultados numéricos en peso promedio a los 21 días edad de las aves suplementadas con el consorcio de actinomicetos.
Los grupos que recibieron algún aditivo en la dieta, incluyendo el grupo que recibió el consorcio de actinomicetos, aumentaron significativamente la relación entre la longitud de las vellosidades y la profundidad de la cripta (L: PC) en ambas porciones intestinales a los 21 días y en duodeno a los 28 días de edad de las aves, en comparación con el grupo control no tratado (Cuadro 3). En los estudios realizados por Shokryazdan et al. (2017) y Li et al. (2019) se reportaron resultados similares, encontrándose un incremento en la relación L: PC en yeyuno a los 21 y 42 días de edad en pollos de engorde al ser suplementados con cepas de Lactobacillus salivarius y Bacillus spp frente a un grupo control con dieta basal, respectivamente. En contraste con lo anterior, existen estudios donde fue observada la ausencia de un efecto sobre la relación L: PC por el uso de probióticos. Hung et al. (2012), De Souza et al. (2018) y Kazemi et al. (2019) no encontraron diferencias significativas entre grupos con y sin adición de probióticos para la relación L: PC a la misma edad. El índice intestinal está asociado a la eficiencia de crecimiento y la superficie de absorción de nutrientes; por lo tanto, un bajo índice intestinal indicaría una mayor tasa de renovación celular, pero insuficiente para incrementar el tamaño de las vellosidades (Awad et al. 2009; Clevers, 2013).
Una explicación para la respuesta similar observada entre el grupo tratado con el consorcio de actinomicetos y los otros grupos evaluados sobre la profundidad de criptas y la relación L:PC en ambas porciones intestinales a los 28 días, es que, posiblemente a esta edad, se llegó a establecer una adecuada inmunidad en las aves, la cual ayudó a controlar el daño en la mucosa intestinal reduciendo las diferencias que fueron observa- das a los 21 días para estas variables, donde, un cuadro inflamatorio causado por patógenos o toxinas, pudieron tener un impacto negativo importante sobre el grupo control no tratado como consecuencia de un desequilibrio en el recambio celular intestinal provocando un incremento en la renovación de células epiteliales.
La inclusión de microorganismos probióticos en la dieta de pollos de engorde permite el rápido desarrollo de las bacterias benéficas en el tracto digestivo (Alkhalf et al., 2010). De igual manera, se ha asociado un mayor peso relativo de los órganos linfoides con una mayor competencia de la respuesta inmune (Gore y Qureshi, 1997). De acuerdo con Torshizi et al. (2010), el peso relativo del bazo y la bursa fue influenciado positivamente por la administración de probióticos en comparación con el grupo control a los 42 días de edad, resultado que se relacionó con una mejor ganancia de peso y conversión alimenticia al finalizar el estudio. Por otro lado, Gorozabel et al. (2020) un mayor valor de peso relativo del hígado en aves que recibieron Lactobacillus spp en el agua de bebida.
Lo anteriormente descrito, contrasta con lo observado en el estudio, ya que, los grupos suplementados con el consorcio de actinomicetos no afectaron significativamente los pesos relativos de los órganos evaluados a los 21 y 28 días de edad. Al culminar el estudio, el peso relativo del bazo en el grupo tratado con promotores antibióticos fue significativamente mayor en comparación al grupo control y al grupo suplementado con el consorcio de actinomicetos (Cuadro 4), aunque no hubo relación con el rendimiento productivo, ya que los tratamientos evaluados fueron similares entre sí. Este resultado concuerda con los hallazgos reportados por Willis y Reid (2008) y Jwher et al. (2013) quienes evaluaron los efectos de una mezcla de cepas de Lactobacillus sobre el peso relativo de hígado, bazo, páncreas y bursa de Fabricio sin encontrar diferencias significativas al ser comparados con un grupo control a diferentes edades. De igual forma, Arencibia et al. (2019) tampoco reportaron diferencias significativas entre un grupo de aves que fueron alimentadas con Streptomyces RL8 y un grupo control no tratado para el peso relativo del hígado, bazo e intestino en pollos de 21 días de edad.
CONCLUSIONES
Los resultados demostraron que el consorcio de actinomicetos no tiene efecto negativo sobre las variables productivas y tuvo un efecto sobre el rendimiento productivo similar al obtenido con un probiótico comercial y un promotor de crecimiento.
La adición del consorcio de actinomicetos en la dieta tuvo efecto positivo sobre la integridad intestinal al presentar una mejora en la profundidad de cripta y la relación entre la longitud de vellosidad: profundidad de cripta en duodeno y yeyuno a los 21 días de edad, obteniendo resultados similares respecto al resto de grupos que recibieron algún tipo de tratamiento, mientras que no presentó efecto alguno sobre el peso relativo de los órganos entre los grupos evaluados.
El consorcio de actinomicetos representa una potencial alternativa para reemplazar eficazmente a probióticos y los promotores de crecimiento de tipo antibióticos en la alimentación de las aves.












 uBio
uBio 


