INTRODUCCIÓN
La transferencia de embriones (TE) es una herramienta importante dentro del manejo reproductivo y la mejora genética del ganado bovino, introduciendo características favorables de individuos de alto valor genético para incrementar el rendimiento de establos lecheros; adicionalmente, puede mejorar la fertilidad de vacas con estrés de calor o de vacas repetidoras (Drost et al., 1999; Hasler, 2001). La TE como técnica incluye la producción de embriones in vivo mediante un proceso previo de multiovulación y colección de embriones en la hembra, mientras que la producción de embriones in vitro se desarrolla enteramente en laboratorio (Palma, 2008b).
Para la producción de embriones in vitro se utilizan ovocitos aspirados de ovarios de vacas de los centros de beneficio o de vacas en pie mediante la aspiración folicular guiada por ultrasonografía (Hasler, 2014). La técnica de producción de embriones in vitro mediante la aspiración de ovocitos en hembras en pie de alto valor genético y el uso semen sexado incrementa el progreso genético para la mayor producción lechera (Pontes et al., 2010; Blondin, 2017). La industria de producción de embriones para el 2018 reporta que el 96.7% del millón y medio de transferencias de embriones realizas en ese año se realizaron en vacas dedicadas a la producción lechera (Viana, 2018).
Las tasas de concepción con embriones frescos o congelados producidos in vitro se ven afectados por factores tales como la estación del año, la hembra receptora, el estadio y calidad del embrión, la sincronización del celo de la receptora, el tamaño de cuerpo lúteo (CL) y la condición corporal (Hasler, 2001; Peixoto et al., 2007; Gonella et al., 2013; Ferraz et al., 2016). Asimismo, las tasas de gestación son mayores al transferir embriones de producción in vivo en comparación con embriones producidos in vitro (Pérez-Mora et al., 2020). De otra parte, las condiciones de crianza en altura generan interrogantes sobre los factores que afectan la preñez de las hembras receptoras tras la transferencia de embriones producidos in vitro, de allí que el objetivo del presente estudio fue determinar los factores que afectan la tasa de preñez en hembras receptoras de embriones producidos in vitro en condiciones de altura.
MATERIALES Y MÉTODOS
Lugar del Estudio y Animales
La colección de ovarios fue realizada una vez por semana durante tres meses en un centro de beneficio privado ubicado en la ciudad de Puno. Los animales donadores de ovarios fueron vacas de descarte, adultas, no gestantes, de raza Brown Swiss. La producción de embriones in vitro se realizó en las instalaciones del Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional del Altiplano (UNA), Puno. La transferencia de embriones se realizó en 50 hembras receptoras (nulíparas, primíparas y multíparas) Brown Swiss con el tracto reproductivo aparentemente normal (previa evaluación ginecológica y ultrasonográfica). El sistema de manejo fue extensivo y con alimentación mixta (pastos naturales y cultivados) y los animales pertenecían a productores del distrito de Macari, provincia de Melgar, departamento de Puno, Perú, zona ubicada a más de 150 km del laboratorio y a una altitud de 3970 m.
Producción de Embriones in vitro
El proceso de producción de embriones in vitro fue realizado según Suzuki et al. (1999) y Vajta et al. (1997), utilizando una incubadora portátil, sistema que fue adecuado por Pérez et al. (2019a), teniendo los siguientes pasos:
Transporte de los ovarios y colección de ovocitos:
Los ovarios fueron llevados desde el centro de beneficio al laboratorio en un lapso de 2 a 3 h, en solución salina (0.9% NaCl adicionada con 50 µg de gentamicina/ml) en una bolsa de polietileno sumergida en agua temperada a 30-35 °C dentro de un termo. Los ovarios fueron lavados tres veces con solución salina (37 ºC) previo a la colección de los ovocitos. Se aspiraron folículos entre 3 y 8 mm con una aguja 20G x 1" con una jeringa de 10 ml y el contenido aspirado fue colocado en un vial de 15 ml que estaba dentro de un equipo de baño maría. Luego de 10 min de reposo se eliminó el sobrenadante y el sedimento fue vertido en una placa Petri (30x10 mm) para evaluar los ovocitos bajo un estereoscopio a 40X (Leica S8APO, Alemania). Se seleccionaron ovocitos de grado A (Complejos cumulus oophorus [COCs] con masa compacta con al menos 4 a 5 capas de células y citoplasma homogéneo) y B (COCs con 2 a 3 capas de células del cumulus adherida a la zona pelúcida y con citoplasma homogéneo) (Singh et al., 2017).
Maduración de ovocitos y fertilización in vitro:
La maduración se realizó de acuerdo con el protocolo recomendado por Pérez et al. (2019a). Se colocaron de 20 a 30 ovocitos por pozo y fueron lavados en tres oportunidades con el medio de maduración (TCM 2520 Sigma®), suplementado con 0.2 mM de piruvato de sodio, 0.5 mM de bicarbonato de sodio, 10% de suero fetal, 10 µl de anfoterecina B/ml, 10 UI/ml de gonadotropina coriónica equina [Novormon®, Sintex, Argentina], 5 UI/ml de gonadotropina coriónica humana [Pregnyl®N.V. Organon]). Luego, los ovocitos se introdujeron en 500 µl del medio de maduración en placas Petri de 4 pozos cubiertas con aceite mineral. Los ovocitos fueron mantenidos por 24 h a 38.5 ºC, 5% de CO2 y alta humedad (80-90%) dentro la incubadora portátil sumergida en baño maría.
La fertilización in vitro (FIV) se realizó según protocolo de Parrish et al. (1986) con ligeras modificaciones acordes al Laboratorio de Reproducción Animal, UNA (Pérez et al., 2019a), utilizando el medio Fert-TALP. Se utilizó semen congelado en pajilla de 0.5 ml de un solo toro de raza Brown Swiss de origen nacional para evitar el efecto macho, los espermatozoides fueron seleccionados por swim-up en Sperm-TALP y después de centrifugarlos y re-supenderlos se determinó la motilidad y se ajustó la concentración a 1 x 106/ml. De este volumen se colocó 10 µl (aproximadamente 10 000 espermatozoides motiles) a cada pozo de fertilización (500 µl). El proceso de fertilización fue por 18 h dentro la misma incubadora portátil con las mismas condiciones realizadas para la maduración de los ovocitos.
Cultivo y Evaluación de Embriones
Los presuntos cigotos fueron denudados (Vajta et al., 1996), siendo trasladados a un tubo de ensayo de vidrio de 15 ml de capacidad que contenía 500 µl de medio de cultivo mSOFaa (Tervit et al., 1972). El contenido se homogenizó en el vórtex (Vibramix VM3E, Ovan®, España) a su máxima revolución (2600 rpm) por 30 s y luego el contenido se vertió a una placa Petri (30 x10 mm). El tubo se enjuagó tres veces con el mismo medio y los presuntos cigotos recuperados también fueron lavados tres veces con el medio de cultivo (mSOFaa). Se les traspasó a placas Petri que contenían en cada pozo 500 µl de mSOFaa suplementando con 5% de suero fetal (previamente equilibradas 2 h antes). Las placas se acondicionaron dentro la incubadora portátil, cambiando de medio de cultivo cada tres días. Luego de 72 h de la fertilización se determinó el número de embriones fertilizados y a los 7 días pos-cultivo se determinó el estado de desarrollo embrionario utilizando el estereoscopio a 80X.
Receptoras
Se verificó que las receptoras (nulíparas, primíparas y multíparas) tuvieran un ciclo estral completo antes de la transferencia. Asimismo, se registraron las siguientes características:
Factores cuantitativos: Condición corporal (1 al 5, donde 1= muy delgado y 5= con exceso de peso); diámetro del cuerpo lúteo (CL) medido mediante ultrasonografía (promedio del diámetro mayor y menor, mm); número de partos según los registros de los productores.
Factores cualitativos: Lugar de depósito del embrión (cuerno derecho o izquierdo según la posición del CL); calidad de embrión (grado 1 [G1] y grado 2 [G2]), según Palma (2008a).
Transferencia de Embriones
El proceso de producción y transferencia de embriones se realizó de acuerdo con lo indicado en la Figura 1.
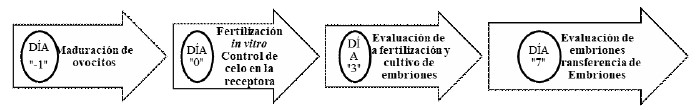
Figura 1 Proceso de producción de embriones in vitro y transferencia de embriones en vacas Brown Swiss criadas en altura
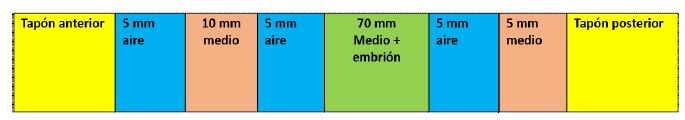
El transporte de los embriones se realizó en pajillas de 0.25 ml (colocando un embrión G1 o G2) conteniendo medio mSOFaa suplementado con 20% de suero fetal. Las pajillas rellenadas con el medio y el embrión (Figura 2) fueron protegidas con papel toalla y colocadas de forma horizontal dentro una caja de poliestireno expandido (Tecnopor®) pequeña (19x11.5 cm y 7.5 cm de alto) manteniendo una temperatura de 15-16 ºC. El tiempo de transporte entre el laboratorio hasta el lugar de transferencia fue alrededor de 4 h. La disposición del embrión transportado se muestra en la Figura 2.
Todas las transferencias de embriones fueron hechas a los 7 días de haberse detectado el celo. Este fue sincronizado previamente con el protocolo de Pre-Synch (dos aplicaciones de prostaglandina F2α [D-Closprostenol, Prostal, Over, Argentina] en dosis de 2.5 ml/animal/aplicación). Para la transferencia se sujetó a la vaca recipiente y se realizó la limpieza y desinfección de la vulva, así como se aplicó anestesia epidural (Lidocaína 2%, 4 ml, Vetocaína A2, AgrovetMarket®). Se determinó el tamaño y posición del CL mediante ultrasonografía con un equipo portátil (DRAMINSKI 4Vet Slim®, Polonia) con 6 MHz de frecuencia equipado con un transductor lineal transrectal.
La pajilla fue colocada en el aplicador para TE protegido con una camiseta sanitaria, el aplicador se pasó a través del cérvix hasta llegar al cuerno ipsilateral del CL donde fue depositado (Bó y Mapletoft, 2018; Palma, 2008b). El diagnóstico de preñez se realizó mediante ultrasonografía a los 30 y 60 días posteriores a la TE determinando la presencia del concepto y del feto.
Análisis Estadístico
Los datos fueron sometidos a estadística descriptiva (promedio y desviación estándar) para los factores cuantitativos de condición corporal (escala de 1 a 5), diámetro de cuerpo lúteo (CL, mm) y número de partos en las receptoras según estado (preñez y no preñez), mediante la prueba no paramétrica de Wilcoxon. Los factores cualitativos de efecto del lugar de depósito de los embriones en el útero (cuerno derecho o izquierdo) y calidad de embrión (grado 1 y 2) según el estado (preñez y no preñez) fueron evaluadas mediante tablas de contingencia de Chi cuadrado.
Todos los factores en conjunto fueron evaluados mediante una regresión logística binaria (debido a que los datos no poseían el supuesto de homocedasticidad) utilizando la metodología de máxima verosimilitud (Peixoto et al., 2007; Pérez et al., 2019b; Vaughan et al., 2013), siendo la variable de respuesta el evento binomial de preñez y no preñez. Los análisis fueron realizados mediante el programa estadístico R 4.0.2 con el paquete Rcmdr (R Core Team, 2020).
RESULTADOS Y DISCUSIÓN
La tasa de concepción en vacas receptoras de embriones producidos in vitro fue del 26% (13/50 receptoras), resultado dentro del rango de 20 y 50% reportado en la literatura (Al-Katanani et al., 2002; Block et al., 2010; Gonella et al., 2013; Ferraz et al., 2016), aunque otros estudios reportan resultados superiores con embriones producidos in vitro (Colazo y Mapletoft, 2007; Pinaffi et al., 2015) y transferidos a gran escala. El 26% de concepción se debería a la distancia recorrida desde el laboratorio al lugar en que se realizó la transferencia, recorrido que pudo tener un efecto negativo sobre la uniformidad de la temperatura de transporte y el tiempo transcurrido (Ideta et al., 2013).
Factores Cuantitativos en la Preñez
Factores cuantitativos como la condición corporal, el diámetro del cuerpo lúteo (CL) y el número de partos influenciaron significativamente (p<0.05) la tasa de preñez al utilizar embriones de producción in vitro (Cuadro 1)
Cuadro 1 Factores cuantitativos que intervienen en la preñez de embriones producidos in vitro de vacas Brown Swiss criadas en altura (n=50)

La disminuida condición corporal de las receptoras del estudio podría haber afectado la tasa de preñez. Según Lamb y Mercadante (2014), la condición corporal en receptoras de aptitud lechera debe estar entre 3 y 4, en tanto que Gümen et al. (2003) indican que hembras con CC baja (<2.5) presentan una alta incidencia de regresión del CL con la consiguiente pérdida de la gestación. Las vacas con mayor tamaño de CL tuvieron una mayor tasa de preñez. Se sabe que existe una relación directa entre el diámetro del CL con la producción de progesterona, hormona encargada del mantenimiento de la gestación (Filho et al., 2010; Rigoglio et al., 2013). Además, un CL de mayor diámetro presenta una mayor vascularización, lo cual favorece una mayor funcionalidad (Pinaffi et al., 2015). De otra parte, la mayor tasa de preñez en hembras jóvenes (nulíparas y primíparas) con relación a vacas multíparas observada en el presente estudio también ha sido reportado por Ferraz et al. (2016). Posiblemente debido a la concentración local de ciertos metabolitos, que a su vez reducen la síntesis de estradiol y progesterona (Stangaferro et al., 2018; Schuermann et al., 2019).
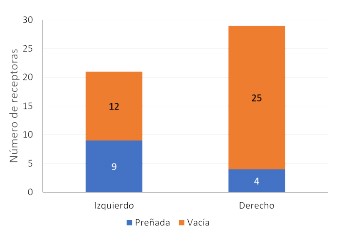
Figura 3 Efecto de la ubicación del cuerpo lúteo en el ovario derecho o izquierdo sobre la tasa de gestación con embriones frescos procedentes de producción in vitro
Factores Cualitativos en la Preñez
Cuerno uterino
La deposición del embrión se realizó en el cuerno uterino ipsilateral al ovario que presentaba el cuerpo lúteo. Los resultados indican una frecuencia de preñez de 4/29 y de 9/ 21 cuando las transferencias fueron realizadas en los cuernos derecho e izquierdo, respectivamente (p=0.0275). En este sentido. Alkan et al. (2020) reportaron un ligero incremento de la preñez cuando el embrión fue transferido cuando el CL estaba presente en el lado izquierdo (42.2% vs. 37%) utilizando embriones producidos in vivo.
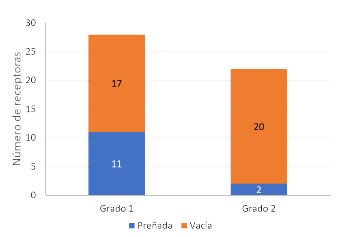
Calidad de embrión
Se obtuvo una frecuencia de preñez de 11/28 y de 2/22 cuando las transferencias fueron realizadas con embriones Grado 1 y Grado 2, respectivamente (p=0.01568). El 39.3% de preñez logrado con embriones de grado 1 demuestra la mayor capacidad de sobrevivir que aquellos de grado 2, posiblemente debido a una mayor producción de interferón tau que es requerida para el reconocimiento de preñez continuando su desarrollo embrionario y evitando la liberación de prostaglandina F2á (PGF2á) que podría generar la luteólisis (Carter et al., 2008; Alkan et al., 2020).
Modelo Lineal Generalizado
El modelo lineal generalizado sobre los factores en conjunto que afectan la preñez de embriones producidos por in vitro se muestra en el Cuadro 2. El modelo lineal generalizado permite determinar en conjunto todos los factores que afectan la preñez, pudiendo observarse que ningún factor fue significativo.
Cuadro 2 Factores cuantitativos y cualitativos en conjunto que intervienen en la preñez de embriones procedentes de FIV
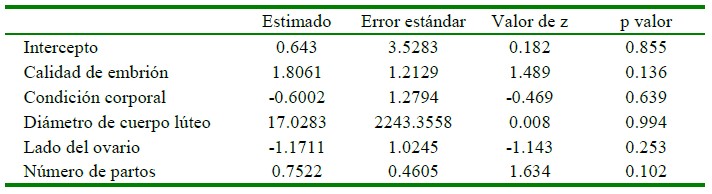
En conclusión, los mejores resultados para un programa de transferencia de embriones producidos in vitro se podrían obtener con receptoras nulíparas o primíparas que presenten un CL de mayor diámetro, CC >2.6, lugar de transferencia al lado izquierdo y utilizando embriones de grado 1 en receptoras.












 uBio
uBio