INTRODUCCIÓN
El cuy (Cavia porcellus) es un roedor mamífero que cuenta con una población de 17.4 millones de individuos en el Perú, según el Instituto Nacional de Estadística e Informática (INEI) (2018), siendo el Perú uno de los principales exportadores de carne de cuy en Sudamérica. Sin embargo, esta actividad pecuaria sufre grandes pérdidas económicas a causa de problemas sanitarios causados por la salmonelosis, siendo el serovar Typhimurium el reportado con mayor frecuencia en anteriores investigaciones (Zuñiga et al., 2001; Morales et al., 2017).
El ingreso de Salmonella en el cuy se da a través del tracto intestinal, de allí que la respuesta inmune de mucosas juega un rol importante frente a dicho patógeno. La inmunoglobulina A(IgA) es la inmunoglobulina más abundante en las mucosas, siendo reconocida como la primera línea de defensa (He et al., 2007; Brandtzaeg, 2010; Boyaka, 2017). Bajo un enfoque preventivo, el uso de vacunas puede ser importante para disminuir el impacto de la salmonelosis en los cuyes. Dentro de los tipos de vacunas que se conocen, las cepas atenuadas son muy convenientes porque simulan una infección sin ocasionar sintomatología clínica, suficiente para estimular una respuesta inmune a nivel de mucosa entérica (Chatfield et al., 1989; Simon et al., 2012). Por otro lado, Kiros et al. (2012) destacan la importancia del uso de modelos animales para el desarrollo de vacunas con el propósito de determinar la calidad y cantidad de la respuesta inmune a la vacunación.
En el Perú no se dispone de información respecto a una vacuna comercial efectiva para la prevención de la salmonelosis en los cuyes, tampoco de ensayos en el desarrollo de una vacuna lo cual es necesario para conocer su capacidad de protección, por lo que su desarrollo, evaluación y comercialización es de imperiosa necesidad. Por ello es necesario realizar evaluaciones previas de los candidatos vacunales en animales de experimentación a fin de conocer su real capacidad de generar una respuesta inmune. Es por tal motivo que el presente estudio tuvo por objetivo evaluar la actividad inmunogénica de tres cepas atenuadas de Salmonella Typhimurium sobre los niveles de excreción de IgA fecal en ratones.
MATERIALES Y MÉTODOS
Lugar de Ejecución
El ensayo experimental se llevó a cabo en el bioterio del Laboratorio de Biología y Genética Molecular de la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM), en Lima, Perú.
Animales
Se utilizaron ratones albinos hembras de cuatro semanas de edad de la cepa BALB/c, adquiridos de Instituto Nacional de Salud (INS). Los animales fueron colocados aleatoriamente en jaulas metálicas (una caja por grupo) de 40 cm2 (piso) x 15 cm de altura. Fueron alimentados ad libitum con alimento peletizado formulado específicamente para crianza de ratones de laboratorio. Los ratones fueron sometidos a un periodo de acondicionamiento y cuarentena de 14 días. El proyecto consideró las normas del Comité de Ética y Bienestar Animal (CEBA) de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, y aprobado según constancia CEBA 2020-6.
Cepas Atenuadas de Salmonella Typhimurium
Se utilizaron tres cepas vivas atenuadas de Salmonella Typhimurium, que se mantuvieron en congelación de -80 °C y que previamente se había comprobado que carecían de capacidad patogénica e invasiva. La cepa 1 carecía de capacidad para la síntesis de aminoácidos esenciales, la cepa 2 había perdido la capacidad de supervivencia en macrófagos y la cepa 3 carecía de capacidad de invasión.
Grupos Experimentales
Los ratones fueron distribuidos aleatoriamente en cuatro grupos experimentales, cada uno con siete animales. Los tratamientos (A, B y C) correspondieron ratones inoculados con una cepa viva atenuada de S. Typhimurium (cepa 1, cepa 2 y cepa 3, respectivamente) y un grupo control (inoculado con PBS estéril).
Preparación del Inóculo
Para la reactivaciones de las cepas atenuadas, se tomó una alícuota de 50 µl que fue inoculada en un tubo conteniendo 10 ml de caldo Luria Bertani (LB) e incubado por 18 horas a 37 °C. Posteriormente, se transfirió todo el cultivo a frascos conteniendo 500 ml de caldo LB y fue incubado por 18 h a 37 °C en agitación constante usando una incubadora de agitación orbital (MaxQ™ 4450, Thermo Scientific). Luego se homogenizó el caldo LB y se dispensó en tubos estériles cónicos de 50 ml. Los tubos fueron centrifugados a velocidad media (5000 g) en una centrífuga Multifuge X3R (Thermo Scientific), se descartó el sobrenadante y el material sedimentado fue resuspendido en 2 ml de solución de glucosa al 20% hasta llegar a una concentración de 109 UFC/100 µl de solución. La concentración fue obtenida mediante medición por espectrofotometría en un espectrofotómetro Genesys 10uv a 600 nm usando, además, un control de concentración conocida.
Inoculación de Ratones
Después del periodo de cuarentena y adaptación al ambiente del bioterio (1 semana), los ratones correspondientes a los grupos tratamiento (Grupos A, B y C) fueron inoculados con 100 µl de la cepa atenuada con 109 UFC/animal vía oral utilizando una sonda orogástrica 18G de 2.5 cm de longitud y 2 mm de diámetro (Sigma Aldrich), siguiendo las recomendaciones descritas en la guía «Manejo y cuidado de animales de laboratorio: Ratón» del Instituto Nacional de Salud (INS, 2008). De igual manera se procedió a administrar 100 µL PBS por vial oral a los animales correspondientes al grupo control.
Muestras y Extracción de IgA Fecal
Se recolectaron muestras fecales los días 1, 9, 15 y 21 pos-inoculación de la cepa atenuada colocando a los ratones en cajas metálicas desinfectadas. Las muestras fueron colocadas en tubos de microcentrífuga de 1.5 ml y procesadas mediante extracción de proteínas fecales para la medición y lectura de IgA contra Salmonella Typhimurium mediante un ELISA indirecto in house.
Para la extracción de IgA se colocó 100 mg de heces en un tubo de microcentrífuga que contenía 1 ml de PBS y 50 µl de un inhibidor de proteasas Sigma FastTM. Luego se homogenizó en un vórtex durante 15 min, para luego colocar en una centrífuga refrigerada a 4 ºC y 10000 g durante 10 min. Finalmente se recuperó el sobrenadante y se almacenó a -20 ºC para su posterior procesamiento.
ELISA Indirecto in house
El desarrollo de la prueba de ELISA indirecto in house se realizó con base a los protocolos descritos por Ledesma et al. (2017) y Moreno et al. (2018).
Para la obtención del antígeno para la prueba de ELISA se reactivó una cepa de S. Typhimurium del banco de cepas de laboratorio, el cual se encontraba conservado a -80 °C en caldo TSA (Agar Triptona-Soja) con glicerol al 25%, procediéndose a tomar una alícuota de 50 µl y colocarlo en 5 ml de caldo BHI (Infusión Cerebro Corazón), y dejándose por 18 horas a 37 °C. El cultivo resultante se transfirió a un frasco conteniendo 100 ml caldo BHI y se incubó por 18 horas a 37 °C en agitación constante (80 RPM) en un incubadora de agitación orbital (MaxQ™ 4450, Thermo Scientific). Posteriormente el contenido del caldo fue transferido a tubos de plástico cónicos estériles de 50 ml y se procedió a centrifugar a 5000 rpm por 10 min a 4 °C, eliminando el sobrenadante. El pellet bacteriano resultante de cada tubo se homogenizó en 10 ml de PBS estéril. Se procedió a lisar las células del pellet bacteriano para obtener el antígeno usando un sonicador (Sonicador SFX250, Branson Ultrasonics) aplicando 7 pulsos de 10 s, con intervalo de 10 s. Se centrifugó a 12000 rpm por 30 min a 4 °C recuperándose el sobrenadante. Se mi- dió la concentración de proteína total de la muestra usando un fluorómetro Qubit (Invitrogen™).
Se usó 100 µl de proteína total de Salmonella Typhimurium a una concentración de 35 µg/ml obtenido en el procedimiento anterior para tapizar placas de poliestireno de 96 pocillos (Nunc Maxisorp® 96 well plate), incubándose a 37 °C durante 1 h. Posterior a ello, se realizaron tres lavados con 200 µl de solución de Buffer fosfato salino con Tween como Buffer de Lavado (PBS- T). Para bloquear los pocillos se usó 200 µl de BSA 3% a 4 ºC durante 16 h. Posteriormente se realizaron tres lavados con PBS-T para agregar, por duplicado, las muestras problemas a una concentración de 100 µl/pocillo y a una dilución de 1/200.
Las muestras fueron incubadas a 37 ºC durante 1 h. Luego se realizaron tres lavados con PBS-T y se adicionaron 100 µl del anticuerpo Anti-IgA de ratón marcado con HRP a una dilución 1/20000. Las muestras fueron nuevamente incubadas a 37 ºC durante 1 h para luego realizar tres lavados más con PBS- T antes de añadir 100 µl de sustrato cromógeno (TMB). Posteriormente, las muestras fueron incubadas durante 10 min a temperatura ambiente (Ledesma et al., 2017; Moreno, 2018). Finalmente, se midió la densidad óptica (DO) de las muestras usando una longitud de onda de 650 nm en un lector de microplacas Modelo 680 Bio-Rad.
Análisis Estadístico
Se realizaron curvas de excreción de IgA durante el tiempo de estudio, cuyos datos obtenidos fueron comparados estadísticamente día por día. Primero se aplicó la prueba de Normalidad Shapiro Wilk (p>0.05), lo que indica que siguen una distribución normal. Luego se aplicó el análisis de varianza y la prueba de Tukey con una significancia de 0.05.
RESULTADOS Y DISCUSIÓN
La IgA es el principal anticuerpo secretado en las mucosas y juega un rol fundamental en la protección y regulación homeostática del epitelio de la mucosa intestinal separando el ambiente exterior del interior del cuerpo, lo que se conoce como exclusión inmune que es un proceso que evita que los patógenos ingresen al organismo (Corthésy, 2013). Chen et al. (2018) demostró que la cepa atenuada de deleción Äcrp (carece de capacidad para le transcripción de ADN) de S. Typhimurium al ser administrada por vía oral en ratones en dosis única era capaz de inducir altos títulos de IgA en mucosa e IgG sérica.
Los grupos vacunados con las cepas atenuadas mostraron una respuesta significativamente mayor a partir de la Semana 1 en comparación con el grupo control (p<0.05), resultados que fueron similares a los obtenidos por Chen et al. (2018). La cepa 1 destacó con relación a las otras, pues con el paso de las semanas se evidencia una tendencia a mayores DO relacionado con la excreción de IgA de la mucosa. La cepa 2 evidenció una diferencia significativa de DO frente al grupo control a partir de la Semana 4, aunque no tan marcada como la cepa 1 (Figura 1). Los resultados se deberían a la naturaleza de la candidata vacunal, pues al ser una cepa atenuada tiene potencial inmunogénico. Por otro lado, la cepa 3 presentó una pobre respuesta, posiblemente debido a una pérdida total de la capacidad de colonización, invasión y replicación en el hospedero.
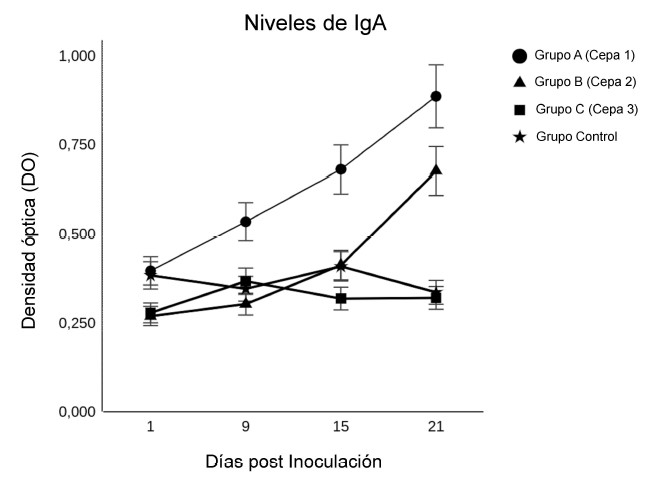
Figura 1 Resultados del ELISA para los niveles de IgA fecal (DO650) en los días 1, 9, 15 y 21 pos-inoculación de 109 UFC/100 µl de tres cepas atenuadas de Salmonela Typhimurium. Los puntos representan las medias y las barras de error a errores estándares (SE)
Haneda et al. (2011) también obtuvieron niveles altos de IgA con una cepa mutante slyA de S. Choleraesuis. La administración oral de la candidata vacunal en ratones demostró una alta inmunogenicidad y expresión de IgA fecal a partir de la tercera semana. También demostró ser eficaz para proteger a los animales frente al desafío con la cepa silvestre. Asimismo, Evora et al. (2016) con cepas mutantes ÄlppAB y ÄlppAB ÄmsbB encontraron niveles altos de IgA, especialmente con la segunda cepa.
La diferencia de DO entre la cepa 1 y la 2 puede deberse a la naturaleza de las cepas atenuadas, ya que la cepa 2 es defectuosa en la supervivencia y replicación en las células fagocíticas y es incapaz de generar una respuesta completa al estrés generado por el hospedero, mientras que la cepa 1 es defectuosa en la síntesis de aminoácidos esenciales provocando un defecto en la pared celular que lo vuelve más sensible e incapaz de replicarse en las células fagocíticas. En suma, se podría decir que la cepa 2 tiene mayor grado de atenuación que la cepa 1.
Los animales del grupo control que fueron inoculados con PBS presentaron IgA fecal durante todo el experimento, a pesar de que fueron negativos a la presencia de Salmonella spp durante el monitoreo de cuarentena. Esto se podría explicar porque para la técnica de ELISA indirecto «in house» se utilizó proteína total de Salmonella Typhimurium en el tapizado de la fase sólida, por lo que antígenos comunes de distintos microorganismos entéricos serían captados por los anticuerpos tipo A circulante.
Finalmente, fue evidente la estimulación de las cepas vivas atenuadas de S. Typhimurium en la excreción de IgA especifica, siendo esta una buena evidencia de que pueden ser buenos candidatos a vacuna para prevenir la infección severa por S. Typhimurium. Los futuros estudios por realizarse deberán verificar la eficacia de estos anticuerpos en generar una respuesta protectiva contra la colonización y/o invasión de cepas patógenos de S. Typhimurium, ya sea bloqueando o disminuyendo la adherencia de la bacteria en el tracto intestinal y previniendo o disminuyendo la severidad de las lesiones causadas por la infección natural.












 uBio
uBio 


