INTRODUCCIÓN
Varios estudios han informado sobre la extracción y caracterización de gelatinas de piel de pescado de varias especies comerciales, incluidos peces de acuicultura como la trucha arcoíris (Tabarestani et al., 2010), carpa común, carpa herbívora (Ninan et al., 2010), tilapia (Niu et al., 2013) y peces marinos como el atún de aleta amarilla (Cho et al., 2005), y tiburón perro (Shyni et al., 2014). Sin embargo, la piel de mahi-mahi (Coryphaena hippurus) no ha sido estudiada como fuente de producción de gelatina de pescado. En este sentido, Cho et al. (2005), Karim y Bhat (2009) y Muyonga et al. (2004) indicaron que las gelatinas de pescado de aguas cálidas poseen mejores propiedades (fuerza de gel, viscosidad, puntos de fusión y gelificación) que las gelatinas de peces de aguas frías y son similares a las gelatinas obtenidas de mamíferos. Los fabricantes de gelatina consideran que la fuerza del gel es la propiedad física más importante porque determina el valor comercial de la gelatina, mientras que el rendimiento de proteína está relacionado con la rentabilidad (GMIA, 2019). Tanto la fuerza de gel como el rendimiento de proteínas dependen de las condiciones de extracción empleadas (Gómez et al., 2002) y pueden mejorarse mediante la optimización.
El mahi-mahi (C. hippurus) es una especie pesquera epipelágica de aguas cálidas que se distribuye en los océanos Pacífico, Atlántico e Índico y en el mar Mediterráneo. La pesquería peruana de mahi-mahi representa el 50% de la captura total a nivel mundial (Amorós et al., 2017), habiéndose capturado 47 711 toneladas en 2018 (Ministerio de la Producción, 2018). El procesamiento primario de esta especie genera una gran cantidad de subproductos como las pieles que representan alrededor de 12% del peso total (Barriga et al., 2012) y, en consecuencia, problemas ecológicos y de contaminación ambiental sin una regulación adecuada. Shyni et al. (2014) sostienen que la conversión de residuos en productos con valor agregado puede ser beneficiosa para la industria pesquera.
La piel de mahi-mahi es particularmente fuerte y resistente, características relacionadas con su alto contenido de colágeno, el cual puede ser transformado a gelatina soluble a través de etapas que involucran la interacción de las principales variables que influyen sobre el proceso de extracción. La metodología de superficie de respuesta (MSR) es una herramienta eficaz para la optimización de procesos y, en este caso, para la obtención de gelatina con mejores propiedades. Se han reportado varios procesos de optimización en la extracción de gelatina (Cho et al., 2005; Wangtueai y Noomhorm, 2009; Ardekani et al., 2013). Es así que el propósito de este estudio fue determinar las condiciones óptimas para la extracción de gelatina de piel de mahi-mahi y obtener la máxima fuerza de gel y rendimiento proteico utilizando MSR. Además, se analizaron las características fisicoquímicas de la gelatina de piel para evaluar su potencial aplicación.
MATERIALES Y MÉTODOS
Material Biológico
Las pieles de mahi-mahi (Coryphaena hippurus) se obtuvieron a partir del fileteo del recurso en el Terminal Pesquero Mayorista de Ventanilla (TPMV), Callao, Perú. La longitud de los pescados y de las pieles fluctuaron entre 100-110 cm y 75-85 cm, respectivamente. El material residual (escamas y carnes adheridas) se eliminó manualmente con un cuchillo.
La gelatina de piel se extrajo siguiendo el método de Gómez-Guillén et al. (2002) con ligeras modificaciones. En el laboratorio, las pieles frescas fueron lavadas, cortadas en trozos de 1-2 cm, y luego remojadas en una solución de hidróxido de sodio (NaOH) 0.05 M durante 3.0-3.5 h con agitación constante a temperatura fría (~ 8 ± 1 °C) en una relación piel/solución de 1: 5 (p/v), para eliminar los lípidos y proteínas no colagénicas. Se drenó la solución alcalina (dos veces) y se lavaron con agua hasta alcanzar la neutralidad. En estas condiciones, las pieles se trataron con ácido cítrico 0.025 M durante 60-70 min con agitación constante a una temperatura ~8 ± 1 °C en una relación piel/solución de 1:5 (p/v). Posteriormente, se enjuagaron con agua hasta alcanzar un pH cercano a la neutralidad. Las extracciones de gelatina se realizaron en un rango de soluciones de ácido cítrico (0.10.9%) en una relación piel/solución de 1:3 (p/ v), a temperaturas comprendidas entre 40 a 70 °C durante 60-400 min con agitación en un baño de agua (Memmert, Alemania). Las soluciones fueron filtradas (papel Whatman No. 2) y el líquido resultante se secó a 50 ºC (MMM Group, Planegg, Alemania) durante 2022 h y finalmente fue molido y almacenado.
Propiedades Fisicoquímicas
Composición proximal y pH
El contenido de humedad, lípidos, cenizas y proteínas de la gelatina en polvo de piel de mahi-mahi se determinó de acuerdo con la metodología de la AOAC (2005). El contenido de proteína total se calculó utilizando un factor de conversión de nitrógeno de 5.4 (Shyni et al., 2014). El pH de la gelatina se determinó como se describe en el método de British Standard Institution (BSI, 1975) usando un medidor de pH Seven Easy (Mettler-Toledo USA). Todas las mediciones se realizaron por triplicado.
Fuerza de gel
La fuerza del gel se determinó según Gómez-Guillén et al. (2002). El polvo de gelatina se disolvió en agua desionizada a 60 °C para obtener una concentración final de 6.67%. La fuerza de gel (g) se determinó a 7 °C usando un analizador de textura Brookfield (LFRA 1500, Brookfield Engineering Laboratories, USA). La medición se realizó por triplicado.
Rendimiento de proteína
La concentración de proteína soluble se determinó por el método de Biuret (Yang et al., 2007), utilizando un espectrofotómetro a 540 nm (UV/Vis, Perkin Elmer, USA) con albúmina de suero bovino (BSA, grado estándar, Sigma, USA) como estándar. El rendimiento de proteína (RP) se determinó mediante la siguiente ecuación: RP (%) = (P × V / W) × 100, donde P es la concentración de proteína (g/ml), V es el volumen del extracto (ml) y W es el peso de muestra usada para la extracción (g).
Electroforesis en gel de poliacrilamida SDS -PAGE(SDS-PAGE)
La gelatina se analizó mediante SDSPAGE (Laemmli, 1970). La gelatina en polvo se disolvió a una concentración de 1 mg/ml en buffer tampón (Tris-HCl 50 mM, pH 7.5; glicerina al 50%, SDS al 1%, azul de bromofenol al 0.02%, BPB). Se usó un marcador proteico de alto peso molecular (MW) (Sigma, USA) (36-205 kDa) para estimar el peso molecular de las cadenas de gelatina.
Aminoácidos
La composición de aminoácidos se analizó según lo descrito por Heinrikson y Meredith (1984), usando HPLC (Chromaster, Hitachi, Japón). El contenido de hidroxiprolina (Hyp) se determinó de acuerdo con los métodos AOAC (2005). Los resultados se expresaron como gramos de aminoácidos por 100 g de proteína.
Viscosidad
La viscosidad dinámica se determinó según Niu et al. (2013). Se obtuvo una solución de gelatina al 6.67%. La viscosidad de la solución se determinó con un viscosímetro Brookfield DV2T (Brookfield Engineering Laboratories, USA) equipado con un husillo SC4-18, a 60 ± 0.1 °C y 70 rpm, y los valores se midieron en centipoises (cP). La medición se realizó por triplicado.
Punto de fusión y gelificación
La determinación del punto de fusión y de gelificación se basó en el método de Muyonga et al. (2004), utilizando soluciones de gelatina al 6.67 y 10.0%, respectivamente. La medición se realizó por triplicado.
Diseño Experimental
Las condiciones óptimas para la extracción de gelatina fueron determinadas por MSR, utilizando un diseño compuesto central (DCC) de cinco niveles y tres factores. El DCC consistió en 20 tratamientos incluyendo 23 puntos factoriales, seis puntos axiales (α = 2) y seis réplicas del punto central. Las variables independientes fueron temperatura de extracción (X1, 40 -70 °C), tiempo de extracción (X2, 60-400 min) y concentración de ácido cítrico (X3, 0.10-0.90%). La resistencia del gel (g, Y1) y el rendimiento de proteínas (%, Y2) se seleccionaron como variables dependientes tal como se observa en el Cuadro 1.
Cuadro 1 Diseño compuesto central para optimizar las condiciones de extracción de la gelatina de piel de mahi-mahi (Coryphaena hippurus) junto con los datos experimentales y su valor predicho según los modelos de superficie de respuesta de segundo orden
| Orden estándar | Nivel de código de variable | Fuerza de gel (g) | Rendimiento de proteína (%) | ||||
|---|---|---|---|---|---|---|---|
| X1 | X2 | X3 | Experimental | Predicho | Experimental | Predicho | |
| 1 | 46.1 | 129 | 0.26 | 454.2 | 440.6 | 16.84 | 16.84 |
| 2 | 63.9 | 129 | 0.26 | 350.0 | 357.6 | 20.41 | 20.36 |
| 3 | 46.1 | 331 | 0.26 | 396.9 | 399.8 | 18.34 | 18.21 |
| 4 | 63.9 | 331 | 0.26 | 346.7 | 354.0 | 21.36 | 21.44 |
| 5 | 46.1 | 129 | 0.74 | 404.5 | 412.3 | 16.71 | 16.73 |
| 6 | 63.9 | 129 | 0.74 | 338.0 | 329.2 | 20.25 | 20.26 |
| 7 | 46.1 | 331 | 0.74 | 381.4 | 371.5 | 17.49 | 17.64 |
| 8 | 63.9 | 331 | 0.74 | 335.3 | 325.7 | 20.97 | 20.86 |
| 9 | 40 | 230 | 0.50 | 390.1 | 395.7 | 15.74 | 15.72 |
| 10 | 70 | 230 | 0.50 | 287.3 | 287.4 | 21.35 | 21.39 |
| 11 | 55 | 60 | 0.50 | 409.5 | 410.1 | 18.89 | 18.98 |
| 12 | 55 | 400 | 0.50 | 370.8 | 372.9 | 20.56 | 20.64 |
| 13 | 55 | 230 | 0.10 | 423.3 | 415.3 | 19.12 | 19.18 |
| 14 | 55 | 230 | 0.90 | 360.9 | 367.7 | 18.66 | 18.61 |
| 15 | 55 | 230 | 0.50 | 388.8 | 391.5 | 19.92 | 19.81 |
| 16 | 55 | 230 | 0.50 | 383.3 | 391.5 | 19.89 | 19.81 |
| 17 | 55 | 230 | 0.50 | 394.3 | 391.5 | 19.76 | 19.81 |
| 18 | 55 | 230 | 0.50 | 390.5 | 391.5 | 19.79 | 19.81 |
| 19 | 55 | 230 | 0.50 | 396.9 | 391.5 | 19.80 | 19.81 |
| 20 | 55 | 230 | 0.50 | 386.0 | 391.5 | 19.83 | 19.81 |
Análisis Estadístico
Los datos experimentales se analizaron mediante el software Design-Expert(r) v. 12.0 (USA) utilizando análisis de regresión múltiple. El ajuste se realizó a un modelo de segundo orden para cada respuesta y la ecuación se expresó de la siguiente manera: Y= β0 + β1X1 + β2X2 + β3X3 + β11X1 2 + β 22X2 2 + β 33X3 2 + β 12X1X2 + β13X1X3 + β23X2X3, donde Y representa la variable dependiente (fuerza de gel y rendimiento de proteínas), β0 representa el término constante, βi representa los términos lineales, βii representa los términos cuadráticos para una sola variable y βij representa los términos de interacción (i = 13; y j = 1-3). La significancia estadística (p<0.05) de la ecuación del modelo se evaluó mediante análisis de varianza (ANOVA). Se determinó el valor R2 ajustado y la falta de ajuste. Posterior a las determinaciones de predicción del modelo, las condiciones óptimas de extracción de gelatina se obtuvieron mediante la función de deseabilidad (Montgomery, 2011).
RESULTADOS Y DISCUSIÓN
Modelo de Superficie de Respuesta
Todos los coeficientes lineales (X1, X2, X3) fueron significativos (p<0.05) en ambos modelos. Los términos X1X3, X2X3, X2 2, X3 2 de Y1 (fuerza de gel) y los términos X1X3, X2 2 de Y2 (rendimiento de proteína) fueron no significativos (p>0.05) y, por tanto, excluidos. Los modelos ajustados se muestran en las ecuaciones 1 y 2. Los valores de R2 para Y1 e Y2 fueron 0.9629 y 0.9978, respectivamente. Según el ANOVA que se muestra en el Cuadro 2, ambos modelos de regresión fueron significativos (p<0.05) y la prueba de falta de ajuste no significativa (p>0.05), lo cual es un buen indicador de que el modelo es adecuado (Ardekani et al., 2013). Las ecuaciones del modelo de superficie de respuesta ajustado son:
Ecuación 1
Fuerza de gel (Y 1) = 391.49 - 32.21X1 - 11.08X2 - 14.17X3 + 9.30X1X2 - 17.65X1 2
Ecuación 2
Rendimiento de proteína (Y 2) = 19.81 + 1.69X1 + 0.49X2 - 0.17X3 - 0.07X1X2 - 0.12X2X3 - 0.44X1 2 - 0.32X3 2
Para optimizar las respuestas simultáneamente (maximizar), se definió la función de deseabilidad de la siguiente manera: objetivo (fuerza de gel = 400 g y rendimiento de proteína = 21%).
Cuadro 2 Análisis de varianza (ANOVA) para el modelo de superficie de respuesta de segundo orden de la fuerza del gel y el rendimiento de proteínas
| Respuestas | Fuente | SS | DF | MS | F value | P-value |
|---|---|---|---|---|---|---|
| Fuerza de gel | Modelo | 24251.37 | 9 | 2694.60 | 52.40 | 0.0000 |
| Residual | 514.28 | 10 | 51.43 | |||
| Falta de ajuste | 386.25 | 5 | 77.25 | 3.02 | 0.1254 | |
| Error puro | 128.03 | 5 | 25.61 | |||
| Total | 24765.65 | 19 | ||||
| Rendimiento de proteínas | Modelo | 46.85 | 9 | 5.21 | 782.90 | 0.0000 |
| Residual | 0.07 | 10 | 0.01 | |||
| Falta de ajuste | 0.05 | 5 | 0.01 | 2.54 | 0.1649 | |
| Error puro | 0.02 | 5 | 0.00 | |||
| Total | 46.91 | 19 |
Gráficos de Superficie de Respuesta
La Figura 1 muestra la función de respuesta estimada y los efectos de las variables independientes (X1, X2 y X3) sobre la fuerza de gel (Y1) y el rendimiento de proteínas (Y2), respectivamente. En la Figura 1a se observa que el factor X1 (temperatura de extracción) tuvo un efecto mayor sobre la fuerza de gel, que disminuyó con un aumento de X1 de 47.5 a 70.0 °C y del tiempo de 60 a 400 min. El tratamiento térmico por encima de 40 °C destruye los enlaces de hidrógeno y escinde una serie de enlaces covalentes, lo que desestabiliza la triple hélice y da como resultado la gelatina soluble (Karim y Bhat, 2009) que se encuentran en estado de sol y forman geles físicos termorreversibles al enfriarse. El resultado concuerda con lo reportado por Tan et al. (2019), quienes evaluaron temperaturas de extracción de 45 a 75 °C sobre piel de tilapia negra, y obtuvieron gelatinas con fuerza de gel de 850 g usando temperaturas de 45 °C. Altas temperaturas de extracción provocan la degradación de las proteínas (Wangtueai y Noomhorm, 2009) e influyen sobre la fuerza de gel de las gelatinas. Durante la gelificación, las cadenas sufren una transición conformacional de desorden-orden y regeneran parcialmente la estructura de triple hélice del colágeno (Pezron et al., 1991). La red tridimensional resultante es responsable de la fuerza e integridad del gel (Karim y Bhat, 2009); por lo tanto, condiciones de extracción rigurosas dan como resultado hidrogeles con menos fuerza de gel, tal como reportaron Casanova et al. (2020) con extracción de gelatina de piel de carbonero (Parus major) a 80 °C.
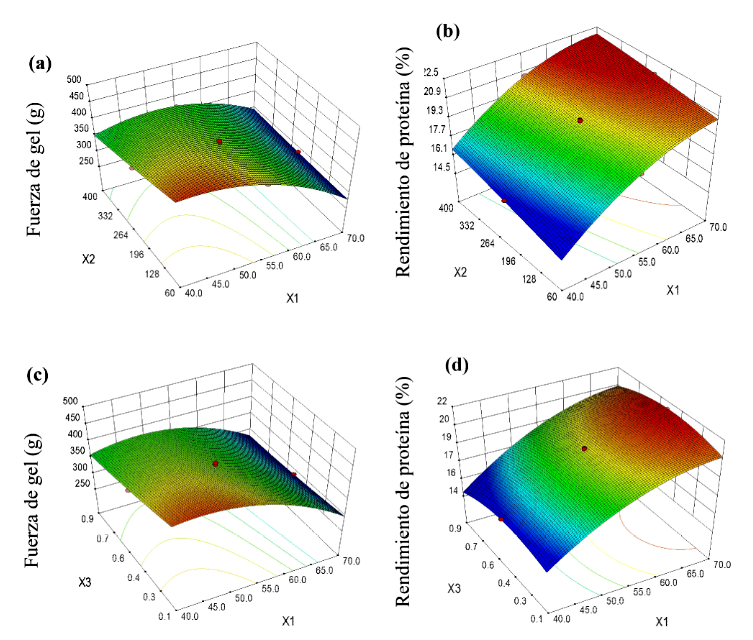
Figura 1 Gráficos de superficie de respuesta para la fuerza de gel y rendimiento de proteína como una función de X1 y X2 (a, b) de X1 y X3 (c, d) de la gelatina de piel mahi-mahi (Coryphaena hippurus)
Las gelatinas mostraron valores bajos de fuerza de gel (1.9 y 7.7 g). Los factores X2 y X3 mostraron un efecto menos marcado. Los efectos de las variables independientes sobre Y2 (rendimiento de proteína) se muestran en las figuras 1c y 1d. Tanto X1 como X2 ejercieron efectos directamente proporcionales sobre el rendimiento de extracción, donde la temperatura de extracción tuvo un mayor efecto sobre Y2. Un aumento de X1 o X2 facilitó la fragmentación de las cadenas de colágeno, aumentando la proporción de moléculas desestabilizadas conduciendo a una mayor proporción de gelatina extraída. Los valores de rendimiento de extracción más altos (>21%) se obtuvieron utilizando temperaturas de extracción entre 62.5 y 70.0 °C para tiempos entre 280-400 min. Fan et al. (2017) informaron que condiciones de extracción excesivas (altas temperaturas de extracción y tiempos prolongados) sobre piel de salmón condujeron a la formación de cadenas á más cortas debido a la degradación de cadenas proteicas. Los rendimientos más altos de se obtuvieron empleando el factor X3 entre 0.15 y 0.55%. Las concentraciones más altas de ácido cítrico no aumentaron el rendimiento de extracción. La influencia del pH sobre el rendimiento de extracción y la fuerza de gel de las gelatinas es conocida (Koli et al., 2013; Derkach et al., 2019).
Optimización de la Extracción de Gelatina
Los valores experimentales obtenidos en condiciones óptimas fueron: temperatura de extracción (X1) de 56.8 °C, tiempo de extracción (X2) de 331 min y concentración de ácido cítrico (X3) de 0.26% para obtener una gelatina de 387 ± 4.5 g de fuerza de gel y 20.4 ± 0.08 % de rendimiento de proteína con una función de deseabilidad de 0.912.
Propiedades Fisicoquímicas de la Gelatina Optimizada
Composición proximal y pH
La gelatina obtenida tuvo un alto contenido de proteína (88.3%), con valores bajos de humedad (6.8%), lípidos (0.2%) y cenizas (1%). El contenido de proteína en la gelatina de piel de pescado es generalmente alto, con rangos entre 88.4 y 91.2% (Ninan et al., 2014; Shyni et al., 2014); sin embargo Khiari et al. (2015) reportaron 84.1% de contenido proteico en la gelatina extraída de piel de bacaladilla (Micromesistius poutassou) mediante un pretratamiento con ácido cítrico. El contenido de humedad estuvo por debajo del límite prescrito del 13 % para la gelatina comestible (GMIA, 2019).
El bajo contenido de lípidos (0.2%) indicó que el método utilizado fue eficaz para desgrasar la materia prima. El contenido de cenizas estuvo por debajo del límite máximo reportados por Shyni et al. (2014) de 2.6% y por Khiari et al. (2015) de 1.9%. Además, las gelatinas con un contenido de cenizas inferior al 2% son aceptables para aplicaciones alimentarias (Kasankala et al., 2007; GMIA, 2019).
El pH fue 4.9, valor que se encuentra dentro del rango de pH de 3.8 a 5.5 para la gelatina comestible (GMIA, 2019).Alfaro et al. (2014) reportaron un pH de 3.2 para el bagre africano (Clarias gariepinus), en tanto que Shyni et al. (2014) obtuvieron un pH de 4.2 para el rohu y 4.3 para el barrilete (Katsuwonus pelamis). Según esto, la gelatina de piel de mahi-mahi cumple con los requisitos para una gelatina comestible.
Fuerza de gel
La fuerza de gel de la gelatina de piel de mahi-mahi en condiciones óptimas fue de 387 g. Este resultado fue mayor al reportado por Gómez-Guillén et al. (2002) para gelatinas de pescado de agua fría, bacalao (Gadus morhua) (70 g) y merluza (Merluccius sp) (100 g). El valor obtenido también fue mayor al de las gelatinas de peces de aguas cálidas como en la perca del Nilo (Lates niloticus) (134-229 g) (Muyonga et al. (2004), y de 267 g en carpa herbívora (Ctenopharyngodon idella) (Kasankala et al., 2007), pero menor a los 526 g en atún de aleta amarilla (Thunnus albacares) (Cho et al., 2005).
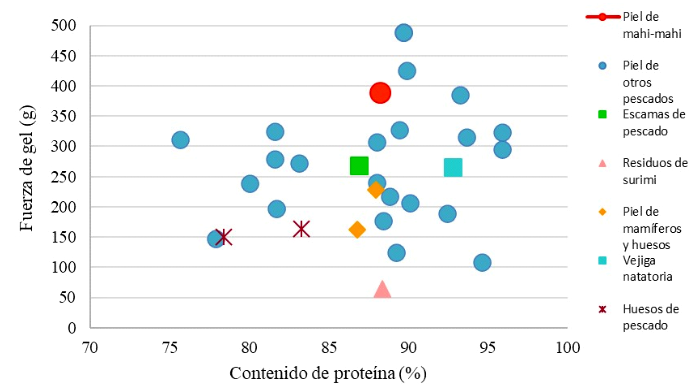
En el presente estudio también se obtuvieron valores más bajos de rendimiento de extracción (423 y 454 g). La fuerza de gel de la gelatina de piel de mahi-mahi fue mayor que las gelatinas de bovino, con valores entre 200 y 221 g (Muyonga et al., 2004; Cho et al., 2005), y las gelatinas de porcino, con valores de 240295 g (Cho et al., 2005; Karim y Bhat, 2009). La variación en la fuerza de gel depende del perfil de aminoácidos, el rango de peso molecular y el pH de la gelatina obtenida (Karim y Bhat, 2009; Fan et al., 2017). Esto depende de las condiciones de extracción, como la presencia de ácidos y su concentración, ya que el aumento de iones H+ favorece el acceso del agua a las fibras de colágeno. Esta agua es retenida por fuerzas electrostáticas entre grupos polares cargados (hinchamiento electrostático) o por enlaces de hidrógeno entre grupos polares no cargados y átomos negativos (hidratación liotrópica) (Gustavson, 1956). Un mayor hinchamiento de la matriz está relacionado con una mayor solubilización del colágeno y, en consecuencia, con una menor resistencia de gel. En la Figura 2 se observa que las gelatinas de pieles de pescado mostraron valores de fuerza de gel comprendidos entre 94.6 y 488.0 g, siendo fuerza de gel de la gelatina de piel de mahi-mahi uno de los valores más altos.
Rendimiento de proteína
El rendimiento proteico de la gelatina extraída de piel de mahi-mahi fue de 20.4%, un valor más alto que 19.8%, valor reportado en la extracción de gelatina de piel de carpa herbívora (Ctenopharyngodon idella) empleando HCl (Kasankala et al., 2007) y que 19.2%, valor reportado en la extracción de gelatina de piel de bagre de canal (Ictalurus punctatus) utilizando ácido acético (Yang et al., 2007).
La variación en el rendimiento de extracción depende de la edad, tamaño y conformación estructural del colágeno de la especie que se utiliza para extraer la gelatina; asimismo, de las condiciones previas al proceso de extracción y del proceso propiamente dicho (Karim y Bhat, 2009; Yang et al., 2007). En adición, Cho et al. (2014) indicaron que las capas de la dermis de la piel de cuatro especies de peces mostraron una alta concentración de fibras de colágeno, lo que se relaciona con el mayor grosor de las áreas dorsal y ventral y, en consecuencia, con una alta tasa de extracción de colágeno. En la Figura 2 se observa que el contenido de proteína en gelatinas obtenidas de diversas matrices varió entre 75.0 y 96.0%, aproximadamente, donde la gelatina de piel de mahi-mahi alcanzó un valor de 88.3%, un valor muy cercano al valor máximo que reporta la GMIA (2019) para gelatinas comerciales extraídas de piel y huesos de porcino y bovino (84.0 y 90.0% de proteína).
Perfil de electroforesis en gel de poliacrilamida-SDS (SDS-PAGE)
Las moléculas de colágeno compuestas por tres cadenas α entrelazadas conforman la triple hélice de colágeno las cuales están estabilizadas por enlaces de hidrógeno entre cadenas. La desnaturalización del colágeno afectada por diferentes condiciones de extracción provoca la separación de las varillas y la separación total o parcial de las cadenas debido a la destrucción de los enlaces de hidrógeno, y, tras la desnaturalización, los polímeros existen en forma enrollada (Karim y Bhat, 2009). Por lo tanto, las gelatinas industriales son mezclas de diferentes compuestos: cadenas α (una cadena de polímero), cadenas β (dos cadenas α reticuladas covalentemente) y cadenas γ (tres cadenas α reticuladas covalentemente) (Papon et al., 2007). El perfil SDS-PAGE de la gelatina de piel de mahi-mahi obtenida en condiciones óptimas muestra que las cadenas á1 y á2 y los componentes â (dímero de cadena á unida covalentemente) fueron los componentes principales.
En la Figura 3 se observa que la intensidad de las bandas de las cadenas α1 y α2 con peso molecular aproximado de 116 kDa fue mayor que la banda del componente β con peso molecular aproximado de 200 kDa. Karim y Bhat (2009) señalan que la gelatina consiste en una mezcla de polipéptidos con pesos moleculares de 80 a 250 kDa debido a la escisión de enlaces cruzados químicos entre cadenas y alguna rotura desfavorable al interior de la cadena (Zhou et al., 2006).

Figura 3 Perfil SDS-PAGE de muestra patrón (M) y de gelatina optimizada a partir de piel de mahi-mahi (G) (Coryphaena hippurus)
Perfil de aminoácidos
El perfil de aminoácidos de la gelatina de piel mahi-mahi se muestra en el Cuadro 3. La glicina fue el componente principal (20.9%), seguida de la arginina (19.1%). La gelatina presentó contenidos relativamente altos de ácido glutámico e iminoácidos (prolina e hidroxiprolina), en comparación con lo reportado por Kaewdang et al. (2016), pero con ausencia de los aminoácidos cisteína y triptofano los cuales no suelen estar presentes en el colágeno y la gelatina (Ninan et al., 2010; Shyni et al., 2014).
Cuadro 3 Composición de aminoácidos de gelatina de piel de mahi-mahi (Coryphaena hippurus) optimizada y de piel de mamíferos (porcino and bovino) (g/100 g proteína)
| Aminoácidos | Contenido (g/100 g de proteína) | ||
|---|---|---|---|
| Piel de mahi-mahi (presente trabajo) | Bovino (Ninan et al ., 2010) | Porcino (Ninan et al ., 2010) | |
| Ácido aspártico | 4.32 ± 0.01 | 2.50 | 3.01 |
| Ácido glutámico | 8.57 ± 0.00 | 7.23 | 10.32 |
| Serina | 3.36 ± 0.01 | 2.95 | 3.01 |
| Glicina | 20.86 ± 0.01 | 29.2 | 27.69 |
| Histidina | 0.65 ± 0.00 | 0.08 | 0.03 |
| Treonina | 5.31 ± 0.03 | 2.11 | 2.06 |
| Alanina | 1.88 ± 0.01 | 11.40 | 11.20 |
| Cisteína | 0.00 ± 0.00 | 0.00 | 0.00 |
| Arginina | 19.10 ± 0.01 | 5.10 | 4.90 |
| Prolina | 10.74 ± 0.01 | 11.89 | 12.44 |
| Hidroxiprolina | 7.90 ± 0.11 | 11.02 | 11.26 |
| Tirosina | 0.59 ± 0.00 | 0.11 | 0.08 |
| Valina | 1.95 ± 0.07 | 1.80 | 1.88 |
| Metionina | 1.81 ± 0.06 | 1.01 | 1.43 |
| Isoleucina | 4.41 ± 0.06 | 1.11 | 0.98 |
| Leucina | 2.63 ± 0.06 | 1.90 | 1.73 |
| Fenilalanina | 2.65 ± 0.07 | 1.60 | 1.20 |
| Lisina | 2.94 ± 0.04 | 4.01 | 3.29 |
| Triptófano | 0.00 ± 0.00 | 0.00 | 0.00 |
| Hidroxiprolina + Prolina | 18.64 ± 0.12 | 22.91 | 23.70 |
El contenido de iminoácido fue de 18.6%. Se han observado porcentajes similares en especies cálidas o tropicales, mientras que en peces de agua fría son menores. Ninan et al. (2010) obtuvieron valores de iminoácidos en la gelatina de piel de carpa (Cyprinus carpio) entre 19.2 y 20.9%, mientras que para gelatinas de origen bovino y porcino fueron de 22.9 y 23.7%, respectivamente (Cuadro 3). Por otro lado, Zhou et al. (2006) encontraron un contenido de iminoácido alrededor del 15.0-16.0% en la gelatina de piel de bacalao (Gadus morhua) y el colágeno de piel de abadejo de Alaska (Gadus chalcogrammus), mientras que Kaewdang et al. (2016) reportaron 15.8%. Estos dos aminoácidos estabilizan térmicamente la triple hélice de colágeno, y se requiere una menor proporción en animales con temperaturas corporales bajas (Khiari et al., 2015). La hidroxiprolina es la más importante ya que participa en la formación y estabilidad de la estructura parcial de la triple hélice en la gelatina (Nikoo et al., 2014), lo que se relaciona con la resistencia del gel formado (Gómez-Guillén et al., 2002).
Viscosidad
La viscosidad de la gelatina extraída fue 11.0 cP, un valor mayor que lo reportado en otras especies, algunas de ellas tropicales y grandes como la carpa plateada (Hypophthalmichthys molitrix) (6.9 cP) (Boran et al., 2010), carpa herbívora (Ctenopharyngodon idella) (7.1 cP) (Ninan et al., 2014), tiburón perro (Heterodontus mexicanus) (5.6 cP) y atún barrilete (Katsuwonus pelamis) (4.4 cP) (Shyni et al., 2014). Además, la viscosidad de la gelatina extraída fue superior a la de las gelatinas comerciales (bovina y porcina) cuyo valor oscila entre 2.0 y 7.0 cP (Boran et al., 2010). Shyni et al. (2014) sostienen que la viscosidad está parcialmente controlada por el peso molecular y la distribución del tamaño molecular.Asimismo, Alfaro et al. (2014) indican que el uso de bajas temperaturas de extracción incrementa la viscosidad de las gelatinas obtenidas.
Puntos de fusión y gelificación
Las temperaturas de gelificación y fusión dependen del peso molecular y su distribución; es decir, de la proporción de cadenas α, β y γ (Derkach et al., 2019). Los valores en la gelatina de piel de mahi-mahi fueron de 17.6 y 25.6 °C, respectivamente, los cuales son más altos que los reportados en gelatinas de peces de aguas frías (11-12 y 13.8-14 °C) (Gómez-Guillén et al., 2002), pero comparables a los valores reportados en gelatinas de peces de aguas cálidas (15.5-20.5 y 24.3 - 29.1 °C) (Muyonga et al., 2004; Cho et al., 2005; Boran et al., 2010; Ninan et al., 2014). Sin embargo, son más bajos que lo reportado en gelatinas de mamíferos (23.4-31.8 y 31.4 - 36.5 °C, respectivamente) (Cho et al., 2005; Karim y Bhat, 2009; Boran et al., 2010; Ninan et al., 2014). En general, las gelatinas de origen bovino y porcino tienen puntos de gelificación y fusión más altos que las gelatinas de peces (Karim y Bhat, 2009; Ninan et al., 2014).
Muyonga et al. (2004) y Ninan et al. (2010) reportaron que el contenido de iminoácidos fue de 23.0-24.0% en gelatinas de mamíferos, 18.0-21.0% en gelatinas de peces de aguas cálidas y de 16.0-17.0% en gelatinas de peces de aguas frías. La aplicación de gelatinas con valores bajos de punto de fusión puede enfocarse en la formulación del producto para controlar la textura y la liberación retardada del sabor durante el proceso de masticación (Choi y Regenstein, 2000) y orientar su aplicabilidad en otros mercados renuentes al consumo de gelatina de mamíferos (Koli et al., 2013).
CONCLUSIONES
La gelatina de piel de mahi-mahi (Coryphaena hippurus) mostró valores altos de contenido proteico, fuerza de gel y rendimiento de extracción de proteína.
El proceso de extracción analizado por MSR mostró que la temperatura tuvo el mayor efecto significativo sobre la fuerza gel y el rendimiento de proteínas.
La solución de optimización para la maximización de la fuerza de gel y rendimiento de proteína fue el empleo de una temperatura de extracción de 56.8 °C, un tiempo de tratamiento de 331 min y una concentración de ácido cítrico de 0.26%.
De acuerdo con las propiedades fisicoquímicas, la gelatina de piel de mahimahi podría usarse en aplicaciones alimentarias para reemplazar la gelatina de mamíferos.












 uBio
uBio