INTRODUCCIÓN
La baja calidad nutritiva de los forrajes afecta de manera drástica la ganancia de peso del ganado (Reyes-Gutiérrez et al., 2019). Existen alternativas como los forrajes de corte para la época de bajo valor nutricional y limitada cantidad de materia seca (MS). La caña de azúcar es un cultivo con alto contenido energético en comparación con otros cultivos tropicales, y debido a que su periodo de cosecha coincide con la época de sequía y la baja producción de forrajes, este cultivo es usado como fuente de forraje en sistemas de producción de leche y carne en áreas tropicales (Custodio et al., 2016). Este insumo aunque tiene alto potencial de producción de MS (80 a 120 t ha-1), lo cual implica bajo costo por unidad de MS producida, mantiene su valor nutritivo en estado de madurez fisiológica (Alves et al., 2017), pero contiene niveles altos de fibra detergente neutro (FDN), fibra detergente ácida (FDA), y bajo contenido de proteína cruda (PC, 3.0) y proteína verdadera (PV), la cual representa al contenido de proteína total calculada libre de nitrógeno no proteico (NNP) y se obtiene por diferencia (Bonomo et al., 2009). A pesar de estos valores, la caña es un alimento idóneo como suplemento para rumiantes, principalmente en la época de estiaje en las regiones tropical y subtropical de México (Ley-de-Coss et al., 2018a).
El alto contenido de humedad de la caña de azúcar puede limitar su inclusión en la dieta para rumiantes (Rangel et al., 2015), pero existen procesos biotecnológicos que han permitido el uso y mejora nutricional del pro-ducto final de la caña (con aumentos en la PC y PV) con la adición de fuentes de NNP, subproductos agroindustriales (molido de arroz), aditivos microbianos (Lactobacillus buchneri, L. plantarum, L. buchneri y Pediococcus acidilactici) (Aranda et al., 2012; Reyes-Gutiérrez et al., 2015; Ley-de-Coss et al., 2018a) y mezclas minerales como óxido de calcio, nitrato de sodio y benzoato de sodio (Ávila et al., 2014; dos Santos et al., 2015). Los aditivos fueron incluidos mediante procesos de fermentación de la caña en presencia de oxígeno (producto conocido como sacharinna) o mediante la fermentación en estado sólido, teniendo como resultado una mejora de la composición nutritiva del producto final (Brea-Maure et al., 2015). No obstante, también se ha reportado que la inclusión de óxido de calcio mejoró la calidad nutritiva, pero sin beneficio para los animales (Jacovaci et al., 2017).
Basándose en información científica, algunos aditivos y procesos de transformación de la caña de azúcar no presentan realmente un beneficio a los animales en comparación con las dietas testigos. Incluso se reporta que el etanol en el rumen produce ácido acético y metano (Archimède et al., 2014). Por otro lado, se reporta que el proceso de fermentación en estado sólido (FES) puede mejorar el contenido de PC y PV del producto final de la caña de azúcar adicionada con una fuente de NNP y un inoculo ácido láctico (Ley-de-Coss et al., 2018a), así como los valores de digestibilidad y PC con la adición de un hongo lignolítico (Pleorotus sapidus) a la fermentación de la caña (Peláez et al., 2008, 2011). De otro lado, la adición de cultivos lácticos no mejoró el contenido de PC del ensilado de caña en relación con el testigo, mientras que otros tratamientos químicos, solo aumentaron el pH y la presencia de Clostridium spp.
Se ha reportado la producción de enzimas, combustibles y alimentos para animales a partir de la FES, proceso que se ha dado en condiciones de baja humedad (menos de 12%) no asépticas y de forma natural (Borrás y Torres, 2016). En este contexto, existe una posibilidad de utilizar esta técnica, en las regiones tropicales como estrategia de conservación y mejoramiento del alimento para los rumiantes. Por tanto, el objetivo de esta investigación fue evaluar el contenido de proteína cruda y verdadera de la caña de azúcar molida después del proceso de fermentación en estado sólido con y sin adición de urea o un inóculo a base de P. acidilactici, Lindner.
MATERIALES Y MÉTODOS
El material vegetal se obtuvo en Cristóbal Obregón, Chiapas, México, ubicado a 16° 25' 52.74" de latitud N y 93°26´51.68" de longitud O a 665 msnm. Esta es una región tropical seca con temperatura ambiental entre 18 y 35 °C y precipitación mínima de 5 mm y máxima de 238 mm mensuales para febrero y septiembre, respectivamente. Las pruebas in vitro de la FES, la medición de pH y conteo de microorganismos se realizaron en el Laboratorio de Sanidad Agropecuaria de la Facultad de Ciencias Agronómicas, Campus V de la Universidad Autónoma de Chiapas, Villaflores, Chiapas, México. Los análisis de proteína cruda y proteína verdadera fueron realizados en el Laboratorio de Bromatología en la Facultad de Ciencias Químicas, Campus IV de la Universidad Autónoma de Chiapas, Tapachula, México.
Material Vegetal y Tratamientos
La caña de azúcar (planta completa) de 350 días de crecimiento fue procesada en fresco en un molino (Eléctrico ED-5) con criba de una pulgada. El material molido resultó en un tamaño de 0.5 cm de largo por 0.1 cm de ancho en un 65%, mientras que el material restante fue de mayor tamaño de partícula pero menor a 1.0 cm. El proceso de FES fue realizado en microsilos de plástico, donde se depositó el material con un espesor de 25 cm (sin compactación) que permitió el ingreso de oxígeno al interior. Por triplicado se prepararon los siguientes tratamientos: T1: 5.0 kg de caña integral molida predeshidratada durante 12 horas (CIM), T2: 5 kg de CIM más 2.0% de urea, T3: 5 kg de CIM más 5.0 ml de una solución que contenía 1.0 x 108 UFC de P. acidilactici.
Conteo de Microorganismos
Las concentraciones de bacterias ácido-lácticas (BAL) y bacterias celulolíticas (BC) fueron estimadas usando la técnica del número más probable (NMP), mientras que la concentración de bacterias totales (BT) fue estimada mediante el conteo directo con una cámara Petroff-Hausser (Ley-de-Coss et al., 2018b).
Para el crecimiento y conteo de BAL fue usado el medio selectivo Streptocel (Dioxon(r)), el cual contenía (g L-1) 15.0 peptona de caseína, 5.0 peptona aislada de soya, 4 cloruro de sodio, 1.0 citrato de sodio, 0.2 L-cisteína, 0.2 sulfito de sodio, 5.0 glucosa, 0.2 ácida de sodio, y 0.0002 cristal violeta. El medio se preparó según las instrucciones de la empresa (30 g L-1 en agua destilada) y el pH fue ajustado a 6.4±0.04 usando HCl 0.1 N (Potenciómetro OrionA250, Orion Research).
Para el conteo de las BC se preparó el medio de cultivo anaerobio (MCA) que contenía: 87.8 ml de agua destilada; 5.0 ml de solución mineral I (6 g K2HPO4 en 1000 ml de agua destilada); 5.0 ml de solución mineral II (SMII) [6 g KH2PO4 + 6 g (NH4)2SO4 + 12 g NaCl + 2.45 g MgSO4 + 1.6 g CaCl2 ·H2O en 1000 ml de agua destilada]; 2.0 ml de solución al 8% de Na2CO3; 0.2 g de tripticasa y 0.2 g de celulosa cristalina (como única fuente de energía) (Ley-de-Coss et al., 2018b). Los medios de cultivo fueron esterilizados en matraz Enlermeyer de 500 ml durante 15 min a 121°C, y se depositó 4.5 ml de medio de cultivo en tubos de cultivo (13 x 100 mm) usando pipetas de 10 ml y en condiciones de esterilidad, sin flujo de CO2. Los medios fueron incubados a 38±0.5°C durante 72 h para evaluar esterilidad.
Los MCA fueron inoculados usando una micropipeta Eppendorf (1000 ìl) con 0.5 ml del extracto acuoso resultado de la mezcla de 5.0 g del producto final de la FES de cada tratamiento en cada repetición y tiempos de incubación de 24, 48 y 72 h. A estos se les adiciono 5 ml de una solución estéril compuesta de 90% de agua destilada, 5% de solución mineral I y 5% de solución mineral II. Después de agregar el inóculo, los tubos de cultivo con medios para BAL y BC (MCA) se mantuvieron a 38 ± 0.5 ºC en una incubadora (Felisa FE-373) durante 48 h para BAL y 10 días para BC. Los medios positivos fueron aquellos que presentaron turbidez.
Proteína Cruda y Proteína Verdadera
Veinte gramos de cada tratamiento fue deshidratado a 60 °C en una estufa de aire forzado (Felisa FE-133A, Feligneo). Para determinar el contenido de nitrógeno no proteico (NNP), PC y PV, las muestras fueron procesadas por digestión según el método micro-Kjeldahl. Para determinar la PC se multiplicó el contenido de nitrógeno total por el factor 6.25, para determinar la cantidad de NNP se utilizó la técnica descrita por McCullough (1967) y la PV se calculó por diferencia (NT-NNP) x 6.25 según el protocolo de AOAC (2012).
Análisis Estadístico
Se utilizó un diseño completamente al azar con tres tratamientos y tres repeticiones por cada tratamiento. Las concentraciones de BT, BAL y BC fueron analizadas mediante el modelo lineal generalizado (GLM), usando transformación a logaritmo natural (LN10) de cada valor de concentración bacteriana por tratamiento y tiempo de incubación. De igual manera, los valores de pH, PC y PV fueron analizados mediante el proceso GLM del paquete estadístico SAS (2013). Las medias fueron comparadas mediante el análisis múltiple de Tukey (p<0.05).
RESULTADOS
El pH del medio fue menor (p<0.05) a las 48 y 72 h en el tratamiento CIMu (Cuadro 1), mientras que en CIM y CIMbal no hubo diferencias (p>0.05) durante todo el periodo experimental. Por tanto, el efecto fue independiente de la inoculación de P. acidilactici, que se esperaba redujera el pH en el tratamiento. El tratamiento CIMbal tuvo la mayor (p<0.05) concentración de BAL en comparación con CIMu que tuvo la mayor acidez (pH 5.6 a las 72 h).
Cuadro 1 pH del producto en la fermentación sólida de la caña de azúcar
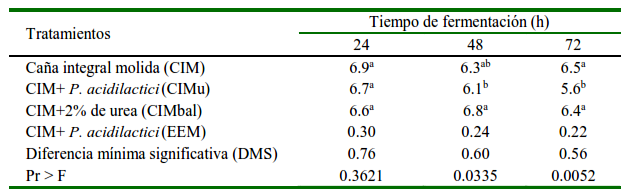
a b Medias con diferentes superíndices difieren (p<0.05)
Las cantidades de PC y PV fueron similares (p>0.05) en los tratamientos, principalmente a las 48 y 72 h de fermentación, con excepción de una menor (p<0.05) cantidad de estos nutrientes a las 24 h en el tratamiento CIM (Cuadro 2). Este resultado refleja la baja efectividad de la urea para la síntesis novo de compuestos nitrogenados; principalmente proteína microbiana. Después de 24 h no hubo incremento (p>0.05) en la cantidad de PC y PV que superara al testigo (CIM). Asimismo, la adición de P. acidilactici no incrementó (p>0.05) el contenido de PV con respecto a los otros tratamientos ni redujo el pH del producto fermentado.
Cuadro 2 Porcentaje de proteína cruda y proteína verdadera en la fermentación en estado sólido de la caña de azúcar
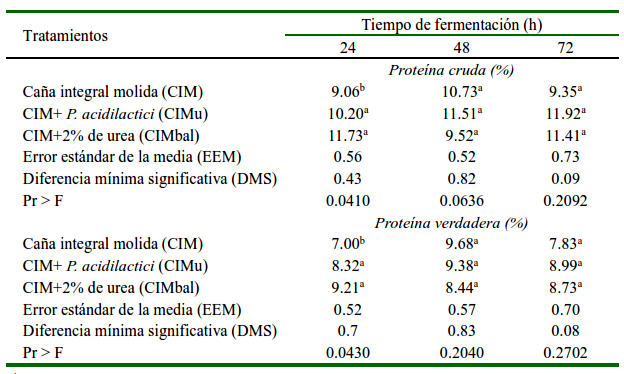
a,b Medias con diferentes superíndices difieren (p<0.05)
Al inicio hubo diferencia (p<0.05) en la concentración de BAL. Esto es, la inoculación de BAL al tratamiento CIMbal explica la mayor cantidad de bacterias, pues las concentraciones en CIM y CIMu indican el crecimiento de bacterias nativas de tipo lácticas (Cuadro 3). Las BAL crecieron en todos los tratamientos a las 48 h y al finalizar la fermentación (72 h), en tanto que en CIMu hubo reducción en la concentración bacteriana (p<0.05) con respecto a los otros tratamientos.
Cuadro 3 Concentración de bacterias ácido-lácticas, celulolíticas y totales en el producto final de la fermentación en estado sólido de caña de azúcar
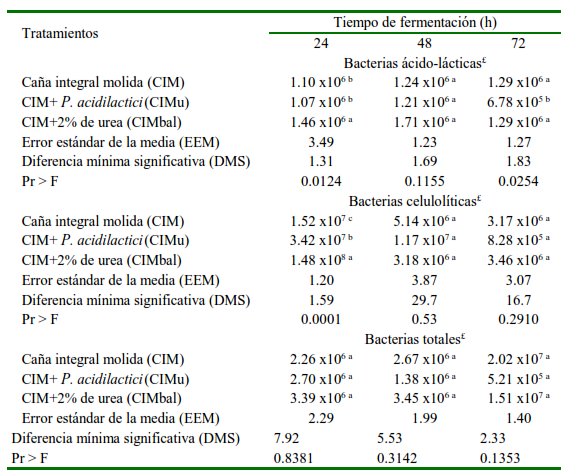
a,b Medias con diferentes superíndices difieren (p<0.05)
Con relación a la concentración de BC, solo hubo diferencia (p<0.05) a las 24 h, pues-las concentraciones de BC fueron similares a partir de las 48 h (p>0.05) en todos los tratamientos. Así, la cantidad de BC encontrada en los tres tratamientos indicó estabilidad en las concentraciones de BC, independientes del pH y de las concentraciones de BAL. Las concentraciones de BT en todos los tratamientos fueron similares (p>0.05), lo cual indica el crecimiento en la FES de microorganismos nativos presentes en el cultivo de caña.
DISCUSIÓN
Se han reportado valores de pH de 4.41 a 4.81 en los tratamientos inoculados con Lactobacillus spp y de 3.62 para el testigo que indican que el uso de BAL mejora la producción de ácidos orgánicos, reduce el pH e inhiben el crecimiento de Clostridium spp (Custodio et al., 2016). Existe la hipótesis que hay mayor acidez en la fermentación de la caña inoculada con bacterias lácticas; sin embargo, este efecto no ocurrió en esta investigación al adicionar la BAL (P. acidilactici), en comparación con el tratamiento CIMu que tuvo la mayor acidez (pH 5.6) en el medio al final del periodo de incubación. Este efecto puede ser atribuido a una rápida fermentación de los azúcares por bacterias nativas con la posible acumulación de ácido láctico (variable no medida) y la pérdida de nitrógeno amoniacal durante la fermentación (dos Santos et al., 2015). La reducción de NNP no afectó la síntesis de PC y PV en CIMu en comparación con el resto de los tratamientos evaluados.
El análisis bromatológico de diversos ensilados aerobios de caña de azúcar, adicionado con urea, sulfato de amonio, aditivos microbianos a base de levaduras y lactobacilos, y zeolita reportaron mejoras en la cantidad de proteína desde las 24 h, en comparación con los tratamientos testigos (Aranda et al., 2012; Reyes-Gutiérrez et al., 2015; Ley-de-Coss et al., 2018a). En cambio, en esta investigación, los tratamientos que recibieron aditivos microbianos o la fuente de NNP no mostraron un aumento significativo en las cantidades de PC y PV en comparación con el testigo (CIM). Estos resultados contradicen los valores obtenidos, principalmente para PC y PV de otros estudios con valores también superiores (37.1, 39.4, 52.5% e incluso superiores a 60%) de PC con otras variedades de caña (dos Santos et al., 2015), e incluso indican que la adición de cepas de BAL mejoró la estabilidad aeróbica del ensilado, pero con bajas en la MS final en los tratamientos.
Las cantidades de PC y PV fueron similares (p>0.05) en los tratamientos, principalmente a las 48 y 72 h de FES. Únicamente hubo menor (p<0.05) cantidad de estos nutrientes a las 24 en el tratamiento CIM (Cuadro 2), resultado que refleja la ausencia de los aditivos que aportan nitrógeno para la síntesis de compuestos nitrogenados. No obstante, las cantidades de PC fueron superiores a las reportadas en el cultivo de caña de azúcar, lo que indica la posible síntesis de compuestos nitrogenados por microorganismos nativos que están presentes en este cultivo (Ávila et al., 2014; dos Santos et al., 2015; Ley de Coss et al., 2018a). Después de 24 h no hubo incremento (p>0.05) de nutrientes nitrogenados en todos los tratamientos, lo que indica, bajo las condiciones de esta investigación, que con la caña de azúcar en la FES no es necesario adicionar fuentes de NNP, debido a su posible pérdida por oxidación del nitrógeno, generando gases de efecto invernadero como óxido nitroso y metano en cantidades de 34.7 hasta 53.7 g kg-1 de materia orgánica (dos Santos et al., 2012; Archimède et al., 2014). Por otro lado, el producto final de la FES de la caña de azúcar podría cubrir los requerimientos de proteína cruda requerida para bovinos de carne y leche de baja producción en regiones tropicales.
La presencia de microorganismos nativos como BT, BAL, BC, bacterias amilolíticas (BAM) y levaduras han sido reportados en la caña de azúcar. Estos organismos sintetizan proteína microbiana a partir del nitrógeno presente y adicionado en forma de urea en el proceso de fermentación de la caña, aumentando la cantidad de PV en el producto final fermentado (Galindo et al., 2006; Rangel et al., 2015; Ley de Coss et al., 2018a). En esta investigación, la adición de P. acidilactici no incrementó (p>0.05) el contenido de PV ni redujo el pH del medio en comparación con los otros tratamientos.
A diferencia de los resultados de esta investigación, Monroy et al. (2006) reportaron una mejora en los niveles de PC en el ensilado de caña de azúcar adicionado con melaza y pulido de arroz (14.6% de PC y 9.6% de PV después de 70 días de conservación), mientras que la adición de 1.5 g de nitrato de sodio por kilogramo de alimento mejoró la calidad del ensilado, aunque la mayor cantidad de PC fue en el testigo (Custodio et al., 2016).
Se ha documentado consorcios bacterianos con fuerte actividad proteolítica y síntesis de compuestos nitrogenados, principalmente proteína microbiana, a partir de urea y otros compuestos nitrogenados presentes en la fermentación de la caña. Los valores reportados son claramente superiores a los encontrados en el presente estudio donde el tiempo de fermentación fue 72 h como máximo en comparación con los 167 días en el estudio de Jacovaci et al. (2017), que permite mayor síntesis de proteína microbiana.
La adición de BAL al tratamiento CIMbal provocó la mayor concentración al inicio de la prueba; sin embargo, las concentraciones de BAL en CIM y CIMu indican el desarrollo de bacterias nativas de tipo lácticas (Ávila et al., 2014; dos Santos et al., 2015). También se ha reportado el crecimiento de levaduras en medios sin aditivos microbianos y la producción de etanol. La presencia de oxígeno en la FES permite el desarrollo de microorganismos aerobios promoviendo la estabilidad aerobia en el medio, controlando el crecimiento de levaduras, producción de ácidos grasos volátiles, así como mantener las características nutritivas del producto (Monroy et al., 2006; Daniel et al., 2015; dos Santos et al., 2015), y finalmente una mayor producción de nutrientes para el animal (Custodio et al., 2016). También la baja humedad permite el manejo del producto final y, menor gasto energético, lo que hace eficiente la producción de alimentos conservados para los rumiantes (Daniel et al., 2015).
Con base en la cantidad de BC encontradas en los tres tratamientos hubo estabilidad en las concentraciones de BC, independientes del pH y de las concentraciones de BAL. Estos resultados no fueron similares a otros trabajos de investigación (Galindo et al., 2006; Monroy et al., 2006). Esto propone que los microorganismos nativos presentes en la caña de azúcar tienen adaptabilidad y crecimiento en la FES (Ley-de-Coss et al., 2018a). Por otro lado, se ha reportado menor cantidad de BC y BT al final del periodo de incubación en aquellos medios donde se inoculó una cepa de BAL. Diversos trabajos de investigación indican que ningún aditivo químico o bacteriano, con relación a los grupos testigo, aumento la cantidad de ácido láctico, redujo el pH, e causó inhibición de Clostridium o levaduras (dos Santos et al., 2015; Brea-Maure et al., 2015; Ley-de-Coss et al., 2018a), pero sí causaron reducciones de etanol, pH y menores pérdidas de MS y nutrientes con la adición de aditivos microbiano (Daniel et al., 2013, 2015).
CONCLUSIONES
La fermentación en estado sólido (FES) de la caña de azúcar permite conservar forraje y mejora limitadamente (72 h) la calidad nutritiva con base al contenido de proteína cruda (PC) y proteína verdadera (PV).
La adición de cepas ácido-lácticas o una fuente de nitrógeno no proteico (NNP) a la FES no mejoró la calidad de los compuestos nitrogenados a 72 h de fermentación, por lo que este periodo debe ser ampliado.
La concentración de microorganismos nativos o adicionados presentes en la caña de azúcar permite la síntesis de proteína microbiana de mejor valor biológico para rumiantes.












 uBio
uBio 


