INTRODUCCIÓN
Cerca del 60% de las enfermedades que afectan a los humanos son consideradas de carácter zoonótico (Castrillón et al., 2019), siendo muchas especies silvestres los reservorios de patógenos que ponen en riesgo la salud animal y humana, así como la conservación de la biodiversidad (Romero et al., 2012). La población felina de vida libre es considerada una fuente de enfermedades zoonóticas como la toxoplasmosis, rabia, y peste negra, entre otras, constituyendo una posible amenaza para la salud pública (Gerhold y Jessup, 2013).
La toxoplasmosis es una enfermedad zoonótica de distribución mundial causada por Toxoplasma gondii, parásito intracelular obligado con capacidad de infectar animales de sangre caliente, siendo los félidos los únicos huéspedes definitivos (Wyrosdick y Schaefer 2015). Por otro lado, las aves, mamíferos y humanos pueden actuar como huéspedes intermediarios (Ding et al., 2017; Bawm et al., 2020; Wana et al., 2020. Los felinos excretan ooquistes resistentes al medio ambiente (Cardia et al., 2013; Yekkour et al., 2017), pero usualmente son asintomáticos, mientras que en otros mamíferos pueden ocurrir infecciones severas e incluso la muerte (Cong et al., 2016). La transmisión a humanos y animales ocurre por la ingesta accidental de ooquistes presentes en aguas o alimentos contaminados, en tanto que la infección congénita puede provocar abortos, muertes neonatales y anormalidades fetales (Abdelbaset et al., 2017). Se estima que la toxoplasmosis afecta cerca de mil millones de individuos, teniendo impacto no solo en la producción animal sino en la salud pública mundial (Sudan et al., 2013).
La leptospirosis es considerada otra enfermedad de carácter zoonótico, causada por un grupo de bacterias del género Leptospira, que comprende alrededor de 64 especies (Quintero et al., 2021). Las espiroquetas de este género comprenden varios serovares liberados por animales domésticos y silvestres, principalmente los roedores (Molina et al., 2020). La infección ocurre mediante la ingesta de agua, tierra y alimentos contaminados con orina, sangre o tejidos infectados, aunque la espiroqueta puede ingresar, además, por vía oral, nasal, conjuntival, genital o por lesiones cutáneas (López et al., 2020). Esta enfermedad es endémica en gran parte del mundo, especialmente en regiones de climas tropicales o posterior a periodos de lluvia (Murillo et al., 2020a). La frecuencia de Leptospira en félidos es baja; sin embargo, son considerados huéspedes accidentales de algunos serovares de Leptospira spp que prevalecen en animales silvestres y domésticos (Azócar et al., 2014; Talebkhan et al., 2015; Lehtla et al., 2020).
Una de las enfermedades zoonóticas con mayor impacto en la salud pública es la brucelosis. Especies de Brucella pueden transmitirse entre animales infectados, siendo la gran mayoría patógenas para el humano. Esta enfermedad es considerada una de las causas más importantes de trastornos reproductivos en animales domésticos de origen infeccioso (Megid et al., 2010). Los gatos son considerados normalmente resistentes a Brucella sp y no presentan enfermedad clínica (Furtado et al., 2015), aunque se ha reportado como causante de enfermedad leve en gatos callejeros (Garoussi et al., 2018).
El presente estudio buscó determinar la presencia de los agentes infecciosos causantes de la toxoplasmosis, brucelosis y leptospirosis empleando la técnica molecular PCR convencional en felinos domésticos y silvestres, así como en el personal relacionado con el cuidado y manejo de estos animales en la ciudad de Pereira-Risaralda (Colombia).
MATERIALES Y MÉTODOS
Consideraciones Bioéticas
El estudio fue aprobado por el Comité de Bioética Animal (Comité Institucional para el Cuidado y Uso de Animales-CICUAUAM) y humano (Comité de Bioética CBEUTP). Los procedimientos fueron realizados en las instalaciones del Laboratorio Multifuncional del Programa de Medicina Veterinaria y Zootecnia y en el Laboratorio de Biología Molecular de la Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira UTP), Colombia.
Tipo de Estudio y Población
Se realizó un estudio descriptivo de tipo corte transversal con la población felina atendida por la Unidad Móvil de Bienestar Animal del Bioparque Ukumarí a través de la campaña de esterilización realizada en la ciudad de Pereira, Risaralda (Colombia) en 20202021. Asimismo, se tomaron muestras de felinos silvestres que se encontraban en cautiverio en el Bioparque Ukumarí o del hogar de paso de fauna silvestre de APAPCARDER. Se consideró una población mínima de 99 felinos domésticos con un nivel de significancia del 95%. La población humana muestreada abarcó a todas las personas involucradas en la manipulación de los animales muestreados.
Se consideraron las variables edad, sexo, estado de vacunación (si el felino estaba vacunado frente a algún agente infeccioso) y zona geográfica de procedencia. Como criterios de inclusión se tuvieron en cuenta felinos no castrados entre 1 y 10 años pertenecientes a familias de estratos socio-económicos uno (bajo-bajo), dos (bajo) y tres (me-dio-bajo) de la ciudad de Pereira, que corresponden a zonas con recursos económicos limitados y, por tanto, de escaso acceso a servicios veterinarios. Se excluyeron animales con enfermedades coronarias y neurológicas de base o en edades extremas (menores de 1 año y mayores de 10 años).
Toma de Muestras Sanguíneas
Las muestras de sangre de los felinos fueron tomadas de las venas cefálicas o yugular externa, posterior al procedimiento quirúrgico aprovechando que el paciente aún se encontraba bajo anestesia para facilitar su manejo. La toma de muestras a las 65 personas se hizo a través de punción periférica (vena basílica o cefálica). La sangre fue colectada en tubos de BD Vacutainer tapa lila que contenían EDTA (ácido etilendiaminotetraacético) como anticoagulante. Las muestras fueron transportadas en neveras portátiles (4-8 °C) hasta el Laboratorio de Biología Molecular adscrito a la Facultad de Ciencias de la Salud, UTP.
Extracción de ADN
La extracción de ADN de las muestras de sangre se hizo empleando el kit QIAamp DNA Blood Mini kit (Qiagen) siguiendo las instrucciones del fabricante. Se verificó la cantidad y calidad del ADN extraído empleando el equipo Multiskan Go (Thermo Scientific) a un rango de absorbancia de 260/280. Se realizó la estandarización de la PCR para cada uno de los agentes estudiados.
Los controles positivos fueron aislados comerciales obtenidos de laboratorios de referencia Laboratorio LMV SAS (Laboratorio Médico Veterinario, Bogotá, Cundinamarca, Colombia), Laboratorio CIDAR (Centro Integral de Diagnóstico Agropecuario de Risaralda, Pereira, Risaralda, Colombia) y Laboratorio Biología Molecular y Biotecnología -UTP (Pereira, Risaralda, Colombia), mediante la amplificación de un fragmento de ADN específico para la región del gen lipL32 lipoproteína de membrana fragmento 422 pb correspondiente a Leptospira sp, fragmento de ADN específico para la región del gen B1 fragmento 469 pb correspondiente a Toxoplasma gondii, y mediante la amplificación de un fragmento de ADN específico de la región del gen BCSP31 fragmento 223 pb correspondiente a Brucella sp empleando la técnica PCR convencional. Los cebadores empleados fueron comparados con las secuencias reportadas en el sitio web GenBank NCBI (National Center for Biotechnology Information) (Cuadro 1).
Como controles positivos se emplearon serovares de Leptospira pomona, serovar de Leptospira copenhageni cepa M20, ADN de taquizoitos de Toxoplasma gondii y ADN de Brucella abortus cepa S99 fragmento 223 pb. La PCR se realizó en el equipo Termociclador Biorad por separado con el fin de identificar cada uno de los microorganismos siguiendo el protocolo estandarizado por el grupo de investigación y adaptado de acuerdo con la revisión de la literatura para cada uno de los agentes estudiados. El protocolo empleado fue un volumen total de 50 µl de reacción que consiste en 2.5 µl de buffer 1x, 0.5 µl dNTPs 0.2 mM, 0.25 µl Taq polimerasa 1.25 UI, 1 µl MgCl2 2.0 mM, 5 µlADN, 13.25 µl agua milliQ estéril. Las condiciones para la PCR se presentan en el Cuadro 2.
Cuadro 2 Condiciones para la PCR
| Condición | Leptospira spp | Brucella sp | Toxoplasma gondii |
|---|---|---|---|
| Desnaturalización inicial | 95 °C, 5 min | 93 °C, 5 min | 95 °C, 10 min |
| Desnaturalización | 93 °C, 1 min | 94 °C, 1 min | 94 °C, 1 min |
| Hibridación | 54 °C, 1 min | 53.9 °C, 1 min | 54 °C, 50 s |
| Extensión | 72 °C, 2 min | 72 °C, 50 s | 72 °C, 1 min |
| Extensión final | 72 °C, 5 min | 72 °C, 5 min | 72 °C, 7 min |
Los amplificados obtenidos fueron corridos en geles de agarosa al 2%, las bandas fueron observadas en un transiluminador de luz UV y documentadas utilizando una cámara fotográfica digital. La presencia de amplificados de acuerdo con el tamaño del amplicón fue indicativo de la presencia del microorganismo.
Análisis de Datos
Se determinó la frecuencia de animales infectados y se realizó una descripción estadística de los datos según procedencia, grupo etario y sexo. Todos los datos fueron sometidos a pruebas de normalidad y homocedasticidad, y una vez cumplidas las premisas se procedió con los análisis de correlación utilizando las pruebas Chi cuadrado y t test (p<0.05).
RESULTADOS
Se muestrearon 168 individuos: 99 felinos domésticos, 4 felinos silvestres (puma: Puma concolor, tigrillo: Leopardus wiedii, yaguarundí: Puma yagouaroundi, Ocelote: leopardus pardalis) y 65 humanos entre los que se incluyeron médicos veterinarios, zootecnistas y técnicos especialistas en cuidado animal de las instituciones hogar de paso CARDER-APAP y del Bioparque Ukumari. Se observó que, de los 99 felinos domésticos, 37% fue positivo para Toxoplasma gondii y 1% positivo para Leptospira spp. De los felinos silvestres, 50% fue positivo para Toxoplasma gondii. No se encontró Brucella sp en los individuos muestreados. En la Figura 1 se observa el producto de PCR que muestra un tamaño de banda esperada de 469 pb para Toxoplasma gondii.
MPM: Marcador de peso molecular 100 pb, 1, 2, 3: muestras de felinos domésticos, CP: control positivo, CN: control negativo
Figura 1 Electroforesis en geles de agarosa 2% para Toxoplasma gondii.
Siendo Toxoplasma gondii el agente infeccioso más frecuente en felinos domésticos, se analizó la relación entre la presencia del agente y algunas variables. Con base en el análisis de correlación de Pearson no se encontró correlación significativa (p>0.05) entre la variable Toxoplasma en la población con las variables vacuna, sexo, edad y zona, siendo los coeficientes de correlación de Pearson cercanos a cero. No obstante la ausencia de correlación entre las variables se puede observar un aparente mayor número de casos positivos en hembras que en machos, así como una mayor cantidad de casos positivos en los individuos más jóvenes (Figura 2).
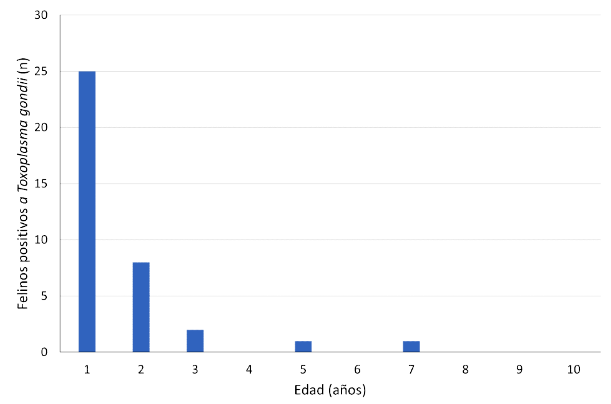
Figura 2 Relación de individuos positivos para Toxoplasma gondii y la edad, en felinos domésticos en el municipio de Pereira.
Los sectores con mayor número de casos positivos a Toxoplasma gondii fueron Cuba (zona 2) y Morelia (zona 4), seguidos de los sectores de Mundo Nuevo (zona 5), Arabia (zona 9), Cerritos (zona 8), que corresponden a estratos socioeconómicos bajos. Con respecto al estado de vacunación, 56.8% de los felinos domésticos positivos a Toxoplasma gondii no estaban vacunados.
DISCUSIÓN
Toxoplasma gondii es considerado uno de los parásitos más estrechamente relacionados con enfermedades de carácter zoonótico, aunque la toxoplasmosis clínica en felinos es muy rara; sin embargo, las infecciones congénitas pueden llegar a ser fatales (Attipa et al., 2021). El 37% de los gatos domésticos muestreados en la ciudad de Pereira fue positivo a Toxoplasma gondii, prevalencia cercana al 32.3 y 41.3% reportada por Attipa et al. (2021) y Bawm et al. (2020) en otros países; sin embargo, difieren del 56.2 y 17.85% de prevalencia encontrados en Colombia por Castrillón et al. (2019) y Zamora et al. (2020).
Los felinos domésticos pueden desarrollar toxoplasmosis con cuadros clínicos de disnea, polipnea, ictericia, así como uveítis y retinocoroiditis (Lindsay, 2020). El presente estudio determinó una prevalencia de 50% (2/4) de infección en felinos silvestres, aunque el tamaño muestral fue muy bajo, requiriendo de mayores estudios en poblaciones felinas silvestres para tener una mejor estimación de la frecuencia de esta enfermedad. La presencia de este parásito en animales silvestres infectados mantenidos en cautiverio representa un riesgo para los trabajadores (Valenzuela et al., 2020).
La mayoría de los casos por Toxoplasma gondii en felinos son subclínicas o crónicas y pueden diagnosticarse indirectamente mediante pruebas serológicas como la detección de anticuerpos anti-Toxoplasma (Must et al. 2017); sin embargo, la técnica de PCR presenta una mayor sensibilidad para diagnosticar toxoplasmosis activa en muestras biológicas en comparación con las pruebas serológicas (Gashout et al., 2016).
Diversos estudios han reportado una mayor excreción de ooquistes en felinos jóvenes en comparación con los felinos mayores (Habibun, 2018). Aunque la infección aguda en gatos jóvenes puede ser fatal, la gran mayoría suele ser asintomático, lo que conlleva a incrementar la probabilidad de infección accidental (Lilly y Wortham, 2013). Por otro lado, la aparente mayor prevalencia de Toxoplasma gondii en felinos menores de un año puede justificarse por la menor competencia de su sistema inmune (Symeonidou et al., 2018). En el presente estudio no se observaron diferencias por sexo, pero Jung et al. (2015) reportaron más casos positivos en felinos hembras que en machos. Con relación a las zonas de procedencia, el mayor número de casos positivos correspondió a estratos socioeconómicos bajos, pudiendo justificarse por las limitadas condiciones económicas, sistemas deficientes de saneamiento, bajo nivel de educación y limitado acceso a los servicios de salud por parte de los propietarios en comparación con estratos socioeconómicos más altos (Majid et al., 2016; Caballero et al., 2022).
La presencia de Leptospira spp en la población felina doméstica fue muy baja comparada con otros estudios realizados en el país (Espinosa et al., 2015) y nula en la población felina silvestre y humana. Estos resultados podrían deberse a los planes de control sanitario llevados a cabo por las autoridades sanitarias del departamento de Risaralda o por la dificultad de detectar el agente en etapas tempranas de la enfermedad mediante la técnica PCR, toda vez que la prueba de microaglutinación (MAT) para la identificación de las serovariedades de Leptospira spp es considerada la prueba oro a nivel mundial (Schlichting et al., 2015); sin embargo, es una técnica con limitaciones para su ejecución e interpretación (Molina et al., 2020). No obstante, se podría emplear muestras de orina para el uso de la PCR (Murillo et al., 2020b) o variaciones de la técnica de PCR que mejoren su sensibilidad (Tubalinal et al., 2018).
CONCLUSIONES
Toxoplasma gondii es el agente infeccioso más frecuente hallado en la población felina doméstica y silvestre.
Leptospira spp no fue un agente infeccioso frecuente en la población felina doméstica y silvestre muestreada.
No se encontró la presencia de Toxoplasma gondii, Leptospira spp o Brucella sp en el personal encargado de la salud y el cuidado de los animales muestreados.












 uBio
uBio 



