INTRODUCCIÓN
La producción porcina en el Perú presenta un gran desarrollo habiéndose incrementado el consumo per cápita de carne porcina en los últimos 20 años, alcanzando los 5.5 kg/hab/año en 2019 (MINAGRI, 2020). Por otra parte, el último censo agropecuario indicó una población de 6376 cabezas de porcino (2603 de línea mejorada) en la provincia de Coronel Portillo, Ucayali (INEI, 2012). Cabe señalar que, como resultado de las inspecciones sanitarias realizadas por el Servicio Nacional de Sanidad Agraria (SENASA) a las granjas porcinas de la provincia, entre los años 2017 y 2018, se han encontrado 30 establecimientos con un mínimo de 25 animales en cría.
En la producción porcina, el alimento demanda cerca del 60% del costo productivo total (Núñez, 2017), siendo ese uno de los aspectos con mayores problemas en la producción, sobre todo en climas tropicales, donde las condiciones climáticas desfavorecen la estabilidad de los insumos (Guerre, 2016). Consecuentemente, varios microorganismos contaminantes pueden afectar su calidad (Garcinuño, 2013), generando alteraciones en los nutrientes, así como el desarrollo hongos y presencia de micotoxinas (Sala et al., 2008; Gimeno y Martins, 2011; Li et al., 2022), interfiriendo con el crecimiento y supervivencia de los animales (Yang et al., 2020). Además, la contaminación por micotoxinas en los piensos representa un peligro para la salud humana debido a la posible transmisión a la carne y la leche (Rosa et al., 2009).
La exposición a las micotoxinas puede causar inmunotoxicidad, disminuyendo los parámetros productivos y reproductivos (Zhang et al., 2018; Changwon et al., 2020). La susceptibilidad de los animales varía con la edad, especie y la toxina involucrada (Pier et al., 1980; Castañeda et al., 2012); siendo el porcino una de las especies más susceptibles, especialmente en los animales en crecimiento y las hembras reproductoras (Diekman y Green, 1992; Zhang et al., 2018; Popescu et al., 2022).
El diagnóstico por micotoxicosis en animales es complejo; no obstante, los cuadros agudos pueden confirmarse mediante lesiones histopatológicas en los tejidos diana, en conjunto con el análisis del alimento para la confirmación de la micotoxina (Gimeno y Martins, 2011). Los cuadros crónicos son más difíciles de diagnosticar, debido a la confusión en el daño de las micotoxinas en dosis bajas o moderadas con infecciones bacterianas o virales secundarias, por deficiencias del sistema inmune o carencias nutricionales (Reddy et al., 2018).
El análisis del alimento mediante el recuento bacteriano y micótico, así como la identificación de agentes patógenos (Da Silva et al., 2013) y micotoxinas (Guerre, 2016) es una práctica altamente recomendada. Las micotoxinas en granos, tejidos y fluidos animales pueden detectarse usando pruebas cromatográficas y de ELISA (Zheng et al., 2006) o a través de técnicas más sencillas basadas en principios inmuno analíticos altamente sensibles (Sashidar, 1993; Zheng et al., 2006). Por este motivo, el propósito de la investigación fue determinar la cantidad de hongos y micotoxinas en insumos y alimento balanceado destinado a la crianza porcina en la provincia de Coronel Portillo, Perú, para conocer el grado de contaminación y su aceptabilidad.
MATERIALES Y MÉTODOS
Lugar y Tiempo del Estudio
La investigación se desarrolló en la provincia de Coronel Portillo, región Ucayali, ubicado en la zona centro oriental del Perú, con un clima tropical húmedo, temperatura promedio de 30 ± 4 °C, humedad de 85 ± 5% y una precipitación de 2344 msnm anual (SENHAMI, 2017). Se trabajó con muestras de insumos y alimento balanceado de 20 granjas porcinas en actividad (aproximadamente 70% del total en la provincia) con al menos 25 animales en cría. Los establecimientos estuvieron localizados en los distritos de Callería, Campo Verde, Yarinacocha y Nueva Requena.
Las muestras fueron procesadas en el Centro de Investigación IVITA, sede Pucallpa, de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Pucallpa, entre noviembre de 2018 y febrero de 2019.
Recolección de Muestras
De las 20 granjas porcinas seleccionadas, 10 manejaban insumos para preparar el alimento y las otras 10 adquirían el alimento elaborado de centros comerciales. Se recolectaron 15 muestras de insumos (9 de maíz, 3 de soya y 3 de polvillo de arroz) y 35 de alimento concentrado (de las etapas de inicio, crecimiento y para reproductores). Muestras de más de una etapa de crianza fueron colectadas en varias de estas granjas.
El muestreo se realizó según al procedimiento de manejo de muestras de piensos, ingredientes de piensos y piensos medicados dispuesto por el SENASA (2017). Para esto, se tomaron muestras representativas de uno o más sacos de insumo o alimento (niveles superior, medio e inferior) introduciendo una sonda de metal de forma inclinada. Se mezclaron las muestras de uno o más para conseguir una muestra global representativa de 0.5 kg.
Procesamiento de Muestras
Las muestras fueron conservadas en un lugar fresco y seco (temperatura ≤ 16 °C y humedad ≤ 14%). El recuento de hongos se hizo el mismo día de la colecta o dentro de los tres días. La extracción de cada muestra con metanol se realizó el mismo día de la colecta y se conservó entre 2 y 4 °C hasta su procesamiento con una prueba de ELISA por grupos de 13 a 15 muestras para optimizar los kits disponibles.
Se empleó el conteo en placa para mohos y levaduras en alimento para el recuento de hongos, según lo indicado por la Asociación Americana de Salud Pública (APHA) (Da Silva et al., 2013). Para la detección de micotoxinas con el análisis de ELISA directa competitiva, se usaron kits de Veratox(r) Aflatoxina (USDA-GIPSA 2012-010. AOAC-RI 050901. ISO 9001:2000), Veratox(r) Ochratoxina A (ISO 9001:2000) y Veratox(r) Zearalenona (ISO 9001:2000).
Comparación de Resultados
Los resultados de los análisis para recuento de hongos fueron comparados con los parámetros descritos por Gilbert et al. (2000), quienes clasifican la calidad de insumo o alimento de acuerdo con el número de Unidades Formadoras de Colonias por gramo de alimento (UFC/g) en satisfactorio (<104), aceptable (104 -105) e inaceptable (>105). En el caso de micotoxinas se hizo la comparación con los Límites Máximos Permisibles (LMP) recomendados por The European Commision, (2006) y descritos por Gimeno (2009) (Cuadro 1).
Cuadro 1 Cantidades máximas tolerables (µg/kg) de micotoxinas en alimento para porcinos (12% de humedad)
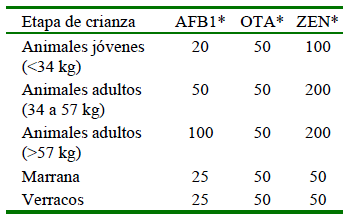
* AFB1 = aflatoxina B1; OTA = ocratoxina A; ZEN = zearalenona
Fuente: European Commission (2006); Gimeno (2009)
Análisis de Datos
Los resultados se presentan en tablas que describen frecuencias y porcentajes de la calidad de las muestras de insumo o balanceado para el recuento de hongos (satisfactoria, aceptable, inaceptable) por distritos y etapas de crianza. Los niveles de micotoxinas se describen por frecuencia y porcentajes de muestras sobre los LMP por tipo de micotoxina, etapa de crianza y distrito. Se aplicó la prueba de Chi cuadrado para determinar la asociación entre la calidad del alimento con la etapa de crianza, y entre la calidad y la procedencia (distrito), la prueba t Student para muestras relacionadas para determinar las micotoxinas con mayor frecuencia de contaminación; y la prueba de Duncan para determinar diferencia en la frecuencia de muestras con micotoxinas por tipo de alimento, y entre los promedios de micotoxinas por tipo de alimento y por distrito. En todos los casos se utilizó un nivel de significancia de 0.05.
RESULTADOS
La mitad (5/10) y la cuarta parte (5/20) de las granjas porcinas tuvieron al menos una muestra de insumo y alimento balanceado con calidad inaceptable, respectivamente. El 50% (10/20) de establecimientos tuvo al menos una muestra de alimento balanceado con micotoxinas sobre los LMP. Seis de 15 insumos y 5 de 25 alimentos balanceados fueron considerados como alimentos inaceptables para el consumo de los cerdos (Cuadro 2).
Cuadro 2 Frecuencia numérica y porcentual de la calidad de los insumos y de alimento balanceado en granjas porcinas en la provincia de Coronel Portillo, Ucayali (2018-2019)
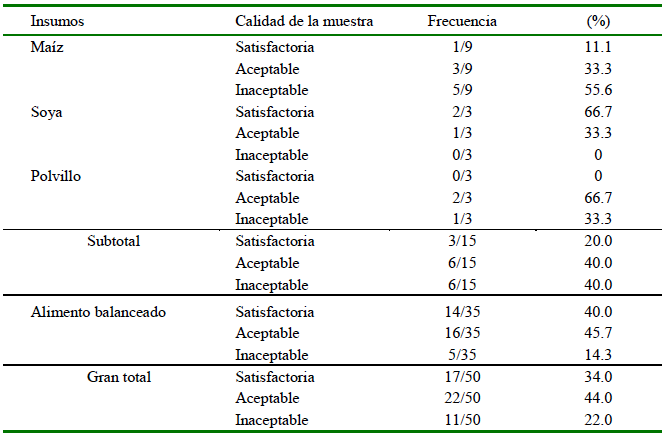
Las muestras de insumos con calidad inaceptable (6) fueron de Callería (3/6), Campo Verde (2/6) y Nueva Requena (1/6), siendo el maíz el que tuvo la mayor frecuencia de muestras con calidad inaceptable (5/9). De las 35 muestras de alimento balanceado, la etapa de inicio tuvo tres (3/12) muestras inaceptables, una en la etapa de crecimiento (1/11) y una en el balanceado de reproductores (1/12). Se encontró asociación entre la calidad y el tipo de alimento (p<0.05). Por otro lado, el porcentaje de muestras inaceptables fue menor en Campo Verde (14.8%, 4/27); sin embargo, no se encontró asociación entre la calidad y la procedencia del alimento (p<0.05).
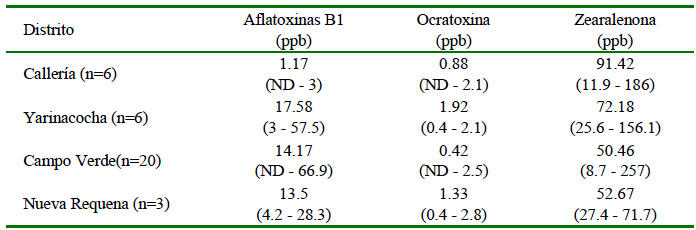
El promedio en el recuento de hongos y cantidades de micotoxinas fue más elevado en las muestras de alimento de inicio (Cuadro 3). Las micotoxinas con mayor frecuencia de contaminación y superiores a los LMP fueron zearalenona (9/35, 25.7%) y aflatoxina (6/35, 17.1%) (p<0.05). Las concentraciones promedio más altas de aflatoxina B1 estuvieron en los alimentos de inicio y las de zearalenona en la etapa de reproductores (p<0.05) (Cuadro 3). Igualmente, hubo mayor porcentaje de muestras por encima a los LMP para aflatoxinas en la etapa de inicio (5/12, 41.7%), y para zearalenona en la etapa de reproductores (7/12, 58.3%) (p<0.05). Los promedios y rangos de ocratoxinas fueron mínimos y por debajo a los LMP en todas las etapas: 0.83 ppb (ND-2.5) en inicio, 1.24 ppb (ND-6) en crecimiento y 0.41 ppb (ND-0.9) en reproductores.
Cuadro 3 Recuento de hongos (UFC/g) y concentraciones de micotoxinas (promedios y rangos, ppb) en el alimento balanceado de granjas porcinas de la provincia de Coronel Portillo, Ucayali (por etapa de crianza) (2018-2019)

ND: No detectado
El mayor número de muestras de alimento balanceado que sobrepasaron el LMP de micotoxinas se presentó en el distrito de Yarinacocha (3/6); asimismo, tuvo el promedio más alto de aflatoxinas, mientras que el promedio más alto de zearalenona fue observado en el distrito de Callería, aunque los valores máximos dentro de los rangos son variables para ambas micotoxinas (Cuadro 4). Por otro lado, los valores promedio de ocratoxinas fueron muy bajos en todos los distritos. Finalmente, no hubo diferencia significativa entre las frecuencias de muestras con micotoxinas entre los distritos (p<0.05).
DISCUSIÓN
El 25% o más de granjas porcinas que tuvieron insumos y/o alimento balanceado con recuentos inaceptables de hongos y alimento balanceado con micotoxinas sobre los LMP confirman la amplia contaminación de insumos y alimento usado en la alimentación animal (FAO, 2014), especialmente en zonas tropicales debido a la ubicuidad de los hongos (Serrano y Cardona, 2015; Guerre et al., 2016).
Si bien el porcentaje de granjas porcinas con insumos o alimento inaceptable (Cuadro 2) se encuentra debajo al reportado de Martínez et al. (2013) en Cuba, donde más del 90% de piensos para porcinos no eran aptos; sin embargo, los niveles hallados en el presente estudio podrían afectar la salud de los animales si se suministran en forma continua (Alcázar, 2015). considerando que la aflatoxicosis depende de la dosis y el tiempo, afectando principalmente a animales en crecimiento (Popescu et al., 2022). Esto es un claro indicativo de realizar mejoras en el cuidado del alimento, especialmente en la etapa de crecimiento y reproducción, para no comprometer los parámetros productivos (Gimeno y Martins, 2011; Yang et al., 2020).
No se dispone de reportes específicos de micotoxinas en balanceado para porcinos en el país; sin embargo, los resultados fueron similares al reporte de Tepox et al. (2015) en México con más del 50% de los alimentos contaminados con micotoxinas sobre los LMP, en tanto que Quero (2020) reportó que el 40% de alimentos terminados se encuentran contaminados con zearalenona. Por otra parte, Yang et al. (2020) en Taiwán reportaron 70.2 y 58% de muestras de alimento contaminado con aflatoxinas y zearalenona, respectivamente.
Investigadores como Fernández et al. (2022) reportaron asimismo la presencia de micotoxinas en alimento de porcinos, encontrando niveles no permitidos en 3 de 11 establecimientos porcinos. En forma similar, Maniglia-Merida et al. (2015) reportaron la presencia de micotoxinas en alimento, aunque los niveles de aflatoxinas y zearalenona se encontraron dentro de los límites permisibles.
Los resultados encontrados para zearalenona (Cuadros 3 y 4) son semejantes a los hallados por Flores et al. (2006), quienes reportaron que el 65% de los alimentos superaban el LMP de zearalenona; sin embargo, estos niveles pueden generar problemas reproductivos a mediano o largo plazo (Zhang et al., 2018). En este sentido, Lahjouji et al. (2020) mencionan que la exposición a zearalenona puede promover el desarrollo de patologías intestinales graves. Por otro lado, las bajas cantidades halladas de ocratoxinas en el alimento balanceado son equivalentes a lo encontrado por Castro et al. (2015).
Los resultados del presente estudio indican que si bien existe contaminación por hongos y micotoxinas en insumos y alimento para porcinos en Ucayali, la evaluación constante del estado sanitario en su manejo y conservación, así como de prácticas adecuadas de almacenamiento y conservación de insumos y balanceado por parte de los porcicultores locales podrían evitar pérdidas a mediano o largo plazo en los parámetros productivos en la producción porcina.












 uBio
uBio