INTRODUCCIÓN
La salmonelosis en cuyes es causada por el serotipo Typhimurium de la bacteria Salmonella enterica subesp enterica. Es una enfermedad con tasas de mortalidad superiores al 90% y con una morbilidad mayor al 50% (Chauca, 1997, Morales et al., 2007), pudiendo cursar sin signos clínicos aparentes, pero con efectos negativos en la absorción de alimentos y en la ganancia de peso (Bazán et al., 2019). El Perú es el principal productor y consumidor de cuyes (Cavia porcellus), de allí que el desarrollo de tecnologías que puedan incrementar la producción y disminuir las perdidas relacionadas a la infección por S. Typhimurium conllevarían a la mejora económica de los productores (Chauca, 1997; Zuñiga et al., 2001; Ortega et al., 2015; Morales, 2017). No obstante, no se dispone que una vacuna que proteja a estos animales y evite las pérdidas económicas relacionadas con la enfermedad.
Dentro de las tecnologías vacunales, las vacunas vivas atenuadas representan una buena estrategia para la prevención de la salmonelosis y otras infecciones entéricas (Tennant et al., 2015). Para uso humano existe una vacuna comercial con base a una cepa atenuada para la prevención de la fiebre tifoidea causada por S. Typhi y el cólera, causado por Vibrio cholerae (Kenner et al., 1995). En animales de producción, como aves, también se dispone de una vacuna comercial para la prevención de la infección por S. Typhimurium y S. Enteritidis, además de investigaciones de cepas vivas atenuadas para la prevención de enfermedades causadas por estas bacterias (McWhorter y Choulsakar, 2018; Kang et al., 2022).
Para generar una cepa atenuada se requiere inactivar uno o varios genes relacionados con algunas funciones de la bacteria que no comprometan la capacidad básica de supervivencia. En general, los genes de elección a atenuar son aquellos relacionados a la virulencia, a la capacidad de invasión, de supervivencia intracelular, o de la capacidad de degradar algún compuesto especifico (Lin et al., 2015). La eficiencia de estas cepas atenuadas es variable, pudiendo generar una inmunidad capaz de evitar la infección o disminuir el daño a los tejidos (Gómez, 2000).
La elaboración de vacunas que simulan una infección natural sin la gravedad que podría causar la infección por la bacteria puede contribuir enormemente a la protección de la infección (Chatfield et al., 1989; Simon et al., 2012). En el caso de la salmonelosis, se opta por la administración por vía oral de una cepa atenuada para estimular una respuesta inmune de mucosas, incrementando los niveles de IgA que inhiben la invasión de la bacteria patógena. Por ese mismo hecho, la bacteria atenuada solo persiste para ocasionar una respuesta inmune, y que es eliminada posteriormente por el animal siendo incapaz de ocasionar una infección activa (Harrison et al., 1997; Zhang et al., 1997; Heithoff et al.,1999; Curtis et al., 2009).
Contar con una vacuna capaz de poder prevenir, o disminuir el efecto patógeno o el daño a los tejidos de la infección natural puede generar ganancias económicas a los productores. Ante esto, en el presente estudio se evalúa una cepa atenuada, como posible candidato vacunal contra la salmonelosis en cuyes como posible candidato vacunal con relación a su capacidad de disminuir las lesiones o los efectos negativos en la producción de la salmonelosis en cuyes.
MATERIALES Y MÉTODOS
Lugar de Ejecución
El ensayo experimental se llevó a cabo en el bioterio del Laboratorio de Biología y Genética Molecular de la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM), Lima, Perú.
Ética y Condiciones de Crianza
Todos los procedimientos experimentales con animales fueron aprobados por el Comité de Ética y Bienestar Animal (CEBA) de la FMV-UNMSM (CEBA 2020-6). Los cuyes fueron adquiridos de una granja en Pachacamac (Lima, Perú) y alojados en el área de crianza experimental en módulos metálicos de 1.60 m de altura, 0.75 m de ancho y 0.76 m de profundidad, alojando 5-6 animales por módulo. Las jaulas se adecuaron en un ambiente controlado de temperatura y humedad, con extracción constante del aire. Los cuyes recibieron alimentación y agua ad libitum. El alimento fue de tipo pellet balanceado, adquirido en la Planta de Alimentos Balanceados de la Universidad Agraria La Molina, Lima.
Grupos Experimentales
Se utilizaron 51 cuyes hembra de dos semanas de edad, agrupados aleatoriamente en tres grupos de 17 animales cada uno (Cuadro 1), y distribuidos uniformemente en 9 jaulas (5-6 animales por jaula). El cálculo del tamaño muestral se realizó con base a la fórmula de diferencia de dos proporciones, considerando una diferencia de mortalidad al desafío entre animales vacunados (80% de supervivencia) y no vacunados (30% de supervivencia) de 50%, un nivel de confianza de 95% y un poder de la prueba de 80%, resultando en el uso de 14 animales por grupo como mínimo.
Cuadro 1. Grupos experimentales
| Grupos | Tratamiento | Cuyes |
|---|---|---|
| 1 | Inoculado con cepa atenuada y desafiado | 17 |
| 2 | Solo desafiado | 17 |
| 3 | Sin inoculación con cepa atenuada y sin desafío (Control) | 17 |
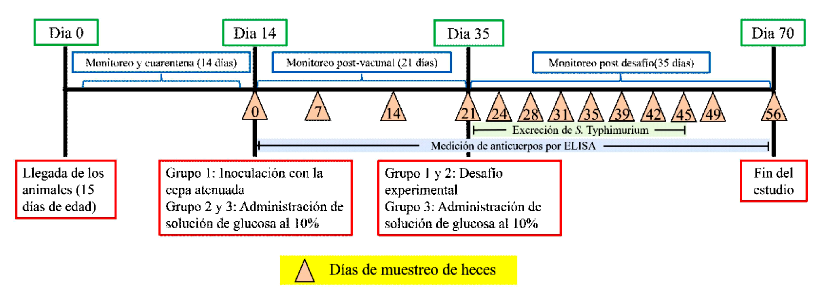
Se tuvo un periodo de adaptación y seguimiento por 14 días, donde se tomaron muestras de heces para descartar la excreción de salmonelas por los animales de experimentación. El descarte de salmonelas se realizó por técnicas microbiologías estándares, descrito más adelante.
Cepa viva atenuada de S. Typhimurium
Se utilizó una cepa viva atenuada de S. Typhimurium, el cual se mantiene conservada a -80 °C en caldo LB (Luria Bertani) con glicerol al 20%. Estudios previos determinaron la carencia de la capacidad patogénica e invasiva en ensayos piloto previos in vivo y en el estudio de Changanaquí et al. (2022). El gen atenuado en la cepa vacunal participa en la respuesta frente al estrés dentro del hospedero y en la supervivencia en macrófagos. Para la reactivación y preparación del inóculo de la cepa atenuada, se siguieron los protocolos descritos por Changanaquí et al. (2022).
Cepa virulenta de S. Typhimurium
Para el desafío experimental se utilizó una cepa de S. Typhimurium de comprobada acción virulenta según estudios previos (Mejía et al., 2019, Espinoza et al., 2023), el cuál fue aislado de un caso mortal de salmonelosis en un cuy procedente de una granja de crianza comercial en Pachacamac-Lima, en enero de 2016 y se mantiene conservado a -80 °C en glicerol al 20%. La reactivación se realizó según el procedimiento descrito por Mejía et al. (2019) y diluido finalmente en glucosa al 10% a una concentración de 109 UFC/100 µl.
Procedimiento Experimental
La inoculación de la cepa atenuada (108 UFC/cuy diluido en 100 µl de glucosa al 10%) a los cuyes del grupo 1 se realizó por vía oral, mezclado con el alimento peletizado. Los cuyes de los grupos 2 y 3 recibieron 100 µl de una solución de glucosa al 10%. La administración de los tratamientos se realizó colocando a los animales de forma individual en una jaula de metal con 5 g de alimento peletizado mezclado con el tratamiento asignado. Los animales fueron supervisados hasta que ingirieron completamente el alimento.
Se realizó el seguimiento y monitoreo pos-inoculación por 21 días para detectar posibles signos clínicos adversos inducidos por la inoculación de la cepa atenuada y que el animal desarrolle una respuesta inmune contra la cepa inoculada. Posteriormente, los animales de los grupos 1 y 2 fueron desafiados con 109 UFC/cuy de una cepa virulenta de S. Typhimurium, vía oral, diluidos en 100 µl de glucosa al 10%, administrados de la misma forma que la cepa atenuada. Posterior al desafío, los animales fueron observados durante 5 semanas (35 días) (Figura 1). Pasado este tiempo, se procedió al sacrificio y necropsia de los animales que sobrevivieron usando una combinación de ketamina y xilacina (Ket-A-Xyl®,Agrovet Market) a una dosis de 0.05-0.1 mg/animal vía IM como sedación y 2 ml de pentobarbital sódico a 6.5% (Halatal®, Montana) intracardiaco. Los animales muertos durante el periodo pos-desafío y los que se sacrificaron al finalizar el estudio fueron sometidos a necropsia y toma de muestras para histopatología y aislamiento microbiológico.
Recolección de Datos
Toma de muestras fecales
Se tomaron muestras de heces de los tres grupos durante el periodo pos-inoculacion de la cepa atenuada y pos-desafío en los días descritos en la Figura 1. Para esto, se tomaron 10 pellets frescos de heces recién excretados por jaula, haciendo un pool, para dividirlo en tres partes iguales, procesando cada parte como una muestra individual. Las heces se usaron para la cuantificación de IgA y de la excreción de S. Typhimurium.
Necropsias y toma de muestras
En los animales muertos durante el periodo de monitoreo pos-desafío y en los que fueron sacrificados al finalizar el estudio se realizó la necropsia respectiva registrando las lesionas características en órganos como intestino delgado, hígado, pulmón, nódulos linfáticos mesentéricos (NLM), vesícula biliar, además de exudado en la cavidad abdominal, presencia de heces diarreicas en la zona perianal y pelo hirsuto al momento de la necropsia. Para el análisis histopatológico se tomaron muestras de intestino delgado, hígado y pulmón, y para el aislamiento de S. Typhimurium, se analizaron los mismos órganos, además del bazo.
Registro de pesos y consumo de alimento
Se registraron los pesos individuales en la recepción (día 0), en la inoculación con la cepa atenuada (día 14), en el desafío (día 35) y al final del estudio (día 56) usando una balanza digital electrónica de 5 kg (Miray). El pesaje se realizó en las mañanas, antes de la administración del alimento diario. La ganancia diaria de peso promedio se obtuvo dividiendo el peso ganado por el animal en cada intervalo de tiempo evaluado sobre el tiempo transcurrido en ese periodo en días.
El consumo de alimento fue determinado mediante el cálculo de la diferencia de peso del alimento ofrecido al inicio del día con el alimento recogido al finalizar el día y dividido por la cantidad de animales presentes en la jaula, obteniendo un valor en gramos de consumo de alimento promedio por animal.
Medición de IgA anti-Salmonella mediante ELISA Indirecto in house
La medición de IgA se evaluó de forma semanal desde el periodo post inoculación de la cepa atenuada, en los días 0, 7, 14, 21, 28, 35, 42, 49 y 56 (Figura 1), la cual se realizó mediante una prueba de ELISA indirecto in house.
Obtención de antígeno total de S. Typhimurium
Los antígenos para el inmunoensayo fueron preparados usando el protocolo modificado de Ledesma et al. (2017) y Moreno (2018). Para ello, cepas de S. Typhimurium fueron colocadas en 50 ml de caldo Infusión Cerebro Corazón (Merck) e incubadas a 37 ºC por 24 h, para luego ser centrifugadas a 8500 g por 15 min a 4 °C. Los pellets celulares fueron lavados tres veces con buffer fosfato salino (PBS) y resuspendidos en 10 ml de PBS frío. Las células bacterianas fueron sonicadas en 7 pulsos de 10 s c/u, tomando 10 s entre pulsos, para luego centrifugarlo a 11000 g por 30 min a 4 ºC. Se recuperó el sobrenadante y se cuantificó la proteína soluble total usando un fluorómetro QubitTM (Thermo Scientific).
Preparación de las placas de ELISA
Se tapizaron placas de poliestireno de 96 pocillos de alta afinidad (Nunc Maxi-Sorp™) con 100 µl de proteína soluble total de S. Typhimurium a una concentración de 35 µg/ml e incubado a 37 °C por 1 h. Se realizaron tres lavados con 200 µl de buffer de lavado PBS-T (Tween 20 al 0.1% diluido en PBS). Se realizó el bloqueo de los pocillos colocando 200 µl de buffer de bloqueo (albumina sérica bovina al 3% diluido en PBS) e incubado a 4 ºC durante 16 h, para luego realizar tres lavados con PBS-T. Posterior al lavado y secado, se procedió a usar las placas.
Obtención de IgA a partir de heces
Para la extracción de IgA se colocó 100 mg de heces en un tubo de microcentrífuga que contenía 1 ml de PBS y 50 µl de inhibidor de proteasas (Sigma FastTM, Sigma Aldrich). Se procedió a homogenizar con la ayuda de un vortex y luego centrifugado a 10 000 g por 10 min a 4 °C. Se recuperó el sobrenadante y se almacenó a -20 °C. Estos se diluyeron a 1/200 en buffer de bloqueo para ser usado en la técnica de ELISA.
Procedimiento de ELISA
Se colocó por triplicado 100 µl por pocillo de cada muestra en una placa de ELISA. La placa con las muestras se incubó a 37º C por 1 h. Luego, se realizaron tres lavados con 200 µl/pocillo de buffer de lavado. Luego del secado de la placa, se colocaron 100 µl de un anticuerpo anti-IgA de cuy conjugado con HRP (Horseradish peroxidase) (Sheep anti-Guinea Pig IgA Secondary Antibody, HRP, Invitrogen) a dilución 1/10000 en buffer de bloqueo. Se incubó a 37 ºC por 1 h para luego realizar tres lavados más con el buffer de lavado antes de añadir 100 µl de sustrato cromógeno TMB (3,32 ,5,52 -Tetramethy-lbenzidine (TMB) SureblueTM). Por último, las muestras fueron incubadas por 15 min a temperatura ambiente y leídas en un lector de placas de ELISA (Modelo 680 - Bio-Rad) a una longitud de onda de 650 nm, para obtener los valores de absorbancia o densidad óptica (D.O.) de cada muestra.
Evaluación de la Excreción de S. Typhimurium
La excreción de S. Typhimurium fue realizado a partir de muestras de heces y analizado mediante qPCR. El análisis de la excreción se realizó en los días 21, 24, 28, 31, 35, 39, 42 y 45 pos-inoculación de la cepa atenuada (Figura 1) (0, 3, 7, 10, 14, 18, 21 y 24 días pos-desafío).
Extracción de ADN total de heces y condiciones de qPCR
Se utilizaron 100 mg de heces para la extracción de ADN total usando la prueba comercial QIAamp PowerFecal DNA Kit (Invitrogen) siguiendo las instrucciones del fabricante.
Para la amplificación de ADN de S. Typhimurium por qPCR, se usaron los cebadores ttr-4 y ttr-6 descritos por Malorny et al. (2004) en un volumen final de 20 µL conteniendo 10 µL de SYBR Green Master Mix, 0.75 µL de cada cebador y 1 µL de ADN extraído. Las condiciones de reacción consistieron en una desnaturalización inicial de 95 °C por 5 min seguidos por 40 ciclos de 95 °C por 1 min, 60°C por 1 min y 72°C por 1 min.
Realización de la curva estándar
Para la realización de la curva estándar que permita la cuantificación absoluta deADN de S. Typhimurium se utilizó una cepa de S. Typhimurium confirmada mediante PCR convencional. Se inoculó 100 µl de un cultivo fresco a un tubo conteniendo 10 ml de caldo LB, incubándose a 37 °C por 24 h. Se cuantificó el crecimiento obtenido del tubo mediante espectrofotometría (1.0 OD600 = 2.5 x 108 células). Luego se tomó 1 ml de este cultivo para extracción de ADN por medio del kit comercial GeneJET Genomic DNA Purification Kit (Invitrogen) siguiendo el protocolo recomendado por el fabricante. Se realizaron diluciones seriadas del ADN bacteriano a 10-1, 10-2, 10-3, 10-4, 10-5, 10-6, 10-7, 10-8 y 10-9 usando agua libre de nucleasas y amplificado usando el protocolo descrito anteriormente.
Evaluación Histopatológica
La evaluación histopatológica se realizó en secciones de tejido derivado de órganos de los cuyes post mortem. Muestras de hígado, pulmones e intestino delgado fueron colocadas en una solución de formaldehido al 10% y después de un tiempo de fijación de 24 h se procesaron para seccionamiento de tejido y tinción con hematoxilina-eosina. Las láminas histopatológicas fueron observadas mediante un microscopio óptico (Zeiss, USA).
Patoscores de las lesiones del intestino delgado
Los cortes histológicos de intestino delgado fueron evaluados mediante la metodología descrita por Vishwakarma et al. (2012) a través de la asignación de un patoscore, el cual se basó en la observación de lesiones patológicas microscópicas específicas: edema en la submucosa (0-3 puntos), infiltración de polimorfonucleares (0-4 puntos), pérdida de células caliciformes (0-3 puntos), y ulceración epitelial (0-3 puntos). El puntaje obtenido por cada criterio fue sumado, obteniéndose un puntaje total de 0 -13 puntos, el cual definió el grado de lesión del intestino, definiéndose como intacto (0 puntos), inflamación mínima (1-2 puntos), inflamación leve (3-4 puntos), inflamación moderada (58 puntos) o inflamación severa (9-13 puntos). Finalmente, se obtuvo un puntaje promedio por cada grupo experimental.
Análisis Estadístico
Se utilizó la prueba exacta de Fisher para determinar diferencias estadísticas entre los porcentajes de las lesiones macroscópicas y microscópicas. Las diferencias estadísticas entre los valores de patoscores, pesos de los animales y valores relativos de IgA se evaluaron mediante la prueba del análisis de varianza previa evaluación de la normalidad mediante a prueba de Shapiro Wilk. Comparaciones pos-análisis fueron realizados con la prueba de Tukey. Las diferencias se consideraron significativas a un valor de p<0.05.
RESULTADOS
Efecto protector, lesiones macroscópicas e histopatología del candidato vacunal
De los 17 cuyes por grupo, 5 individuos de los grupos 1 y 2 murieron por efecto del desafío con la cepa virulenta, no habiendo diferencia significativa entre ellos (p<0.05), en tanto que no hubo mortalidad en el grupo control (p<0.05; Cuadro 2). La mortalidad ocurrió a partir del segundo día del desafío, siendo mayor en las últimas semanas del estudio para el grupo vacunado y desafiado, aunque terminando con igual número de muertes dentro de los dos grupos (Figura 2).
Cuadro 2. Mortalidad en 17 cuyes inoculados con una cepa atenuada y desafiados con una cepa virulenta de Salmonella Typhimurium
| Grupos | Muertos | |
|---|---|---|
| 1 | Inoculado con la cepa atenuada y desafiados | 5 |
| 2 | Solo desafiados | 5 |
| 3 | Control (No inoculado con la cepa atenuada y no desafiado). |
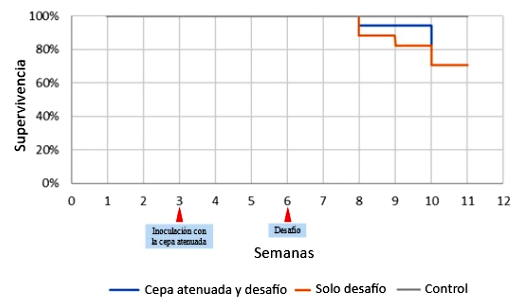
Figura 2. Curva de supervivencia en cuyes inoculados con una cepa atenuada y desafiados con una cepa virulenta de Salmonella Typhimurium
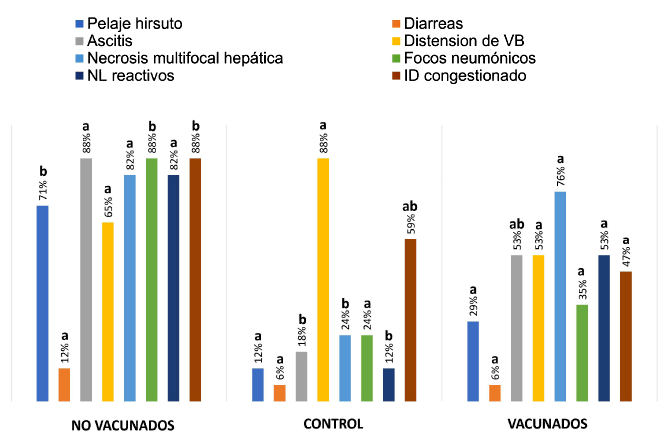
Figura 3. Frecuencia de lesiones macroscópicas en cuyes inoculados con una cepa atenuada y desafiados con una cepa virulenta de Salmonella Typhimurium. Las barras del mismo color indican la misma lesión para cada grupo experimental. Letras diferentes indican si hubo o no diferencia estadística entre cada una de las lesiones por cada grupo experimental.
Lesiones macroscópicas
La Figura 3 muestra las lesiones macroscópicas encontradas en el estudio:
Los cuyes del grupo 2 (desafiado no vacunado) tuvieron una mayor, pero no significativa frecuencia de ascitis (p>0.05) y mayor congestión en el intestino delgado que evidencia una enteritis activa en comparación con el grupo 1 (vacunado y desafiado) (p<0.05).}
Los grupos 1 y 2 presentaron una frecuencia similar de necrosis multifocal hepática (p>0.05).
Hubo una mayor frecuencia de cuyes del grupo 2 con pelaje hirsuto en comparación con el grupo 1 (p<0.05).
Se observó una mayor cantidad de animales con focos neumónicos en el grupo 2 frente al grupo 1 (p<0.05).
No hubo diferencia significativa en la frecuencia de animales con vesícula biliar distendida, con diarreas ni con nódulos linfáticos mesentéricos reactivos entre los grupos 1 y 2.
Lesiones histopatológicas
El grupo 2 (desafiado no vacunado) presentó un mayor, pero no significativo porcentaje de animales afectados con neumonía hemorrágica multifocal y degeneración hidrópica hepática que el grupo 1 (vacunado y desafiado) (p>0.05). Por otro lado, el grupo 1 presentó un mayor, pero no significativo porcentaje de animales afectados con hepatitis necrótica multifocal que el grupo 2 (p>0.05) (Figura 4). Las lesiones observadas en intestino delgado que fueron categorizados mediante los patoscores (edema en la capa submucosa, infiltración de células polimorfonucleares, pérdida de células caliciformes, ulceración del epitelio intestinal) fueron similares entre los grupos 1 y 2, pero mayores a las observadas en el grupo control (Cuadro 3). El patoscore en los grupos 1 y 2 indica una inflamación leve y moderada, respectivamente, a nivel intestinal.

Figura 4. Frecuencia de lesiones histopatológicas en cuyes inoculados con una cepa atenuada y desafiados con una cepa virulenta de Salmonella Typhimurium
Cuadro 3. Promedio de patoscore obtenido en muestras de intestino delgado en 17 cuyes inoculados con una cepa atenuada y desafiados con una cepa virulenta de Salmonella Typhimurium
| Grupos | Media ± EE | |
|---|---|---|
| 1 | Inoculado con la cepa atenuada y desafiados | 4.41±1.04ª |
| 2 | Solo desafiados | 5.71±0.70a |
| 3 | Control (No inoculado con la cepa atenuada y no desafiado) | 0.29±0.18b |
a,b Diferentes superíndices indican diferencia estadística (p<0.05)
Respuesta inmune humoral a la inmunización, cuantificación y aislamiento de S. Typhimurium
En la evaluación de la respuesta humoral inducida frente al candidato vacunal no se observó una diferencia significativa en la reactividad de IgA entre los cuyes vacunados y desafiados (grupo 1) en comparación con los no vacunados y desafiados (grupo 2) (p>0.05), aunque se pudo notar valores ligeramente superiores en el grupo 1 durante todo el estudio (Figura 5). La excreción de S. Typhimurium (UFC por gramo de heces) se comenzó a observar el día 14 pos-desafío en el grupo desafiado no vacunado y a partir del día 21 en los grupos 1 y 2, siendo el grupo 2 el que presentó mayor excreción en los días 18 y 21 pos-desafío, lo cual muestra una posible tendencia. Por otro lado, el grupo 3 (control) no evidenció excreción de S. Typhimurium en el periodo de evaluación (Cuadro 4).
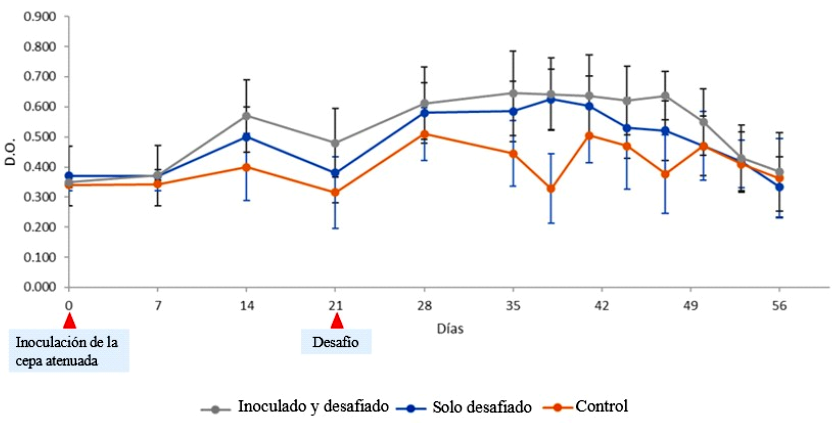
Figura 5. Resultados del ELISA para los niveles de IgA (DO 650) en cuyes inoculados con una cepa atenuada y desafiados con una cepa virulenta de Salmonella Typhimurium. Los puntos representan las medias y las barras a errores estándares (SE)
Cuadro 4. UFC/g de heces observados tras una reacción de PCR en tiempo real en las muestras de ADN extraídas de heces recolectadas de cuyes inoculados con una cepa atenuada y desafiados con una cepa virulenta de Salmonella Typhimurium
| Días pos-desafío | Grupo 1 (Inoculado con la cepa atenuada y desafiados) | Grupo 2 (no vacunado no desafiado) | Grupo 3 (Control - No inoculado y no desafiado) |
|---|---|---|---|
| 0 | - | - | - |
| 3 | - | - | - |
| 7 | - | - | - |
| 10 | - | - | - |
| 14 | - | 4.3 x 101 | - |
| 18 | 3.2 x 101 | 9.2 x 102 | - |
| 21 | 3.5 x 101 | 1.9 x 103 | - |
| 25 | - | - | - |
En el aislamiento de S. Typhimurium del bazo, pulmones e hígado fue similar en los grupos 1 y 2 (p>0.05). Por otro lado, se obtuvo un mayor aislamiento en el grupo 1 (desafiado no vacunado) con relación al grupo 1 (vacunado y desafiado) (p<0.05), tal como se evidencia en la Figura 6.
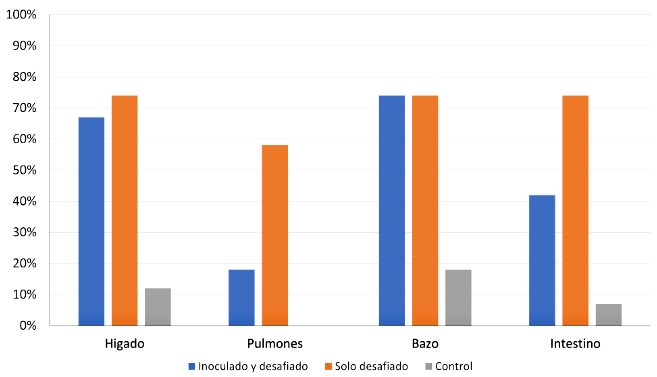
Figura 6. Resultados de aislamiento de S. Typhimurium por órgano en cuyes inoculados con una cepa atenuada y desafiados con una cepa virulenta de Salmonella Typhimurium
Peso vivo y ganancia de peso
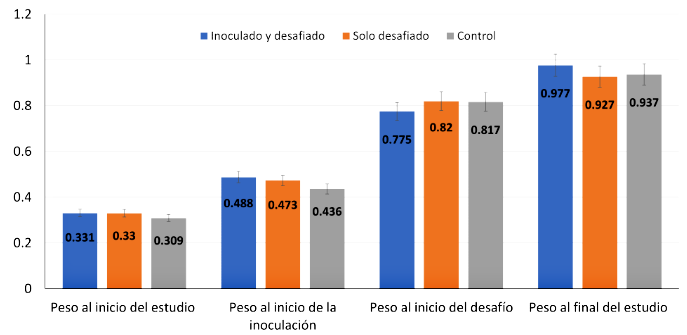
Tanto el peso vivo de los animales como la ganancia diaria de peso por tratamiento fueron estadísticamente similares en todas las etapas del estudio (p>0.05). La ganancia diaria de peso, a pesar de que fue mayor en los animales inoculados con la cepa atenuada y desafiados en comparación con los otros dos grupos, no hubo diferencia estadística entre estas (Cuadro 5). Asimismo, con relación al peso vivo, al término del estudio hubo una ligera diferencia a favor del grupo vacunado y desafiado como se observa en la Figura 7.
Cuadro 5. Ganancia de peso diario (GPD) de cuyes inoculados con una cepa atenuada y desafiados con una cepa virulenta de Salmonella Typhimurium
| Tratamientos | GPD (g) | D.E. |
|---|---|---|
| Inoculados y desafiados | 9.74a | 1.78 |
| Solo desafiados | 8.66a | 1.77 |
| Control | 8.47a | 1.95 |
Promedios con superíndices similares son estadísticamente similares (p>0.05)
DISCUSIÓN
El presente estudio tuvo por finalidad evaluar la eficacia protectora vacunal en términos de mortalidad, lesiones e inducción de anticuerpos IgA de una cepa atenuada de Salmonella Typhimurium de origen cobayo administrada oralmente a cuyes. Para ello se analizó la asociación entre la inoculación de una cepa atenuada y las lesiones causadas frente al desafío con una cepa virulenta, tomando para su evaluación las variables excreción de IgA en heces, excreción de Salmonella Typhimurium en heces, ganancia de peso, lesiones micro y macroscópicas y el aislamiento de S. Typhimurium en los órganos.
Se han llevado a cabo diversas experiencias con serotipos de Salmonella, tanto para el control de la enfermedad como para portadores de antígenos en animales de producción con resultados variables. Una de las características en común es que estas vacunas eran altamente inmunogénicas, con efectividad entre 75 a 100% y con alto porcentaje de seguridad, donde los genes atenuados en la mayoría de las cepas vacunales estuvieron relacionados con la virulencia (Singh, 2009; McWhorter y Chousalkar, 2018; Park et al., 2020).
Una de las mediciones de importancia en la evaluación de una vacuna es el porcentaje de supervivencia pos-desafío. En este estudio, la mortalidad registrada en los grupos desafiados, tanto vacunados y como no vacunados fue similar (30%, 5/17). En el estudio de Tennant et al. (2015) se describe la eficacia de una cepa genéticamente atenuada en el gen guaBA de S. Typhimurium en ratones BALB/C que resultó en una supervivencia del 100% para el grupo inmunizado. En esa misma línea, Park et al. (2020) analizaron la eficacia de una cepa atenuada en el gen yjeK de S. Typhimurium, un gen relacionado con la expresión de una isla de patogenicidad que codifica una variedad de factores de virulencia. En ese estudio, la cepa fue administrada vía intraperitoneal en ratones BALB/C, logrando la supervivencia ante el desafío oral con una cepa wild type de S. Typhimurium.
En el presente estudio, la cepa usada para el desafío, a pesar de que se usó con éxito en un estudio previo (Espinoza, 2021), no generó la mortalidad esperada, lo que quizás no permitió evaluar adecuadamente este parámetro dentro de la eficacia de la cepa atenuada. Se ha demostrado que el mantenimiento de las cepas a bajas temperaturas puede influenciar la expresión de ciertos genes de virulencia (Huang et al., 2015), o incluso la adaptación a medios de laboratorio y no replicarse en sus hospederos naturales puede alterar su capacidad patogénica, como ha sido demostrado en cepas patógenas de E. coli (Fernández-Brando et al., 2012). Esto podría explicar la perdida de la capacidad patogénica de la cepa de S. Typhimurium usada en el desafío experimental.
Para la mayoría de los parámetros evaluados, tales como la ganancia de peso, porcentaje de lesiones, excreción de IgA y eliminación de S. Typhimurium en heces no se encontró diferencia significativa entre los grupos tratados. Si bien la ganancia de peso fue similar entre los tres grupos, los cuyes vacunados y desafiados obtuvieron 50 y 40 g más al final del estudio que los grupos desafiado no vacunado y el control, respectivamente, lo cual podría explicarse en una mejor integridad en las células entéricas, traduciéndose en una mejor absorción de nutrientes, efecto que ha sido corroborado en estudios in vitro e in vivo en ratones y aves (Fiorentino et al., 2013; Ghosal et al., 2015; Zhang et al., 2021). A pesar de la diferencia entre los pesos entre los animales de los grupos experimentales, esto es una cuestión del azar y no propia del tratamiento experimental. Otros estudios, como el de Park et al. (2020) no observan diferencias estadísticas en los pesos finales en los individuos inoculados con una cepa atenuada de S. Typhimurium en relación con los animales desafiado.
Los valores de excreción de IgA en las heces no fueron estadísticamente diferentes entre el grupo inoculado con la cepa atenuada y desafiado con el grupo no vacunado no desafiado, aunque a partir del día 14 de la inoculación se encontraron niveles de IgA ligeramente superiores en el primer grupo. No obstante, los niveles de anticuerpos IgA no fueron los esperados y estadísticamente similares a los del grupo control. Factores como el protocolo de obtención de IgA, el tiempo y la forma de conservación de la muestra pueden alterar los niveles detectables de este tipo de anticuerpo en la muestra (Park et al., 2014), además del estado fisiológico del animal (Campos-Rodríguez et al., 2013).
Por otro lado, McWhorter y Chousalkar (2018), al evaluar la capacidad de inducción de IgA total en mucosa intestinal (íleon) de gallinas ponedoras, encontraron que la inoculación con la cepa silvestre de S. Typhimurium indujo una mayor expresión de IgA que la cepa vacunal, una cepa atenuada en el gen aroA y distribuida comercialmente para la prevención de salmonelosis en aves. Asimismo, Periaswamy et al. (2012), evaluando una cepa atenuada en un gen de virulencia (ssaV) de S. Typhimurium en un modelo de ratón sometido a inmunosupresión, demostró que la cepa atenuada fue capaz de inducir niveles mucho más altos de IgA anti-antígeno O de Salmonella, que aquellos que no fueron inoculados. Otros estudios, como el de Zhu et al. (2017), también lograron demostrar la capacidad de inducir niveles de IgA fecal en cerdos inoculados con una cepa viva atenuada de S. Cholerasuis
Se encontró una mayor frecuencia de lesiones micro y macroscópicas compatibles con salmonelosis en los animales solo fueron desafiados en comparación con los controles y el grupo inoculado con la cepa atenuada y desafiado, especialmente en el caso de focos neumónicos e intestino. Por otro lado, se logró el aislamiento de Salmonella, tanto en hígado, bazo, pulmones e intestinos, en proporciones estadísticamente similares en los dos grupos desafiados. La presencia de lesiones y aislamiento de Salmonella en animales controles es porque no se trabajó con animales libres de patógenos (SPF), y a pesar de que se realizó un descarte de salmonelas por las heces antes del inicio del estudio, estos microorganismos pueden permanecer en órganos de manera latente (Tischler y McKinney, 2010).Asimismo, el empleode cepas atenuadas, incluso comerciales, no garantiza una inmunidad esterilizante y es posible observar lesiones pos-desafío y aislar el microorganismo usado en el desafío, así como la presencia de diarreas incluso en animales inmunizados (McWhorter y Chousalkar, 2018, Higginson et al., 2021, Ji et al., 2022).
En este contexto, el estudio de Lin et al. (2022) demuestra que en pollos SPF vacunados con una vacuna comercial bivalente en base a una cepa de S. Typhimurium y S. Enteritidis, se pudo aislar S. Enteritidis en el 67% de aves a partir de hisopados cloacales y en el 25% en tejidos en aves a los 14 días del desafío con S. Enteritidis y en el 25% de hisopados cloacales y en 16.7% de tejidos en aves desafiadas con S. Typhimurium; sin embargo, en ambos casos las aves fueron protegidas y no presentaron signos clínicos severos ni contaminación en los huevos.
Uno de los principales órganos afectados en animales infectados por Salmonella es el tracto intestinal. En esa línea, Vishwakarma et al. (2012) evaluaron el efecto de una cepa atenuada en un gen de virulencia (ssaV) en un modelo murino con inmunosupresión sobre el efecto del desafío obteniendo valores patoscore de 8en animales desafiados sin vacunar y de 2-2.5 en vacunados y desafiados, siendo la principal lesión el edema en la membrana serosa y necrosis de las vellosidades intestinales. Estas lesiones fueron observadas también en este estudio, dando un patoscore de 5.71 en individuos del grupo de solo desafiados, 4.41 en inoculados con la cepa atenuada y desafiados y 0.29 en los individuos controles.
Es interesante resaltar que los animales pudieron eliminar S. Typhimurium hasta el último día donde se realizó esta evaluación, 21 días después del desafío, aunque las cantidades en relación con otros estudios es baja.
Así, los ratones inmunizados con la cepa vacunal en el estudio de Vishwakarma et al. (2012) eliminaron 108 UFC/g de heces hasta el día 28 post desafío; en tanto que en el estudio de Lin et al. (2022) se detectaron valores de 101.1 UFC/g de heces de S. Typhimurium en el día 14 en aves SPF, un valor más similar al del presente estudio.
CONCLUSIONES
No hubo una asociación significativa en el efecto protector contra la mortalidad frente al desafío experimental en los grupos experimentales desafiados.
Los grupos experimentales desafiados no mostraron diferencia estadística en las lesiones macroscópicas y microscópicas ocasionadas por la cepa virulenta de S. Typhimurium.












 uBio
uBio