INTRODUCCIÓN
La duración de la gestación puede variar a causa de factores como el sexo fetal, número de fetos, raza, genotipo de los padres y estado nutricional, así como factores medio ambientales (Stevenson, 2007). La fisiología reproductiva de las llamas y alpacas presenta características particulares, existiendo aún cierto vacío en el conocimiento, especialmente sobre el periodo de gestación, el cual se describe como una gestación larga, teniendo en promedio 344 días (Sumar, 1996). Las descripciones del desarrollo del útero grávido, volumen de líquidos fetales y desarrollo fetal entre otras características, son ampliamente conocidas en las especies domésticas (Arthur et al., 1991); sin embargo, este conocimiento es mínimo y disperso en la alpaca.
El proceso de desarrollo intrauterino del feto respecto a la curva de peso fetal, longitud fetal y largo de la columna vertebral han sido descritos en alpacas (Bravo y Varela, 1993). Mediante ecografía, es posible detectar el embrión a los 22 días poscópula (Bravo et al., 2000) y mediante biometría fetal realizada ecográficamente es posible aproximar la edad fetal en llamas (Herrera et al., 2002).
En alpacas, se ha podido determinar cambios en el grosor de la pared uterina y disminución de los fluidos uterinos durante diferentes etapas de la gestación mediante ecografía transabdominal (Ferrer et al., 2013).
El volumen total de los líquidos fetales en la oveja, la vaca y la yegua aumenta a medida que avanza la edad gestacional, pero por separado muestran tendencias diferentes, siendo mayor el fluido alantoideo frente al amniótico (Arthur et al., 1991). En la yegua se describen 15 L de fluido alantoideo al término de la gestación (Vatti, 1992).
El mayor porcentaje de gestaciones de la alpaca se produce en el cuerno izquierdo, a pesar de que las ovulaciones se presentan de manera similar en ambos ovarios (Sumar, 1983). Las alpacas tienen un comportamiento reproductivo estacional, donde el parto se produce generalmente entre los meses de diciembre a marzo (meses de mayor pluviosidad) y solo produce una cría. Son extremadamente raras las gestaciones y partos dobles y en caso de que se produzcan, los fetos tienen menor peso promedio (Bravo, 2002). La mayor frecuencia de partos se presenta entre las 07:00 y 13:00 h y más del 70% paren de pie, siendo estas características particularidades de la especie que ayudan a la sobrevivencia neonatal (Rodríguez et al., 2014). Existe muy baja presentación de partos distócicos en alpacas (Bravo, 2002). El parto es facilitado gracias a la presencia de la membrana epidermal, estructura que fue descrita en camélidos del viejo y nuevo mundo (Fowler, 2010). Bajo estas consideraciones, el objetivo de este trabajo fue contribuir a la descripción del proceso de la gestación en alpacas mediante la biometría abdominal, uterina y fetal, así como la volumetría de los fluidos fetales.
MATERIALES Y MÉTODOS
El estudio fue realizado en el Laboratorio de Reproducción Animal de la Estación IVITA Maranganí, Cusco (Perú), de la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM). Se utilizaron 10 hembras preñadas como grupo control, la medición del diámetro abdominal se realizó sobre la piel, evitando medir sobre la fibra. Además, se confirmó la gestación mensualmente mediante ecografía transrectal (Esaote® Tringa linear, Italia) con transductor lineal transrectal de 5 MHz y se evaluó la ubicación uterina mediante palpación rectal. Se hizo el seguimiento del diámetro abdominal desde el primer mes de gestación hasta el parto utilizando una cinta métrica milimetrada. Se determinó el peso al nacimiento y se colectó la placenta inmediatamente de expulsada para medir el total del fluido alantoideo presente. Las hembras fueron mantenidas durante todo el año en pasturas naturales, en condiciones de crianza tradicional, a 4400 msnm.
Adicionalmente, se utilizaron 49 alpacas preñadas, con fechas de servicio conocidas, consideradas como descarte y que fueron faenadas en el camal del distrito de Maranganí. Las hembras eran de raza Huacaya, adultas, con edades entre 6 a 10 años. Se observo la ubicación del útero y cuerno grávido en todas las hembras faenadas, luego se retiraron los úteros grávidos seccionados a nivel del cérvix y se llevaron al laboratorio para su evaluación:
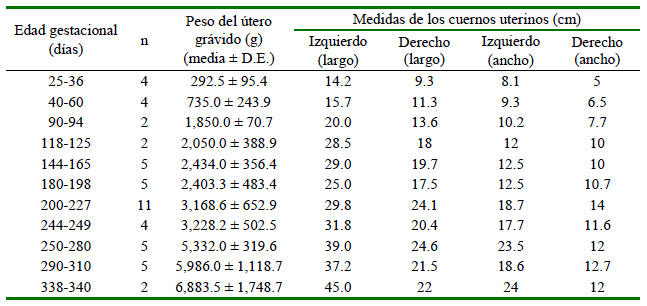
Se determinó el peso total del útero gravido (balanza Greetmed® GT130-100, China, con una precisión de ± 0.1 g). Se determinó el largo y ancho del cuerno grávido (cuerno izquierdo) y no grávido (cuerno derecho) (Bravo y Varela, 1993) utilizando una regla metálica milimetrada (±1 mm).
Se diseccionó el cuerno grávido y se extrajo el embrión/feto, según su edad gestacional determinada mediante la fecha de empadre conocida en cada caso. Estos fueron agrupados mensualmente según la edad gestacional (30, 60, 90, 120, 150, 180, 210, 240, 270, 300 y 330 días [rango ± 15 días]). Se pesaron en la balanza pediátrica, arriba indicada, y se tomó la medida de la longitud corona-grupa (CRL=crown rump length) con una regla metálica milimetrada (±1 mm).
Se colectaron los fluidos amniótico y alantoideo en vasos graduados por separado, y se consignó el volumen total.
En dos especímenes (150 y 180 días) se inyectaron 10 mL de tinta china tanto al saco amniótico como alantoideo para teñir los fluidos y hacerlos visibles. Así se pudo verificar la extensión de las membranas amniótica (150 días) y alantoidea (180 días) (Figura 1).
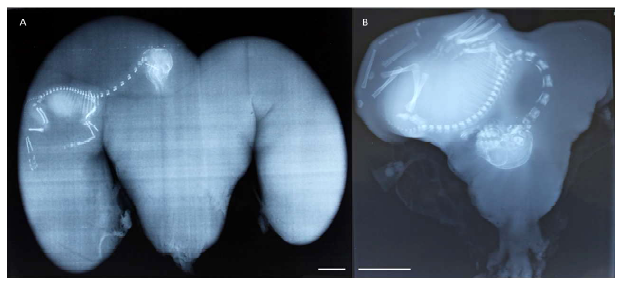
Se utilizaron dos úteros grávidos de 90 y 240 días de gestación, que fueron sometidos a Rayos X (placa radiográfica a una potencia de 40 KV y 2.3 Mas, DRGEM®, China) para determinar la ubicación y posición del feto dentro del cuerno grávido (Figura 2).
Se utilizaron medidas de tendencia central para la descripción. Para determinar asociación entre el largo y peso fetal así como entre los fluidos alantoideo y amniótico se realizó una prueba de correlación utilizando el software SAS® 2009. El presente estudio fue autorizado por el Comité de Ética y Bienestar Animal de la FMV-UNMSM, mediante Constancia de Autorización Ética N.º CEBA-2020-01.
Figura 1. Delimitación del saco amniótico (A) (Barra= 3.5 cm) y alantoideo (B) (Barra= 3.7 cm) de la alpaca, mediante tinción de los fluidos con tinta china
RESULTADOS Y DISCUSIÓN
Los promedios de los diámetros abdominales de las alpacas gestantes del grupo control se presentan en el Cuadro 1. Las dimensiones de los uteros gravidos en hembras faenadas se muestran en el Cuadro 2.
Cuadro 1. Diámetro abdominal (Promedio ± DE) en alpacas con diferente edad gestacional (10 observaciones por edad)
| Edad gestacional | Diámetro abdominal |
|---|---|
| (días) | (cm) |
| 30 | 76.1 ± 4.8 |
| 60 | 80 ± 5.1 |
| 90 | 81.8 ± 5.3 |
| 120 | 82.8 ± 5.1 |
| 150 | 85.2 ± 6.5 |
| 180 | 93.9 ± 6 |
| 210 | 97.1 ± 5.4 |
| 240 | 102.9 ± 4.6 |
| 270 | 104.7 ± 5.3 |
| 300 | 104.8 ± 5.8 |
| 330 | 106.7 ± 3.5 |
El diámetro o perímetro abdominal de alpacas vacías se ha descrito para la raza Huacaya en 79.46 cm y para la raza Suri en 75.13 cm (Sumar, 1998), mientras que Muñoz (2007) indica un promedio de 79.20 cm en alpacas de la cordillera chilena. En el presente trabajo (Cuadro 1), el diámetro a los 30 días de gestación fue similar a estos reportes. A partir de dicha medida, se observa un incremento gradual conforme avanza la gestación llegando con un diámetro abdominal de 106.6 cm a los 330 días, muy cerca a la fecha de parto. No existen reportes sobre el diámetro abdominal durante la gestación en alpacas; sin embargo, León et al, (2011) indican que el útero grávido de llamas se acomoda redirigiéndose al lado derecho de la cavidad abdominal, puesto que el lado izquierdo está ocupado por el compartimento proximal del estómago (Alzola et al., 2004), tal como fue observado en todos los especímenes de este estudio, mediante palpación rectal y por observación directa en los animales faenados. Esta característica posiblemente esté limitando un mayor desarrollo volumétrico del útero grávido en alpacas en estadios avanzados, debido a la competencia por el espacio abdominal entre el útero grávido y los órganos digestivos, tal como fue descrito en ovejas (Forbes, 1968).
En el presente estudio, todas las gestaciones se encontraron en el cuerno izquierdo. Se pudo observar un incremento gradual del peso del útero grávido (Cuadro 2), tal como fue descrito en ovinos (Okoye et al., 2021). Asimismo, se pudo observar que a medida que avanza la gestación, el útero ingresa a la cavidad abdominal aproximadamente el día 90, tal como lo indican Bravo y Varela (1993). A medid que avanza la edad gestacional e incrementa el tamaño y peso, avanza craneal-mente hasta tener contacto con el diafragma el día 240 (Bravo y Varela, 1993). El incremento fue gradual, siendo más evidente en el cuerno grávido, tanto en el largo (14.2 cm el día 30 hasta 45 cm el día 330) y ancho (8.1 cm el día 30 hasta 24 cm el día 330). Estas medidas difieren ligeramente a lo reportado por Bravo y Varela (1993), quienes indican 15 x 10 cma los 60 días y 60 x 25 cm a los 330 días, mientras que, en el presente estudio el cuerno grávido midió 15.7 x 9.3 y45 x 24 cm en dichas edades, respectivamente. El cuerno derecho (no grávido) también incrementó las medidas largo y ancho durante la gestación, pero en menor medida, similar a lo descrito en alpacas (Bravo y Varela, 1993) y cabras (Waziri et al., 2012).
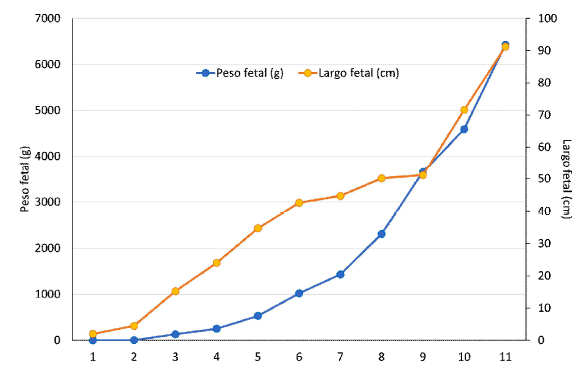
Tal como sucede en otras especies, el peso fetal registrado incrementó gradualmente a medida que avanza la edad gestacional (Cuadro 3; Figura 3); sin embargo, los pesos mensuales fueron ligeramente inferiores a lo reportado por Bravo y Varela (1993), aunque dentro del rango descrito para la especie (Tibary et al., 2014). Estas diferencias pueden atribuirse a diversos factores, entre ellos, la estación de parto (Davis et al., 1997), el tiempo de gestación (Hardefeldt et al., 2013), así como también el sistema productivo y la calidad de pasturas donde se mantuvieron las madres (Bryant et al., 1989). Por otro lado, los pesos fetales fueron diferentes al reporte hecho por Castro (2017), quien aproximó las edades fetales de acuerdo con el diámetro biparietal fetal reportado por Gazitua et al. (2001) en especímenes colectados en matadero.
Cuadro 3. Biometría del feto y volumetría de fluidos uterinos de la alpaca (promedio ±DS) (n= 49).
| Edad gestacional (días) | Peso fetal (promedio ± DE) (g) | Largo fetal total (promedio ± DE) (cm) | Líquido alantoideo (promedio ± DE) (mL) | Líquido amniótico (promedio ± DE) (mL) |
|---|---|---|---|---|
| 25-36 | 0.8 ± 0.6 | 2.0 ± 0.8 | 178.7 ± 78.9 | - |
| 40-60 | 4.1 ± 1.9 | 4.5 ± 5.0 | 475.2 ±217.3 | 10.0 ± 5.0 |
| 90-94 | 132.0 ± 1.2 | 15.3 ± 3.5 | 1067.5 ± 95.5 | 27.5 ± 3.5 |
| 118-125 | 253.0 ± 24.6 | 24.0 ± 4.9 | 900.0 ± 258.1 | 14.0 ± 4.9 |
| 144-165 | 531.1 ± 260.3 | 34.7 ± 35.7 | 946.0 ± 314.6 | 65.6 ± 35.7 |
| 180-198 | 1,020.0 ± 141.8 | 42.6 ± 19.7 | 726.6 ± 289.1 | 24.0 ± 12.7 |
| 200-227 | 1,431.4 ± 699.8 | 44.7 ± 22.4 | 862.8 ± 144.4 | 40.1 ± 22.4 |
| 244-249 | 2,309.1 ± 1005.4 | 50.1 ± 27.8 | 364.5 ± 212.1 | 66.8 ± 27.8 |
| 250-280 | 3,646.0 ± 1309.1 | 51.1 ± 28.4 | 756.0 ± 211.7 | 82.6 ± 28.4 |
| 290-310 | 4,592.0 ± 398.9 | 71.6 ± 21.8 | 602.0 ± 120.5 | 65.0 ± 20.3 |
| 338-340 | 6,430.0 ± 1499.1 | 91.2 ± 35.4 | 1,720.0 ± 1103.1 | 135.0 ± 35.4 |
| Neonatos | 6,910.2 ± 664.6 | 87.5 ± 30.5 | 2,166.6 ± 348.9 | - |
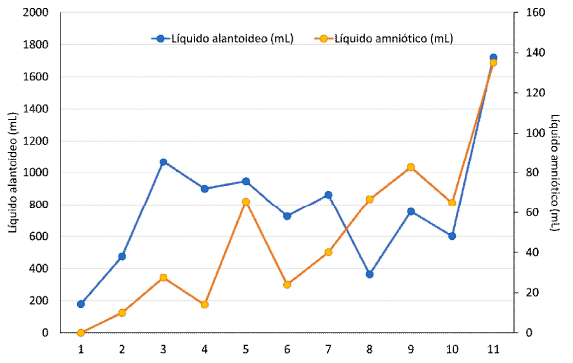
El fluido amniótico y el alantoideo se incrementan de acuerdo con el avance de la edad gestacional, tal como lo describeArthur (1991) en vacas gestantes. Asimismo, según describe dicho autor, el fluido alantoideo siempre presenta mayor volumen frente al fluido amniótico, tal y como fue observado en el presente estudio (Figura 4), donde el fluido amniótico representa el 1.2, 2.6, 1.5, 6.9, 3.3, 4.6, 18.3, 10.9, 10.8 y 7.8% del fluido alantoideo para los 60, 90, 120, 150, 180, 210, 240, 270, 300 y 330 días de gestación, respectivamente. El fluido alantoideo se encuentra llegando a su mayor volumen en el último mes de gestación (Cuadro 3), posiblemente para cumplir la función de dilatación y lubricación del canal de parto. En general, se observa bajo volumen de fluidos fetales, tal como lo indican Tibary et al. (2008) y Whitehead (2018).
La longitud total o Crown Rump Length (CRL) de fetos de alpaca ha sido determinada también por Bravo y Varela (1993); sin embargo, los valores obtenidos en el presente estudio son superiores, pero siendo similares a la medida indicada como total lenght nose to tail en dicho estudio. A medida que avanza la edad gestacional, el feto y el cuerno grávido aumentan de tamaño, pero el bajo volumen del fluido amniótico y, posiblemente la capacidad del saco amniótico, no permiten que el feto se ubique a lo largo de todo el útero grávido, manteniéndose en el cuerno izquierdo con evidente limitación de su área de expansión, tal como se puede observar en la Figura 2. Adams y Domínguez (2007) indican que el diagnóstico de gestación por «balotaje» o sucusión se puede realizar a partir de los 8 meses, cuando el diámetro abdominal se encuentra sobre los 100 cm, el peso fetal superior a los 2 kg y el CRL mayor a 50 cm. En el presente estudio, los valores de peso y largo fetal presentan un coeficiente de correlación de 0.933, lo que muestra una relación muy cercana entre ambas variables (Figura 3).
El incremento temprano de fluido alantoideo es necesario para facilitar la interdigitación de las vellosidades coriónicas con las criptas endometriales durante la placentación (Bazer et al., 2012; Okoye et al., 2021), cumpliendo posiblemente la misma función en alpacas, donde la placenta epiteliocorial difusa presenta la formación de capilares en el tejido conectivo presente entre las capas trofoblástica y endometrial, evidenciando así el inicio de la función nutricia placentaria en alpacas al día 45 aproximadamente (Olivera et al., 2003). El mayor incremento del fluido alantoideo estaría relacionado a la formación de la membrana corioalantoidea, la cual es necesaria para permitir el crecimiento del feto. Las observaciones indican el aumento del volumen alantoideo a los 90 días de gestación (1067 mL), de forma similar a la descripción hecha por Eley et al, (1977), quienes indican un incremento del volumen alantoideo a los 100 días de gestación en vacas, mientras que Bazer et al, (2012) reporta en ovejas un incremento gradual de los volúmenes de fluidos placentarios, pero con mayor volumen del fluido amniótico.
El incremento del fluido alantoideo en cabras es gradual, varía desde 25.5 mL a los 25 días hasta 735 mL el día 140 de gestación (Waziri et al., 2012), mientras que en alpacas se observan fluctuaciones del volumen alantoideo desde los 30 días con 204 mL, mostrando un primer pico a los 150 días (946 mL), desciende a los 180 días y vuelve a subir a los 210 días (862 mL), y vuelve a descender al día 240 (364.5 mL) para presentar un incremento final hacia los 330 días (1720 mL), muy cerca a la fecha de parto (Cuadro 3). Estas fluctuaciones en alpacas coinciden con el reporte hecho por Bravo y Varela (1993), quienes indican un incremento gradual hasta los 150 días, un descenso hasta los 210 días y otro incremento hasta los 330 días, aunque en dicho estudio se suma el volumen de los fluidos amniótico y alantoideo. Fluctuaciones en el volumen del fluido alantoideo también han sido descritas en ovejas (Okoye et al., 2021) y marranas (Goldstein et al., 1980).
El fluido amniótico es imperceptible a los 30 días, a los 60 días se encontró 10 mL, mostrando fluctuaciones a lo largo de la gestación, llegando a un pico de 135 mL el día 330 (18% del fluido alantoideo). Este comportamiento es diferente a lo observado en cabras (Waziri et al., 2012) y ovejas (Okoye et al., 2021), donde el fluido amniótico presenta mayor volumen frente al alantoideo. Este menor volumen del fluido amniótico podría estar limitando el movimiento fetal intrauterino en la alpaca, específicamente dentro del saco amniótico, lo cual puede estar relacionado a la baja frecuencia de presentaciones de partos distócicos, especialmente los causados por malposición fetal, tal como lo reportó Bravo (2002).
Durante el parto, el saco amniótico aparece en la vulva después de la ruptura del alantocorion (Rodríguez et al., 2014); sin embargo, la lubricación del canal de parto se facilita en mayor medida por la presencia de la membrana epidermal (Iturrizaga et al., 2007), debido a que el volumen de fluido amniótico es insuficiente para lubricar el canal de parto, permitiendo la expulsión fetal.
CONCLUSIONES
El proceso de gestación ocurre principalmente en el cuerno izquierdo, quién compite por el espacio intraabdominal con los órganos digestivos, siendo desplazado hacia la región central y ventral del abdomen.
El diámetro abdominal se incrementa sutilmente, no permitiendo mayor disponibilidad de espacio intraabdominal al útero grávido.
El mayor crecimiento fetal se observó en el último mes de gestación.
Existe bajo volumen de fluidos placentarios, principalmente el líquido amniótico.












 uBio
uBio