Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Anales de la Facultad de Medicina
versão impressa ISSN 1025-5583
An. Fac. med. v.72 n.1 Lima jan./mar. 2011
ARTÍCULOS ESPECIALES SOBRE EL HOMBRE DE LA ALTURA
Respuesta hipófiso gonadal a la infusión pulsátil de GnRH en la altura
Hypophyso-gonadal response to GnRH pulsatile infusion at high altitude
Óscar Castillo1 ; Guido Molina2 ; Nora Ugarte3 ; Édgar Florentini1 ; Fausto Garmendia2
1 Instituto Nacional de Biología Andina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
2 Instituto de Investigaciones Clínicas, Universidad Nacional Mayor de San Marcos, Lima, Perú.
3 Departamento de Ciencias Biológicas, Universidad San Antonio Abad, Cusco, Perú.
RESUMEN
Introducción: Se conoce que la capacidad fértil del sujeto nativo de altura es similar a la del sujeto nativo de nivel del mar. Objetivos: Evaluar la reserva hipófiso testicular, utilizando una metodología de infusión pulsátil con dosis bajas de GnRH.
Diseño: Estudio experimental, básico. Lugar: Instituto de Investigaciones Clínicas, Universidad Nacional Mayor de San Marcos, Lima, Perú; Laboratorio de Ciencias Biológicas, Universidad San Antonio Abad, Cusco, Perú. Participantes: Sujetos normales nativos de nivel del mar y de altura. Intervenciones: Se evaluó 12 sujetos de sexo masculino, habitantes de la altura (Cusco, 3395 m.s.n.m.) y un grupo similar de sujetos habitantes de nivel del mar (Lima, 150 m.s.n.m.). Fueron sometidos a una infusión pulsátil intravenosa de GnRH por 24 horas. Se midió las concentraciones plasmáticas de LH, FSH y testosterona. Principales medidas de resultados: Concentraciones de LH, FSH y testosterona. Resultados: Las concentraciones basales de LH, FSH y testosterona fueron similares en ambos grupos. Asimismo, se observó elevaciones significativas de LH sobre su basal, desde las tres hasta las 24 horas, en ambos grupos. Conclusiones: No se observó diferencias significativas en las concentraciones promedio de FSH y testosterona durante la infusión entre ambos grupos; solo los habitantes de la altura mostraron elevación significativa de FSH, en comparación con su valor basal, lo cual podría sugerir que los habitantes de la altura tendrían una mayor reserva hipofisaria.Palabras clave: Hormona liberadora de gonadotropinas, hormona luteinizante, hormona estimulante folicular, testosterona, altura.
ABSTRACT
Introduction: It is known that fertility of normal high altitude dwellers is similar to that at sea level. Objectives: To determine the hypophyso-gonadal reserve using a pulsatile methodology with low doses of GnRH. Design: Experimental, basic study. Setting: Instituto de Investigaciones Clinicas, Universidad Nacional Mayor de San Marcos, Lima, and Laboratorio de Ciencias Biologicas, Universidad San Antonio Abad, Cusco, Peru. Participants: Sea level and high altitude normal subjects. Interventions: Twelve normal male high altitude dwellers (Cusco, 3395 m.a.s.l.) and 12 subjects living at sea level (Lima, 150 m.a.s.l.) were submitted to an intermittent intravenous infusion of GnRH for 24 hours. Serum LH, FSH and testosterone concentrations were measured using RIA techniques. Main outcome measures: LH, FSH y testosterone concentrations. Results: LH, FSH and testosterone basal concentrations were similar in both groups. Significant LH increases from basal concentrations was observed from 3 to 24 hours in both groups. Conclusions: Although no significant differences in serum FSH and testosterone mean concentrations were found during infusion to both groups, only high altitude dwellers presented significant FSH elevation from their basal values which might suggest that the normal high altitude dwellers have a higher hypophysis reserve.
Keywords: Gonadotropin releasing hormone, luteinizing hormone, follicle-stimulating hormone, testosterone, high altitude.
INTRODUCCIÓN
Se conoce que la exposición aguda a la altura produce alteración temporal de la función hipófiso testicular, tanto en animales (1-3) como en humanos (4-7), caracterizada por oligospermia - azoospermia y disminución de la concentración sérica de gonadotropinas y testosterona. Por otro lado, los habitantes normales de altura no muestran concentraciones diferentes de LH, FSH y testosterona bajo condiciones basales (8-11).
La respuesta hipofisaria a la aplicación intravenosa de hormona liberadora de gonadotropinas (GnRH) en bolo no ha mostrado diferencias entre los sujetos de nivel del mar y de altura, pero sí se ha observado una mayor sensibilidad testicular en los sujetos de altura (12). También se ha hallado una respuesta mayor de FSH al citrato de clomifeno en habitantes de la altura (HA) (11). Estos resultados sugieren que se han producido cambios adaptativos en el sujeto de altura, con la finalidad de mantener una función hipófiso testicular normal.
Se conoce que la GnRH se sintetiza a nivel hipotalámico; además, se sabe que su liberación fisiológica y su efecto a nivel de los gonadotropos se producen en forma intermitente o pulsátil. Este conocimiento ha generado diversos modelos de infusión episódica de GnRH utilizados en la clínica, en pacientes con deficiencia endógena de GnRH (13-17) y también en sujetos normales (18).
La infusión en bolo de GnRH ya ha sido estudiada; sin embargo, se desconocen los efectos de la administración pulsátil de esta hormona. Es por ello nuestro interés de evaluar la reserva hipófiso testicular en sujetos normales que residen tanto a nivel del mar como en la altura, utilizando una forma fisiológica de estimulación (pulsátil) con dosis bajas de GnRH.
MÉTODOS
Se realizó un ensayo clínico de intervención, no controlado y no aleatorizado, en 24 sujetos de sexo masculino, entre 20 y 30 años. Se les dividió en dos grupos: el grupo A incluyó 12 sujetos nativos de nivel del mar (NM) (Lima, 150 m.s.n.m.) y el grupo B, 12 sujetos habitantes de la altura (HA) (Cusco, 3 395 m.s.n.m.). Todos tuvieron un desarrollo sexual normal.
Se les colocó un catéter intravenoso en el antebrazo, el cual fue conectado a la minibomba Zyklomat (Ferring, Kiel, Alemania), la cual infundió 5 microgramos de GnRH en forma pulsátil cada 90 minutos, durante las 24 horas. Se obtuvo muestras de sangre antes de la administración de GnRH y a los 15 minutos, 30 minutos, 60 minutos, 90 minutos, 3 horas, 4,5 horas, 9 horas, 12 horas y 24 horas, durante la administración de GnRH.
Se realizó las determinaciones hormonales de LH (19), FSH (20) y testosterona (21) con radioinmunoensayo (RIA).
Los cálculos estadísticos fueron efectuados aplicando la prueba t de student. Para determinar la significación de los incrementos absolutos con respecto a sus valores basales de cada grupo, se aplicó la fórmula para muestras pareadas t (n-1) = d/Esd. Se consideró significancia estadística para valores de p < 0,05.
Los sujetos de investigación firmaron el consentimiento informado respectivo, aceptando su participación en el proyecto. El ensayo fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos.
RESULTADOS
Las concentraciones basales de LH, FSH y T fueron similares en ambos grupos, no encontrándose diferencia significativa. Se observó una elevación significativa y similar de LH en ambos grupos, durante la infusión de GnRH, siendo a los 15 minutos la concentración de LH mayor en los sujetos de nivel del mar. No se apreció diferencias significativas en las concentraciones de FSH o testosterona (figuras 1, 2, 3).
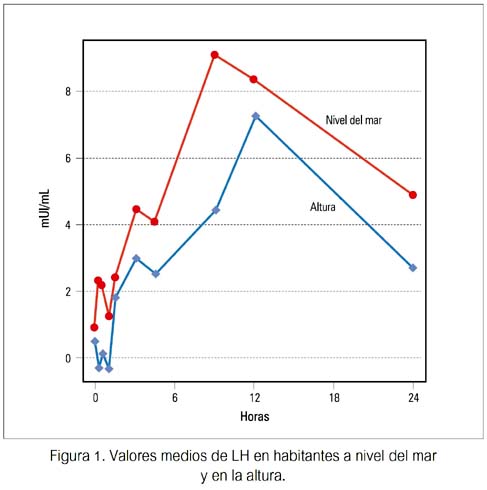
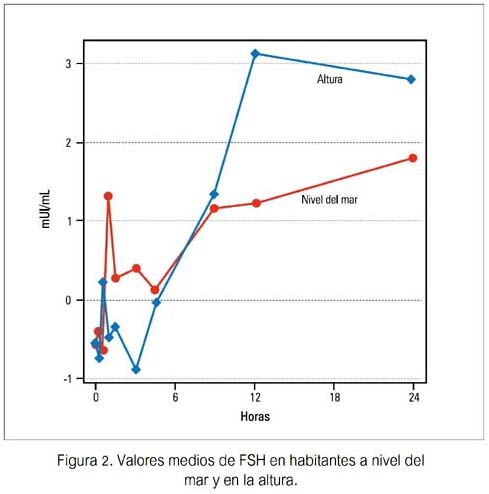
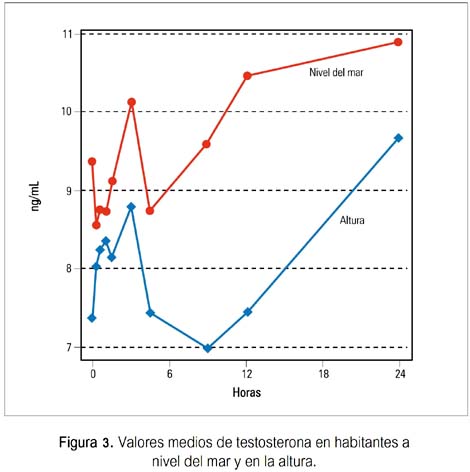
Durante la infusión pulsátil de GnRH, los incrementos de LH de su valor basal fueron significativos y similares en ambos grupos, desde las 3 hasta las 24 horas. Los valores de FSH mostraron un aumento gradual y significativo solo en el grupo B de habitantes de altura, a las 24 horas (p< 0,02). Los valores de testosterona mostraron un patrón irregular en ambos grupos, no observándose incremento significativo en relación al basal en ambos (tabla 1).
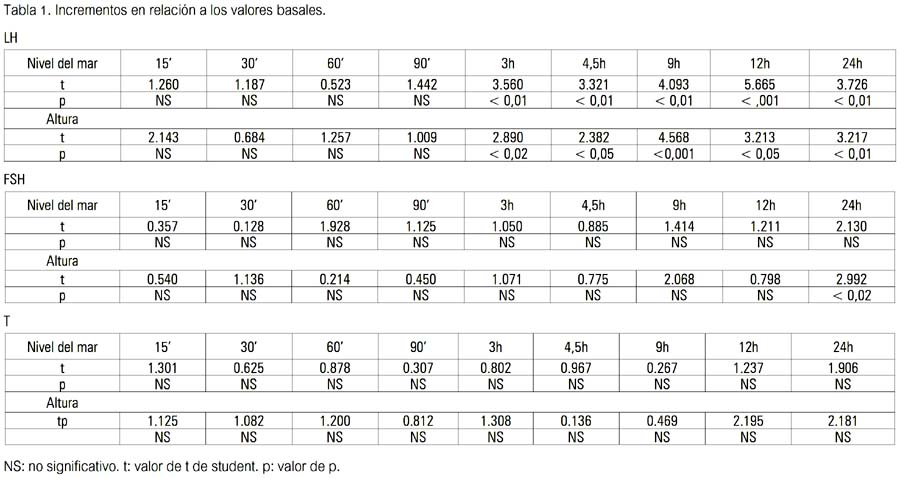
Cuando se comparó los incrementos entre ambos grupos, no se halló diferencias significativas
.DISCUSIÓN
En estudios previos, la función hipofisaria ha sido evaluada utilizando GnRH en forma de bolo, bajo infusión continua o usando dosis suprafisiológicas de GnRH. Actualmente se sabe que la secreción fisiológica endógena de GnRH se produce en forma pulsátil y en pequeñas dosis.
Utilizando el citrato de clomifeno como un estimulador hipotalámico de GnRH endógeno en sujetos de altura (Cusco, 3395 m.s.n.m.), se halló una mayor respuesta de FSH al quinto día, durante la administración del clomifeno, lo cual sugería que los sujetos de altura tenían una mayor sensibilidad hipofisaria al GnRH que los sujetos de nivel del mar (11).
En un estudio previo, hemos evaluado la sensibilidad hipofisaria en sujetos nativos de altura utilizando GnRH en bolo, por vía intravenosa, con dosis de 50 microgramos, no encontrando diferencias significativas en la respuesta hipofisaria de LH y FSH, entre ambos grupos. Pero, sí se observó una mayor respuesta testicular en los sujetos de altura, la cual fue apreciada como un incremento significativo de testosterona sobre su valor basal. Este hallazgo ha sido interpretado como una mayor sensibilidad de las células intersticiales de Leydig al GnRH, en los sujetos de altura (12). Asimismo, utilizando dosis de 100 µg por vía subcutánea, no se encontró diferencias en la respuesta de LH y FSH entre grupos de altura y nivel del mar (22). Otro estudio reveló una mayor respuesta de FSH en los sujetos de altura y una menor respuesta de LH, utilizando una dosis mayor de GnRH (100 µg) y a una altura de 4 200 m.s.n.m. (23).
Se sabe que la administración en bolo de GnRH y en dosis suprafisiológicas permite la evaluación de la sensibilidad hipofisaria, pero no la reserva hipofisaria. Para lograr evaluar la reserva hipofisaria, es necesario utilizar dosis suprafisiológicas de GnRH bajo un modelo de infusión continua o utilizando dosis menores de GnRH, bajo un modelo de infusión pulsátil.
Con el uso de dosis pequeñas de GnRH y utilizando un esquema de infusión intermitente, tal como el usado en la presente investigación, se evita el fenómeno de taquifilaxia (down regulation) (24). Este fenómeno se produce generalmente cuando el GnRH es administrado en forma continua, con dosis suprafisiológicas, o cuando se utiliza análogos de GnRH de acción larga.
Al inicio de la administración pulsátil de GnRH (15 minutos), encontramos una mayor elevación de LH en los sujetos de nivel del mar, lo cual podría significar una mayor sensibilidad hipofisaria que en el sujeto de altura. Pero, cuando se comparó los incrementos de FSH durante la infusión, solamente se observó elevaciones significativas de su basal en los sujetos de altura.
Estos hallazgos apoyan el conocimiento de que los sujetos de altura tendrían una mayor reserva hipofisaria que los sujetos de nivel del mar, para FSH, y una menor sensibilidad hipofisaria para LH. Al parecer el sujeto nativo de altura necesita incrementar su reserva hipofisaria para obtener una función gonadal normal. Este fenómeno podría ser posible como un mecanismo de adaptación cuando un sujeto normal de nivel del mar viaja a la altura.
AGRADECIMIENTOS
Los autores agradecen a la Dra. Anne S. Hartree, Departamento de Bioquímica, Universidad de Cambridge, por las hormonas purificadas de LH y FSH; así como también, a la National Pituitary Agency, National Institutes of Health, USPHS, Bethesda, Maryland, por los antisueros de FSH y LH.
Al Consejo Nacional de Ciencia, Tecnología e Innovación Tecnológica (CONCYTEC), Lima, Perú, y la Fundación Alexander von Humboldt, Bonn Bad Godesberg, Alemania, por su colaboración en el presente estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Monge MC, Mori-Chávez P. Fisiología de la reproducción en la altura. An Fac med. 1942;25:34.
2. Monge MC, San Martín M. Nota sobre la azoospermia de carneros recién llegados a la altura. An Fac med.1942;25:58.
3. San Martín J, Castañon J. Aspectos de la fisiología experimental de la reproducción en la altura. An Fac med.1945;28:32.
4. Donayre JR, Guerra-García R, Moncloa F, Sobrevilla LA.
Endocrine studies at high altitude. IV. Changes in semen of men. J Reprod Fert.1968;16:55-8.5. Guerra-Garcia R. Testosterone metabolism in men exposed to high altitude. Acta Endocrin Panam. 1971; 2:55.
6. Sobrevilla LA, Midgley R. The plasma gonadotropina response to acute high altitude exposure. Acta Endocrin Panam.1971;1:47.
7. García-Hjarles MA. Espermatograma y bioquímica seminal de nativos de altura y pacientes con mal de montaña crònica. Arch Biol Med Exp. 1989;22:61.
8. Sobrevilla LA, Romero I, Moncloa F, Donayre J, Guerra-García R. Endocrine studies at high altitude. III Urinary gonadotropins in subjects native to and living at 14,000 feet and during acute exposure of men living at sea level. Acta Endocr (Copenh). 1967;56:369-75.
9. Guerra-García R, Velásquez A, Whitembury J. Urinary testosterone in high altitude natives. Steroids.1965;6:351-5.
10. Garmendia F. Determinación de hormonas proteicas por métodos radioinmunológicos. Rev Peruana Patol.1970;12:3.
11. Garmendia F, Valdivia H, Castillo O, Ugarte N, Garmendia A. Hypothalamo-hypophyso-gonadal response to clomiphene citrate at median high altitude. Horm Metab Res.1982;14:679.
12. Garmendia F, Castillo O, Valdivia H, Ugarte N, Garmendia A. Sensibilidad hipófiso testicular del nativo normal de altura a la administración de hormona liberadora de gonadotropinas. ArchBiol Andina.1985;13:207-11.
13. Leyendecker G, Stock H, Wildt L. Brain and pituitary peptides II. Pulsatile administration of Gn-RH in hypothalamic failure: basic and clinical aspects. Second Ferring Symposium Brain and Pituitary Peptides, Kiel, 1982. Karger,1983.
14. Armstrong SP, Caunt ChJ, Fowkes RC, Tsaneva-Atanasova K, McArdle CA. Pulsatile and sustained gonadotropin-releasing hormone (GnRH) receptor signaling. J Biol Chem. 2010;32:24360-71.
15. Leyendecker G, Wildt L, Hansmann H. Pregnancies following chronic intermittent (pulsatile) administration of Gn-RH by means of a portable pump "Zyklomat". A new approach to the treatment of infertility in hypothalamic amenorrhea. J Clin Endocrinol Metab.1980;55:1214.
16. Skarin G, Nillius SJ, Wibell L, Wide L. Chronic pulsatile low doses Gn-RH therapy for induction of testosterone production and spermatogenesis in a man with secondary hypogonadotropic hypogonadism. J Clin Endocrinol Metab.1982;55:723.
17. Hetzel WD, Castillo O. Pulsatile Gn-RH substitution in hypothalamo-hypogonadotropic men. Acta Endocrinologica.1982;97:86-7.
18. Valk TW, Corley KP, Kelch RP, Marshall JC. Pulsatile gonadotropin-releasing hormone in gonadotropin deficient and normal men: suppression of folliclestimulating hormone responses by testosterone. J Clin Endocrinol Metab.1981;53:185-91.
19. Odell W, Doss GT, Rayford OL. Radioinmunoassay for luteinizing hormone in human plasma or serum: physiological studies. J Clin Invest.1967;46:248-55.
20. Midgley AR. Radioimmunoassay for human follicle-stimulating hormone. J Clin Endocrinol Metab.1967;27:295-9.
21. Hasan SH, Cadwell BV. Radioinmunoassay Methods. Livingstone Edinburg-London: Ed. Kirhank E & Churchill WM,1971.
22. Paredes M, Varea R, Graces G, Avila C, Coy D, Schally A. Pituitary response to luteinizing hormonereleasing hormone analog at sea level and high altitudes. Obstet Gynecol.1982;59:52.
23. Coyotupa J, Llerena LA, Guerra-García R. Respuesta a LH-RH en hombres normales de altura y de nivel del mar.VII Jornadas Peruanas de Endocrinologia. Abstr. Nº 42,1977.Oct.20 – Nov 2.
24. Belchetz PE, Plant TM, Nakai Y, Keogh EJ, Knobil E. Hypophysial responses to continuous and intermittent delivery of hypothalamic gonadotropin releasing hormone. Science.1978;202:631.
Correspondencia:
Dr. Óscar Castillo Sayán
Instituto Nacional de Biología Andina
Av. Alfonso Ugarte 848, Lima 1
Correo: oscar.oculm@gmail.com
Trabajo recibido el 6 de octubre de 2010 y aceptado para publicación el 7 de diciembre de 2010.














