Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Anales de la Facultad de Medicina
versão impressa ISSN 1025-5583
An. Fac. med. v.73 n.3 Lima jul./set. 2012
SECCIÓN BIOQUÍMICA Y NUTRICIÓN
Diversidad genético molecular de cepas de Bacillus thuringiensis con potencial tóxico contra Aedes aegypti
Genetic and molecular diversity of Bacillus thuringiensis strains and insecticidal activity potential against Aedes aegypti
Doris Huerta1, Milagros Chang2,3, Oscar Acosta1
1
Centro de Investigación de Bioquímica y Nutrición (CIBN), Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú2 Universidad Nacional La Molina
3 Maestría en Bioquímica, Unidad de Posgrado, Facultad de Medicina, UNMSM
Resumen
Objetivos: Evaluar la diversidad genético molecular de cepas nativas aisladas de B. thuringiensis tóxicas contra Aedes aegypti, vector del dengue. Diseño: Estudio descriptivo, analítico. Institución: Centro de Investigación de Bioquímica y Nutrición, Facultad de Medicina, UNMSM. Material biológico: Cepas nativas y estándar de B. thuringiensis. Intervenciones: Se extrajo el ADN genómico de 53 cepas nativas y 10 cepas estándar de B. thuringiensis aisladas del suelo de distintas regiones geográficas del Perú. Para el análisis de diversidad, se evaluó secuencias repetitivas de ADN mediante la técnica REP-PCR, siendo visualizados en geles de agarosa teñidos con bromuro de etidio. Se hizo el análisis de clúster con el dendograma de similaridad de cepas estándares y nativas de B. thuringiensis, utilizando programas bioinformáticos. Principales medidas de resultados: Diversidad evaluada mediante los perfiles genéticos (bandas de ADN repetitivas) en geles de agarosa y dendograma de cepas B. thuringiensis. Resultados: Las cepas procedentes de Junín, Huaral, Ica, Cusco, Arequipa y Cajamarca tendieron a formar grupos según procedencia, destacándose dos caracterizadas como potencialmente tóxicas contra Aedes aegypti (de Ica y de Cajamarca); estas muestran el gen cry2 y cry4 (datos no presentados), formando un subgrupo con cepas estándar tóxicas HD-968 y GM 33, las que contienen el gen cry2. Conclusiones: Se observa gran diversidad de cepas nativas de B. thuringiensis procedentes de diferentes lugares del país, con cierta tendencia a formar subgrupos según procedencia geográfica y en relación de similaridad con las cepas B. thuringiensis estándares, algunas con potencial para ser utilizadas contra Aedes aegypti, vector del virus del dengue.
Palabras clave: Bacillus thuringiensis, diversidad, genes cry, técnica REP-PCR.
Abstract
Objectives: To determine the molecular genetic diversity of native B. thuringiensis strains toxic against Aedes aegypti, vector of dengue. Design: Descriptive, analytical study. Setting: Biochemistry and Nutrition Research Center, Faculty of Medicine, San Marcos University, Lima, Peru. Participants: Native and standard strains of B. thuringiensis. Interventions: Extraction of B. thuringiensis genomic DNA from 53 native strains and 10 standard strains isolated from different Peruvian regions soil samples. Diversity was determined by repetitive DNA sequences using REP-PCR technique, visualized in agarose gels stained with ethidium bromide. B. thuringiensis standard and native strains cluster analysis was performed by dendrogram of similarity using bioinformatic programs. Main outcome measures: Diversity of B. thuringiensis strains. Results: Strains from Junin, Huaral, Ica, Cusco, Arequipa, and Cajamarca tended to form groups according to source, highlighting two strains characterized as potentially toxic against Aedes aegypti (Ica and Cajamarca), that presented cry4 and cry2 gene (data not shown), outlining a subgroup or cluster with toxic standard strains HD-968 and GM 33 containing the cry2 gene. Conclusions: A great diversity of B. thuringiensis native strains coming from different regions of the country have a tendency to form sub-groups according to geographical origin and in relation to standard strains, some of them with a bioinsecticidal potential against B. Thuringiensis, vector of dengue.
Key words: Bacillus thuringiensis, diversity, cry genes, REP-PCR.
Introducción
B. thuringiensis es una bacteria ubicua entomopatógena, gram positiva, aeróbica, de la familia Bacillaceae, que se caracteriza por sintetizar un cuerpo paraesporal o cristal de proteínas denominadas δ-endotoxinas o proteínas Cry, con actividad tóxica contra una variedad de insectos vectores de muchas enfermedades metaxénicas que son problemas de salud pública en nuestro medio, como Aedes aegypti, vector del virus del dengue.
Estos cristales se forman durante la esporulación y en ellos reside su actividad tóxica, cuando son ingeridos por larvas de diferentes órdenes de insectos (1-3), como Lepidóptera (polillas y mariposas), Díptera (moscas y mosquitos), Coleóptera (escarabajos) e Himenóptera (abejas y avispas), Homóoptera, Mallophaga (4), e incluso Platyhelminthes, Sarcomastigophora y nematelmintos, mites y protozoarios (1), pero no afecta a los mamíferos (2,3,5).
Dadas las características de B. thuringiensis como agente de control biológico y debido a su presencia cosmopolita, sus esporas han sido aisladas de diversas fuentes, como suelo, agua, hojas de plantas, insectos muertos, productos almacenados y telarañas (6).
La diversidad de B. thuringiensis se manifiesta por la variabilidad de los genes cry y sus respectivas proteínas Cry biotóxicas (18), además de variaciones a lo largo de su genoma, como en las regiones extragénicas repetitivas (REP); por ello, es importante estudiar la diversidad genético molecular para evaluar su potencial bioinsecticida.
La diversidad genética y toxicidad de las cepas de B. thuringiensis difieren con las condiciones geográficas de las diferentes regiones donde las cepas fueron aisladas (7). Dado que cada región es un hábitat diferente, esta podría contener nuevas cepas con potencial tóxico más efectivo para un amplio espectro de insectos. En el Perú, al igual que en otros países, debe establecerse una colección de cepas nativas de B. thuringiensis, porque es importante conocer la distribución de las cepas nativas aisladas de diferentes regiones geográficas de nuestro país, identificar nuevas cepas y evaluar su potencial entomocida, para ayudar al control de vectores de plagas y enfermedades metaxénicas, que en nuestro país aun no han sido controladas. Por lo anterior, nuestro objetivo fue evaluar la diversidad genético molecular de cepas nativas de Bacillus thuringiensis que pueden ser tóxicas contra Aedes aegypti.
Métodos
Las 53 cepas nativas de B. thurigiensis provenientes de muestras de rizósfera de Arequipa, Cajamarca, Cuzco, Lambayeque, Lima (Huaral), Ica, Junín y Tacna, del cepario del laboratorio de Microbiología Ambiental y Biotecnología de la Facultad de Ciencias Biológicas de la UNMSM, fueron identificadas por la presencia de inclusiones paraesporales observadas con microscopio de contraste de fase.
Las 10 cepas estándar de referencia fueron preparaciones liofilizadas proporcionadas por el Ph.D. Alejandro P. Rooney -de Microbiological Genomics and Bioprocessing Research Unit del Departamento de Agricultura de los EE UU (USDA)- al laboratorio de Microbiología Ambiental y Biotecnología de la Facultad de Ciencias Biológicas de la UNMSM, y que aparecen listadas en la tabla 1.
La extracción de ADN genómico de cepas nativas y referenciales de B. thuringiensis fue realizada a partir de cultivos bacterianos crecidos en agitación constante toda la noche, en 50 mL de caldo nutricio; luego, 5 mL de cultivo fue centrifugado a 2 000 rpm por 10 minutos. Se decantó el sobrenadante suave y rápidamente para recuperar el precipitado, el cual fue resuspendido en el líquido sobrante y transferido 200 uL a ependorf. Para aislar el ADN según metodología estándar, se utilizó el protocolo de un kit comercial de preparación de molde para PCR de alta pureza.
En el análisis de diversidad se evaluó secuencias repetitivas de ADN mediante amplificación por PCR de elementos palindrómicos extragénicos repetitivos (REP-PCR) con modificaciones (8). Se utilizó 53 muestras nativas y 10 estándar de ADN genómico de B. thuringiensis. La reacción de amplificación fue realizada con 2,0 uL de buffer 10X, 8,0 uL de dNTPs 2,5 mM, 2 mM MgCl2, 2 uM primers REP-1 y REP-2, 2 U Taq, 1 uL ADN 100 ng/uL, agua Mili Q para completar 20 uL de mezcla de reacción. La secuencia de los primers REP fue la siguiente:
Los elementos REP son regiones de ADN extragénicas repetidas y esparcidas en el genoma de bacterias, de 21-65 pb (9). El REP-PCR emplea oligonucleótidos que reconocen secuencias conservadas REP y las regiones amplificadas corresponden a los segmentos que separan dichas secuencias. Así, el polimorfismo generado dependerá de la variedad en la distribución de las repeticiones y de la distancia entre las secuencias REP dentro del genoma (10-11).
La PCR fue realizada siguiendo el siguiente programa: 4 min a 94ºC, seguido por 40 ciclos de 1 min a 94ºC, 1 min a 45ºC, 2 min a 72 ºC y una extensión final de 10 min a 72ºC.
Los productos de la PCR fueron separados por electroforesis en gel de agarosa al 1,5%, teñidos con bromuro de etidio y visualizadas las bandas en un transiluminador UV.
El análisis de los patrones de bandas REP-PCR obtenidos fueron identificados por sus velocidades de migración específicas en el gel. Se construyó matrices binarias (0/1) para ser comparadas con los patrones; la presencia de una banda fue indicada por uno (1) y la ausencia como cero (0). Una vez obtenida la matriz binaria, se construyó una matriz de distancias genéticas empleadas para construir un dendograma con el algoritmo UPGMA (método de agrupamiento de pares no ponderados con significancia aritmética) (17).
La similaridad entre las cepas fue determinada empleando los coeficientes de Jaccard. El análisis de clúster o agrupamiento fue evaluado en el dendograma generado por el algoritmo UPGMA y representado con el dendograma de similaridad de cepas estándar (n=10) y nativas (n=53) de B. thuringiensis, estimado con los patrones de bandas REP-PCR, utilizando el programa NTSYS (13,17).
Resultados
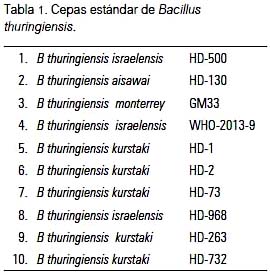
Se evaluó un total de 63 cepas, 10 estándar y 53 nativas, de B. thuringiensis. Los amplificados obtenidos de las secuencias REP contiguas generaron patrones electroforéticos distintivos entre las diversas cepas evaluadas, describiendo un patrón polimórfico; la mayoría de patrones presentó un promedio de 13 a 15 bandas (figura 1), como se observa en el gel de agarosa, tal como ha sido comunicado (8,12-14,16). Estos resultados fueron corroborados cuando se analizó la matriz binaria y se generó el dendograma de similaridad (UPGMA).
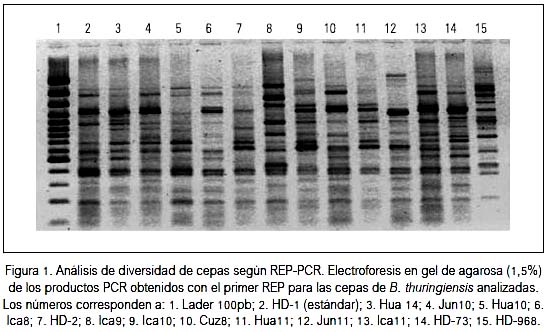
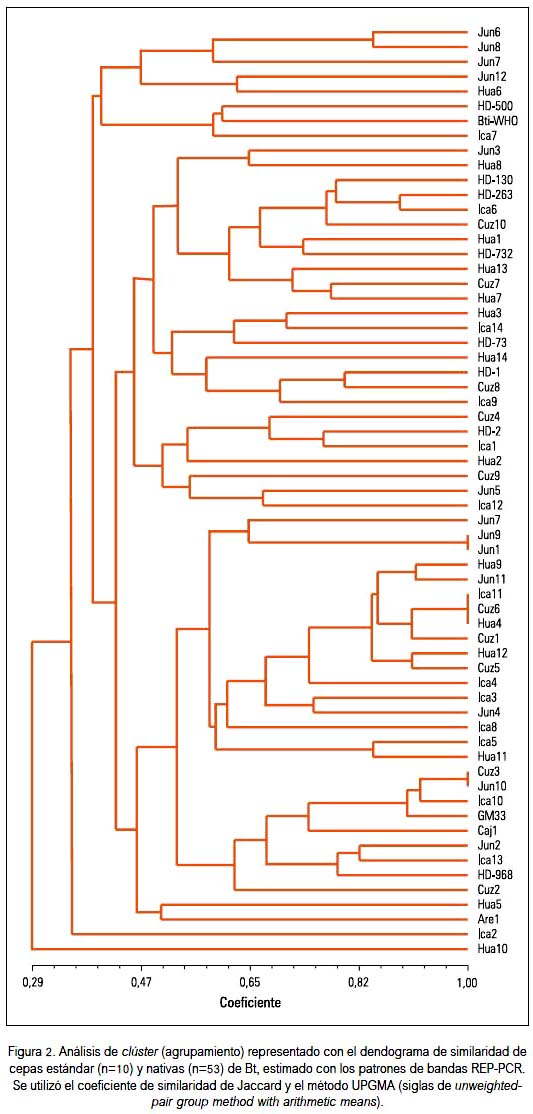
El análisis de clúster representado con su dendograma de similaridad de cepas nativas y estándares de B. thuringiensis basado en los patrones electroforéticos REP, y evaluado con el coeficiente de Jaccard y el método UPGMA, nos muestra, en general, tres grandes agrupamientos o clúster (tabla 2).
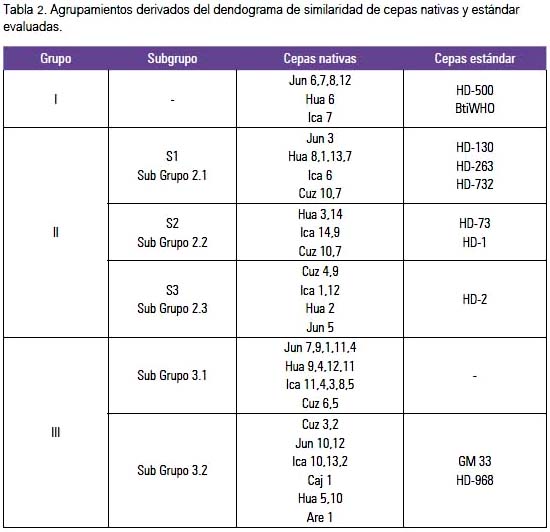
El primer grupo incluyó cepas nativas de Junín (Jun6, Jun7, Jun8, Jun12), Huaral e Ica y cepas estándar HD-500 y Bti-WHO.
El segundo grupo, el más grande y con mayor número de subgrupos, incluyó otras cepas nativas de distinta procedencia, principalmente de Junín, Huaral, Ica y Cusco y las cepas estándar, formando tres subgrupos: el subgrupo HD-130/HD-263/HD-732; subgrupo HD-73; y el subgrupo HD-2.
El tercer grupo incluyó cepas nativas principalmente de Junín, Huaral, Ica, Cusco, Arequipa y Cajamarca, y las cepas estándar HD-968 y GM33, existiendo la particularidad de que el subgrupo más grande solo estaba conformado por cepas nativas; las cepas Are1 y Hua5 fueron las más disímiles entre ellas, y las cepas Jun1 y Jun9 fueron muy similares, así como Ica11, Cuz6 y Hua4, y Cuz3 y Jun10. La cepa Hua10 (Huaral) es la que más se alejó de la similaridad de las cepas de B. thuringiensis estudiadas, conformando una sola rama aislada de los tres grandes agrupamientos.
Destacaron dos cepas caracterizadas como potencialmente tóxicas contra Aedes aegypti (una de Ica y otra de Cajamarca). Formaron un subgrupo o clúster con las cepas estándar tóxicas HD-968 y GM 33, que contienen el gen cry2, y las nativas presentaron los genes cry2 y cry4 (resultados no presentados).
Discusión
B. thuringiensis es una bacteria estrechamente relacionada con las bacterias B. anthracis (agente del ántrax) y B. cereus (patógeno oportunista del humano). El descubrimiento de la actividad biocida de B. thuringiensis sobre larvas de muchos lepidópteros sugirió su uso potencial en el control biológico de insectos plaga; y, más adelante, el hallazgo de B.thuringiensis israelensis (1978) capaz de matar mosquitos, amplió su margen de utilidad en el control de insectos vectores de enfermedades de interés en salud pública. En las siguientes décadas se descubrió nuevas subespecies, encontrándose una gran diversidad, las cuales se han caracterizado por su serotipo H flagelar, o sea por las proteínas presentes en el flagelo, en más de 45 serotipos y 58 serovariedades (4).
El serotipaje ha sido la técnica mejor conocida para identificar y caracterizar cepas de B. thuringiensis, habiéndose identificado 69 serotipos y 82 variedades serológicas (20). Sin embargo, se presentan algunas restricciones, como la incapacidad de procesar cepas no flageladas y diferenciar cepas de B. thuringiensis de algunas B. cereus, impidiendo encontrar relaciones filogenéticas entre los serotipos. Debido a las incongruencias y discrepancias observadas con este método, se hace esfuerzos hacia el desarrollo de técnicas moleculares basadas en la diversidad de su genoma. Técnicas como los PFGE, RFLP, AFLP, PAPDE, REP-PCR, ribotipificación y secuenciación de genes específicos, han mostrado diversos grados de eficiencia en la diferenciación de cepas, además de establecer posibles grupos filogenéticos (8,12-14,18,19). REP-PCR ha sido ampliamente usado en una variedad de especies bacterianas y no bacterianas para identificarlas, caracterizarlas y evaluar su diversidad (14).
El polimorfismo de elementos repetitivos (REP-PCR fingerprint) es un método frecuentemente usado para tipificar bacterias (8), mediante el análisis de la distribución de secuencias de ADN repetitivas en diversos genomas procariotas. El análisis genético de estas secuencias puede revelar distancias y patrones específicos para especies. Las secuencias REP, específicamente, han sido utilizadas en diversos estudios para clasificar y relacionar taxonómicamente especies de B. cereus y ayudar a aclarar la relación genética entre poblaciones de B. cereus y B. thuringiensis (13), así como, para identificación de nuevos aislados de B. thuringiensis (12). Se ha demostrado que esta técnica de REP-PCR es altamente discriminatoria, reproducible, rápida, fácil y capaz de identificar serotipos de B. thuringiensis, que puede convertirse en un procedimiento de caracterización (14).
El análisis REP-PCR de las diversas cepas nativas evaluadas en este estudio mostró patrones de bandas distintivas, como se observa en el gel de agarosa (figura 3), con resultados similares a los encontrados en otras investigaciones (8,12,13).
El análisis de clúster representado en el dendograma de similaridad, tanto de cepas nativas como estándares de B. thuringiensis (figura 4), basado en los patrones REP y evaluado con el coeficiente de Jaccard y el método UPGMA, mostró, en general, tres grandes agrupamientos o clúster.
El primer grupo incluyó a cepas nativas principalmente de Junín (Jun6, Jun7, Jun8, Jun12), Huaral 6 e Ica 7 y las cepas estándar HD-500 y Bti-WHO, relacionadas con actividad tóxica contra dípteros y lepidópteros.
El segundo grupo, el más grande y con mayor número de subgrupos, incluyó a otras cepas nativas de distinta procedencia, principalmente de Junín 3, Huaral (Hua1, Hua2, Hua3, Hua7, Hua8, Hua13 y Hua14), Ica (Ica1, Ica6, Ica9, Ica12 e Ica14) y Cusco (Cuz4, Cuz7, Cuz8, Cuz9, y Cuz10), junto con las cepas estándar que forman el subgrupo HD-130/HD-263/HD-732 -relacionadas con actividad biocida contra dípteros y lepidópteros, exceptuando las cepas HD-130 que por su contenido de gen Cry 8 puede ser tóxica para coleópteros (3)-, el subgrupo HD-73 relacionado con toxicidad frente a dípteros, y el subgrupo HD-1 relacionado con lepidópteros principalmente, pero también tendría actividad frente a mosquitos (7).
El tercer grupo incluyó cepas nativas principalmente de Junín, Huaral, Ica, Cusco, Arequipa y Cajamarca, y las cepas estándar HD-968 y GM33, relacionadas con actividad frente a una variedad de insectos, existiendo la particularidad de que el subgrupo más grande solo estaba conformado por cepas nativas; las cepas Are1 y Hua5 fueron las más disímiles entre ellas, y las cepas Jun1 y Jun9 fueron muy similares, así como Ica11,Cuz6 y Hua4, y Cuz3 y Jun10. La cepa Hua10 (Huaral) fue la que más se alejó de la similaridad de las cepas nativas estudiadas, conformando una sola rama aislada de los tres grandes agrupamientos.
En general, utilizando el análisis REP-PCR, en el presente trabajo se observó una gran diversidad de las cepas nativas de B. thuringiensis procedentes de diferentes lugares de Junín, Huaral, Ica, Cusco, Arequipa y Cajamarca, con cierta tendencia a formar subgrupos según procedencia geográfica y en relación de similaridad con las cepas B. thuringiensis estándares, tal como se comunica en otros trabajos de América (3,14,16).
B. thuringiensis constituye una especie genéticamente diversa. El uso de secuencias de ADN repetitivas, tal como REP para clasificación bacteriana, sigue siendo útil y ofrece una alternativa para tipificar cepas de B. thuringiensis y para reconocer las relaciones filogenéticas entre subgrupos, comparando la posible similitud genética entre diferentes genomas bacterianos (8-13). En esta investigación con cepas peruanas se ha podido correlacionar la similaridad según procedencia geográfica.
El estudio basado en las secuencias REP es realizado para complementar la caracterización molecular de genes cry de cepas nativas peruanas de B. thuringiensis (datos no mostrados); además, se puede comparar los resultados obtenidos con otras características de B. thuringiensis ya conocidas, como la forma del cristal (3,15), pero sobre todo por el contenido de genes, lo cual nos permite identificar preliminarmente la actividad y el potencial larvicida que presentan estas cepas nativas.
Utilizando los marcadores moleculares REP, se observó una gran diversidad de las cepas nativas de B. thuringiensis procedentes de diferentes lugares del país, con cierta tendencia a formar subgrupos según procedencia geográfica y en relación de similaridad con las cepas B thuringiensis estándares, y algunas con potencial biotóxico para ser utilizadas contra Aedes aegypti, vector del dengue, que constituye un problema de salud pública en nuestro País.
Referencias bibliográficas
1. Feitelson JS, Payne J, Kim L. Bacillus thuringiensis: insect and beyond. Nature Biotech. 1992;10:271-5.
2. Ceron J, Ortiz A, Quintero R, Guereca L, Bravo A. Specific PCR primers directed to indentify Cry I and Cry III genes within a Bacillus thuringiensis collection. Appl Environ Microbiol. 1995;61(11):3826-31.
3. Ibarra J, Del Rincón M, Orduz S, Noriega D, Benintende G, Monnerat R, et al. Diversity of Bacillus thuringiensis strains from Latin America with insecticidal againts different mosquito especies. Appl Environ Microbiol. 2003;69(9):5269-74.
4. Schnepf E, Crickmore N, Vanrie J, Leredus D, Baum J, Feitelson J, Zeigler D, Dean DH. Bacillus thuringiensis and its pesticidal crystal proteins. Microbiol Mol Biol Rev. 1998:62:775-806.
5. Maduel P, Armengol G, Llagostera M, Lindow S, Orduz S. Immigration of Bacillus thuringiensis to bean leaves from soil inoculum or distal plant parts. J Appl Microbiol. 2007;102(6):2593-600.
6. Jiménez N, Muñoz C, Gómez I, Saab G, Damian J, Gill S, Soberón M, Bravo A. Bacillus thuringiensis Cry1Ab mutants affecting oligomer formation are non toxic to Manduca sexta larvae. J Biol Chem. 2007;282(29):21222-9.
7. Thomas DJ, Morgan JA, Whipps JM, Saunders JR. Plasmid transfer between Bacillus thuringiensis subsp. israelensis strains in laboratory culture, river, water and dipteran larvae. Appl Environ Microbiol. 2001;67(1):330-8.
8. Versalovic J, Koeuth T, Lupski J R. Distribution of repetitive DNA sequences in eubacteria and application to fingerprint of bacterial genomes. Nucleic Acids Res. 1991;19(24):6823-31.
9. Tobes R, Pareja E. Bacterial repetitive extragenic palindromic sequences are DNA targets for insertion sequence elements. BMC Genomics. 2006:7:62.
10. Fernández-Cuenca F. Aplicaciones de las técnicas de PCR a la epidemiología molecular de las enfermedades infecciosas. Enf Infec Microbiol Clin. 2004;22:355-60.
11. Vilchez G, Alonso G. Alcances y limitaciones de los métodos de epidemiología molecular basados en el análisis de ácidos nucleicos. Rev Soc Ven Microbiol. 2009;29(1):6-12.
12. Lima ASG, Guidelli AM, Abreu IL, Lemos MVF. Identification of new isolates of Bacillus thuringiensis using rep-PCR products and δ-endotoxin electron microscopy. Genet Mol Biol. 2002;25(2):225-9.
13. Peruca AP, Vilas-Boas GT, Arantes OMN. Genetic relationships between sympatric populations of Bacillus cereus and Bacillus thuringiensis, as revealed by rep-PCR genomic fingerprinting. Mem Inst Oswaldo Cruz. 2008;103(5):497-500.
14. Reyes-Ramirez A, Ibarra J. Fingerprinting of Bacillus thuringiensis Type Strains and Isolates by using Bacillus cereus Group-Specific Repetitive Extragenic Palindromic Sequence-Based PCR Analysis. Appl Environ Microbiol. 2005;71(3):1346-55.
15. Flores A, Woolcott J, Egúsquiza R, Patiño A, Huerta D, García F. Biodiversidad de Bacillus thuringiensis patotipos II y IV Bacillus sphaericus aislados de suelos agrícolas peruanos. Biotempo. 2010;10:57-70.
16. Sauka D, Basurto-Ríos R, Ibarra J, Benintende G. Characterization of an Argentine Isolate oa Bacillus thuringiensis Similar to tha HD-1 Strain. Neurotrop Entomol. 2010;39(5):767-73.
17. Backeljau T, De Bruyn L, De Wolf H, Jordaens K, Van Dongen S, Winnepennincks B. Multiple UPGMA and neighbor-joining trees and the performance of some computer packages. Mol Biol Evol. 1996;13(2):309.
18. Ibarra J. Diversidad de Bacillus thuringiensis y su implicación en el rango de toxicidad. (Conferencia inaugural) Memorias del XXV Congreso Nacional de Entomología. Sociedad Chilena de Entomología. Talca, Chile 2003:1.
19. Lyndsay R, Agron P, Hill K, Jackson P, Ticknor L, Keim P, Andersen G. Genome differences that distinguish bacillus anthracis from Bacillus cereus and Bacillus thuringiensis. Appl Environ Microbiol. 2003;69(5):2755-64.
20. Xu D, Coté JC. Sequence diversity of the Bacillus thuringiensis and B. cereus sensu lato flagellin (H antigen) protein: comparison with H serotype diversity. Appl Environ Microbiol. 2006;72(7):4653-62.
Fuente de financiamiento: Recursos propios e infraestructura del CIBN
Correspondencia:
Magister Doris Huerta Canales
Laboratorio de Biología Molecular
Centro de Investigación de Bioquímica y Nutrición
Facultad de Medicina, UNMSM, Lima, Perú.
Correo: dorishuerta@yahoo.com













