Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Anales de la Facultad de Medicina
versão impressa ISSN 1025-5583
An. Fac. med. vol.76 no.2 Lima abr./jun. 2015
http://dx.doi.org/dx.doi.org/10.15381/anales.v76i2.11146
ARTÍCULO DE REVISIÓN
Melanoma en la región de cabeza y cuello
Melanoma in the head and neck region
Francisco Avello Canisto1,2,a, Allan Avello Peragallo2,b
1 Médico Asistente, Servicio de Cirugía de Cabeza, Cuello y Máxilo-Facial, Hospital Nacional Dos de Mayo, Lima, Perú.
2 Departamento de Cirugía, Universidad Nacional Mayor de San Marcos, Lima, Perú.
a Docente; b Profesor Principal
Resumen
El melanoma es una neoplasia maligna producto de la degeneración y atipia del melanocito (célula formadora del pigmento melanina). Al melanocito lo encontramos en la piel (capa basal de la epidermis), globo ocular (membrana coroidea) y sistema nervioso central (piamadre). La localización en cabeza y cuello, representa el 30% de todos los melanomas en general, después de las extremidades inferiores y superiores, y más de las dos terceras partes se localizan en la piel de la cara. Menos frecuente es su origen en las membranas mucosas (fosas nasales, cavidad oral, conjuntivas), donde generalmente carece de melanina. Hay casos reportados de melanoma intraocular y de glándula salival submaxilar, pero su presentación es muy rara.
Palabras clave: Melanoma, niveles de Clark, profundidad de Breslow.
Abstract
Melanoma consists in malignant degeneration and atypia of melanocytes (melanin pigment forming cells). Melanocytes are found in skin (basal layer of epidermis), eye (choroid membrane) and central nervous system (pia mater). Location in head and neck represents 30% of all melanomas, following upper and lower extremities localization, and over two-thirds are located in the skin of the face. Origin in the mucous membranes (nose, oral cavity, and conjunctiva) is less common and usually lacks melanin. There are reports of intraocular and submandibular salivary gland melanomas, but these presentations are very rare.
Keywords: Melanoma, Clark's level, Breslow's depth.
INTRODUCCIÓN
El melanoma es una neoplasia que se origina más frecuentemente en la piel clara, que tiene intolerancia a los rayos solares. Los factores hormonales son importantes en la etiología del melanoma, ya que su incidencia tiende a aumentar después de la pubertad y exacerba su desarrollo durante la gestación. El 30% de los melanomas se originan de un nevus o ‘lunar’ preexistente (nevus dermo-epidérmico o de unión), de estos aproximadamente la tercera parte son congénitos. El traumatismo continuo en los lunares de la cara, al afeitarse por ejemplo, tiene rol etiológico importante. En raras ocasiones hay casos de regresión parcial/total de la lesión como áreas despigmentadas dentro de un melanoma de extensión superficial o en zonas donde hubo una lesión pigmentada (1-3).
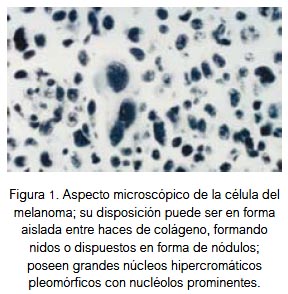
Los melanocitos atípicos tienen grandes núcleos hipercromáticos pleomórficos, con nucléolos prominentes; su disposición puede ser en forma aislada entre haces de colágeno, formando nidos o dispuestos en forma de nódulos (figura 1). La mayoría de melanomas los encontramos en la piel y son pigmentados; sin embargo existen melanomas no pigmentados o amelanóticos y también de localización en mucosas y vísceras.
La incidencia del melanoma se ha incrementado en diferentes poblaciones, principalmente por factores ambientales que desencadenan el desarrollo de la lesión en poblaciones más susceptibles genéticamente. La exposición exagerada a radiaciones solares que contienen rayos ultravioleta, fototipos de piel I y II, enfermedades autoinmunes y la inmunodepresión son factores de riesgo. Australia es uno de los países con más alta incidencia de melanoma. Un estudio realizado en Queensland, entre 1993 y 1997 registró 51,1 casos anuales por cada 100 000 varones y 38,1 casos anuales por cada 100 000 mujeres. En EE UU, la incidencia se estima en 34 casos por cada 100 000 habitantes. En Italia, entre 1992 y 1997 se registraron más de 100 casos por millón de habitantes; mientras que en Japón, entre 1964 y 1995, se registró una incidencia anual de 2 casos por millón de habitantes. En nuestro país, en el Instituto Nacional de Enfermedades Neoplásicas (INEN), entre los años 1985 y 1997 se registraron 902 casos (1,1% del total de cánceres) (4).
Parte del presente trabajo fue la revisión de 17 historias clínicas de pacientes portadores de melanoma en la región de cabeza y cuello (Servicio de Cirugía de Cabeza y Cuello del Hospital Nacional Guillermo Almenara Irigoyen, 1968 a 2002) (2,3), de los cuales el 70% se localizó en piel, 18% en mucosas (cavidad oral, nasal, conjuntiva) y 12% de localización visceral (ojo, glándula submaxilar). El 72% se presentó en el sexo masculino, siendo 88% de raza mestiza. Su mayor incidencia (57%) estuvo entre los 40 y 70 años de edad. Todos los pacientes fueron sometidos a tratamiento quirúrgico radical con diagnóstico anatomopatológico de melanoma y posteriormente tratamiento complementario radioterápico y/o quimioterápico.
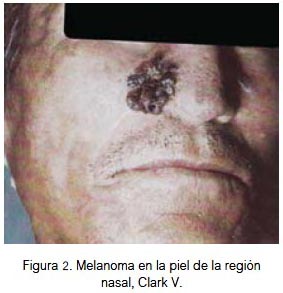
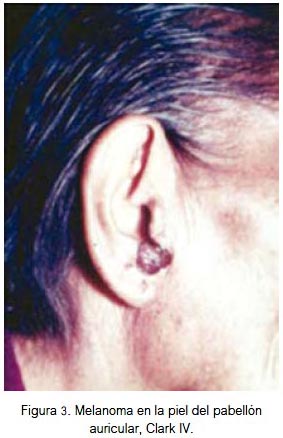
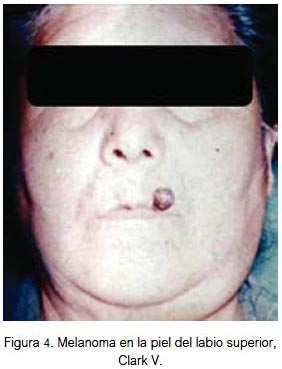
En piel, el 25% se localizó en la región nasal (figura 2), 25% región auricular (figura 3), 17% región labial (figura 4), 17% región geniana, 8% región palpebral y 8% región occipital. El 84% fueron lesiones pigmentadas (color negro) y 16% amelanóticas. Su diámetro varió entre 3 y 40 mm; todos fueron de tipo nodular y 70% ulcerados. Todas las lesiones fueron apilosas, de bordes irregulares, el 25% presentó prurito y el 35% tuvo lesión pigmentada previa. Las lesiones correspondieron a nivel III, IV y V de Clark. El 25% de los pacientes falleció (nivel V de Clark).
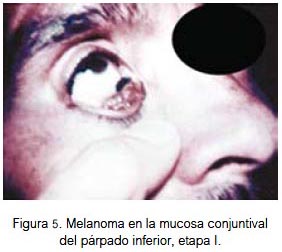
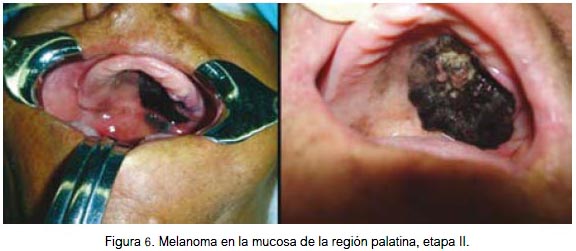
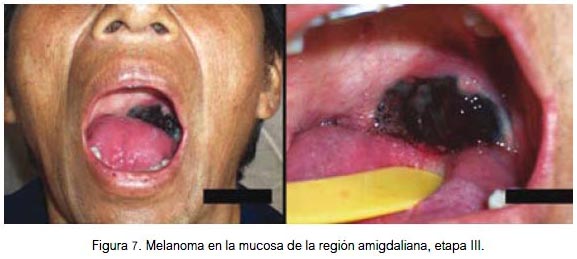
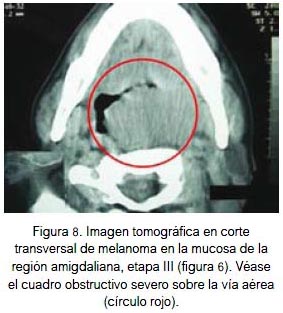
En mucosa se localizó por igual a nivel de la fosa nasal, conjuntiva palpebral (figura 5) y cavidad oral (figuras 6, 7 y 8). Todas fueron lesiones pigmentadas (color negro). A nivel palpebral se presentó como una lesión nodular. La ulceración se evidenció en fosa nasal. Correspondieron a etapa I (palpebral) y II (nasal y bucal) de la clasificación para lesión mucosa. Los tres pacientes fallecieron.
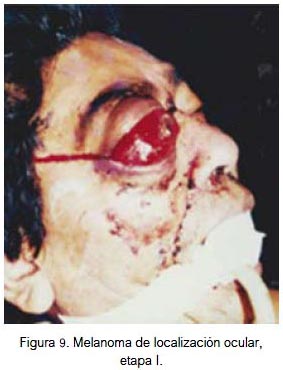
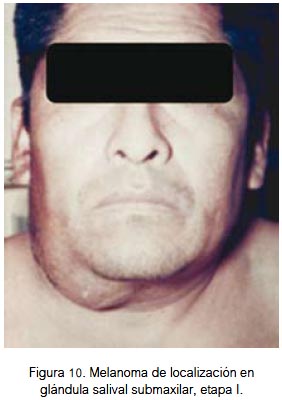
En vísceras se localizó a nivel del globo ocular (figura 9) y de la glándula submaxilar (figura 10). Ambas fueron lesiones pigmentadas (color negro). Se evidenció lesión ulcerada en el globo ocular. Correspondieron a etapa I de la clasificación para lesión mucosa (aplicable a lesión visceral). Los dos pacientes fallecieron.
CLÍNICA
Generalmente el melanoma se presenta como una lesión pigmentada, cuyo aspecto distintivo es el color oscuro (marrón, azulado o negro), dependiendo de la concentración del pigmento (pudiendo variar el mismo dentro de la misma lesión). Pero, el melanoma puede ser amelanótico, es decir sin pigmentación, de aspecto granulomatoso, rojizo (1,2).
Hay tres tipos clínicamente definidos de melanoma cutáneo. El melanoma superficial es la variedad más común, le sigue el melanoma nodular, siendo el melanoma lentigo maligno menos común, aunque algunas publicaciones lo consideran como el más frecuente en cabeza y cuello.
Cuando exista una lesión pre-melanoma o ‘lunar’, se debe tener en cuenta los cambios que ocurren para su transformación, como son, aumento de tamaño, variación del color, ulceración, sangrado y prurito. El crecimiento de la lesión es tridimensional, pero predomina en una dirección, la misma que dependerá del tipo de melanoma (1).
Para determinar la extensión de la enfermedad, los estudios auxiliares de utilidad son las radiografías pulmonares y óseas, la gammagrafía hepática y ósea, necesarias para detectar metástasis a distancia, así como la tomografía espiral multicorte y la resonancia magnética. Debemos tener en cuenta el estudio del ganglio centinela, que es el primer ganglio o grupo de ganglios que reciben el drenaje linfático de un tumor primario, es decir, el ganglio con las máximas probabilidades de albergar una metástasis inicial. Es importante también la determinación de pigmentos melánicos en orina (1,2).
CLASIFICACIÓN
Para determinar el crecimiento y extensión en profundidad del melanoma cutáneo, se aplica la clasificación por niveles de Clark (analiza los niveles anatómicos en profundidad que invade la lesión de la piel, desde la epidermis hasta el tejido celular subcutáneo) y por profundidad de Breslow (mide la profundidad de la lesión en milímetros: desde menos de 0,75 mm hasta más de 4 mm). Ambas clasificaciones constan de cinco grupos cada una. A mayor profundidad peor pronóstico, teniendo presente que el grosor de la piel donde se encuentra la lesión varía según sea su localización. También se aplica la clasificación T-N-M (tumor primario, invasión ganglionar regional y metástasis a distancia). De acuerdo a esta se puede agrupar por estadios del I al IV. El melanoma mucoso, desde el punto de vista clínico, se agrupa en tres etapas (localizado, extensión a ganglios regionales y enfermedad metastásica a distancia), las mismas que pueden considerarse para el melanoma visceral (intraocular, glándula salival, etc.) (3).
CLASIFICACIÓN HISTOPATOLÓGICA POR NIVELES De CLARK:
-
Nivel I: (in situ) la lesión melanótica es intraepidérmica y se encuentra por encima de la capa basal.
-
Nivel II: (nivel dérmico papilar) el tumor atraviesa la capa basal e invade la dermis superficial o papilar sin alcanzar la dermis reticular.
-
Nivel III: (nivel dérmico papilar-reticular) el melanoma invade toda la dermis papilar y llega al límite con la dermis reticular sin invadirla.
-
Nivel IV: (nivel dérmico reticular) el melanoma invade la dermis reticular extensamente.
-
Nivel V: (nivel subcutáneo) existe la extensión del melanoma hasta el tejido celular subcutáneo.
CLASIFICACIÓN TUMORAL SEGÚN ESPESOR O PROFUNDIDAD DE BRESLOW:
-
Menor de 0,75 mm de profundidad.
-
De 0,75 a 1,5 mm de profundidad.
-
De 1,51 a 3 mm de profundidad.
-
De 3,01 a 4 mm de profundidad.
-
Más de 4 mm de profundidad.
ETAPAS CLÍNICAS DEL MELANOMA MUCOSO Y VISCERAL:
-
Etapa I: Melanoma localizado.
-
Etapa II: Melanoma con extensión a ganglios regionales.
-
Etapa III: Melanoma con enfermedad metastásica a distancia.
TRATAMIENTO
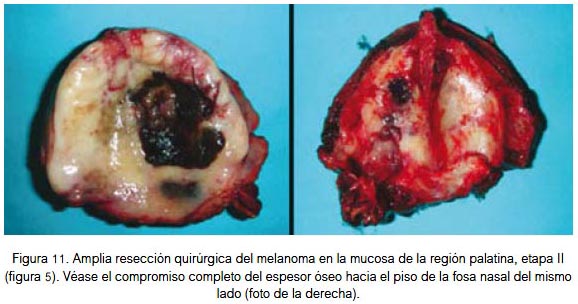
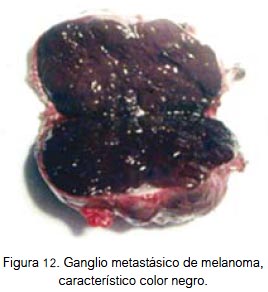
El tratamiento principal del melanoma es la cirugía local amplia o radical (figura 11), dependiendo de sus dimensiones y localización. En piel, la resección en superficie debe comprender un margen de tejido sano de hasta 3 cm para lesiones menores de 3 cm de diámetro, y de hasta 5 cm para lesiones de mayor diámetro; el margen de resección en profundidad debe incluir la aponeurosis y deberá ser mayor que en la superficie. En localización visceral, la cirugía indicada es la resección total del órgano afectado. La disección radical de cuello se realiza complementariamente en presencia de metástasis ganglionares cervicales. En raros casos hay metástasis ganglionar sin evidencia de enfermedad localizada; esto puede deberse a que la lesión primaria está en una zona poco o nada visible, o que en lugar de la lesión primaria se evidencie una zona cicatricial, en la que hubo anteriormente una lesión névica (melanoma) que el sistema inmune se encargó de destruir oportunamente. Pero, antes de lograr por completo esta acción ya había focos de micrometástasis ganglionar (de manifestación clínica posterior). Puede darse el caso de algún paciente al que se le extirpa un nevus, aparentemente benigno, el que por error no es enviado a estudio anátomo patológico, y que posteriormente el mismo paciente acuda con metástasis cervicales sin evidencia de lesión primaria, salvo la cicatriz operatoria y el antecedente del nevus. En algunas oportunidades se encuentran lesiones satélite o metástasis en tránsito (masas tumorales separadas del componente dérmico de la neoplasia primaria, por tejido colágeno), las primeras son las localizadas hasta a 5 cm de la lesión primaria, y las metástasis en tránsito son las ubicadas a más de 5 cm de la lesión primaria (en dirección del drenaje linfático). Se debe tener presente que el ganglio linfático metastásico del melanoma es de color negro (figura 12), sea o no pigmentada la lesión primaria (1-3).
En ocasiones, los melanomas localizados, resecables en su totalidad, son biopsiados o peor aún cauterizados pensando que son lesiones benignas, logrando con esta conducta su extensión y diseminación.
Como tratamiento complementario, la radioterapia es usada con buenos resultados, observándose el control e incluso la regresión local del tumor y de la enfermedad regional. En caso que la lesión primaria sea demasiado grande, puede aplicarse radioterapia previa a la cirugía, con la finalidad de reducir la tumoración, para posteriormente realizar una cirugía menos mutilante y más conservadora. La quimioterapia determina una mejora en la sobrevida del paciente, con agentes quimioterápicos adecuados y combinándolos entre ellos, especialmente en melanoma metastásico. La inmunoterapia en pacientes inmunocompetentes ha demostrado ser útil en el tratamiento del melanoma, especialmente en tejidos blandos y en menor proporción en las metástasis viscerales; se emplea la vacunación con BCG o la aplicación de interferones (alfa, beta, gamma), esta última en mayor uso actualmente. Se están usando tratamientos combinados de interferones con agentes quimioterápicos, interferones entre sí, interferones con interleuquina-2, interferones con factor de necrosis tumoral, interferones con anticuerpos citotóxicos, interleuquina-2 con agentes quimioterápicos. Aunque no se precisan cifras estadísticas concluyentes, los resultados obtenidos son alentadores. La interleuquina-2 tiene acción indirecta sobre el melanoma, estimula la actividad citotóxica del linfocito T sobre las células tumorales, a diferencia de los interferones que tienen acción directa sobre la neoplasia. Se ha observado regresión de las lesiones cutáneas, especialmente cuando se aplica intralesional, pero con menor efectividad en las metástasis o en las lesiones viscerales. Se considera que la falla del sistema inmune condiciona el crecimiento progresivo del tumor y la aparición de metástasis regionales (como ocurriría con el resto de neoplasias malignas) (1-3).
PRONÓSTICO
El pronóstico del melanoma es peor que el de cualquier otra neoplasia maligna, dependiendo de su extensión. Tiene un alto poder metastatizante; esto dependerá también de la localización anatómica y grosor de la piel o tejido en el que se encuentre. El melanoma mucoso es de peor pronóstico que el cutáneo; no se puede determinar con exactitud si esto se debe al diagnóstico tardío por la localización o se debe a patrones histológicos propios. La sobrevida a cinco años en los pacientes con nivel Clark I y II es mayor del 85%, para el nivel III es de aproximadamente 70%, para el nivel IV 55% y para el nivel V cerca de 10%. En estudios recientes se ha relacionado la sobrevida con el espesor del tumor, siendo la sobrevida a cinco años de 100% para los tumores menores de 0,75 mm de espesor; esta cifra se redujo marcadamente cuando la lesión tenía más de 1,5 mm. Tanto para el melanoma mucoso como para el visceral, cinco años de sobrevida es demasiado, a pesar que clínicamente sea una lesión limitada y que quirúrgicamente se logre un control local de la neoplasia.
CONCLUSIONES Y RECOMENDACIONES
El melanoma se origina más frecuentemente en la piel clara, con intolerancia a los rayos solares. Tiene mayor incidencia en el sexo masculino y por encima de los 40 años de edad. En cabeza y cuello representa el tercer lugar en presentación de todo el cuerpo; más de las dos terceras partes se originan en la piel de la cara. Aproximadamente la tercera parte de los melanomas cutáneos se originan de un nevus pre-existente, de estos la tercera parte se presenta desde el nacimiento. En general, tanto para la evolución como para el pronóstico de la enfermedad, son importantes los siguientes factores: el nivel de invasión Clark, el espesor Breslow, el tipo clínico del melanoma con su respectivo patrón de crecimiento histológico, la ubicación del melanoma, ulceración (mayor de 3 mm de diámetro tiene mal pronóstico) y el número de mitosis. El promedio de curación para un melanoma cutáneo de extensión superficial es cercano al 75%, para el melanoma lentigo maligno aproximadamente 60% y para el melanoma nodular es menor de 50%. Debemos tener en cuenta que una recurrencia de la enfermedad (local o regional) empeora el pronóstico y aumenta el riesgo de metástasis a distancia. De igual manera, cuando se evidencian lesiones satélite, el pronóstico empeora.
El informe anátomo-patológico ideal es el que considera el espesor de la lesión, índice mitótico y márgenes de la lesión.
REFERENCIAS BIBLIOGRÁFICAS
1. Avello A. Cirugía de Cabeza, del Cuello y Maxilofacial. Lima: MAD Corp SA.; 2002.
2. Avello A, Avello F. Melanoma en Cabeza y Cuello. XV Congreso Peruano de Cirugía de Cabeza, Cuello y Máxilo-Facial y VIII Congreso Sudamericano de Cirugía de Cabeza y Cuello, tema libre. Lima, 1 al 3 de Noviembre del 2002.
3. Avello F. Melanoma maligno en la región de cabeza y cuello: número de casos reportados en el Servicio de Cirugía de Cabeza y Cuello del Hospital Nacional Guillermo Almenara Irigoyen (IPSS-Lima), 1968 - 1993. Tesis para optar el Título de Médico-Cirujano. Universidad Particular San Martín de Porres, Facultad de Medicina. Lima, 1996.
4. Lozano N, Ramos W, Galarza C, Cerrillo g, Tello M, Gutiérrez E. Melanoma cutáneo y mucoso: epidemiología, características clínicas y metástasis a distancia en un hospital de Lima-Perú. Período 1996-2007. Dermatología Peruana. 2009;19(4):316-23.
5. Villarreal P, Mateo J, Alvarez C, rodríguez E, Fernández A, Morillo A. Tratamiento de los melanomas cutáneos de la cabeza y el cuello. Estado actual. Rev Esp Cirug Oral y Maxilofac Madrid. 2005 julago;27(4):183-95.
6. Camus M. Cáncer de piel y melanoma de cabeza y cuello. Manual de Patología Quirúrgica de Cabeza y Cuello. Pontificia Universidad Católica de Chile. Disponible en: http://www.escuela.med.puc.cl/publ/manualCabezaCuello/CancerPiel/html.
7. Yánez N, Pinto D, Landázuri L. Manejo del melanoma en mucosa de cabeza y cuello. Oncología. 2006;16(1):57-61.
8. González O. Melanomas de cabeza y cuello. Un tema siempre polémico. Rev Argent Cir. 2013 jun;104(2):65-75..
9. Billings K, Wang M, Sercarz J, Fu y. Clinical and pathologic distinction between primary and metastatic mucosal melanoma of the head and neck. Otolaryngol Head Neck Surg. 1995;112(6):700-6.
10. Gutman M, Inbar M, Chaitchik S, Merhav A, Pausner D, Skoznik Y. Malignant melanoma of the mucous membranes. Eur J Surg Oncol. 1992;18(4):307-12.
11. García-rozado A, Villarreal P, Mayor M. Melanoma de cabeza y cuello. Protocolos clínicos de la Sociedad Española de Cirugía Oral y Maxilofacial. Disponible en: http://www.secom.org/web/wpcontent/uploads/2014/01/cap41.pdf.
12. Cascinelli N, Belli F. Treatment of regional nodes. Semin Surg Oncol. 1992;8(6):370-3.
13. Friedman R, Rigel D, Kopt A. Cáncer de piel. Buenos Aires, Argentina: Edit Med Panamericana S.A. 1993:163-218.
14. Tocornal F, Krause F, Bermeo J, Mercado V, González P, Cevo T. Melanoma de mucosa en cabeza y cuello. Rev Otorrinolaringol Cir Cabeza y Cuello Valparaíso-Chile. 2004;64:183-9.
15. Younes M, Myers J. Melanoma of the head and neck: Current concepts in staging, diagnosis and management. Surg Oncol Clin N Am. 2004;13:201-29.
16. Medina-Franco H, Beebken S, Heslin M, Urist M. Sentinel node biopsy for cutaneous melanoma in the head and neck. Ann Surg Oncol. 2001;8:716-9.
17. Pandey M, Mathew A, Iype E, Sebastian P, Abraham E, Nair K. Primary malignant mucosal melanoma of the head and neck region: pooled analysis of 60 published cases from India and review of literature. Eur J Cancer Prevention. 2002;11:3-10.
18. Lazos M, Suárez N, López L. Melanoma extra-cutáneo de cabeza y cuello. Estudio clínico-patológico de 19 casos. Rev Med Hosp Gen Mex. 2001;64(3):131-6.
19. Solidoro S. Quimioterapia del cáncer. Instituto Nacional de Enfermedades Neoplásicas. 1ra. Edición, Edit. Monterrico S.A. Lima-Perú. 1994;385-90.
20. Yeilding N, Gerstten C, Kirkwood J. Analysis of specificity of a melanoma-reactive monoclonal antibody produced by a human B-cell line. Am Assoc Cancer res. 1991;32:A1441.
21. Carlson J, Dickersin g, Sober A, Barnhill r. Desmoplastic neurotropic melanoma. A clinic pathologic analysis of 28 cases. Cancer. 1995;75(2):478-94.
22. Oxford clinical communications or Schering Plough International. Advances in the treatment of melanoma. Brigitte Dréno, Editor. Oxford-UK, 1995.
Artículo recibido el 5 de agosto de 2014 y aceptado para publicación el 27 de octubre de 2014.
Conflictos de intereses: Los autores niegan que existan conflictos de intereses.
Correspondencia:
Dr. Francisco Avello Canisto
Servicio de Cirugía de Cabeza, Cuello y Máxilo-Facial, Hospital Nacional Dos de Mayo Parque de la Medicina,
Av. Grau s/n (altura cuadra 13), Barrios Altos, Lima 1, Perú
Correo electrónico: favelloc@hotmail.com














