INTRODUCCIÓN
En el Perú, el cáncer de mama constituye la neoplasia más frecuente en mujeres y el sexto tipo de cáncer más letal en la población general 1, con una incidencia anual estimada de 28 casos por cada cien mil habitantes y una tasa de mortalidad anual de 9,2 por cada cien mil habitantes, siendo además responsable de la pérdida de 27929 años de vida saludable, principalmente por su componente de muerte prematura 2. La sobreexpresión del receptor del factor epidérmico humano (HER2), una tirosina quinasa de membrana cuya activación promueve la proliferación y supervivencia celular, ocurre en un 20%-30% de los cánceres de mama y se asocia con tumores más agresivos, con mayor tasa de recurrencia y mayor mortalidad 3,4.
El desarrollo e implementación de una guía de práctica clínica (GPC) constituye una herramienta valiosa para mejorar la calidad de cuidado y promover el cambio de comportamiento profesional relacionado con la atención de salud 5,6. En ese sentido, la Sociedad Peruana de Cancerología conformó un equipo multidisciplinario con el propósito de elaborar una GPC que brinde a los profesionales de salud recomendaciones basadas en la mejor evidencia disponible para orientar las decisiones sobre el diagnóstico y tratamiento del cáncer de mama HER2+, contribuyendo a disminuir la mortalidad, morbilidad, mejorar el pronóstico y calidad de vida de la población afectada.
METODOLOGÍA
La metodología de elaboración de la GPC se describe con detalle en el material suplementario que acompaña a la presente publicación. Así, se conformó un grupo elaborador compuesto por un panel de metodólogos y especialistas clínicos quienes suscribieron previamente una declaración de conflictos de interés, se formuló preguntas clínicas relevantes según juicio clínico y priorizó desenlaces importantes para la toma de decisiones, se realizó una búsqueda de GPC similares al tópico de interés en PubMed y organismos elaboradores o recopiladores de GPC, y se evaluó la calidad metodológica de las GPC identificadas mediante AGREE II. Las recomendaciones de las GPC identificadas fueron analizadas y discutidas por el panel de especialistas sobre la base de la pertinencia de la recomendación y la adaptación a diferentes elementos del contexto de implementación, particularmente sobre el balance entre beneficios y riesgos, costos y uso de recursos, valores y preferencias de los pacientes. Para cada etapa de la elaboración de la GPC, se siguieron los lineamientos propuestos por el Ministerio de Salud del Perú 7.
RECOMENDACIONES
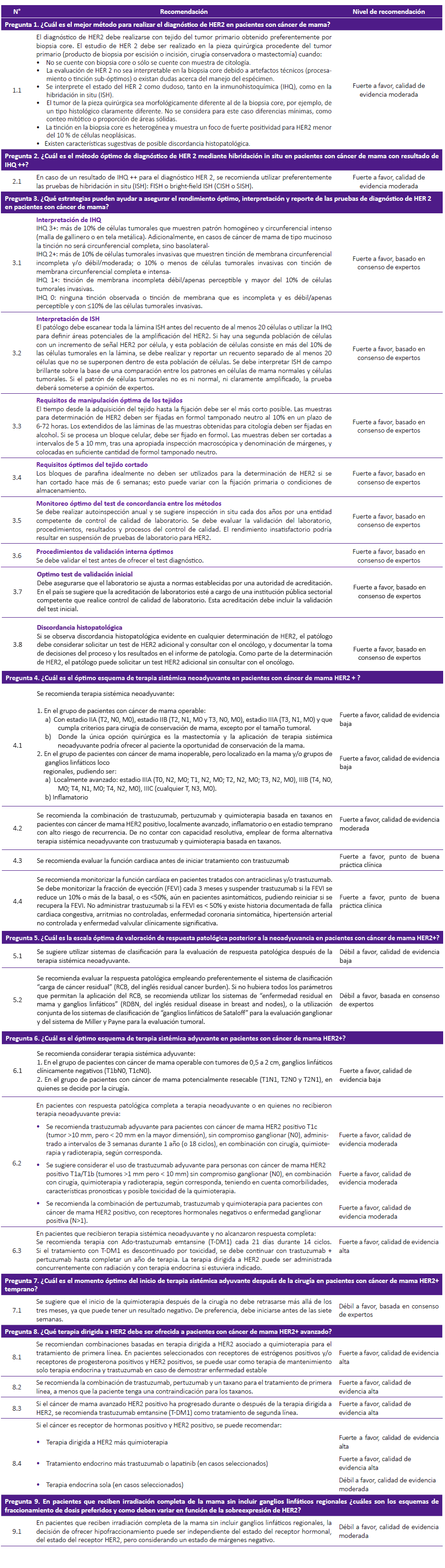
Se priorizaron nueve preguntas clínicas: tres preguntas de diagnóstico y seis preguntas de tratamiento de cáncer de mama HER2+. Se formuló un total de 25 recomendaciones clínicas. Ocho GPC, elaboradas por NCCN 8, ASCO 9, NICE 10, ASCO/CAP 11, ASTRO 12, IETSI 13, ESMO 14 y SIGN 15 sirvieron como insumo principal para la elaboración de la presente GPC Tabla 1.
Proceso de formulación de recomendaciones
Pregunta 1. ¿Cuál es el mejor método para realizar el diagnóstico de HER2 en pacientes con cáncer de mama?
Se identificaron tres GPC que aportaron elementos para responder a la pregunta de investigación. ASCO 9 e IETSI 13 establecieron que el tejido del tumor primario puede obtenerse por biopsia core o de la pieza quirúrgica procedente del tumor primario mediante biopsia por escisión o incisión, cirugía conservadora, o mastectomía. SIGN 15 indicó que en caso no contar con biopsia core o contar sólo con muestra de citología, se puede evaluar el estado de HER2 en la pieza quirúrgica, debiendo repetir la prueba en caso de dudas en su confiabilidad o representatividad. IETSI 13 coincidió con la recomendación de SIGN 15.
Recomendación
El panel de especialistas clínicos, recomienda por consenso utilizar preferentemente biopsia core por ser menos traumática e invasiva, permitir una recuperación más rápida, ser un procedimiento conocido y empleado por los especialistas, y no requerir sala quirúrgica, equipos o mayor cantidad de personal.
Pregunta 2. ¿Cuál es el método óptimo de diagnóstico de HER2 mediante hibridación in situ en pacientes con cáncer de mama con resultado de inmuno-histoquímica (IHQ) ++?
Se identificaron tres GPC que aportaron elementos para responder a la pregunta de investigación. ASCO 9 recomendó ante un resultado ambiguo (IHQ++) solicitar pruebas de hibridación in situ (ISH) en la misma muestra o en una muestra nueva, ya sean cromogénicas (CISH o SISH) o con fluorescencia (FISH). Adicionalmente, ESMO 14 sostuvo que las pruebas de ISH pueden reemplazar a la IHQ para evaluar el estado de HER2. La GPC de IETSI desarrolló una actualización de evidencias que demuestra, en general, una buena concordancia entre FISH y CISH, o SISH, aunque destaca que ASCO 9 sugiere precaución con el uso de pruebas cromogénicas.
Recomendación
En la discusión del panel de especialistas, se sostuvo que FISH ha mostrado alta sensibilidad y especificidad para la detección de HER2, con menor variabilidad entre observadores. Sin embargo, es una prueba más laboriosa, cara, y requiere un microscopio de campo oscuro, por lo cual debe admitirse la posibilidad de emplear alternativamente CISH o SISH.
Pregunta 3. ¿Qué estrategias pueden ayudar a asegurar el rendimiento óptimo, interpretación y reporte de las pruebas de diagnóstico de HER2 en pacientes con cáncer de mama?
Se identificaron dos GPC que aportaron elementos para responder a la pregunta de investigación. ASCO 9 planteó medidas relacionadas con la inclusión de controles, métodos de evaluación de laboratorio apropiados, validación de la metodología de los ensayos estandarizados, establecimiento de un número mínimo de casos evaluados por año, y cumplimiento de principios generales de fijación y manejo de muestras, como medidas para el aseguramiento de la calidad del diagnóstico de HER2. IETSI 13 desarrolló una búsqueda actualizada ratificando la validez de estas recomendaciones.
Recomendaciones
El panel de especialistas consideró adecuadas todas las recomendaciones. Sin embargo, decidió extender la recomendación sobre la definición de IHQ +++ incluyendo la tinción basolateral en el caso de cáncer de mama de tipo mucinoso, así como la precisión sobre los requisitos de manipulación de tejidos, en cuanto a la fijación en alcohol para la muestras obtenidas para citología y en formol para los bloques celulares, toda vez que la recomendación original de IETSI 13 podría interpretarse de forma ambigua.
Pregunta 4. ¿Cuál es el óptimo esquema de terapia sistémica neoadyuvante en pacientes con cáncer de mama HER2 +?
Se identificaron cinco GPC que aportaron elementos para responder a la pregunta de investigación. SIGN 15 recomendó terapia sistémica neoadyuvante (TSN) para pacientes con cáncer de mama inoperable (localmente avanzado o inflamatorio), y para pacientes con cáncer de mama temprano >=T2 (independientemente del N) o >=N1 (independientemente del T), pero localizado a los grupos de ganglios linfáticos mamarios/loco regional, o cuando la única opción quirúrgica es la mastectomía y se pueda ofrecer a la paciente la oportunidad de conservación de mama. ESMO 14 recomendó TSN en tumores operables localmente avanzados y grandes. La recomendación de IETSI 13 sobre candidatos a recibir TSN se basa en lo recomendado por NCCN 8.
Recomendaciones
El panel de especialistas, por consenso manifestó su acuerdo con esta última recomendación. En cuanto a los esquemas de terapia, SIGN 15 recomendó que sean acompañados por quimioterapia basada en antraciclina/taxanos. La recomendación sobre el bloqueo dual con trastuzumab y pertuzumab difiere, siendo recomendada por ESMO 14, pero no por SIGN 15 ni IETSI 13. Al respecto, el panel de especialistas sostiene que dos metaanálisis 16,17 de publicación posterior a la actualización de evidencias de la GPC de IETSI 13, muestran que el bloqueo dual con trastuzumab y pertuzumab produjo mejoría de la sobrevida global, sobrevida libre de progresión y probabilidad de alcanzar respuesta completa, en comparación con solo trastuzumab, por lo cual el panel recomienda como alternativa preferida el bloqueo dual con trastuzumab y pertuzumab.
Pregunta 5. ¿Cuál es la escala óptima de valoración de respuesta patológica posterior a la neoadyuvancia en pacientes con cáncer de mama HER2+?
Se identificaron dos GPC que aportaron elementos para responder a la pregunta de investigación. IETSI 13 actualizó la evidencia de la recomendación de ESMO 14, incluyendo información de un ensayo clínico de etiqueta abierta que concluyó que las mejores escalas para predecir los desenlaces de sobrevida global y libre de enfermedad fueron los sistemas de clasificación "enfermedad residual en mama y ganglios linfáticos" (RDBN, por sus siglas en inglés), "carga de cáncer residual" (RCB, por sus siglas en inglés) y "ganglios linfáticos de Sataloff".
Recomendación
El panel de especialistas consideró modificar la recomendación de IETSI 13 dando un lugar preferente a la evaluación mediante RCB, por ser la técnica actualmente empleada a nivel internacional y tener la ventaja de permitir calificar numéricamente la respuesta patológica. En caso de no contar con los parámetros para la aplicación de RCB, utilizar RDBN, o utilizar de manera conjunta los sistemas de clasificación de "ganglios linfáticos de Sataloff" para evaluación ganglionar, y del sistema de Miller y Payne para la evaluación tumoral.
Pregunta 6. ¿Cuál es el óptimo esquema de terapia sistémica adyuvante en pacientes con cáncer de mama HER2+?
Se identificaron cinco GPC que aportaron elementos para responder a la pregunta de investigación. IETSI 13 recomendó terapia sistémica adyuvante en pacientes con tumores operables de 0,5 a 2 cm y ganglios linfáticos clínicamente negativos (T1bN0, T1cN0), y en pacientes con tumores potencialmente resecables (T1N1, T2N0 y T2N1) en quienes se decide por la cirugía.
Recomendaciones
El panel de especialistas adoptó por consenso la recomendación de IETSI. En relación a los esquemas de terapia sistémica, el panel de especialistas consideró importante diferenciar dos grupos de pacientes: 1 aquellos que alcanzaron respuesta patológica completa en neoadyuvancia o no recibieron terapia neoadyuvante previa; y 2 aquellos pacientes que recibieron terapia sistémica y no alcanzaron respuesta patológica completa. En el primer grupo de pacientes, se decidió por consenso adoptar la recomendación de NICE 10 que estableció el uso de trastuzumab en tumores T1a/ T1b/ T1c sin compromiso ganglionar. Esta recomendación se apoya además en resultados de un meta-análisis reciente 18 que estableció que el uso de trastuzumab y quimioterapia como terapia adyuvante en estadío temprano redujo la probabilidad de muerte en un 33%, y la probabilidad de recurrencia en un 35%, en comparación con solo quimioterapia. Por otra parte, los resultados del ensayo APHINITY mostraron que la combinación de pertuzumab, trastuzumab, y quimioterapia, mejora significativamente la sobrevida libre de enfermedad en pacientes con alto riesgo de recurrencia (enfermedad ganglionar positiva o receptores hormonales negativos), debiendo ser la alternativa preferida para este tipo de pacientes. Finalmente, el ensayo KATHERINE 19 en pacientes con cáncer de mama HER2+ y enfermedad invasiva residual después de completar terapia neoadyuvante conteniendo un taxano (con o sin antracicilina) y trastuzumab, mostró que trastuzumab emtansine (T-DM1) redujo en un 50% el riesgo de recurrencia de cáncer de mama invasivo o muerte, por lo cual el panel de especialistas recomienda T-DM1 en este grupo de pacientes.
Pregunta 7. ¿Cuál es el momento óptimo del inicio de terapia sistémica adyuvante después de la cirugía en pacientes con cáncer de mama HER2+ temprano?
Se identificaron tres GPC que aportaron elementos para responder a la pregunta de investigación. SIGN 15 estableció que retrasar la quimioterapia más de tres meses después de la cirugía puede tener un resultado negativo en mayores de 65 años, mientras que ESMO 14 estableció que el tratamiento debe empezar preferentemente de 2 a 6 semanas después de la cirugía. La búsqueda de evidencia actualizada de IETSI reportó siete semanas como el mejor umbral para alcanzar el tiempo de sobrevida global más largo (8 años). El panel de especialistas incorporó y discutió los hallazgos de una revisión sistemática publicada en fecha posterior a la actualización del IETSI, en la cual dos estudios incluidos mostraron que en comparación con el inicio de quimioterapia antes de 30 días, el riesgo de muerte se incrementó en un 19% cuando se inició después de los 60 días 20 y en 34% cuando se inició después de los 90 días 21.
Recomendación
Los resultados de estos estudios son congruentes con la recomendación planteada por IETSI 13, por lo cual se acordó por consenso adoptar dicha recomendación, en el sentido de iniciar quimioterapia adyuvante de preferencia antes de las siete semanas después de la cirugía, y no después de los tres meses.
Pregunta 8. ¿Qué terapia dirigida a HER2 debe ser ofrecida a pacientes con cáncer de mama HER2+ avanzado?
Se identificaron dos GPC que aportaron elementos para responder a la pregunta de investigación. ASCO 9 recomendó terapia anti-HER2 asociada a quimioterapia como tratamiento de primera línea en pacientes con cáncer de mama HER2+ avanzado. En tumores HER2+ con receptores de estrógenos positivos y/o receptores de progesterona positivos, se propone considerar terapia endocrina y trastuzumab como terapia de mantenimiento en caso de lograr control de enfermedad. En cuanto a los esquemas de terapia, recomienda la combinación de pertuzumab, trastuzumab y docetaxel basados en resultados del ensayo clínico CLEOPATRA. El reporte final del ensayo 22 publicado en forma posterior a la GPC de ASCO, muestró una reducción del 32% en el riesgo de muerte y una diferencia de 6,3 meses en la sobrevida libre de progresión a favor del tratamiento con pertuzumab, trastuzumab y docetaxel, en comparación con el tratamiento con trastuzumab más docetaxel.
Recomendación
En función a estos resultados, el panel de especialistas decidió por consenso adoptar la recomendación de la GPC de ASCO para la terapia de primera línea en cáncer de mama HER2+ metastásico. Respecto a la segunda línea de tratamiento, ASCO 9 discutió los resultados del segundo análisis interino del ensayo clínico EMILIA, que comparó el tratamiento con capecitabina y lapatinib, respecto a trastuzumab emtansine (T-DM1) en pacientes con cáncer de mama irresecable, localmente avanzado o metastásico, previamente tratados con trastuzumab y un taxano. El panel de especialistas discutió los resultados finales de este ensayo 23, publicados posteriormente a la GPC de ASCO, los cuales mostraron una reducción del riesgo de muerte en un 25% y una menor frecuencia de eventos adversos de grado 3 o 4 en el grupo tratado con TDM-1, respecto al grupo tratado con capecitabina y lapatinib. En base a estos resultados, el panel de especialistas decidió por consenso recomendar T-DM1 como segunda línea de tratamiento para el cáncer de mama HER2+ metastásico.
Pregunta 9. En pacientes que reciben irradiación completa de la mama sin incluir ganglios linfáticos regionales, ¿cuáles son los esquemas de fraccionamiento de dosis preferidos y como deben variar en función de la sobreexpresión de HER2?
Se identificó una GPC que aportó elementos para responder a la pregunta de investigación. ASTRO 24 recomendó que la decisión de ofrecer radioterapia hipo fraccionada puede ser independiente del estado del receptor HER2 y del estado de márgenes. La recomendación se basa en resultados del ensayo clínico NCT00156052 25 que no identificó diferencias significativas en el riesgo de recurrencia local en pacientes con sobreexpresión de HER2 (HR: 0,91; IC 95:% 0,22 a 3,81). A pesar de ello, debido a la presencia de un número reducido de casos (solo 39 pacientes HER2+) no se puede demostrar de forma concluyente diferencias en el riesgo de recurrencia local entre la radioterapia hipofraccionada y con fraccionamiento convencional. Respecto a los márgenes de resección, la revisión sistemática de literatura no identificó ninguna evidencia que evaluara si el ancho del margen negativo interactuaba con el fraccionamiento de la dosis.
Recomendación
El panel de especialistas discutió estos hallazgos, decidiendo adoptar la recomendación de ofrecer hipofraccionamiento independiente del estado del receptor de HER2. Sin embargo, por consenso se decidió modificar la recomendación respecto al estado de márgenes, considerando necesaria la presencia de un estado de márgenes negativos como condición para ofrecer tratamiento con radioterapia, debido a que no se garantiza un control local adecuado con la dosis de radiación estándar para enfermedad sub-clínica en el caso de que los márgenes estén comprometidos.
Plan de actualización de la GPC
La presente GPC debe actualizarse a los cinco años de su elaboración, o previamente en caso de disponer de nueva evidencia que modifique de forma significativa sus recomendaciones. Para la identificación de nueva evidencia relevante, se desarrollará una búsqueda sistemática de literatura.
MATERIAL SUPLEMENTARIO
El material suplementario del presente artículo, se encuentra disponible en formato electrónico en la página web de la revista Anales de la Facultad de Medicina: https://revistasinvestigacion.unmsm.edu.pe/index.php/anales/article/view/18839/16368.