INTRODUCCIÓN
Los síndromes hemorrágicos y trombóticos del embarazo son importantes causas de morbilidad y mortalidad materna y fetal en todo el mundo. Una revisión de la Organización Mundial de Salud (OMS) sobre las causas de mortalidad materna reportadas por 115 países en el lapso del 2003 al 2009 (total 66 799 casos), encontró que el 73% de muertes fueron debidas a causas obstétricas directas y 27% secundarias a causas indirectas (por ejemplo, VIH/SIDA). Las causas obstétricas directas más frecuentes fueron las hemorragias (27%), trastornos hipertensivos (14%), septicemia (10,7 %), abortos (7,9%) y enfermedad tromboembólica venosa (ETEV, 3%) 1.
En el Perú, en el lapso de 1958 a 1983, según un estudio en el Hospital Edgardo Rebagliati (154 casos) las infecciones fueron la primera causa de mortalidad debido a causas obstétricas directas (la mayoría, 25,3%, secundaria a aborto séptico y endometritis), seguidas de enfermedad hipertensiva (21,4%) y hemorragias (16,8%) 2. Más recientemente, entre 2015 al 2019, la hemorragia posparto (HPP) fue la primera causa de muerte materna con el 23,1%, siendo desplazada al segundo lugar (18,3 %) por las complicaciones del COVID-19 en el 2021 3.
Esta revisión tiene como objetivo describir la evaluación diagnóstica y el tratamiento de la principales causas obstétricas y hematológicas de la HPP, describir las evidencias que esclarecen el rol de las trombofilias hereditarias y el síndrome antifosfolípido como factores predisponentes a ETEV y pérdidas fetales recurrentes, así como también los avances en la última década en cuanto a la intervención preventiva de estos problemas.
Otro objetivo de la revisión es poner de relieve la importancia del trabajo colaborativo multidisciplinario de obstetras, hematólogos, anestesiólogos, transfusionistas y neonatólogos a fin de optimizar los resultados del tratamiento de estas complicaciones -potencialmente letales- para la madre y el feto.
BÚSQUEDA DE LA LITERATURA
Fueron utilizadas las palabras claves: hemorragias y embarazo, trombocitopenias y embarazo, coagulopatías, síndrome antifosfolípido, pérdidas fetales, tromboembolia venosa embarazo. Se procedió a la búsqueda electrónica en PubMed, Up To Date, Scielo, así como publicaciones en las revistas oficiales de las sociedades de Hematología y Ginecología-Obstetricia. Se seleccionaron estudios aleatorizados, revisiones sistemáticas, reporte de casos, series y algunos estudios retrospectivos. También se revisaron artículos obtenidos de referencias bibliográficas de artículos de revisión recientes.
DESARROLLO DEL TEMA
Las complicaciones hemorrágicas en la gestante pueden resultar de causas primariamente obstétricas como la hemorragia posparto, o condiciones hematológicas tales como la coagulación intravascular diseminada, enfermedad de Von Willebrand y trombocitopenias severas de etiología inmune o microangiopática.
Hemorragia posparto
La hemorragia posparto (HPP) es la causa más común de hemorragias en la práctica obstétrica. Se define como la pérdida de sangre igual o mayor de 1000 ml asociada con signos o síntomas de hipovolemia, independiente del tipo de parto 4. Las consecuencias de la HPP pueden ser anemia severa, el shock hipovolémico, histerectomía, falla orgánica múltiple y muerte 5.
La HPP pueden ser primaria o temprana, la que ocurre dentro de las primeras 24 horas posparto; o secundaria o tardía, la que ocurre después de las 24 horas y hasta las 12 semanas posparto 4,5. La causa más común de HPP primaria es la atonía uterina (70 % de los casos); con menor frecuencia puede resultar de laceraciones del canal del parto, la retención de placenta, el espectro de placenta accreta, la inversión uterina, rotura uterina, coagulopatías adquiridas o trombocitopenias severas 4-6.
La HPP secundaria o tardía puede deberse a la subinvolución del sitio placentario, retención de restos placentarios, endometritis y coagulopatías hereditarias como la enfermedad de Von Willebrand o, raramente, hemofilias tipo A o B 4-6.
Factores de riesgo
Los factores de riesgo de la atonía uterina son el trabajo de parto prolongado o precipitado, sobre distención uterina debido a embarazo múltiple, polihidramnios, macrosomía fetal, corioamnionitis, fibroides uterinos, uso prolongado de oxitocina. Los factores de riesgo de laceraciones del canal vaginal son el parto instrumentado y el trabajo de parto precipitado, y de la rotura uterina la cirugía uterina previa (i.e. cesárea o miomectomía), la distocia de hombros, hiperdinamia o versión cefálica externa 4-6.
Shock hipovolémico en HPP
No existe una metodología objetiva para cuantificar el volumen de sangre perdido, sin embargo, el consenso es estimar la pérdida de sangre a través del monitoreo de las funciones vitales, estableciendo tres grados de shock hipovolémico 7:
El shock hipovolémico (SH) leve, que es la pérdida de sangre de 1000 a 1500 ml (16% - 25% del volumen en una mujer de 50 a 70 kg), con frecuencia cardiaca de 90 a 100 lpm, la presión arterial sistólica de 80 - 90 mmHg, palidez leve y frialdad, sensorio normal.
El SH moderado, que es la pérdida de sangre entre 1500 a 2000 ml (26%- 35%), con frecuencia cardiaca de 101 a 120 lpm, la presión arterial sistólica 70 - 79 mm Hg, presencia de palidez, frialdad, sudoración y agitación.
El SH severo, que es la pérdida mayor de 2000 ml de sangre (>35%), la frecuencia cardiaca es > 120 lpm, presión arterial sistólica < 70 mm Hg, presencia de palidez, frialdad, sudoración, llenado capilar mayor de 3 segundos, y compromiso del sensorio (letargia o inconciencia).
El índice de choque (IC) es un parámetro que también se utiliza para detectar el shock hipovolémico en etapas tempranas. Se obtiene dividiendo la frecuencia cardiaca por la presión arterial sistólica de la paciente. En obstetricia, el IC normal es 0,7 a 0,9; un índice de choque ≥ 1,0 indica pérdida sanguínea importante, predice la necesidad de trasfusión masiva de componentes sanguíneos y se asocia con un mayor riesgo de mortalidad 8.
Prevención de HPP
Durante el embarazo, se debe identificar a las pacientes con riesgo de HPP, por ejemplo, aquellas con cesárea o hemorragia puerperal previas, o inserción anormal de la placenta. Además, se debe consultar con el hematólogo para la evaluación y manejo de anemias, trombocitopenias o sospecha de coagulopatías. Se debe tener disponibilidad de laboratorio, sangre, sala de partos/operaciones, y equipo médico-quirúrgico.
Al inicio del trabajo de parto se debe obtener un hemograma, electrolitos, tiempo de protrombina (TP), tiempo de tromboplastina parcial activado (TTPa) y fibrinógeno. En los partos vaginales y por cesárea, el tratamiento activo de la tercera etapa del parto se hace con oxitocina 10 UI por vía intramuscular y la tracción sostenida del cordón umbilical 4,5,7. Si la oxitocina no estuviera disponible, se debe usar ergometrina/metilergometrina a 200 μg IM/EV (contraindicado en pacientes hipertensas) o misoprostol (400-600 μg VO) o carbetocina 100 μg por vía EV 5,7.
Tratamiento de la HPP
El tratamiento incluye las siguientes acciones dividas en medidas iniciales, primera línea de tratamiento de la atonía uterina, segunda y tercera línea de tratamiento. En las medidas iniciales se aplica: masaje uterino bimanual, exploración uterina manual y evacuación de tejido retenido y de coágulos. Se administra líquidos intravenosos, preferiblemente cristaloides, para restaurar el volumen plasmático.
En la primera línea de tratamiento de la atonía uterina se debe utilizar oxitocina intravenosa. Si la atonía y hemorragia persisten, usar ergometrina 200 μg intramuscular o misoprostol 800 μg vía sublingual 4,5,7. Administrar ácido tranexámico (ATx, agente antifibrinolítico) a 1 gr en 10 ml (100 mg/ml) por vía endovenosa a razón de 1ml/min dentro de las 3 horas del parto vaginal o cesárea 5-7,9,10). No existe evidencia que el ATx después de 3 horas posparto sea beneficioso 5,10. Si la hemorragia continuara más allá de 30 minutos, o si después de haber cesado se reiniciara dentro de 24 horas de la primera dosis, puede administrarse una segunda dosis de ATx (6.
En la segunda línea de tratamiento; realizar el taponamiento intrauterino con balón de Bakri, el catéter Foley o un condón-catéter 6,11. Finalmente, en la tercera línea de tratamiento realizar la embolización de la arteria uterina 12. Si el sangrado persistiera, se recomiendan tratamientos quirúrgicos conservadores, por ejemplo, suturas compresivas (de B-Lynch, de Hayman o de Cho), o la ligadura de la arteria uterina o hipogástrica. Si esto no diera resultados, se recomienda la histerectomía total o subtotal (4-6.
El soporte hematológico 13 consiste en: a) Transfusión de plaquetas si la paciente tiene <75 x 106/L (mantenerlas > 50 x 109/L); b) Infusión de plasma fresco congelado (PFC) 15 ml/kg o más si TP y TTP prolongados > 1,5 sobre el valor control o, si TP y TTP no disponibles, después de transfusión de 4 unidades glóbulos rojos; c) Mantener el fibrinógeno > 2 g/L usando PFC o crioprecipitado (provee factor VIII, factor von Willebrand, fibrinógeno, factor XIII); y d) Si hemorragia persistiera, considerar uso cauteloso de factor VII recombinante 60 µ/kg, pues conlleva riesgo de trombosis.
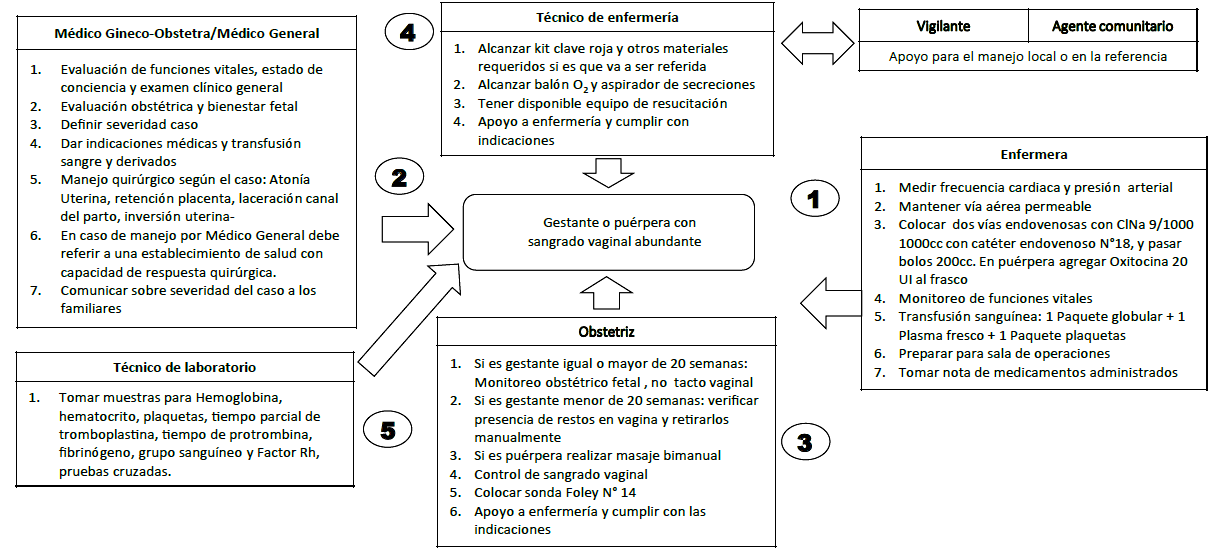
Cesada la hemorragia, se recomienda iniciar tromboprofilaxis por 10 días 13. El algoritmo de manejo de HPP en el Instituto Nacional Materno Infantil se presenta en la figura 1.
Coagulación intravascular diseminada
La coagulación intravascular diseminada (CID) puede ser factor desencadenante o agravante de HPP. Es un síndrome trombo-hemorrágico que resulta de la producción aumentada y/o la liberación, por tejido necrótico o restos placentarios, del factor tisular (FT), el cual activa el factor VII y la cascada de la coagulación. El proceso puede resultar en sangrado y/o formación de micro trombos de fibrina y plaquetas que obstruyen los vasos pequeños y medianos y causan disfunción de órganos (14.
Las causas subyacentes de CID pueden ser infecciones severas de cualquier etiología, cáncer (i.e adenocarcinomas, leucemia promielocítica), trauma, tumores vasculares y causas obstétricas (por ejemplo, desprendimiento abrupto de placenta (DAP)), síndrome preeclampsia/ HELLP, feto muerto, y embolismo de líquido amniótico 14,15.
Las manifestaciones clínicas son variables: a) La forma subclínica se caracteriza por pruebas de coagulación anormales solamente; b) la forma hiperfibrinolitica en la cual predomina el sangrado -como en el DAP, septicemia y trauma-; y c) la forma trombótica, está asociada con disfunción de órganos y/o púrpura fulminans.
El CID debe sospecharse en presencia de uno o más factores subyacentes relevantes esquistocitos en el frotis de sangre y pruebas de coagulación seriadas anormales, estos últimos hallazgos corresponden a (plaquetopenia, prolongación del tiempo de protrombina y tiempo de tromboplastina parcial activado, hipofibrinógenemia y elevación de productos de degradación de fibrina y dímeros-D) 14,15. Recientemente se ha propuesto un método diagnóstico cuantitativo específico para el embarazo que toma en cuenta los cambios hemostáticos propios del embarazo, el cual ha demostrado tener una alta sensibilidad y especificidad en DAP (16.
El tratamiento eficaz de las causas subyacentes, por lo general resulta en mejoría o resolución de la coagulopatía. El soporte hematológico está indicado en presencia de sangrado activo o riesgo de sangrado alto con la siguiente estrategia: transfusión de plaquetas (mantener plaquetas > 50 000/µL), crioprecipitado (provee fibrinógeno, factor VIII, factor von Willebrand), y plasma fresco. Si hay evidencia de trombosis, considerar uso de heparina y otros anticoagulantes (antitrombina, trombomodulina) 15,16.
Enfermedad de von Willebrand
La enfermedad de von Willebrand (EVW) es la más común de las coagulopatías hereditarias; afecta ambos sexos y tiene una prevalencia de 1 en 1000 personas (17. Resulta de la deficiencia parcial (EVW tipo 1), total (tipo 3) o disfunción (tipo 2) del factor von Willebrand. Este tiene como función mediar la adhesión de las plaquetas al endotelio lesionado y estabilizar el factor VIII 18.
La EVW debe sospecharse en mujeres con historia personal o familiar de menorragias, hemorragia posparto, equimosis, epistaxis y sangrado posquirúrgico 19. Estos casos deben consultarse con el hematólogo para diagnóstico y tratamiento. Una revisión sistemática de 16 estudios de cohortes y 76 casos reportados de mujeres embarazadas con EVW (n = 811 partos) reveló una incidencia de 34% de HPP 20.
Pautas de manejo
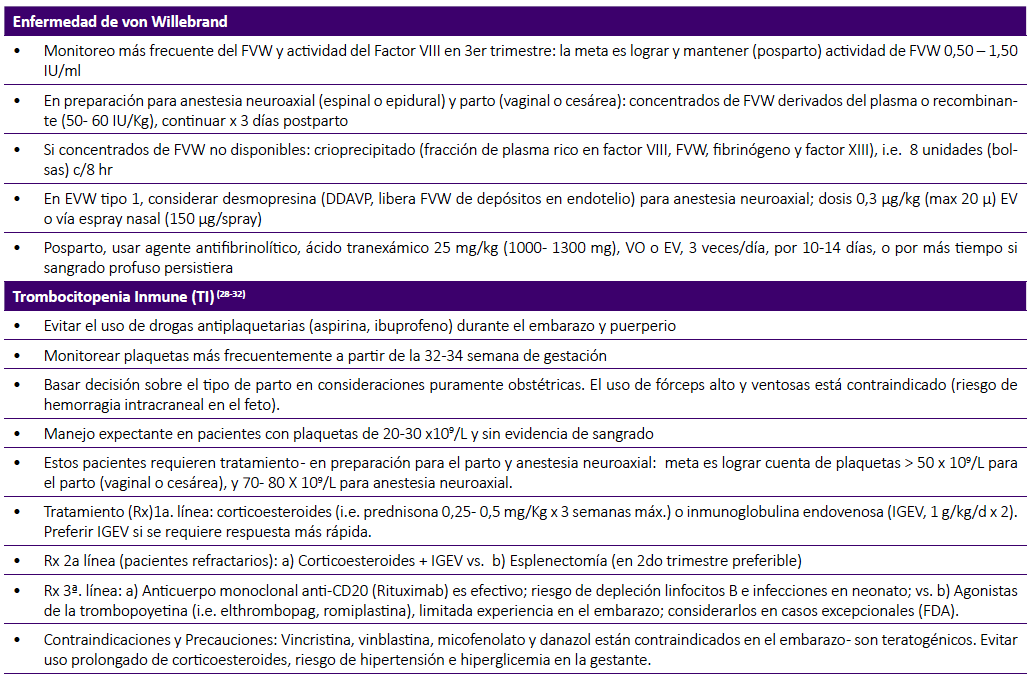
Las recomendaciones de manejo de la gestante con EVW, propuestas por varios grupos de expertos internacionales están resumidas en la Tabla 1 21,22.
Trombocitopenias
En un estudio que incluyó 7500 gestantes, se observó trombocitopenia en 9,9% de mujeres con embarazos normales y en 11,9 % de mujeres con complicaciones relacionadas con el embarazo 23. Las causas más frecuentes son la trombocitopenia gestacional (TG) con 70 a 80% de casos, caracterizada por ser asintomática y con plaquetas usualmente > 100 x 109/L; preeclampsia/HELLP (20%), trombocitopenia inmune (3 a 4 %) y otras causas (1%). Este último grupo incluye las infecciones, trombocitopenias hereditarias y las microangiopatías trombóticas 24.
Con excepción de la TG, las otras trombocitopenias son causas potenciales de morbilidad y mortalidad materna y fetal significativas 24-26. Se sugiere consultar con el hematólogo todos los casos de pacientes con plaquetas < 100 x 106/L.
Trombocitopenia inmune (TI)
Es la causa mas frecuente de trombocitopenia severa (conteo de plaquetas < 50 x 109/L) en el primer o segundo trimestre del embarazo, y se observa en 1/1,000 a 10,000 embarazos. Las pacientes con plaquetas < 50 x 109/L en el tercer trimestre tienen riesgo de HPP 27. La tabla 2 muestra líneas de manejo actualizadas 28-30. Ambos tratamientos de primera línea, corticoesteroides o inmunoglobulina endovenosa (IGEV), son eficaces y tienen baja toxicidad en madre y el feto 31.
Tabla 2 Características Clínicas y de Laboratorio de las Microangiopáticas Trombóticas del Embarazo
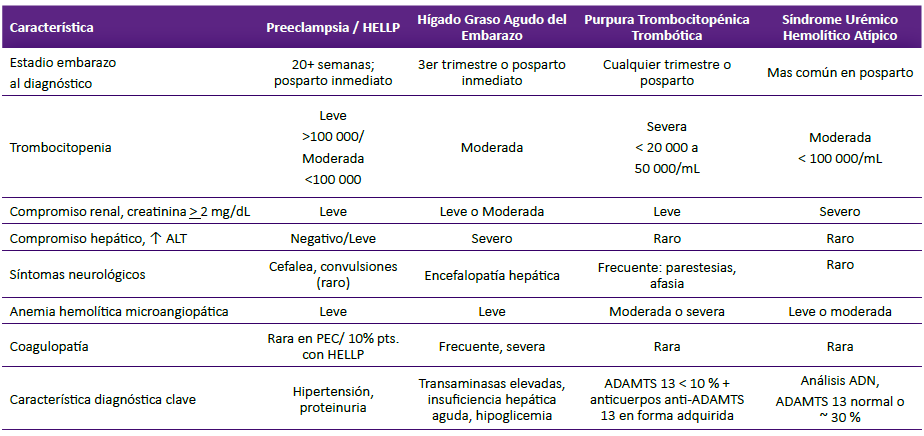
Tabla modificada de artículo de Cines y colaboradores 25
Microangiopatías trombóticas en el embarazo
Las microangiopatías trombóticas o anemias hemolíticas microangiopáticas se caracterizan por trombocitopenia, anemia hemolítica y trombosis microvascular; y resultan en daño de órganos. El análisis de laboratorio revela plaquetopenia (<100 x 109/L), anemia hemolítica no inmune (Hb<10 g/dL y prueba de Coombs negativa), deshidrogenasa láctica (DHL) > 1,5 niveles normales (debido a necrosis tisular y hemolisis) y disfunción hepática y renal 24-25. El frotis de sangre típicamente muestra eritrocitos fragmentados (esquistocitos) (Figura 2).
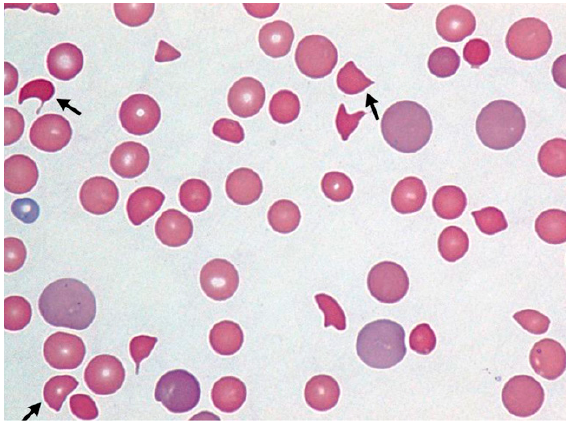
Figura 2 Frotis de sangre característico de microangiopatías trombóticas (o anemias hemolíticas microangiopáticas), muestra policromasia (hematíes grandes color púrpura, indican hemólisis) y esquistocitos (hematíes fragmentados, flechas).
En la gestante, las microangiopatías trombóticas (MATs) pueden ser: a) MATs específicas del embarazo, en pacientes con preeclampsia/síndrome HELLP, e hígado graso agudo del embarazo (HGAE); o b) MATs no específicas del embarazo como púrpura trombocitopénica trombótica (PTT, presente en 1 de 20 000 mujeres, mayormente debuta en 2da mitad del embarazo) y síndrome urémico hemolítico atípico (SUHa, presente en 1 de 25 000 gestantes, 80% se manifiesta en posparto) 24,25,32,33. La tabla 2 muestra características clínicas y diagnósticas de las MATs. La tabla 3 muestra líneas de tratamiento de PTT y SUHa.
Preeclampsia y síndrome HELLP
El síndrome HELLP (Hemolysis Elevated Liver function tests Low Platelets) es una forma severa de preeclampsia que típicamente se presenta en el tercer trimestre con dolor epigástrico o en cuadrante superior derecho, nauseas o vómitos. Los hallazgos de laboratorio incluyen anemia hemolítica microangiopática, DHL > 600 IU/L, conteo de plaquetas < 100 x 109/L, bilirrubina total > 1,2 mg/ dL y AST > 70 IU/L 34.
Las complicaciones maternas más frecuentes son la coagulación intravascular diseminada, el desprendimiento prematuro de placenta, la insuficiencia renal aguda y el sangrado 35. En una cohorte de 295 casos, se observó 10 casos de muerte materna y la tasa de mortalidad perinatal fue de 226 en 1000 36.
En cuanto a la patogenia, un estudio de laboratorio que utilizó el suero de pacientes con HELLP y el anticuerpo monoclonal anti-C5 (eculizumab), demostró hiperactivación del complemento por la vía alternativa en 23 mujeres embarazadas con el síndrome HELLP clásico y atípico; ello no se observó en gestantes sin HELLP ni en los controles. Esto sugiere una patogenia similar a la del síndrome urémico hemolítico atípico (SUHa). Consecuentemente, similar a la experiencia con SUHa, eculizumab sería una opción de tratamiento en pacientes con HELLP 37.
Hígado graso agudo del embarazo (HGAE)
Ocurre en 1 de cada 7000 a 20 000 embarazos y se caracteriza por compromiso hepatocelular severo. La hipoglicemia y la coagulopatía severa debido a insuficiencia hepática son manifestaciones características de HGAE. Los factores de riesgo incluyen embarazos múltiples, obesidad y feto de sexo masculino con deficiencia hereditaria de oxidación de ácidos grasos 24,25, 35.
Pautas de manejo de preeclampsia/ HELLP y HGAE
El tratamiento de elección es la inducción del parto y soporte transfusional. En preeclampsia/HELLP el parto resulta en rápida mejoría y resolución dentro de 48 horas. Si esto no ocurre, considerar posibilidad de PTT o SUHa. En HGAE la mejoría posparto es más lenta 25,34.
Se ha reportado que la dexametasona (10 mg EV c/12 h) produce mejoría de la hemolisis, plaquetopenia y la disfunción hepática 38. Una revisión Cochrane de 11 estudios que comparó dexametasona vs placebo (n = 550 pacientes) confirmó el efecto beneficioso sobre las plaquetas, pero no demostró ningún impacto positivo en la morbi-mortalidad materna y perinatal 39.
Complicaciones trombóticas: pérdidas fetales y enfermedad tromboembólica
Rol de las trombofilias en complicaciones trombóticas
Las trombofilias son síndromes o condiciones adquiridas o heredadas que predisponen a trombosis. En el embarazo, las trombofilias son factores predisponentes a ETEV, pérdidas fetales y complicaciones de insuficiencia placentaria. Las trombofilias adquiridas son el síndrome antifosfolípido, el cáncer, deficiencias adquiridas de las proteínas anticoagulantes naturales, síndromes mieloproliferativos, hemoglobinuria paroxística nocturna, y ciertas quimioterapias 40.
Las trombofilias hereditarias (TH) resultan de mutaciones hipo funcionantes de los genes que codifican las proteínas anticoagulantes naturales (antitrombina [AT], proteína C [PC] y proteína S [PS]); o mutaciones hiperfuncionantes del factor V (Factor V Leyden [FVL]), o la protrombina (Protrombina G20201 A/G [PGM]). También son trombofilias la elevación de factores procoagulantes VII, VIII, IX y FVW e hiperhomocisteinemia 41,42.
El FVL y la PGM son más prevalentes en poblaciones de origen europeo con ETEV (7-10% y 5 %, respectivamente), mientras que las deficiencias de PC y PS predominan en pacientes con ETEV del Japón, Taiwán, Tailandia y Brasil 43. En Latinoamérica, el FVL se detectó en 3-4% de pacientes con ETEV en Brasil y Argentina y 0,85 % de mestizos mexicanos 44.
Pérdidas fetales recurrentes
Las pérdidas fetales recurrentes (PFR) se definen como dos o más pérdidas fetales antes de las semana 20 del último periodo menstrual y ocurre en 1 - 2% de parejas que tratan de concebir. Las alteraciones cromosomiales estructurales en los padres son la principal causa de PFR antes de la semana 10 de gestación y las trombofilias son la causa más frecuente después de la semana 10. En aproximadamente el 50% de los casos, no se logra identificar causa ni factor de riesgo 45.
Trombofilias y pérdidas fetales recurrentes
El síndrome antifosfolípido y las trombofilias hereditarias son importantes factores de riesgo de PFR. En un metaanálisis de 1974 casos de PFR, el síndrome antifosfolípido fue la causa subyacente aparente en 10 y 17% de los casos. Asimismo, en 643 mujeres con PFR, se demostraron el FVL y la PGM en un promedio de 8,5 % y 3 %, respectivamente, y las deficiencias de las proteínas C y S (n = 250 pacientes) en un promedio de 2,7 % de las pacientes 46.
Síndrome antifosfolípido
El síndrome antifosfolípido (SAF) es una enfermedad autoinmune caracterizada por trombosis arterial o venosa y/o complicaciones obstétricas, mediados por anticuerpos antifosfolípidos. En la población general su incidencia es de 5 por 100 000 personas por año 47. Las mujeres embarazadas con SAF tienen riesgo de sufrir preeclampsia, abortos y pérdidas fetales, trombosis, parto prematuro y mortalidad perinatal 48.
Diagnóstico de SAF
Requiere de por lo menos un criterio clínico y un criterio de laboratorio 47. Dentro de los criterios clínicos están a) Uno o más episodios de trombosis venosa, arterial o microvascular; b) Una o más muertes inexplicables de un feto morfológicamente normal a partir de las 10ª semana de la gestación, o uno o más nacimientos prematuros antes de la semana 34 de gestación debido a preeclampsia, eclampsia o insuficiencia placentaria; y c) Tres o más abortos espontáneos antes de la 10ª semana de gestación.
Dentro de los criterios de laboratorio se tiene la positividad de 1 o más de las siguientes tres pruebas, realizadas en 2 o más ocasiones, separadas por al menos 12 semanas: a) Anticoagulante lúpico (AL); b) Anticardiolipina IgG o IgM; c) Anti-β2 glicoproteína 1 IgG y/o IgM.
El riesgo de complicaciones obstétricas es mayor cuando hay historia de trombosis previa, doble o triple positividad de los anticuerpos antifosfolípidos o positividad a título elevado del AL48.
Prevención del SAF obstétrico
Los expertos internacionales recomiendan descartar SAF en mujeres gestantes con PFR 42,47. Si se confirma el diagnóstico, se recomienda iniciar el manejo preventivo con dosis bajas de aspirina (ASA, 81 mg) preconcepcional, a la cual debe añadirse la heparina de bajo peso molecular (HBPM, 40 mg SC, d/día) en cuanto el embarazo es confirmado. El tratamiento debe continuarse por 12 semanas posparto 49.
En la experiencia europea con 1000 gestantes con SAF, el tratamiento combinado (HBPM + ASA) resultó en una tasa de nacidos vivos de 85%, superior a la tasa de 49,6% observada cuando las gestantes no recibieron ningún tratamiento 50. Un metaanálisis de 5 estudios en 1295 pacientes que comparó HBPM + ASA versus ASA sola, estimó tasas de nacidos vivos de 89% versus 70%, respectivamente 51.
Trombofilias hereditarias y pérdidas fetales recurrentes
La demostración de asociaciones de THs con PFR 46, generaron la hipótesis del uso profiláctico de heparina como un medio de prevención eficaz. Sin embargo, un metaanálisis de 8 estudios prospectivos y aleatorizados en 483 gestantes portadoras de THs, no demostró una reducción de pérdidas fetales tempranas ni tardías en las mujeres que recibieron tromboprofilaxis con HBPM +/- aspirina comparadas con las mujeres que no recibieron tratamiento 52.
Basadas en esta evidencia, las sociedades obstétricas internacionales actualmente no recomiendan investigar THs en mujeres con PFR, ya que los resultados no tendrían implicancias terapéuticas.
Enfermedad tromboembólica venosa en el embarazo
Prevalencia en el embarazo
La enfermedad tromboembólica venosa (ETEV) es una causa importante de morbimortalidad en países desarrollados, con una incidencia reportada de 199 en 100 000 años-mujer en los Estados Unidos (Minnesota) en una población mayoritariamente caucásica 53.
En el Perú, se han reportado casos de ETEV en dos mujeres embarazadas 54,55, pero carecemos de datos sobre su prevalencia en gestantes de la población general. En México, se ha estimado una incidencia de 500 mil casos por año en la población general 56. La gestante tiene un riesgo 4 a 5 veces más elevado de ETEV que la no gestante. La ETEV puede manifestarse como trombosis de venas profundas (TVP), lo cual ocurre en 75-80% de casos, como tromboembolia pulmonar (TEP) o ambos. La pierna izquierda y las venas iliofemorales están comprometidas en 85% y 72% de casos de TVP, respectivamente 57. Mientras que 2/3 de TVP ocurren durante el embarazo, la mayoría de TEP ocurren en el posparto 53.
Factores de riesgo
El embarazo es una condición protrombótica de causa multifactorial, entre las causas tenemos el estasis del retorno venoso, el incremento fisiológico de los factores procoagulantes, y la disminución de las proteínas anticoagulantes y la fibrinolisis (cambios destinados a disminuir la HPP); a su vez, el daño del endotelio vascular pélvico y uterino durante el parto o la cesárea actúa como factor precipitante 55. Otros factores de riesgo son la historia previa de trombosis, las trombofilias hereditarias o adquiridas, edad mayor de 35 años, obesidad, operación cesárea de emergencia, preeclampsia, infecciones puerperales y HPP 58.
Rol de trombofilias en ETEV del embarazo
En un metaanálisis de 36 estudios observacionales en mujeres embarazadas con TH (n = 41 297), el riesgo absoluto de ETEV anteparto/posparto en gestantes con deficiencias de AT, PC y PS fue, respectivamente, de 7,3/11,1; 3,2/5,4; y 0,9/4,2. En mujeres homocigotas de FVL el riesgo fue de 2,8/8,8 y en heterocigotas compuestos de FVL y PGM el riesgo fue <3 %; el riesgo asociado con el SAF fue de 15,8 59.
Diagnóstico y manejo de ETEV del embarazo
Típicamente, TVP se manifiesta con eritema, edema, dolor y signo de Hoffman de la extremidad comprometida. La ultrasonografía Doppler de compresión, por lo general, confirma el diagnóstico (especificidad 94 a 97%) 60,61. En casos con resultados inciertos, el venograma por resonancia magnética es útil. Si se confirma TVP, debe iniciarse anticoagulación con heparina; estudios imagenológicos pulmonares ya no son necesarios, pues los resultados no alterarían el plan de tratamiento 60.
La TEP es una de las principales causas de muerte materna en países desarrollados. El cuadro clínico incluye disnea, dolor torácico, tos, hemoptisis, diaforesis, mareos; en casos severos, hipotensión y sincope 62. El abordaje diagnóstico inicial de TEP se basa en la evaluación clínica utilizando uno de los modelos de predicción clínica y los niveles de dímeros-D (< 500 ng/ml vs 1000 ng/ml), para determinar la probabilidad de TEP y la necesidad de imagenología pulmonar, como gammagrafía V/P o la angiografía pulmonar tomográfica computarizada (AP-TC) 62-64. Estas pruebas tienen tasas de falsos negativos de solo 0,5 % 60-62, pero ambas pruebas conllevan el riesgo de irradiación de la madre y el feto y no son accesibles en hospitales no especializados. Por estas razones, es buena práctica restringir su uso en lo posible.
El algoritmo YEARS ha sido evaluado prospectivamente en 498 gestantes con sospecha clínica de TEP. Su uso permitió evitar el uso de la AP-TC en un 65% (48/74) de pacientes en el 1er trimestre, en 46% (89/193) de pacientes en el 2do trimestre y 32 % (74/231) de pacientes en el 3er trimestre 65.
Sobre el manejo de ETEV, recomendamos revisar los artículos de Middeldorp y Khan, y sus colaboradores 60,62, así como las guías de la Sociedad Americana de Hematología 66.
Descarte de trombofilias y prevención de ETEV en el embarazo
Las sociedades norteamericanas de Hematología y Obstetricia recomiendan descartar el SAF y las trombofilias hereditarias en mujeres gestantes con historia personal y/o familiar de ETEV y ofrecer tromboprofilaxis en ciertas situaciones 63,65. Se recomienda no realizar esta evaluación al tiempo del diagnóstico de ETEV, ni durante los tres meses iniciales de terapia anticoagulante 39. La tabla 4 muestra las recomendaciones de la Sociedad de Hematología Americana (SHA) sobre tromboprofilaxis en el embarazo y el posparto en diferentes escenarios clínicos 66.
Tabla 4 Prevención de tromboembolismo en mujeres gestantes con trombofilias hereditarias de acuerdo a guías de la Sociedad Americana de Hematología 66
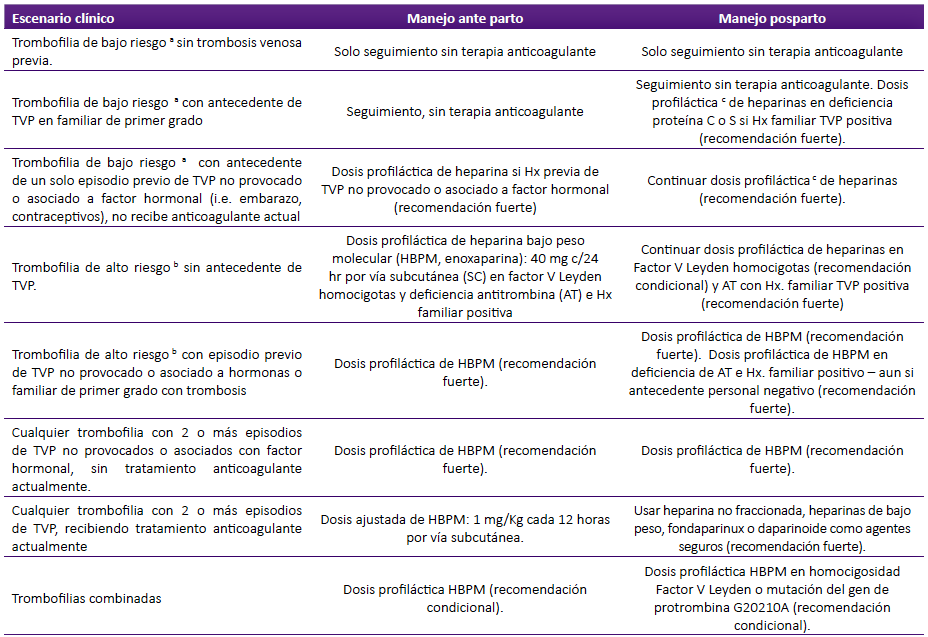
TVP, trombosis venosa profunda; Hx: Historia; a Trombofilia de bajo riesgo: FVL heterocigota, PGM heterocigota, deficiencia de proteína C y deficiencia de proteína S; b Trombofilias de alto riesgo: Factor V de Leyden (FVL) homocigota, Protrombina G20210A (PGM) homocigota, combinación de FVL + PGM heterocigotos y deficiencia de antitrombina (AT); c Dosis profiláctica de heparina de bajo peso molecular (HBPM, enoxaparina) 40 mg c/12 hr SC
Anticoagulación durante el embarazo, puerperio y lactancia
La heparina de bajo peso molecular (HBPM) es el anticoagulante de elección porque no atraviesa la placenta y tiene baja toxicidad en la madre. Debe ser descontinuada 12-24 horas antes de anestesia epidural o el parto y no reiniciarla hasta después de 4 horas de la remoción del catéter epidural 66.
La warfarina (coumadina) está contraindicada en el primer trimestre del embarazo por ser teratogénica; en el 2do y 3er trimestre, su uso conlleva un riesgo significativo de sangrado y muerte fetal 67. Sobre los anticoagulantes orales directos, actualmente no hay suficientes evidencias para contraindicar su uso durante el embarazo 68. En cuanto a la lactancia materna, las heparinas y la warfarina son consideradas seguras 60,66. Los anticoagulantes directos no son seguros; se recomienda no usarlos en madres que dan de lactar 69.
CONCLUSIONES
La HPP es la causa más frecuente de morbimortalidad materna en el mundo, su principal causa es la atonía uterina. La identificación temprana de pacientes en riesgo y el pronto inicio de tratamiento con oxitocina, ácido tranexámico y el manejo quirúrgico conservador son efectivos en la mayoría de las pacientes. Se revisa el diagnóstico y manejo de algunas de las condiciones hematológicas que pueden causar o agravar la HPP. Se revisa el rol del SAF y las TH en PFR y ETEV del embarazo. Se recomienda descartar SAF en gestantes con PFR y THs en gestantes con historia personal o familiar de ETEV, con el objetivo de implementar la tromboprofilaxis.