INTRODUCCIÓN
La pubertad se caracteriza por la aparición de caracteres sexuales secundarios y aceleración del crecimiento 1. Múltiples factores genéticos, nutricionales y ambientales 2,3 estarían involucrados. El incremento de la secreción pulsátil de la Hormona Liberadora de Gonadotropina (GnRH) estimula secreción hipofisaria de la hormona luteinizante (LH), la hormona folículo estimulante (FSH), estrógenos y testosterona. 4
Marshall y Tanner 5 determinaron 5 estadios del desarrollo mamario (M) y vello púbico (VP) considerándose M1/VP1 como prepuberal y M5/VP5 al estadio adulto, basándose en la secuencia normal de aparición de los caracteres sexuales secundarios. Las niñas tienen como primera manifestación clínica del inicio puberal la aparición del botón mamario (telarquia), seguido de la aparición de vello pubiano y la primera menstruación o menarquia; que ocurre entre los 8 a 13 años. Según estos criterios, la aparición progresiva de caracteres sexuales antes de los 8 años se define como pubertad precoz (PP). 6,7
Respecto a la incidencia y prevalencia de PP, el estudio de Teilmann G et al. 8, en población danesa, estimó una prevalencia de 0,2% en las niñas y 0,05% en niños. En nuestro medio, se han publicado estudios descriptivos de PP como el estudio de Cabello y Salinas 9 y no se conoce la verdadera prevalencia e incidencia.
La PP puede ser de origen central (PPC) o periférico (PPP); en la primera hay activación del eje hipotálamo-hipófisis-gonadal (HHG) y liberación temprana de LH y FSH 10. El diagnóstico de PPC en niñas se basa en criterios clínicos, bioquímicos y radiológicos. Los principales criterios clínicos son el desarrollo mamario, antes de los 8 años, y el crecimiento acelerado 11. Dentro de los criterios bioquímicos, la prueba de estimulación con GnRH es el “estándar de oro” para confirmar el diagnóstico de PPC 12; sin embargo, su escasa disponibilidad y altos costos limitan su uso. La determinación de LH basal, según el método inmunoquimioluminiscencia (ICMA), con valores >0.3IU/l muestran una sensibilidad del 60% y especificidad del 100% para el diagnóstico de PPC 13. La determinación de FSH y su relación con LH se desconoce 14. De los criterios radiológicos, la edad ósea es el marcador más importante para el diagnóstico. 15
Considerando que en las niñas el diagnóstico tardío de PPC (por encima de los 8 años de edad), puede ocasionar menor talla final adulta (TFA) con relación a su talla genética (TG) y problemas emocionales por la aparición temprana del desarrollo mamario y el vello pubiano 6,7; el objetivo de este estudio fue determinar las características clínicas, bioquímicas y radiológicas de las niñas con diagnóstico de PPC atendidas en un hospital público de Lima.
MATERIAL Y MÉTODOS
Población de estudio:
Se incluyeron niñas con diagnóstico de PPC basados en el desarrollo mamario antes de los 8 años, LH basal (ICMA)>0.3IU/l, proyección de talla final adulta (PTFA) por encima de la TG y edad ósea avanzada en más de un año con respecto a la edad cronológica atendidas en la Unidad de Endocrinología Pediátrica (UEP) del Hospital Cayetano Heredia (HCH) entre el 2014 al 2019. Fueron excluidas las niñas con diagnóstico de PPP, telarquia prematura aislada, niñas con malformaciones cromosómicas o genéticas y niñas con PPC con historia clínica no habidas o incompletas.
Procedimientos y técnicas:
Se revisaron las historias clínicas de las niñas con diagnóstico de PPC que cumplían con los criterios de inclusión. El diagnóstico de PPC fue definido por los médicos especialistas de la UEP, en base a criterios clínicos, bioquímicos y radiológicos mencionados en los criterios de inclusión. Se consideró desarrollo mamario precoz a la aparición del botón mamario antes de los 8 años. La clasificación del estadio puberal se basó en los criterios de Marshall y Tanner para niñas 5. Se estimó la TG según el método de Tanner 16. Se consideró niveles de LH basal >0,3 IU/l, por ICMA para el diagnóstico de PPC. Se utilizó un punto de corte > 0,6 como criterio de PPC al índice LH/FSH. La edad ósea fue estimada por el método de Greulich-Pyle 17 y se consideró criterio para el diagnóstico de PPC, un valor mayor en un año respecto a la edad cronológica. La resonancia magnética nuclear (RMN) de hipófisis fue tomada con y sin contraste.
Se recopilaron los siguientes datos al diagnóstico: Motivo de consulta, edad cronológica, edad ósea, edad de inicio de la telarquia, peso, talla, IMC, talla genética, estadio puberal, niveles de LH, FSH, estradiol y el informe de la RMN.
La edad cronológica fue categorizada en tres grupos etarios: menores de 6 años, de 6 a 8 años y mayores de 8 años. El estado nutricional se categorizó en normo peso Z-IMC entre -2 DE a 1 DE, sobrepeso Z-IMC >1DE a DE a <1,67 y obesidad Z-IMC ≥1,67, según criterios de la CDC 18. La edad ósea fue categorizada en ≤2 años de adelanto y >2 años respecto a la edad cronológica. Se calculó el Z-talla de la niña, Z-talla genética y Z-IMC utilizando el software Ped(Z)19. Se estimó la PTFA en base a la talla de la niña y la edad ósea en el momento del diagnóstico, según el método de Bayley-Pinneau 20. Los valores de estradiol fueron categorizados en ≤5 pg/ml, >5 a 20 pg/ml y >20 pg/ml. Los niveles de LH fueron categorizados en ≤0,3 UI/l y >0,3 UI/l. /l. El índice LH/FSH fue categorizado en ≤0,6 y >0,6.
Análisis estadístico:
Las variables categóricas fueron descritas en proporciones, las variables continuas y discretas como medias ± DE en datos con distribución normal y como medianas en rango intercuartil (RIQ) para variables sin distribución normal. Para comparar dos medias se utilizó la prueba de t-Student para datos independientes. Para datos apareados, se utilizó la prueba t-test apareado. La prueba de suma de rango de Wilcoxon, para variables sin distribución normal. La normalidad de las variables se evaluó con la prueba de Shapiro-Wilk. Se consideró estadísticamente significativo si p <0,05. Los datos fueron analizados con el programa STATA versión 17, licencia Universidad Peruana Cayetano Heredia (UPCH).
RESULTADOS
Se recopilaron datos de 86 niñas con diagnóstico de PPC. Los motivos de consulta por el cual acudieron a la UEP se muestran en la tabla 1. Las características generales de la población de estudio se muestran en la tabla 2.
Tabla 1 Motivos de consulta de las niñas con pubertad precoz central atendidas en un hospital público Lima 2014-2019.

PP: Pubertad Precoz; VP: Vello Púbico
Otros: mayor velocidad de crecimiento, acné, acantosis nigricans
Tabla 2 Características demográficas y clínicas de las niñas con pubertad precoz central atendidas en un hospital público Lima 2014-2019.
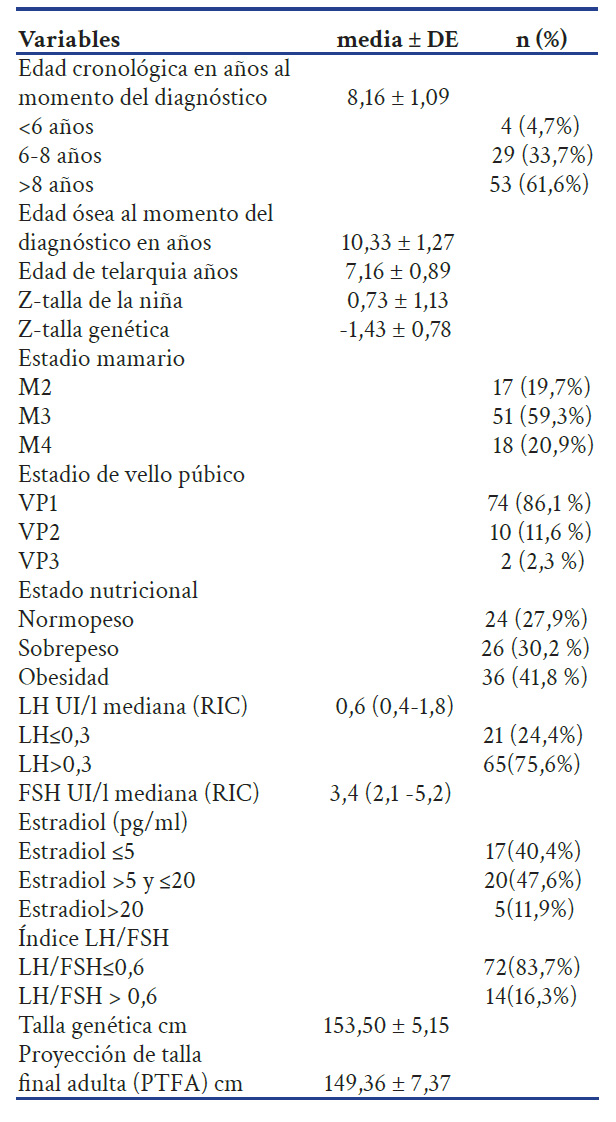
La media de la edad cronológica en el momento del diagnóstico fue 8,16 ± 1,09 años y en 53(61,6%) de los casos fue > 8 años.
La media de la edad ósea al diagnóstico fue 10,33 ± 1,27 años. En 41 (47,7 %) de casos la edad ósea fue mayor a la cronológica en 1 a 2 años y en 45 (52,3 %) fue > 2 años. La diferencia entre las medias de la edad ósea y la edad cronológica fue 2,17 ± 0,18 años (IC 95% 1,81-2,52) (p≤0,0001) (Grafico 1).
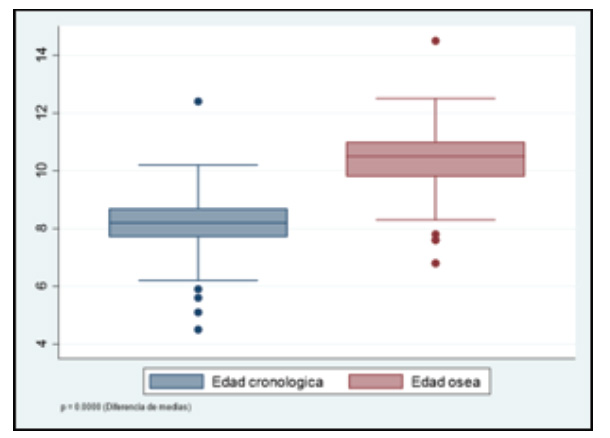
Grafico 1 Medias de la edad cronológica y ósea. La diferencia de medias entre la edad cronológica y la edad ósea al momento del diagnóstico en pacientes con pubertad precoz fue de 2,17 ± 0,18 años (IC 95% 1,81-2,52).
La media del Z -talla de las niñas fue 0,73 ± 1,13 DE y la media del Z-talla genética fue -1,43 ± 0,78 DE. La diferencia entre las medias del Z-talla de la niña y el Z-talla genética fue 2,16 ± 1,0 DE (IC 95% 1,94 - 2,38) (p≤0,0001) (Grafico 2).
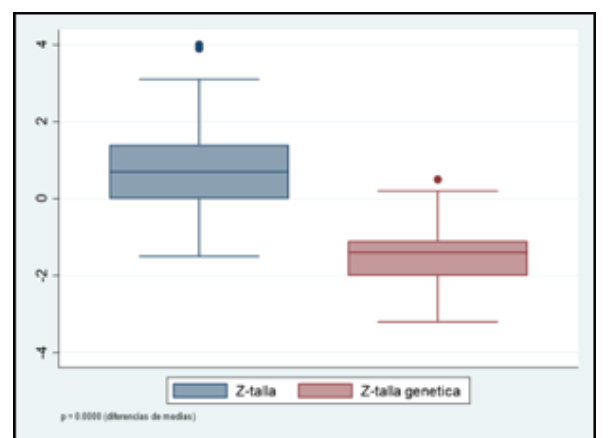
Grafico 2 Talla medida de las niñas y talla genética. La diferencia entre las medias de tallas medida de las niñas y la talla genética de las pacientes con pubertad precoz fue de 2,16 ± 1,0 DE (IC 95% 1,94 - 2,38).
La media de la PTFA, según el método de Bayley-Pinneau, fue 149,36 ± 7,37 cm y la media de la TG, según el método de Tanner JM, fue 153,50 ± 5,15 cm. La diferencia entre las medias de la PTFA y la TG fue 4,13± 0,83 cm (IC 95% 2,47-5,80) (p≤0,0001). (Grafico 3).
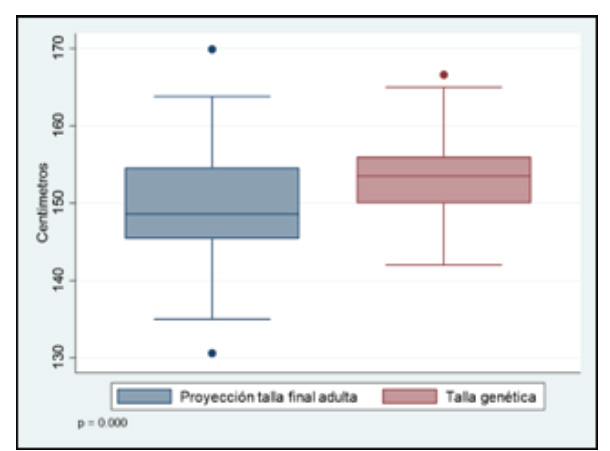
Gráfico 3 Medias de la proyección de la talla final adulta (PTFA) y talla genética. La diferencia entre las medias de la PTFA y la TG fue de 4,13 ± 0,83 cm (IC 95% 2,47-5,80).
Las características generales de las niñas incluidas en este estudio se muestran en la tabla 2.
La mediana de LH fue 0,6 (RIQ: 0,4-1,8). Se encontró LH ≤0,3 en 21 (24,4%) de los casos y LH > 0,3 en 65 (75,6%) casos. La mediana de FSH fue 3,4 (RIQ: 2,1-5,2). La relación LH/FSH fue ≤0,6 en 72 (83,7%) casos y > 0,6 en 14 (16,3%). Los valores de estradiol se encontraron en 42/86 de los casos de los cuales 17(40,4%) presentaron estradiol ≤ 5 pg/ml, en 20 (47,6%) casos fue >5pg/ml a 20 pg/ml y en 5 (11,9%) el estradiol fue >20 pg /ml.
En 64/86 de los casos se encontró el informe de la RMN de hipófisis. De las cuales en 51(79,6%) el informe fue reportado como normal y en 13 (20,3%) se encontró algún hallazgo anormal: siete casos de micro adenoma, tres quistes de Ratke, un quiste en Pars intermedia, una hipoplasia de la hipófisis y un abombamiento del diafragma selar y silla turca.
DISCUSIÓN
En este estudio, el motivo de consulta en el mayor porcentaje (64,9%) de las niñas con diagnóstico de PPC fue el crecimiento mamario y la sospecha de pubertad precoz por parte del personal de salud. Similar al estudio de Falen et al. 21 quienes reportaron que hasta 89.5% consultó por desarrollo mamario. Asimismo, la edad cronológica de diagnóstico fue 8,16 ± 1,09 años, considerada como tardía. Similar al estudio de Martínez et al. 22, quienes reportaron una edad cronológica de 8,4 ± 0,4 años.
Los análogos de GnRH (GnRHa) son el tratamiento de elección para PPC y tienen como objetivo principal mejorar la TFA con relación a la TG 6,7. Sin embargo, el costo beneficio del tratamiento es polémico; debido a la discreta ganancia en la TFA en niñas que iniciaron tratamiento entre 7 a 9 años de edad 23. En el estudio de Klein et al. 24 reportaron una ganancia de 10 cm en la TFA respecto a la PTFA previo al tratamiento, en niñas que iniciaron tratamiento antes de los 6 años a diferencia de las niñas que iniciaron tratamiento después de los 8 años de edad. Este resultado difiere del estudio de Lee et al. 25, quienes encontraron una ganancia discreta de 3,9 ± 4,6 cm en la TFA en niñas que iniciaron tratamiento a los 8,2 ± 0,6 años de edad. En nuestro medio, Martínez et al. 22 encontraron que la ganancia fue 2,7 cm en la PTFA, luego de 20,5 meses de haber iniciado el tratamiento.
La edad ósea avanzada respecto a la edad cronológica y un estadio de desarrollo mamario avanzado, en el momento del diagnóstico de PPC, son factores involucrados en la menor ganancia de TFA 24. Una mayor edad ósea respecto a la cronológica se relaciona con una fusión epifisaria temprana y menor TFA 26. Greulich y Pyle, mediante el uso de una radiografía de la mano izquierda diseñaron un método para evaluar la edad ósea 17. En este estudio, encontramos una edad ósea significativamente mayor a la edad cronológica, similar al estudio de Lee 25 y Martínez 22, lo cual pudiera influenciar en una disminución de la TFA respecto a la TG.
Respecto al desarrollo mamario, el 80,2% de las niñas acudieron en estadios avanzados (M3 y M4), similar al estudio de Falen et al. 21 quienes reportaron estadios avanzados de Tanner en el 64%, lo cual podría afectar la TFA. Limony Y et al. 27 demostraron que a menor edad cronológica de inicio de la pubertad la TFA fue menor respecto a la TG.
En este estudio, con relación al VP llama la atención que el mayor porcentaje (97%) de los casos se encontraron en estadios incipientes VP1 y VP2, a diferencia de los estadios mamarios avanzados. Esto podría explicarse por diferencias raciales, puesto que el estudio de Marshall y Tanner 5, utilizado como referente en este estudio, se llevó a cabo en niñas inglesas de raza blanca. Mientras que, en nuestro país, Freyre et al. 28 demostraron que la escala de Marshall y Tanner no era aplicable para evaluar el VP en adolescentes indígenas peruanas.
En la PP no sólo aparecen tempranamente los caracteres sexuales secundarios, sino también existe un mayor crecimiento en la talla. El incremento en la velocidad de crecimiento (>6cm/año), ha sido utilizado como un indicador clínico para sospechar de PP 29. Sin embargo, en muchos casos no se cuenta con registros previos de la velocidad de crecimiento, lo cual limita su uso. En este estudio, encontramos que las niñas tenían z-talla significativamente mayor respecto al z-talla genética. Lo cual podría significar que las niñas tenían un crecimiento mayor respecto a su TG mucho antes de su diagnóstico. Por lo tanto, la incorporación de la TG en el monitoreo del crecimiento de las niñas podría ser de utilidad en la práctica clínica para sospechar tempranamente de PP.
En las últimas décadas, varios estudios sugieren que la edad de inicio de la telarquia en las niñas estaría ocurriendo a edades más tempranas y que la obesidad sería el factor asociado más importante 30. La influencia del excesivo peso fue evaluado en estudios experimentales. Terasawa et al. 31, demostraron que las monas con alta ingesta de calorías tenían una menarquia más temprana y niveles altos de Leptina e IGF-1 en comparación a los controles. En humanos, Rosenfield et al. 32, demostraron que las niñas con IMC elevado tenían aparición significativamente más temprana de la telarquia, pubarquia y menarquia en comparación con las niñas con IMC normal. En este estudio, encontramos que el mayor porcentaje (72%) de niñas tenían sobrepeso y obesidad; en simultáneo, el mayor porcentaje tenía estadios avanzados de desarrollo mamario (M3 y M4). El cual genera un gran reto para los médicos ante la necesidad de diferenciar lipomastia versus desarrollo mamario para sospechar tempranamente de PP.
Varios métodos se han utilizado para estimar la PTFA, a fin de valorar el beneficio del tratamiento en la TFA. En este estudio, encontramos una diferencia significativamente menor entre la PTFA y la media de la TG utilizando el método de Bayley-Pinneau; debido a que aún existen controversias respecto a los métodos de Tanner-Whitehouse y Roche-Wainer-Thissen en niñas con PP. 33
Como criterios bioquímicos para el diagnóstico de PPC, el estudio de Kandemir et al. 34 encontró una sensibilidad del 98% y especificidad del 100%, considerando un pico de LH > 5UI/l. Sin embargo, a la fecha no existe consenso sobre el punto de corte del pico de LH para definir la activación del eje HHG; por otro lado, su ejecución es limitada por la escasez de GnRH acuoso. La incorporación de métodos ultrasensibles y específicos para la determinación de LH con ICMA ha venido postergando la necesidad de la prueba de estimulación de GnRH para confirmar el diagnóstico de PPC.
El estudio de Pasternak et al. 35 demostró que niveles de LH basales tan bajos como 0,1 UI/l por ICMA la sensibilidad fue de 64% y especificidad de 94% para confirmar el diagnóstico de PPC en niñas. En este estudio, se encontró en 21(24,4%) casos la LH basal ≥ 0,3 UI/l, el cual podría poner en tela de juicio el diagnóstico de PPC; sin embargo, ante la clara evidencia de un desarrollo mamario antes de los 8 años de edad y una edad ósea significativamente mayor respecto a la edad cronológica, la determinación basal de LH con niveles >0,1UI/l podría ser útil para confirmar el diagnóstico. Respecto al índice LH/FSH, en este estudio encontramos que solo el 16,3% presentó un índice de LH/FSH >0,6 como criterio al diagnóstico de PPC. Este hallazgo es similar a otros estudios que han demostrado una gran variabilidad de este índice, debido a la gran variabilidad de los niveles basales de FSH. Supornsilchai et al. 13 concluyeron que en niñas con PPC en estadios avanzados podrían utilizar un índice de LH/FSH > 0.2 como punto de corte para diagnóstico de PPC.
La RMN de hipófisis es útil para identificar causas orgánicas de pubertad precoz central (PPCO), especialmente antes de los 6 años 36,37. En este estudio, el informe de RMN de hipófisis fue informado como normal en el 79,6% de los casos. Similar al estudio de Mogensen et al. 36, donde encontraron que el 94% de niñas con PPC presentaron RMN normal.
Este estudio al ser de tipo serie de casos retrospectivo solo permitió evaluar las historias clínicas en un intervalo de tiempo y no realizar seguimiento de las pacientes.
En conclusión, en este estudio, la sospecha de PPC en niñas se basó en el reconocimiento del desarrollo mamario y la sospecha de PP; sin embargo, la referencia a la UEP ocurrió tardíamente; ya que, la edad cronológica fue mayor a 8 años, la edad ósea fue significativamente mayor a la cronológica, el z-talla de las niñas fue significativamente mayor a la z-talla genética. Además, se encontró un desarrollo mamario avanzado, los cuales podrían influenciar negativamente en la TFA, puesto que la PTFA fue significativamente menor respecto a la TG.















