Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista Peruana de Biología
versão On-line ISSN 1727-9933
Rev. peru biol. vol.25 no.2 Lima abr./jun. 2018
http://dx.doi.org/10.15381/rpb.v25i2.14289
NOTA CIENTÍFICA
Composición química del aceite esencial de las hojas de Hedyosmum luteynii Todzia (Chloranthaceae)
Chemical composition of the essential oil of the leaves of Hedyosmum luteynii Todzia (Chloranthaceae)
Silvia Hipatia Torres Rodríguez* 1, María Clarisa Tovar Torres 2, Víctor Julio García 1,3, María Eugenia Lucena4,5, Liliana Araujo Baptista 4
1 Facultad de Ingeniería, Universidad Nacional de Chimborazo, Riobamba, Ecuador.
2 Facultad de Ciencias, Universidad Nacional de Educación Enrique Guzmán y Valle, Lima, Perú.
3 Facultad de Ciencias, Universidad de Los Andes, Mérida, Venezuela.
4 Facultad de Ciencias de la Salud, Universidad Nacional de Chimborazo, Riobamba, Ecuador.
5 Facultad de Farmacia y Bioanálisis, Universidad de Los Andes, Mérida, Venezuela.
Resumen
El objetivo de este trabajo fue la caracterización química del aceite esencial de Hedyosmum luteynii, a partir de muestras recolectadas en el bosque natural Jacarón, cantón Colta, provincia de Chimborazo, Ecuador. El aceite esencial se extrajo por hidrodestilación; el análisis de la composicion se realizó mediante un cromatógrafo de gases acoplado a un espectrómetro de masas; la identificación de los componentes se realizó por comparación de sus espectros de masas y de los índices de Kováts reportados en la literatura. Se identificaron 28 compuestos, correspondientes al 98.62% del total de los constituyentes, siendo la mayoría monoterpenos hidrocarburos naturales (83.21%). Los constituyentes más abundantes fueron: α-felandreno (32.72%), α-pineno (13.20%), (Z)-β-ocimeno (10.99%), silvestreno (6.51%), biciclogermacreno (5.05%), 1.8-cineol (4.95%), (E)-β-ocimeno (3.88%) y germacreno D (3.20%). Es la primera vez que se reporta al silvestreno como un componente importante en el aceite esencial de una de las especies del genero Hedyosmum. Este resultado hace evidente una marcada diferencia en la composición química del aceite esencial de H. luteynii respecto a otras especies del género Hedyosmum.
Palabras claves: Hedyosmum luteynii; aceite esencial;α-felandreno; β-pineno; (Z)-β-cimeno; silvestreno.
Abstract
In this work, essential oil of Hedyosmum luteynii is characterize from samples collected in the Jacarón natural forest, Colta, Chimborazo, Ecuador. The essential oil was extracted by hydrodistillation; analysis of the composition was carried out by gas chromatograph, coupled to a mass spectrometer; identification of the components was made by comparing their mass spectra and the Kováts indexes reported in the literature. Twenty-eight compounds were identified, 98.62% of the total components. Natural hydrocarbon monoterpenes were the highger (83.21%). The most abundant components were: α-phellandrene (32.72%), α-pinene (13.20%), (Z)-β-ocimene (10.99%), silvestrene (6.51%), bicyclogermacrene (5.05%), 1.8-cineol (4.95%), (E)-β-ocimene (3.88%) and germacrene D (3.20%). For first time, silvestrene is reported as an important component of essential oil in one of the species of the genus Hedyosmum. This result is a important difference in the chemical composition of the essential oil of H. luteynii respect to other species of Hedyosmum.
Keywords: Hedyosmum luteynii, essential oil, α-phellandrene, β-pinene, ocimene, sylvestrene.
Introducción
Hedyosmum luteynii Todzia (Chloranthaceae) es un árbol de 3 – 16 m de altura, con flores verdes, carente de estambres o carpelos, frutas negras, hojas brillantes y aromáticas (Todzia 2012). Hedyosmum luteynii crece de manera silvestre en bosques montanos a una altitud de 2600 – 3600 m y se puede encontrar en regiones desde el centro de Colombia (cordillera central) hasta la cordillera oriental en el centro de Ecuador (Todzia 2012). Hedyosmum es uno de los 4 géneros de plantas con flores perteneciente a la familia Chloranthaceae (Ascarina, Chloranthus, Hedyosmun y Sarcandra) (Carlquist 1992). Esta familia está constituida por aproximadamente 75 especies cuyo ascendiente genético común es una flor fosilizada similar a Hedyosmun que proveniente del cretáceo temprano y que fue encontrada en Barremian-Aptian Portugal (Antonelli & Sanmartín 2011). En el Ecuador se encuentran aproximadamente 12 de las 40 especies del género Hedyosmum: H. anisodorum Todzia, H. cuatrecazanum Occh., H. cumbalense Karsten, H. goudotianum Solms-Laub., H. luteynii Todzia, H. purpurascens Todzia, H. racemosum (Ruiz & Pavón) G. Don, H. scabrum (Ruiz & Pavón) Solms-Laub., H. spectabile Todzia, H. sprucei Solms-Laub., H. strigosum Todzia y H. translucidum Cuatrec (Ulloa-Ulloa & Jorgensen 1993).
La composición química del aceite esencial de al menos 10 de las 40 especies del género Hedyosmun han sido estudiadas por varios autores: H. mexicanum Cordemoy –Costa Rica–, H. bonplandianum HBK –Costa Rica– y H. costaricensis C.E. Woody –Costa Rica– (Mundina et al. 2000); H. arborescens Sw. Caribe –Guadalupe– (Sylvestre et al. 2007); H. brasiliense Mart. Ex Mid. –Brasil- (Murakami et al. 2017); H. brasiliense Miq. –Brasil– (Kirchner et al. 2010); H. glabratum Kunh –Venezuela– (Danis et al. 2012); H. colombianum Cuatrec –Colombia– (Delgado et al. 2010); H. translucidum Cuatrec –Colombia– (Zamora-Burbano & Arturo-Perdomo 2016); H. angustifolium (R et P.) Solms-Laubach –Bolivia– y H. scambrum (R et P.) Solms-Laubach –Bolivia– (Lorenzo et al. 2003); H. sprucei Solms. –Ecuador– (Guerrini et al. 2016); H. scambrum (R. et P.) Solms –Perú– (De Feo & Urrunaga 2007); H. scambrum (R. et P.) Solms –Ecuador– (Morocho 2015).
Aunque, las especies del genero Hedyosmum tienen una larga historia de uso en la medicina tradicional con una variedad de propiedades biológicas/farmacológicas interesantes qué han sido científicamente confirmadas (Gupta 2006), no existen reportes de la composición química del aceite esencial de la especie H. luteynii. A pesar de que, H. luteynii tiene un amplio uso en la medicina tradicional del Ecuador, en particular en el tratamiento y alivio de infecciones respiratorias agudas y enfermedades diarreicas, que son las enfermedades con mayor tasa de morbilidad –cantidad de personas que se enferman en un sitio y tiempo determinado en relación con el total de la población– en el Ecuador (Gupta 2006).
El objetivo de este trabajo fue la caracterización química del aceite esencial de la especie H. luteynii recolectada en la Provincia de Chimborazo, Ecuador. El propósito es contribuir al conocimiento de las especies del genero Hedyosmun (Chloranthaceae), que pueden ser empleadas como fuente de nuevos principios activos, o bien de otros compuestos químicos que sirvan como base en la experimentación farmacológica o en la síntesis de nuevos medicamentos.
Materiales y métodos
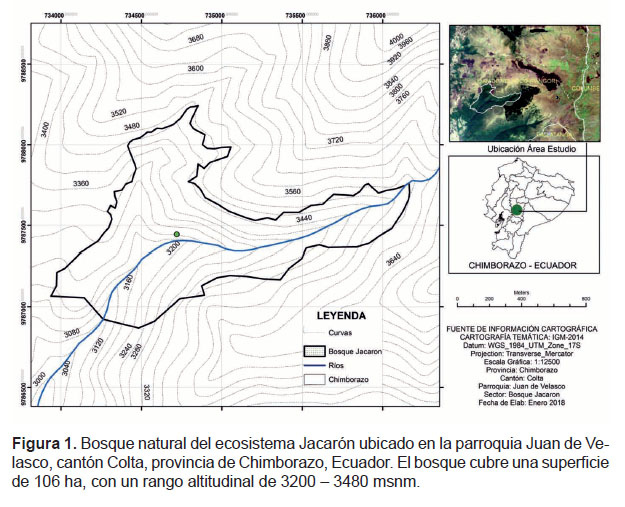
Recolección de material vegetal.- Las hojas frescas de H. luteynii fueron recolectadas de forma manual entre julio y agosto de 2017, en el bosque natural de Jacarón, ubicado en la parroquia Juan de Velasco, cantón Colta, provincia de Chimborazo, Ecuador (1°55'16.36158333"S, 78°53'14.99493303"W; coordenadas UTM: x = 735000. y = 9787500, zona 17S) (Figura 1). El bosque cubre una superficie de 106 ha, con un rango altitudinal de 3200 – 3480 m de altitud, con temperaturas que oscilan entre 9 a 12 oC y precipitación anual de 1200 mm. Los suelos están formados por cenizas volcánicas, con altos contenidos de materia orgánica, valores de pH entre 5.5 y 6.5; clasificados a nivel de gran grupo como Dystrandepts en el orden de inceptisoles, en correspondencia con suelos jóvenes de poco desarrollo que presentan gran acumulación de materia orgánica y saturación de bases menor al 50%.
La muestra testigo (Figura 2), una vez que su identificación taxonómica fue confirmada por MSc. Xavier Cornejo, curador asociado del Herbario GUAY, fue depositada en el Herbario GUAY de la Facultad de Ciencias Naturales de la Universidad de Guayaquil Ecuador bajo el código 0056. Las muestras se conservaron en sacos de polietileno, y fueron colocadas en resguardo en un lugar limpio y libre de humedad hasta su procesamiento. Posteriormente y antes de someterlas al proceso de extracción de sus aceites, se seleccionaron las hojas sanas, se lavaron con agua potable y finalmente fueron troceadas (licuadas).
Extracción del aceite esencial.- Las hojas frescas (5000 g) se licuaron e hidrodestilaron y colocaron en una trampa de Clevenger durante 4 horas, tal como lo especifica la Farmacopea Oficial Italiana (IPZS 2002). Los aceites obtenidos se decantaron, secaron con sulfato de sodio anhidro y se almacenaron en viales de vidrio oscuro y fueron mantenidos a 4 oC en un freezer hasta su correspondiente análisis. El rendimiento fue calculado en base de la masa del aceite y de la masa del material fresco utilizado en la extracción (Palá-Paúl 2002).
Cromatografía de gases acoplada a espectrometría de masas (CG-EM).- El estudio por CG-EM se realizó en un cromatógrafo Hewlett-Packard modelo 5973 serie II, equipado con columna capilar HP-5 MS (30 m de longitud, de 0.2 mm de diámetro interno, con un espesor de pared de 0.25 μm). La temperatura del puerto de inyección fue de 230 ºC y la del cuadrupolo 150 °C. Se utilizó helio como gas portador, a un flujo de 0.9 mL /min ajustado a una velocidad lineal de 34 m/s. La energía de la fuente de ionización fue de 70 eV con un rango de barrido de 40 – 500 amu a 3.9 scans/s. Se inyectó 1.0 μL del aceite diluido en n-heptano con una relación de split de 1:100.
La identificación de los componentes del aceite se realizó por comparación de sus espectros de masas con los reportados en la base de datos de la librería Wiley 6ta Edición y los índices de Kováts reportados en Adams (2007) y Davies (1990).
Resultados y discusión
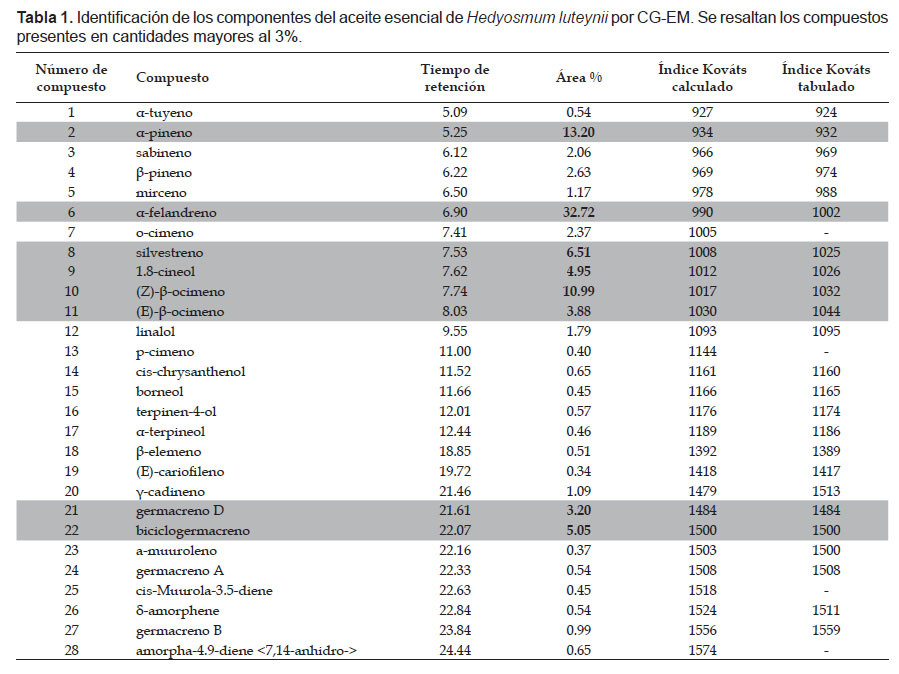
Del proceso de hidrodestilación se obtuvieron 5 mL de aceite esencial de H. luteynii con un rendimiento de 0.071% (0.071 mL/100 g de hojas). El color del aceite esencial obtenido fue amarillo claro de olor agradable, eucaliptico. Los constituyentes del aceite esencial se listan en la Tabla 1. Se identificaron 28 compuestos, correspondientes al 98.62% del total de los constituyentes en el aceite esencial de H luteynii. Todos los constituyentes fueron del tipo terpeno, principalmente monoterpenos C10H16 (83.21%) y sesquiterpenos C15H24 (13.73%). Sin embargo, dentro de estos tuvieron más importancia los hidrocarburos (96.94%) frente a los oxigenados (2.13%). El hecho de que los hidrocarburos superen a los oxigenados se debe a que al actuar como vectores de polinización o controladores del potencial hídrico los hidrocarburos pueden liberarse con mayor facilidad (Palá-Paúl 2002).
Los cuatro componentes más abundantes (suman 63.42%) fueron clasificados como monoterpenos. La prevalencia de monoterpenos en el aceite esencial de H. luteynii es comparable a lo reportado para otras de las especies Hedyosmum. También, se han encontrado prevalencia de los monoterpenos en H. mexicanum (Mundina et al. 2000), H. bonplandianum (Mundina et al. 2000), H. arborescens (Sylvestre et al. 2007), H. brasilense (Kirchner et al., 2010; Murakami et al., 2017), colombianum (Delgado et al. 2010), H. angustifolium (Lorenzo et al. 2003), y H. scambrum (Lorenzo et al., 2003; Morocho Zaragocín, 2015) (Tabla 2).
En general, el predominio de monoterpenos en el aceite esencial de H. luteynii responde a las características del medio donde se desarrolla esta especie (bosque montano alto, 3200 – 3480 m). Los suelos de estos bosques retienen grandes cantidades de agua y esta abundancia de agua hace difícil la liberación de terpenoides al medio, tal como se reporta para Eryngium corniculatum Lam (Palá-Paúl, 2002). Por lo tanto en el aceite esencial de H. luteynii son abundantes aquellos componentes con menor peso molecular que podrán ser desprendidos más fácilmente que aquellos de mayor peso molecular (Palá-Paúl, 2002).
En el aceite esencial de H. luteynii los constituyentes más abundantes fueron: α-felandreno (32.72%), (Z)-β-pineno (13.20%), (Z)-β-ocimeno (10.99%), silvestreno (6.51%), biciclogermacreno (5.05%), 1.8-cineol (4.95%), α-ocimeno (3.88%) y germacreno D (3.20%). En la Tabla 2, se puede observar que los constituyentes más abundantes del aceite esencial de H. luteynii son diferentes de los reportados para otras especies del genero Hedyosmum en el Ecuador, Perú, Bolivia, Colombia, Venezuela, Brasil, Costa Rica y Guadalupe.
Un análisis comparativo entre los constituyentes del aceite esencial de H. luteynii y de otras especies del género Hedyosmum reportados en la literatura (Tabla 2), permitió descartar los compuesto comunes. Este análisis arrojó como resultado que de los 28 compuestos identificados en el aceite esencial de H. luteynii, se han identificado como exclusivos de la especie H. luteynii: silvestreno (6.51%), cis-muurola 3-5-diene (0.45%), amorpha-4.9-diene <7,14-anhidro-> (0.65%).
El silvestreno ha sido tema de controversia los últimos 100 años y algunos investigadores sugieren que no es un hidrocarburo natural y que es un artefacto que se produce durante la extracción (Panda 2008). Así, por ejemplo, Ballesteros-García et al. (2013) reportaron que la acidez generada durante la destilación en corriente de vapor puede producir isomerización de 2-careno en silvestreno. La controversia surgió porque el punto de ebullición del silvestreno es alrededor de los 175 oC, así que es natural preguntarse ¿Es el silvestreno un producto de la hidrodestilación de un compuesto que se encuentra de manera natural en el material vegetal? La respuesta a esta pregunta se escapa al alcance de esta investigación. Se requieren más estudios y la consideración de mecanismos de transporte no convencionales para conseguir una respuesta apropiada. Un mecanismo de transporte a considerar es el que se usan para el crecimiento de cristales por transporte químico. Con esta técnica, en lugar de vaporizar un sólido (líquido) directamente a altas temperaturas, se puede vaporizar a temperaturas (T1) mucho más bajas formando intermedios químicos altamente volátiles con un elemento que sirve de transportador y luego se hace reaccionar la mezcla de gases resultante a una temperatura (T2) utilizando la dependencia de la temperatura del equilibrio químico implicado (T2 < T1) (Binnewies et al. 2013, Nitsche et al. 1961). Esta posibilidad toma fuerza si consideramos que el silvestreno es una mezcla de 2-careno que rápidamente se convierten en silvetreno (Singh 2007).
A pesar de esta controversia, existe un buen número de análisis de aceites esenciales donde se reporta al silvestreno como un constituyente del aceite. Así, Kumari et al. (2014) reportaron al silvestreno como un constituyente del aceite esencial en la fruta, flores, partes áreas y hojas en la familia de plantas: Apiaceae/ Umbrelliferae, Asteraceae/Compositae, Myrtaceae, Zingiberaceae, y Piperaceae. De manera similar, Liu et al. (2017) reportaron valores de silvestreno de 17 a 25% en plantas de Zanthoxylum bungeanum Maxim. (Rutaceae) cultivadas por 11 años. Gallucci et al. (2010) reportaron la existencia de silvestreno en el aceite esencial de hojas de Eugenia uniflora. Sin embargo, esta es la primera vez que se reporta al silvestreno como un constituyente importante en el aceite esencial de una de las especie del genero Hedyosmum de plantas con flores pertenecientes a la familia Chloranthaceae.
Algunos de los principales constituyentes del aceite esencial de H. luteynii han mostrado actividades que se pueden rela-la actividad del α-pineno como broncodilatador. Perry et al. cionar con los usos mencionados en la tabla 2. Por ejemplo: (2000) estudiaron el α-pineno como posible coadyuvante a las Acebey et al. (2010) mostraron la actividad anti-inflamatoria habilidades cognitivas de la memoria. del α-felandreno. Gil et al. (1989) mostraron la actividad anti-inflamatoria del α-pineno. Falk et al. (1990) estudiaronla actividad del α-pineno como broncodilatador. Perry et al. (2000) estudiaron el α-pineno como posible coadyuvante a las habilidades cognitivas de la memoria.
Literatura citada
Acebey L., V. Jullian, D. Sereno, et al. 2010. Anti-leishmanial lindenane sesquiterpenes from hedyosmum angustifolium. PlantaMedica, 76(4), 365–368. DOI: 10.1055/s-0029-1186192. [ Links ]
Adams R. 2007. Identification of essential oils components by gas chromatography/ mass spectroscopy. (A. P. Corporation,Ed.) (4th edición). Carol Stream, Illinois. USA. [ Links ]
Antonelli A. & I. Sanmartín. 2011. Mass Extinction, gradual cooling, orrapid radiation? reconstructing the spatiotemporal evolutionof the ancient angiosperm genus hedyosmum (Chloranthaceae) using empirical and simulated approaches. SystematicBiology, 60(5), 596–615. DOI: 10.1093/sysbio/syr062 [ Links ]
Ballesteros-García, P., Claramunt-Vallespí, R., Sanz del Castillo, D., &Teso-Vilar, E. (2013). Química orgánica avanzada. Madrid España: Universidad Nacional de Educación a Distancia. Retrieved from www.uned.es/publicacione [ Links ]
Binnewies M., R. Glaum, M. Schmidt & P. Schmidt. 2013. Chemical vapor transport reactions - A historical review. Zeitschrift FurAnorganische Und Allgemeine Chemie, 639(2), 219–229. DOI: 10.1002/zaac.201300048 [ Links ]
Cardenas L.C., J. Rodriguez, M.C. Villaverde, et al. 1993. The analgesic activity of Hedyosmum-Bonplandianum - Flavonoid Glycosides. Planta Medica, 59. 26–27. DOI: 10.1055/s2006-959597 [ Links ]
Carlquist, S. (1992). Wood anatomy of Hedyosmum (Chloranthaceae)and the tracheid-vessel element transition. Aliso: A Journal of Systematic and Evolutionary Botany, 13(3), 447-462. DOI:10.5642/aliso.19921303.04 [ Links ]
Danis, M., J. Ortega, N. Peña, L. Rojas, & Y. Cepeda. (2012).Composición química del aceite esencial de Hedyosmum glabratum. Ciencia, 20. http://www.produccioncientifica.luz.edu.ve/index.php/ciencia/article/view/10071. [ Links ]
Davies N.W. 1990. Gas chromatographic retention indices of monoterpenes and sesquiterpenes on methyl silicone and Carbowax 20M phases. Journal of Chromatography, 503. 1–24. DOI: 10.1016/S0021-9673(01)81487-4 [ Links ]
De Feo V. & R. Urrunaga Soria. 2007. Composition of the Essential Oilof Hedyosmum scabrum (R. et P.) Solms (Chloranthaceae). Journal of Essential Oil-Bearing Plants, 10(1), 41–45. DOI:10.1080/0972060X.2007.10643517 [ Links ]
Delgado, P.A., C.E. Quijano, G. Morales & J.A. Pino. 2010. Composition of the Essential Oil From Leaves and Fruits ofHedyosmum colombianum Cuatrec. Grown in Colombia. Journal of Essential Oil Research, 22(May/June). DOI:10.1080/10412905.2010.9700312. [ Links ]
Falk A.A., M.T. Hagberg, A. E. Lof, et al. 1990. Uptake, distribution and elimination of alpha-pinene in man after exposure by inhalation. Scandinavian Journal of Work, Environment & Health, 16. 372–378. http://www.jstor.org/stable/40965820 [ Links ]
Gallucci S., A.P. Neto, C. Porto, et al. 2010. Essential oil of eugenia uniflora L.: An industrial perfumery approach. Journal of Essential Oil Research, 22(2), 176–179. DOI:10.1080/10412905.2010.9700296 [ Links ]
Gil M.L., J. Jimenez, M.A. Ocete, et al. 1989. Comparative study of different essential oils of Bupleurum gibraltaricum Lamarck.Pharmazie, 44. 284–287. http://europepmc.org/abstract/ med/2772005 [ Links ]
Guerrini A., G. Sacchetti, A. Grandini, et al. 2016. Cytotoxic Effect and TLC Bioautography-Guided Approach to Detect HealthProperties of Amazonian Hedyosmum sprucei Essential Oil.Evidence-Based Complementary and Alternative Medicine.DOI:10.1155/2016/1638342 [ Links ]
Gupta M.P. 2006. Medicinal plants originating in the andean high plateau and central region of Bolivia, Ecuador and Peru. Thefuture of products of the andean high plateau and central valleys. REPORT. Submitted to the United Nations Industrial Development Organization, in relation to the Special Service Agreement SSA No. 06-705/A/JP Index Number E940596. http://repositorio.promperu.gob.pe/repositorio/ 123456789/1455
IPZS (Istituto Poligrafico e Zecca dello Stato). 2002. Farmacopeaufficiale della Repubblica Italiana (11th Ed.). Roma-Italy. [ Links ]
Kirchner K., A. Wisniewski, A.B. Cruz, et al. 2010. Chemical composition and antimicrobial activity of Hedyosmum brasiliense Miq., Chloranthaceae, essential oil. Revista Brasileira de Farmacognosia Brazilian Journal of Pharmacognosy, 20(5), 692–699. DOI: 10.1590/S0102-695X2010005000005 [ Links ]
Kumari S., S. Pundhir, P. Priya, et al. 2014. EssOilDB: A database of essential oils reflecting terpene composition and variability in the plant kingdom. DOI:10.1093/database/bau120 [ Links ]
Liu S., S. Wang, S. Song, et al. 2017. Characteristic differences in essential oil composition of six Zanthoxylum bungeanum Maxim. ( Rutaceae ) cultivars and their biologicalsignificance. Journal of Zheijang University-SCIENCE B (Biomedicine & Biotechnology), 18(10), 917–920. DOI: 10.1631/jzus.B1700232) [ Links ]
Lorenzo D., I. Loayza & E. Dellacassa. 2003. Composition of the essential oils from leaves of two Hedyosmum spp. fromBolivia. Flavour and Fragrance Journal, 18(1), 32–35. DOI:10.1002/ffj.1146 [ Links ]
Morocho Zaragocín, S.V. 2015. Valutazione ecologica, studio fitochimico ed analisi dell olio essenziale di Hedyosmumscabrum (Ruiz & Pav.) Solms (Chloranthaceae), dallaProvicia di Loja e Zamora - Ecuador. Universita Degli studi di Pavia. http://repositorio.educacionsuperior.gob.ec/bitstream/28000/1724/1/T-SENESCYT-00820.pdf [ Links ]
Mundina M., R. Vila, F. Tomi, et al. 2000. Composition of the essentialoils from leaves and fruits of three Hedyosmum species fromCosta Rica. Flavour and Fragrance Journal, 15(3), 201–205.DOI: 10.1002/1099-1026(200005/06)15:3<201::AIDFFJ893>3.0.CO;2-I [ Links ]
Murakami C., I. Cordeiro, M. Scotti, et al. 2017. Chemical Composition, Antifungal and Antioxidant Activities of Hedyosmum brasiliense Mart. ex Miq. (Chloranthaceae) Essential Oils. Medicines, 4(3), 55. DOI: 10.3390/medicines4030055 [ Links ]
Nitsche R., H.U. Bölsterli & M. Lichtensteiger. 1961. Crystalgrowth by chemical transport reactions-I. Journal ofPhysics and Chemistry of Solids, 21(3/4), 199–205.DOI:10.1016/0022-3697(61)90098-1 [ Links ]
Palá-Paúl J. 2002. Contribución al conocimiento de los aceites esenciales del género "Eryngium" L, en la Península Ibérica. TesisDoctoral. Universidad Complutense de Madrid, Facultad de Ciencias Biológicas, Departamento de Biología Vegetal I (Botánica). http://eprints.ucm.es/4593/ [ Links ]
Panda H. 2008. Handbook on Oleoresin and Pine Chemicals (Rosin, Terpene Derivatives, Tall Oil, Resin & Dimer Acids). New Delhi - India: Discovery Publishing House. [ Links ]
Perry N.S., P.J. Houghton, A. Theobald, et al. 2000. In-vitro inhibition of human erythrocyte acetylcholinesterase bysalvia lavandulaefolia essential oil and constituent terpenes. Journal of Pharmacy and Pharmacolgy, 52. 895–902.DOI:10.1211/0022357001774598. [ Links ]
Singh G. 2007. Chemistry of Terpenoids and Carotenoids. Sachin Printers, Delhi-India. [ Links ]
Sylvestre M., A. Pichette, A. Longtin, et al. 2007. Chemical Composition of Leaf Essential Oil of Hedyosmum arborescens and Evaluation of Its Anticancer Activity. Natural Product Communications, 2(12), 1269–1272. [ Links ]
Todzia C.A. 2012. Four New Species of Hedyosmum (Chloranthaceae)from South America. Systematic Botany, 13(1), 21–31.http://www.jstor.org/stable/2419238. [ Links ]
Ulloa-Ulloa C., P. Acevedo-Rodríguez, S. Beck, et al. 2017. Anintegrated assessment of the vascular plant species of the Americas. Science, (358), 1614–1617. DOI: 10.1126/science.aao0398. [ Links ]
Ulloa-Ulloa C. & P.M. Jorgensen. 1993. Arboles y arbustos de los Andes del Ecuador (No. Report 30. 2da ed.). Abya-Yala, Quito Ecuador. Retrieved from http://www.efloras.org.
Zamora-Burbano A.M. & Da.E. Arturo-Perdomo. 2016. Composición química del aceite esencial de hojas Hedyosmumtranslucidum Cuatrec. Chloranthaceae (Granizo). Boletín Latinoamericano y del Caribe de Plantas Medicinales yAromáticas, 15(3), 192–198. http://www.blacpma.usach.cl/sites/blacpma/files/articulo_7_-_1030_-_192_-_198_0.pdf [ Links ]
Información sobre los autores:
ST, MT, VG, ML, LA: realizaron el diseño experimental; ST, ML, VG: realizaron los experimentos; ST, VG, ML, LA: analizaron los datos; ST, VG: redactaron el manuscrito; ST, MT, VG, ML, LA: revisaron y aprobaron el manuscrito.
Los autores no incurren en conflictos de intereses.
*Autor para correspondencia.
E-mail Silvia Hipatia Torres Rodríguez: storres@unach.edu.ec
E-mail María Clarisa Tovar Torres: mtovart@yahoo.es
E-mail Víctor Julio García: vgarcia@unach.edu.ec
E-mail María Eugenia Lucena: mlucena@unach.edu.ec
E-mail Liliana Araujo Baptista: laraujo@unach.edu.ec
Presentado: 06/02/2018
Aceptado: 21/03/2018
Publicado online: 30/05/2018