Introducción
Las aguas residuales proceden de diversas actividades humanas, como desechos urbanos y procesos industriales, y requieren una fiscalización ambiental y un adecuado manejo por parte de las entidades involucradas y de los investigadores, debido a que las descargas son vertidos a cuerpos de agua naturales, generando problemas de contaminación por el exceso de nutrientes, en algunos casos la eutrofización de los mismos, afectando los procesos naturales de purificación y la capacidad de asimilación de estos ecosistemas acuáticos (Aslan & Kapdan 2006, Rawat et al. 2011, Renuka et al. 2013, Gonçalves et al. 2016, Winkler & Straka 2019).
A fin de mejorar las características y la calidad de los efluentes a descargar, se desarrollaron las plantas de tratamiento con las siguientes etapas: Pretratamiento, donde se eliminan materias gruesas; tratamiento primario o físico, se realiza la remoción de los sólidos suspendidos; tratamiento secundario o biológico, donde se busca la reducción de materia orgánica, fue diseñado tomando como ejemplo el proceso biológico de la autodepuración que ocurre de manera natural, para que este proceso se haga efectiva y eficiente, deben de existir condiciones adecuados, sin embargo, los efluentes aun contienen alta carga orgánica y microorganismos patógenos, haciendo necesario un tratamiento terciario que normalmente implica una cloración, proceso altamente costoso restringiendo su aplicación (Libhaber & Orozco-Jaramillo 2012, Tilley et al. 2014, Raouf et al. 2019, Herrera 2020).
En la actualidad, el tratamiento terciario convencional de aguas residuales enfrenta el reto de disminuir dichos excesos, por este motivo las recientes investigaciones están orientadas en la búsqueda de innovación tecnológica efectivas y de bajo costo (Gonzales-Fernandez & Muñoz 2018). Diferentes investigaciones, especialmente los enfocados en tratamientos biológicos, han propuesto la ficorremediación, es decir la utilización de microalgas, porque los componentes presentes en las aguas residuales son favorables para su desarrollo (Maity 2014, Yongjun 2016, Khanna et al. 2019). Las microalgas, son una excelente opción, debido a su fácil capacidad de adaptación, resistencia y utilización de nitritos y fosfatos como fuentes de alimentación, además, la posibilidad de utilizar la biomasa microalgal como matriz en energías renovables, así como también generar biocompuestos de alto valor agregado (Khatoon & Pal 2015, Khan et al. 2018, Khanna et al. 2019).
Para la ficorremediación se ha planteado la utilización de cultivos monoespecíficos o consorcios, conociéndose en la actualidad un determinado número de especies de microalgas aptas para la biorremediación, con ventajas importantes principalmente en la reducción de nutrientes lo que mejora la calidad del efluente (AbdelRaouf 2012, Arbib et al. 2014, Uggetti et al. 2018). En algunas investigaciones se redujo el 100% de las concentraciones de nutrientes, estos valores dependen de la especie empleada y las características del agua residual (Markou & Georgakakis 2011, Acién et al. 2016, Mujtaba & Lee 2017, Acién et al. 2018, Liu et al. 2019). Se han reportado algunas microalgas clorofitas como opciones viables para la ficorremediación, entre los géneros se encuentran Scenedesmus, Chlorella, Phormidium, Botryococcus, Chlamidomonas (Martínez et al. 2000, Hernández et al. 2006, Park et al., 2010, Wang et al. 2010) y algunas cianofitas como Arthrospira (Lodi et al. 2003, Olguín et al. 2003, Hernandez-Perez & Labbé 2014).
En nuestro país, existen escasos registros sobre la utilización de las microalgas para la recuperación de aguas residuales descargadas al sistema de alcantarillado o vertidas a un cuerpo de agua con valores de nutrientes permisibles. En tal sentido, en este estudio evaluamos las cepas microalgales Chlorella vulgaris y Demodesmus asymmetricus, con el fin de determinar la proporción que remueve la mayor concentración de nitrógeno y fósforo, a fin de proponer el cultivo de microalgas como una alternativa para el tratamiento de aguas residuales.
Material y métodos
Cultivo inicial de microalgas
Las microalgas evaluadas fueron Desmodesmus asymmetricus código IMPBG-249 y Chlorella vulgaris código IMP-BG-020, proporcionadas en volumen de 250 mL por el Banco de Germoplasma de Organismos Acuáticos del IMARPE, con densidades celulares de 4.80 ± 0.59 y 5.60 ± 0.14 (x106 cel/mL), respectivamente. Se continuó el escalonamiento a 500 mL, 1 L y 7 L, con intervalos de 5 días en el Laboratorio de Alimento Vivo del IMARPE. Se utilizó el medio de cultivo CHU (Creswell, 1993) en una concentración de 1 mL/L y en el cultivo de 7 L se utilizó el Nutriente foliar líquido Bayfoland ® en una concentración de 0.28 mL/L. Los cultivos permanecieron a pH 7.5 ± 0.5, temperatura 20.0 ± 1.5 °C, aireación constante e iluminación constante en el rango de 1500 2500 Lux. Luego, los cultivos en la fase exponencial fueron trasladados al laboratorio de Invernadero y Sala de procesos del IMARPE, para los ensayos de biorremediación.
Muestra de agua residual
La muestra del efluente fue proporcionada por la Planta de Tratamiento de Aguas Residuales (PTAR) La Taboada, Callao, Lima (-11.995590354126339, -77.13342190490293), el 16 de agosto de 2018. Se colectó 50 L in situ, en el canal de salida de la misma, en ese punto se obtuvo el efluente del tratamiento preliminar avanzado de la PTAR, el cual se le retuvo todos los sólidos mayores a 1 mm, arenas y grasas.
Previo al experimento, el efluente fue colocado en reposo y oscuridad por un intervalo de 7 días, a una temperatura de 18 °C, generando anaerobiosis y sedimentación, con esas condiciones se evitó la proliferación de organismos fotoautótrofos, se logró la sedimentación de los quistes de protozoos y huevos de helmintos (principales depredadores de las microalgas) y también un decaimiento en la concentración de bacterias.
Optimización de la proporción de las microalgas
D. asymmetricus y C. vulgaris.Se aplicó el diseño de mezclas con el software estadístico Minitab 17. Se realizó un diseño de mezclas de vértices extremos con dos componentes por triplicado y aleatorizado. Como variable respuesta se evaluó la remoción de los nitratos y fosfatos del agua residual (Tabla 1) y como control el agua residual sin microalgas (C1). La aireación en los tratamientos, se realizó de manera mecánica (agitación horizontal) 3 veces al día (8, 12 y 16 horas), la experimentación fue realizado por 9 días con fotoperiodo 12:12 h, bajo condiciones de un invernadero. Se evaluó el análisis de varianza (ANOVA) con un nivel de significancia α = 0.05.
Monitoreo de parámetros abióticos
La medición de los parámetros abióticos se realizó durante 8 días, 3 veces al día (8, 12 y 16 horas), con un Multiparámetro portátil Multi 350i/SET WTW, el pH y la Temperatura (°C) se midió con un electrodo combinado SenTixTM 41, mientras, el Oxígeno Disuelto (OD) (mg/L) y la salinidad (ppm) con un sensor combinado de conductividad y oxigeno OxiCal® -Cx.
Monitoreo de macronutrientes (N y P)
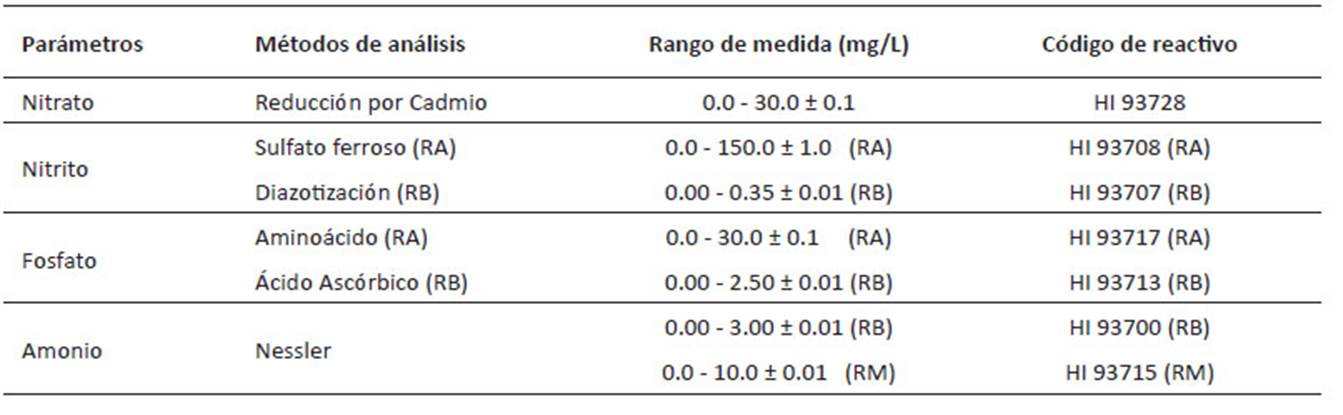
Para el análisis del nitrato (NO --N), nitrito (NO --N), fosfato de cada tratamiento a las 8 de mañana y se realizaron las lecturas por 9 días, empleando un fotómetro multiparámetro para laboratorios HI 83200 (Hanna Instruments). Fueron utilizados tres rangos, rango alto (RA), rango bajo (RB) y rango medio (RM) (Tabla 2).
Resultados y discusión
Monitoreo de parámetros abióticos
Oxígeno disuelto (OD)
El nivel de OD en aguas naturales y residuales depende de las actividades físicas, químicas y bioquímicas del receptor de agua. Su cuantificación es determinante en la polución del agua y en el control de procesos de tratamiento de desechos (Rice et al., 2012). Por otro lado, el OD es un indicador de la actividad fotosintética de las microalgas y los valores registrados son más altos que los encontrados en equilibrio con el aire (Su et al. 2012b). La variación del OD en los 6 tratamientos se muestra en la Figura 1.
Tabla 1 Diseño de mezclas del experimento para el tratamiento del efluente de la PTAR Taboada con las microalgas Desmodesmus asymmetricus y Chlorella vulgaris.
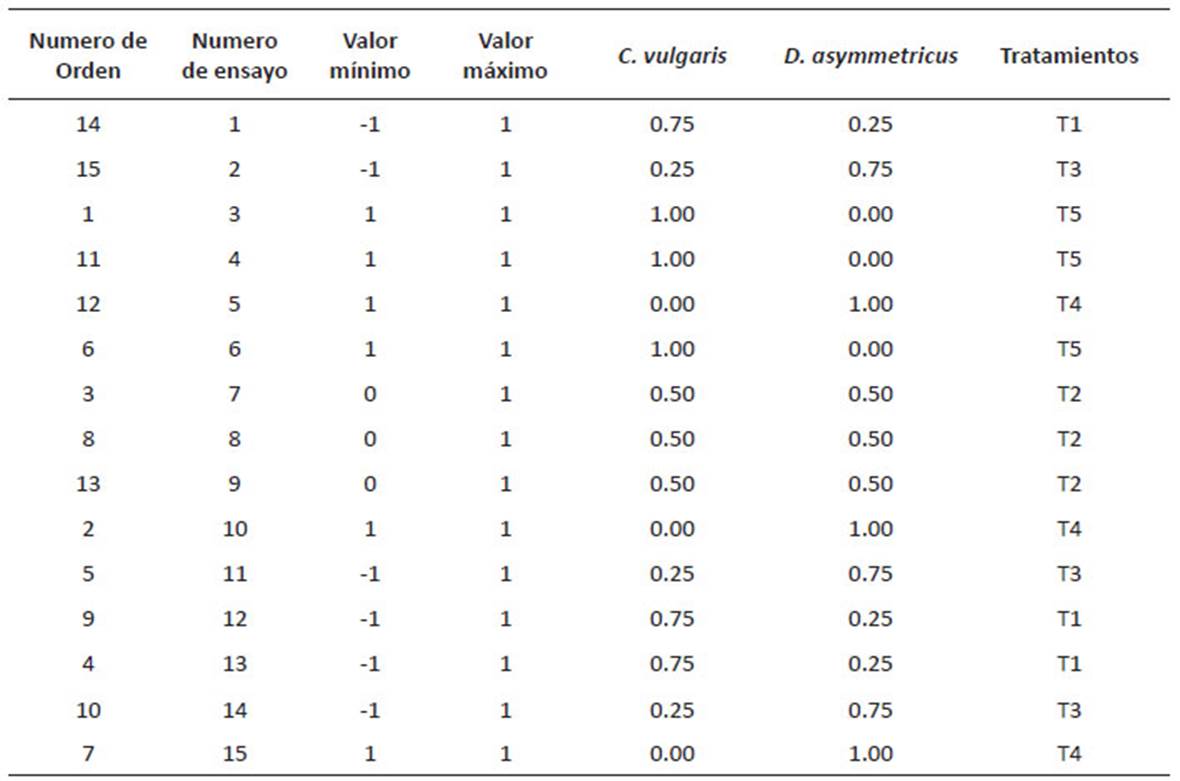
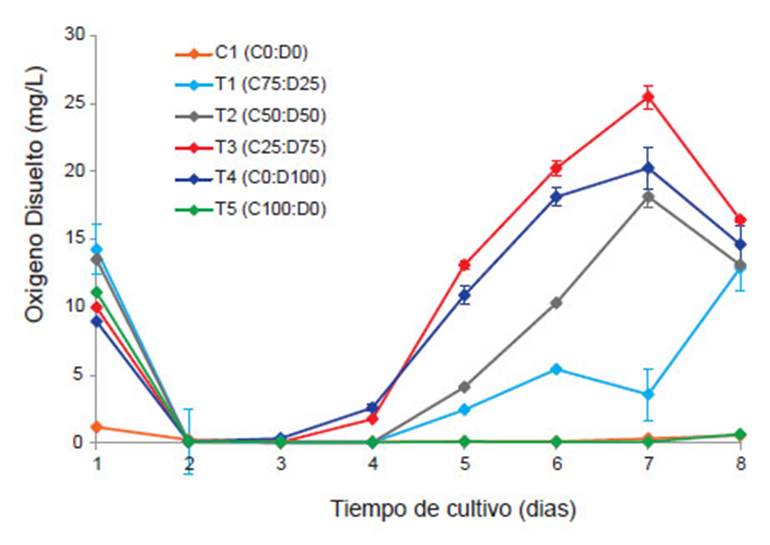
Figura 1 Variación diaria de la cantidad de Oxígeno Disuelto (mg/L) (barras verticales son la desviación estándar).
Al iniciar el experimento el OD (mg/L), registró valores de 11.59 ± 2.03, luego tuvo una disminución hasta 0.12 ± 0.11, durante los 3 primeros días de experimentación (Fig. 1), esto posiblemente debido al consumo realizado por microorganismos heterotróficos (principalmente bacterias aeróbicas), sin embargo, a partir del día 3 comenzó a incrementarse, debido a la actividad fotosintética realizada por las microalgas, se alcanzaron valores máximos durante el día 7 del experimento (T3 =25.50 ± 0.28, T4 = 20.26 ± 2.47 y T2 = 18.14 ± 0.63), se obtuvo diferencias significativas en todos los tratamientos evaluados excepto entre C1-T5 (p=0.970).
Estas concentraciones son superiores a los reportados por Su et al. (2012), quienes emplearon consorcios nativos de microalgas/lodos activados, en diferentes concentraciones, durante 14 días, y el incremento del OD comenzó a partir del segundo día (tratamiento solo con microalgas), mientras en los demás a partir del octavo día. De igual manera en el estudio de Maity et al. (2014), con la cianobacteria Leptolyngbya sp. después de 7 días de cultivo el OD alcanzó un valor máximo de 7.96 ± 0.87, uno de los últimos estudios realizado por López et al. (2016), también empleando consorcios nativos de microalgas/lodos activados, obtuvieron concentraciones máximas de 19.46 al cuarto día de cultivo (tiempo de duración del experimento) y el incremento del OD comenzó a partir del segundo día.
En la Figura 1, se puede observar que los tratamientos con C. vulgaris, presentan menor OD, es más notorio en T5 (100% C. vulgaris), donde se registró un mínimo incremento del OD (0.65 ± 0.54) al día 8 del experimento, posiblemente está asociado a la ausencia del incremento de la densidad microalgal, y la poca aglomeración para incrementar la superficie de absorción y lograr capturar de manera más eficiente los nutrientes disponibles a su alrededor (Kagami & Urabe 2001) a diferencia de D. asymmetricus que son organismos coloniales agrupadas en cenobios, formadas en general por 4 células, dispuestas lado a lado (Lee 2008).
Potencial de hidrógeno (pH)
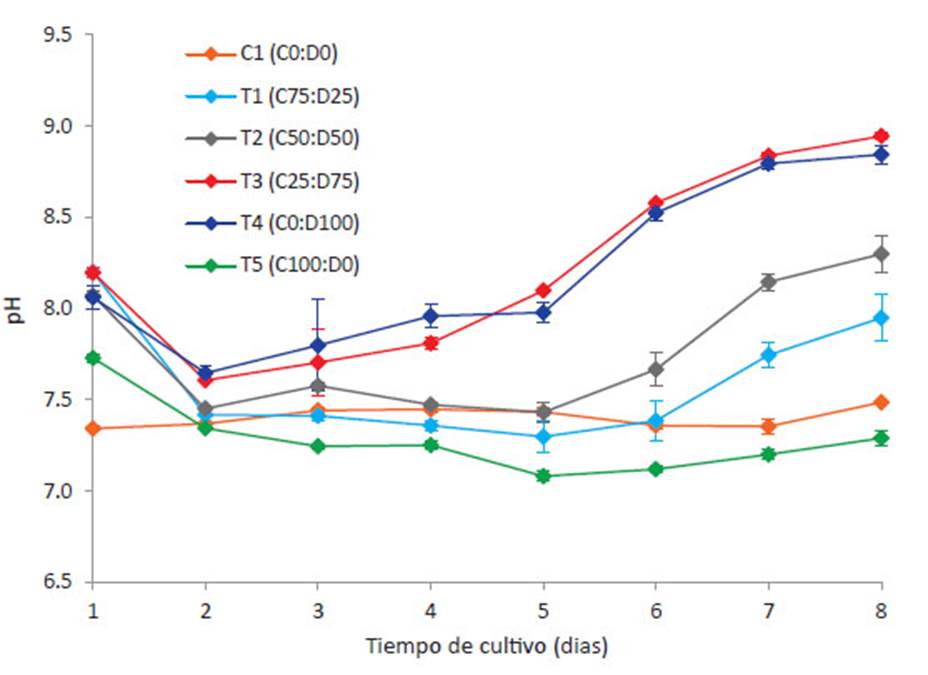
El pH es uno de los factores importantes en el cultivo de microalgas, debido a que su variación en el medio de cultivo puede afectar el metabolismo celular y el incremento de la biomasa microalgal. Cada especie de microalga, necesita un rango determinado de pH que permita un crecimiento óptimo (Xin 2010, Zhang 2014), dependiendo de qué especies químicas esté más habituada a asimilar (De Morais & Costa 2007), se ha indicado el pH 8 es el más indicado para especies dulceacuícolas (Park et al., 2011), sin embargo, en cultivos continuos de los géneros Chlorella y Desmodesmus, se encontraron mejores resultados sobre la producción de biomasa en pH entre 7.2 8.7 (Azov 1982, Ma et al. 2014). La variación del pH en los 6 tratamientos se presenta en la Figura 2.
El pH, al segundo día del experimento presento una caída en todos los tratamientos, alrededor de 7.47 ± 0.13, debido a la baja actividad fotosintética y al proceso de nitrificación. Al final del experimento, se registraron diferencias significativas entre los tratamientos evaluados, excepto entre C1-T5 (p=0.941), T1-T2 (p=0.439) y T3-T4 (p=0.998). En T1, T2, T3 y T4, a partir del día 4, el pH del cultivo comenzó a incrementarse posiblemente por efecto de la fotosíntesis (proceso de alcalinización), en T3 y T4 se encontraron los mayores valores durante el octavo día (8.95 ± 0.03 y 8.84 ± 0.09, respectivamente), en el caso de C1 y T5, los valores se mantuvieron estables hasta el final del experimento.
La microalga C. vulgaris normalmente es cultivada a pH ácido, se presume que para su crecimiento prefiere asimilar el ácido carbónico (H2 CO3 ) como fuente de carbono. Esto se debe a que a pH por debajo de 7.0, el medio de cultivo está dominado por moléculas de CO2 libres o H2 CO3 cuando el CO2 se disuelve en agua (Abalde 1995). En el caso de T1 y T5, esto se lograría mediante la aireación o inyección controlada de CO , cosa que no se realizó en este experimento, solamente se realizó la agitación horizontal 3 veces al día. A menudo en el cultivo C. vulgaris, se realiza un control de pH a través del rociado directo de gas de fuentes industriales y municipales (Ge & Champagne, 2016). Todo lo contrario, con el género Scenedesmus, Su et al. (2012a) descubrieron que la condición ácida dio como resultado un bajo crecimiento de las microalgas y por ende una baja eficiencia en la eliminación de nutrientes.
Por último, empleando consorcios nativos de microalgas y lodos activados, en diferentes concentraciones, encontraron resultados similares a nuestro experimento, el pH en el tratamiento solo con algas, se incrementó a alrededor de 9.2 después de los primeros 7 días y se mantuvo estable hasta el final de la prueba (Su et al. 2012, López 2016). Se han reportado resultados similares en cultivos Phormidium sp., Chlamydomonas reinhardtii y Scenedesmus rubescens, llegando a la conclusión que el pH óptimo está en el rango neutral a ligeramente alcalino (6.0 hasta 8.3) (Azov 1982; Olaizola 2003; Ying et al. 2014, López 2016, Beltrán-Rocha et al. 2017, Morales et al. 2018).
Macronutrientes (N y P)
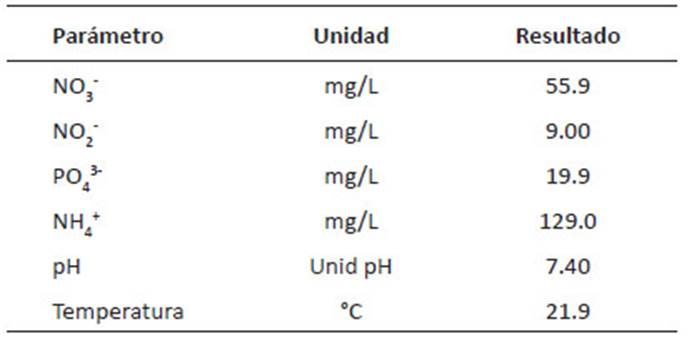
El primer paso para el tratamiento de aguas residuales es conocer su composición inicial y de este modo decidir su uso como medio de cultivo, en razón de ello, primero se determinó, según Redfield 1958, la relación N/P (18.3) (Tabla 3), ya que el incremento de la densidad microalgal y la eliminación de N y P están afectados por las proporciones de N/P. Durante el experimento esta relación tuvo una variación desde 5 hasta 18, estos valores se encuentran dentro del rango establecido como relación óptima para la eliminación de nutrientes con microalgas, el cual varía de 5 a 30, dependiendo de las condiciones de las aguas residuales y es especie específica. Algunas investigaciones en D. asymmetricus registraron la proporción optima entre 9 y 13, y para C. vulgaris entre 11 y 19 (Choi & Lee, 2014), mientras en cultivos mixtos entre 5 y 20 (Prathima et al. 2012).
Dado que la descarga del efluente tratado proveniente de la PTAR La Taboada, muestra una composición adecuada para el cultivo de microalgas, se realizó el experimento.
Tabla 3 Características del efluente de la Planta de Tratamiento de Aguas Residuales (PTAR)La Taboada.
Nitrógeno (NH + / NO --N / NO --N)
La eliminación de nutrientes, entre ellos el nitrógeno, es básicamente un efecto de la asimilación de nutrientes a medida que crecen las microalgas, es el constituyente de los ácidos nucleicos, aminoácidos y de todas las proteínas sintetizadas en base a estos, los cuales son esenciales para su funcionamiento (Beltrán-Rocha et al. 2017, Lachmann et al. 2019).
El nitrógeno en forma de amonio (NH +), tuvo una concentración inicial de 59.8 mg/L. A lo largo del experimento en presencia de los tratamientos no se logró observar una tendencia clara en la disminución de la concentración de NH +. La remoción diaria de NH + se observa en la Figura 3A, se registraron diferencias significativas entre los tratamientos evaluados excepto entre T2-T3 (p=0.651) y T1-T4 (p=0.539), el tratamiento C1 fue significativamente menor a los demás tratamientos (p<0.01). Se observa la mayor eficiencia de eliminación entre los días 8 y 9 en los tratamientos T2 y T3 (24.0 ± 0.35, 17.8 ± 0.10 %, corresponden a las concentraciones de 45.4 ± 0.35 y 49.2 ± 0.72, respectivamente) seguidos de T1, T4 y T5.
Por otro lado, la concentración de nitrato (NO --N) no tuvo diferencias significativas excepto el tratamiento C1 (p<0.05) (Fig. 3B). Al iniciar el experimento el nitrato tuvo un valor de 12.6 mg/L, luego al día 2 de cultivo una disminución hasta en promedio 3.67 ± 0.62 y al día 4 se registró 0.88 ± 0.34, finalmente al último día del experimento se obtuvo una concentración de 0.30 ± 0.23 mg/L y en T3 0.00 mg/L. Mientras la concentración inicial del nitrito (NO -N) fue de 3.33 mg/L, al día 2 del cultivo se incrementó (en promedio 3.54 ± 0.47), para luego descender hasta el día 5 (1.83 ± 0.58), luego la reducción se volvió constante hasta obtener 0.0 mg/L (Fig. 3C), presentándose solo variación estadística con respecto a C1.
Las microalgas obtienen los compuestos nitrogenados del medio generalmente en forma de Ion amonio (NH +) debido a que se incorpora directamente a los aminoácidos por condensación con glutamato, aunque en condiciones de deficiencia pueden incorporar el nitrógeno en forma de nitratos (NO --N) y nitritos (NO -N). Si bien el NH4 + es la especie de nitrógeno preferentemente asimilada por las microalgas debido a que evita los pasos de reducción de nitrógeno que consume energía, se encuentra el NO3--N en un contenido mayoritario, siendo la fuente principal de nitrógeno, el cual es propia de aguas tratadas (como los efluentes de las PTAR) (Sanz-Luque et al. 2015, Beltrán-Rocha et al. 2017). El NO --N, es la forma más oxidada del nitrógeno, a diferencia de las formas amonio y nitrito, es menos toxico, además induce la actividad de la enzima nitrato reductasa, clara ventaja sobre el amonio ya que el exceso de este (>20 mg/L) puede tener efectos negativos sobre el crecimiento microalgal (Morris & Syrett 1963, Lachmann et al. 2019).
El amonio (NH +) durante el experimento no tuvo una reducción significativa de su concentración (Fig. 3A). Este tipo de resultados posiblemente es explicado por la actividad fotosintética (reducción de NO --N a NH+) para la asimilación reductora del N (Fischer y Klein, 1998; Crawford 1995, Fidalgo 1995, Sanz-Luque et al. 2015). Además, las formas NH +/NH son altamente dependientes de temperatura y pH, siendo este último el factor más importante, tal como se explica en el Diagrama de predominancia (Markou & Georgakakis 2011, Beltrán-Rocha 2017), donde a pH con concentraciones inferiores de 9.25 favorecen la formación de NH + y valores superiores a 9.25 predomina el NH4 (Abeliovich y Azov 1976, Markou & Georgakakis 2011), de acuerdo a las condiciones de nuestro estudio el pH más alto fue de 8.95, este valor no permitió la disminución de nitrógeno en forma de NH4 +.
Caso contrario a la concentración de NO --N, donde se tuvo una disminución a partir del cuarto día de cultivo, excepto C1 que obtuvo poca disminución, en este tratamiento aparentemente no hay presencia de organismos fotosintéticos. Durante el experimento se observaron reducciones de NO --N (Figura 3 B) e incrementos de pH (Figura 2), esta relación fue reportado en estudios donde se asimilaron NO --N como fuente de nitrógeno (Zhang et al. 2014, López et al. 2016), así como también se menciona el efecto de la fotosíntesis microalgal, al realizar la interconversión metabólica del nitrato (NO3 --N) al reducir a NH + (Abalde et al. 1995, Sanz-Luque et al. 2015, Taziki et al. 2015, Lachmann et al. 2019).
La concentración de nitrito (NO2 --N) mostró tendencias de incremento durante el periodo experimental con un posterior descenso de concentración (Fig. 3C). Es más notorio en T4 y C1, este último se mantuvo casi constante hasta el quinto día de cultivo, el incremento fue debido posiblemente a dos distintas actividades por microorganismos, en C1 se incrementó la concentración de nitritos debido a la actividad de oxidación bacteriana (presentes en toda agua residual) tiene como característica principal la interconversión de NH + a NO --N (Krekeler 2008) y en el resto de tratamientos probablemente al desarrollo de las microalgas (Beltran-Rocha 2017). También se pudo observar, el aumento de NO --N con una disminución en la concentración de NO --N, este comportamiento también fue observado en estudios realizados con Chlorella sp. en aguas residuales (Wang et al. 2010). Esto es debido a que la incorporación del nitrógeno en forma oxidada en organismos fotosintéticos, ocurre en dos etapas en el cloroplasto (Fischer & Klein 1988, Crawford 1995), por lo tanto, se genera NO2--N en el proceso que NO3 --N es reducido a NH + y posiblemente parte del NO2 --N formado es excretado al citosol (Fidalgo 1995, Burhenne & Tischner 2000, Beltrán-Rocha et al. 2017).
Según Abalde et al. 2012, las microalgas poseen una mejor absorción del nitrógeno en forma de amonio, luego nitritos y por último los nitratos, esto se debe a que la trasformación a sus formas reducidas implica un gasto de energía. Sin embargo, hay casos en que nitrato, nitrito y amonio son asimilados simultáneamente (Fidalgo 1995). Se ha sugerido que el fitoplancton es oportunista en cuanto a la capacidad de asimilar rápidamente cualquier pulso de amonio que pueda surgir en su ambiente a partir de cualquier fuente (Fidalgo 1995). Los autores Su et al (2012b), afirman que los microorganismos en asociación dentro de un cultivo de microalgas contribuyen a la remoción de nutrientes a través del proceso de nitrificación y desnitrificación, es decir, catalizan el proceso de remoción de los nitratos presentes en el medio, permitiendo el crecimiento microalgal.
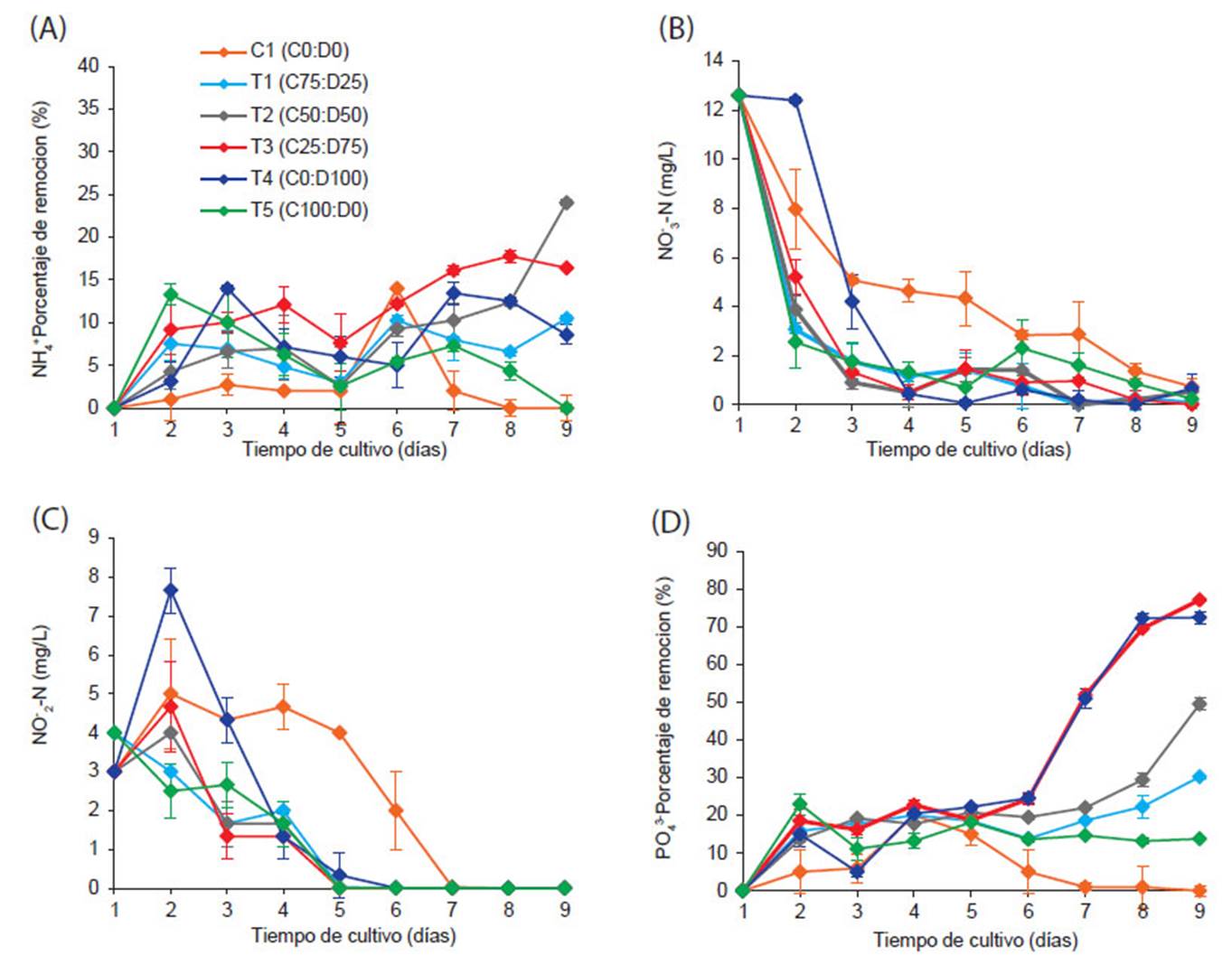
Figura 3 Variación diaria de los macronutrientes con los diferentes tratamientos. (A) Porcentaje de remoción de NH +;
Fósforo (PO 3-)
El ortofosfato (PO 3-), forma química del fósforo preferentemente utilizado por las microalgas, juega un rol importante en los procesos celulares que implican la transferencia de energía y en la biosíntesis de ácidos nucleicos, es un componente esencial que gobierna la síntesis de proteínas así como componente del adenosínfosfato (ADP), el cual es responsable del correcto funcionamiento del transporte intracelular (Martínez et al. 1999, Cai et al. 2013, Zeng et al. 2015, Beltrán-Rocha et al. 2017). El comportamiento de la remoción durante el experimento se observa en la Figura 3D.
El fósforo, tuvo una concentración inicial de 30.0 mg/L. El porcentaje de remoción del C1 fue significativamente menor que en los demás tratamientos (p<0.001), lo que puede deberse a la falta de participación de las microalgas y a la pobre capacidad de eliminación de fósforo de los organismos presentes en el agua residual. Hasta el día 6 del experimento, no hubo una disminución considerable de las concentraciones (<20%) ni diferencias significativas entre los tratamientos. Posteriormente, del sexto al noveno día, en T1 y T5 la reducción se volvió constante (<20%), entre los tratamientos restantes hubo diferencias significativas excepto entre T3-T4 (p=0.761). Se observa la mayor eficiencia de eliminación al noveno día (T3= 77.1 ± 0.32, T4= 72.4 ± 1.62 %, corresponden a las concentraciones de 6.9 ± 0.32 y 8.3 ± 1.62, respectivamente).
De acuerdo a los resultados, la eliminación tanto de fosfatos como de nitratos en el agua residual, depende de procesos complejos, de acuerdo a lo expuesto anteriormente. Por un lado, las microalgas utilizan distintas especies químicas de nitrógeno (amonio, nitrito, nitrato y fosfato) para su desarrollo (Beltrán 2014, Fidalgo 1995).
Por otro lado, las bacterias que hay presentes en el medio emplean igualmente dichos nutrientes como sustrato (Su et al. 2012b). En este tipo de experimento, el fosfato es, con seguridad, el más eliminado.
Optimización de la proporción de las microalgas
D. asymmetricus y C. vulgaris. En la Tabla 4 se muestra las remociones promedio en función del tiempo de cada tratamiento producto del diseño experimental. De acuerdo a los resultados, los tratamientos (T1, T2, T3 y T5) lograron remover en sólo 5 días más del 99% de NO --N (mg/L), y el tratamiento T3 en 9 días logra remover el mayor porcentaje de PO 3(mg/L) y NH + (mg/L), siendo el tratamiento que logró la mayor remoción de nutrientes del agua de la PTAR La Taboada.
Por otro lado, en la Tabla 5 se aprecian los promedios de las condiciones fisicoquímicas en los cultivos. Un buen indicador de la adaptación de las microalgas a los efluentes de la PTAR es la concentración de OD (mg/L), se aprecia que los tratamientos con mayor proporción de D. asymmetricus (T2, T3 y T4), presentan las mayores concentraciones de oxígeno disuelto al día 7 de cultivo, en la Figura 4, el diagrama de cajas determino que el tratamiento T3 obtuvo el mejor resultado, alcanzando una media de 25.50 ± 0.28 mg/L con menor dispersión en los resultados.
Empleando el diseño de mezclas en el programa estadístico Minitab, se determinó que la mezcla óptima de microalgas que lograría la mayor producción de OD, por ende, la mejor adaptación en los efluentes, fue la proporción de 94% de Desmodesmus asymmetricus y 6% de Chlorella vulgaris (Figura 5), esto coincide con el T3 que estuvo compuesto en mayor cantidad por D. asymmetricus.
Tabla 4 Resumen del porcentaje de remoción de los tratamientos para el efluente de la PTAR La Taboada con la mezcla de Desmodesmus asymmetricus y Chlorella vulgaris en condiciones de invernadero.
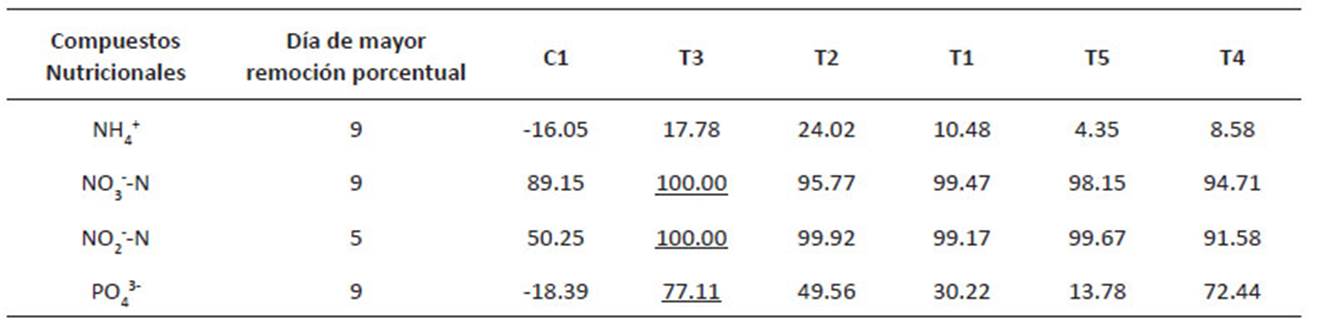
Tabla 5 Promedio de parámetros fisicoquímicos de los cultivos realizados con agua de PTAR La Taboada, en condiciones de invernadero.
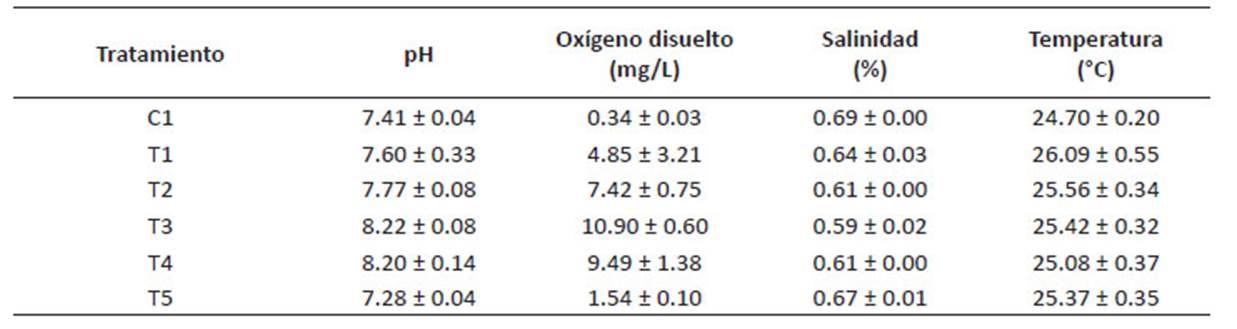
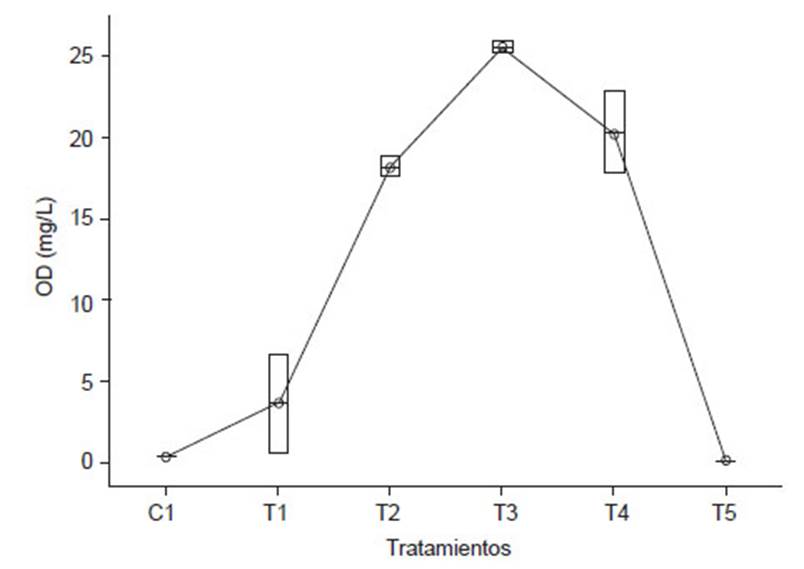
Figura 4 Comportamiento de los niveles de Oxígeno disuelto en cada una de las diferentes mezclas microalgales al día 7 de cultivo.
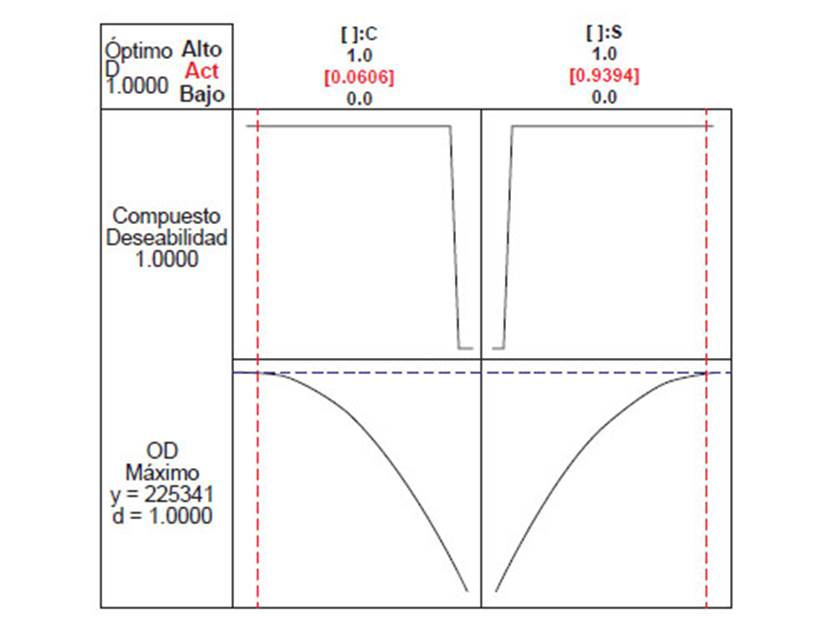
Figura 5 Determinación de la mezcla óptima de microalgas para lograr la mayor producción de Oxígeno disuelto.
La microalga de menor tamaño debería de asimilar en mayor cantidad tanto N como P, porque posee tasas de crecimiento más altas (Marañon et al. 2001, Cuvin-Aralar et al. 2004, Lagus 2009, Kagami & Urabe 2011), además, una menor proporción área/volumen, por lo cual la absorción y el transporte de los nutrientes debería ser más rápido. En el caso de C. vulgaris, las células son pequeñas (< 5 µm), tienen una mayor área superficial para la absorción de nutrientes en relación al volumen para su almacenamiento interno, por lo tanto, el tiempo requerido para que la difusión desplace las sustancias hacia el interior es menor, convirtiéndola en un organismo más eficiente para la eliminación de nutrientes.
Sin embargo, los resultados del experimento evidencian lo contrario para el caso de C. vulgaris, ya que la remoción de N y P fue escasa y el OD producido también fue mínimo, probablemente las pocas células están tomando mucho N, pero no lo utilizan para la división celular, posiblemente lo están almacenando en forma de asparagina (aminoácido con baja proporción C:N) de esa manera sirve como almacén de nitrógeno (Cho et al. 1981, Buchanan et al. 2015), caso contrario con D. asymmetricus, una microalga que produce una alta aglomeración, así logra incrementar la superficie de absorción y captura de manera más eficiente los nutrientes disponibles en el medio (Kagami & Urabe 2001, Lee 2008).
Como ya se mencionó, las microalgas son oportunistas en cuanto a la capacidad de asimilar rápidamente cualquier pulso de nutriente que pueda surgir en su ambiente a partir de cualquier fuente. El NO --N se presenta como la forma más oxidada y mayor estabilidad termodinámica en aguas residuales, siendo por lo tanto la de mayor predominancia y fuente principal de nitrógeno (Barsanti & Gualtieri 2014). En condiciones naturales, se presentan varias fuentes de nitrógeno (NH4 +, NO2 y NO3 ) y hay evidencias que en determinadas situaciones las microalgas asimilan preferencialmente el amonio porque su captación tiene un menor costo energético (Beltrán 2014, Sanz-Luque et al. 2015, Beltrán-Rocha et al. 2017). Sin embargo, la asimilación de NH + produce H+, provocando la disminución del pH (<7.0), medio acido que inhibe el desarrollo de las microalgas (Abdel-Raouf 2012, Abinandan & Shanthakumar 2015).
Por otro lado, la absorción de PO4 3por parte de las microalgas, disminuye en medios alcalinos, ya que disminuye la disponibilidad e induce la eliminación de fosfatos vía co-precipitación química con Ca2+ y la formación de fosfato de calcio [Ca (PO4)2] en un intervalo entre 9 y 11 de pH (Markou & Georgakakis 2011, Cai et al. 2013). Además, adicional a la remoción vía precipitación, se suma la adsorción superficial de fósforo en la pared celular de las microalgas (Martinez et al. 2000).
De acuerdo con los resultados, mientras las microalgas captaron los nutrientes, el pH del medio se incrementó, los valores alcalinos nos indican la mayor actividad fotosintética. Se señala, que durante el crecimiento de las microalgas en sistemas de lagunaje de alta carga, como sistemas naturales de depuración (una alternativa de bajo coste a los sistemas convencionales), en este tipo de tratamiento se han reportado valores que exceden (pH 11), este incremento, se explica en gran parte al consumo de iones HCO3cuya disociación a CO2 proporcionan el carbono necesario para el crecimiento de las microalgas, a la par de propiciar la acumulación de OH(Martínez et al. 2000, Franchino et al. 2013, Andrade & Costa 2007). De acuerdo a diferentes investigaciones, el pH de los cultivos microalgales con fines de producción masiva, se encuentran en rango entre 7 y 9, con un valor óptimo de operación entre 8.2 a 8.7 (Lavens & Sorgeloos 1996, Beltrán-Rocha et al. 2017, Morales et al. 2018).
Ante esta situación, surge como alternativa y a fin de mejorar la producción, el suministro de aireación con dióxido de carbono (CO2), que incrementaría la disponibilidad de carbono, amortiguando el incremento de pH y a la par mantener un valor óptimo favoreciendo la productividad de las microalgas (Craggs et al. 2013). Al añadir CO y regular el pH, se podría reducir la eliminación de nutrientes vía formación de NH y precipitación de PO 3con la ventaja de mantenerlos bio-disponibles para el desarrollo de las microalgas (Heubeck et al. 2007, Markou & Georgakakis 2011, Cai et al. 2013, Umamaheswari & Shanthakumar 2016, Lv et al. 2018).
De acuerdo a los resultados del experimento, surge como alternativa el cultivo mixto, se aprecia que los tratamientos con mayor proporción de D. asymmetricus, presentan los mayores porcentajes de eliminación de nutrientes en 9 días de tratamiento, probablemente se necesite mantener los cultivos en agitación a fin de lograr un mayor contacto y aprovechamiento de nutrientes y microalgas adheridas a los envases, además, de lo mencionado con el pH. Como lo señala Shi et al. (2014), es complicado realmente poder realizar comparaciones de eficiencias en virtud de que los estudios no son similares en cuanto a la relación de biomasa algal, con respecto al volumen y tipo de agua residual y la concentración de nutrientes y modo de aplicación. Simplemente se toman como referencia para tener elementos de posible discusión y aporte al conocimiento del objeto de estudio, como es el tratamiento de aguas residuales mediante el empleo de microalgas.
Conclusiones
La biorremediación con microalgas es una alternativa interesante para remover los nutrientes NH4 +, NO3 --N, NO2 --N y PO4 3-, de la PETAR La Taboada; de acuerdo a los resultados, el tratamiento T3 (25% C. vulgaris / 75% D. asymmetricus) demostró una mayor capacidad de adaptación a las condiciones del agua residual y presentó una remoción superior de los nutrientes.
Sin embargo, los resultados advierten que tanto la elección de las especies como el pretratamiento del agua son importantes. Dado que la implementación de una esterilización efectiva de aguas residuales podría aumentar el costo total de la instalación, nuestros resultados enfatizan la importancia de elegir las especies de microalgas adecuadas.
Teniendo en cuenta que ambas cepas no se vieron afectadas por la presencia de protozoos (predadores principales de microalgas), las convierte en candidatas adecuadas para el desarrollo de una tecnología basada en microalgas para tratar el agua de la PETAR. Sin embargo, C. vulgaris, aunque aparece de manera destacada en muchos estudios a escala de laboratorio sobre el tratamiento de aguas residuales, puede no ser adecuado en condiciones más realistas.
De acuerdo a la optimización del diseño de mezclas, se recomienda que en el proceso de biorremediación, ambas cepas sean cultivadas a una proporción de 6% de C. vulgaris y 94% de D. asymmetricus en un tiempo de cultivo de 9 días, con el fin de obtener resultados de remoción óptimos. Como no se proporcionó aireación externa, la actividad fotosintética fue la única fuerza impulsora para producir el oxígeno necesario para la oxidación y la nitrificación. Por lo tanto, el consorcio de microalgas y seguramente las bacterias heterotróficas/nitrificantes obtuvo como resultado un sistema simbiótico capaz de garantizar un proceso de tratamiento autosostenido con alta eficiencia de remoción de nutrientes, principalmente NO3 --N, NO2 --N y PO4 3-.
En conclusión, se puede decir que los consorcios de microalgas y bacterias son adecuados para la depuración de aguas residuales, y pueden ser acoplados con los sistemas actuales como tratamiento terciario para la remoción de nitrógeno y fósforo residual y así evitar la recirculación de los mismos en las depuradoras convencionales. Sin embargo, aún quedan retos por resolver como el escalado de los sistemas, el aumento de la capacidad de tratamiento y el aprovechamiento de la biomasa obtenida












 uBio
uBio