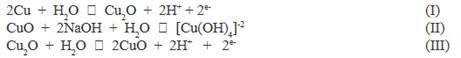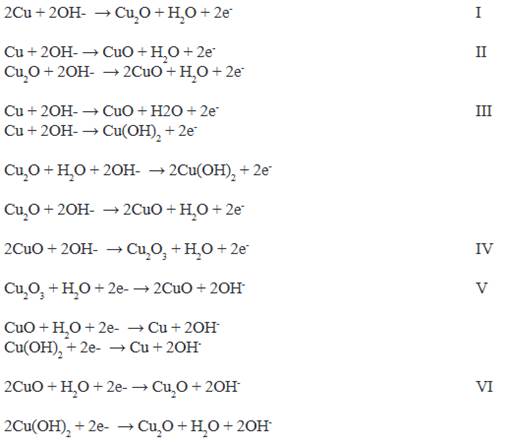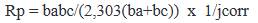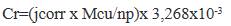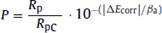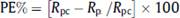INTRODUCCIÓN
La corrosión de los materiales constituye un grave problema económico en la industria por el deterioro acelerado de equipos y maquinarias de alto valor. La corrosión se da en la naturaleza de forma natural, países industrializados invierten altos porcentajes de su PBI dedicados a este fenómeno en prevención y en reparación de los daños ocasionados por este. Las pérdidas ocasionadas por el fenómeno de la corrosión constituye el 25% del gasto en el presupuesto en industrias como la gasífera, petróleo y automotriz1. Este fenómeno es capaz de producir problemas muy graves si no se tiene en cuenta el tipo de material y diseño del mismo y la posible aparición de fallas tienen implicancias sanitarias y ambientales, es por ello que es necesaria la administración de una estrategia para la protección en medios agresivos2. Países tales como Chile, el mayor productor de cobre del mundo con alrededor del 35% del total, basan su economía en la extracción de este metal, y tal es la dependencia respecto al cobre en Chile que se calcula que el 52% de las ganancias debidas a las exportaciones son producto de ella2. Por ello, el desarrollo de un nuevo tipo de materiales que permita la protección del cobre de la corrosión, en medio ácido, alcalino y neutro es un campo de mucha utilidad. Es conocido que el mecanismo de protección de la corrosión del polipirrol sobre metales se debe a su propiedad de transportar electrones e iones en su cadena polimérica, este polímero tiene la propiedad de autoprotonarse manteniendo la propiedad conductora a una gran escala de valores de pH3. Esta propiedad ha llevado incluso al reemplazo de piezas metálicas por materiales poliméricos en algunos casos de estudio4. Entre los polímeros conductores más estudiados se encuentra el polipirrol (PPy), en este trabajo de investigación, estudiamos un monómero como el pirrol para formar mediante síntesis electroquímica, en diferentes medios, el polímero PPy para su aplicación en la protección del cobre de la corrosión.
PARTE EXPERIMENTAL
Para la síntesis electroquímica del polipirrol sobre cobre es necesario primero el pasivamiento de este material, consiste en generar una película intermedia entre cobre y pirrol, en este procedimiento se usó la voltamperometría cíclica de barrido en ácido oxálico 0,3 mol L-1, buffer de fosfato a una concentración de Dihidrogenofosfato de 0,10 mol L-1 e Hidrógeno fosfato de 0,10 mol L-1 y acetato de sodio 0,25 mol L-1 en 8 ciclos a una velocidad de barrido de 20 mV s-1 versus un electrodo de Ag/AgCl como referencia y una barra de grafito como contra electrodo. Ya teniendo el cobre pasivado, la síntesis electroquímica del polipirrol se realiza en los medios mencionados y a una concentración del monómero pirrol de 0,5 mol. L-1. Las placas de cobre con área 0,25 cm2 fueron previamente pulidas con finas lijas de tamaño 2000 y 2500 en alúmina con un tamaño menor a 0,05 µm, enjuagadas con acetona y sonicadas en agua ultrapura. En cada ensayo realizado se usó agua ultra pura obtenida de un sistema Millipore-MilliQ (18,2 MΩ cm). Los experimentos electroquímicos fueron realizados usando un potenciostato Ivium, (Ivium Technologies, Eindhoven, The Netherlands), la caracterización de Espectroscopía Raman se realizó mediante un Espectroscopio Raman HORIBA Scientific.
RESULTADOS Y DISCUSIÓN
En la realización del pasivado de las placas de cobre se utilizó 3 electrolitos diferentes: solución de ácido oxálico, buffer de fosfato y solución de acetato de sodio, adecuando el pH dada la capacidad del Ppy de mantener su forma conductora en un amplio rango de pH, según estudios ya realizados5. Cada electrolito, según su naturaleza y a determinado número de ciclado, imprimen en la superficie del cobre películas que inhiben su disolución, ya sea mediante óxidos, hidróxidos o complejos de cobre. Son estas películas las que servirán luego de plantillas para la electrodeposición del polipirrol a ser analizadas. Este proceso es necesario debido a los bajísimos potenciales de oxidación del cobre, que están por debajo de -500 mV frente a un electrodo de referencia de Ag/AgCl5. En la figura 1 se muestran picos únicos del cobre señalados como I, II, III y IV, los 4 picos anódicos mencionados son atribuidos a la formación de especies oxidadas de cobre como Cu O, Cu(OH) -2, CuO y Cu(OH)-4, respectivamente y los picos catódicos respectivos, siendo la especie correspondiente al cobre (III) muy inestable y por ello es formada en poquísima proporción5. Estas especies se producen mediante las siguientes reacciones5:
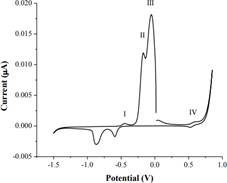
Figura 1 Voltamperometría cíclica correspondiente al electrodo de cobre en solución de NaOH 0,1 mol L-1, a una velocidad de 30 mV s-1 y picos correspondientes a sus estados de oxidación5.
Con la finalidad de evitar que la corrosión de cobre ocurra antes que se forme la primera monocapa de polipirrol se debe hacer una pasivación superficial, esta película intermedia facilitará la oxidación del pirrol, el cual ocurre a 900 mV aproximadamente6.
Pasivación del cobre y electropolimerización del Ppy en Acetato de sodio
El voltamperograma obtenido para el cobre en solución 0,25 mol L-1 de acetato de sodio, pH 8 se muestra en la figura 2a, en ella se observan cuatro picos de corriente anódica (I, II, III y IV) y dos picos de corriente catódica (IV y V), que dan cuenta de la formación y reducción de películas en la superficie del cobre descritas por una serie de reacciones que se detallan a continuación7.
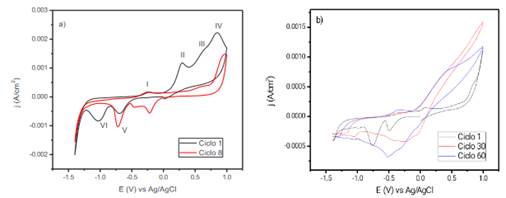
Figura 2 a) Voltamperograma del cobre luego de 1 y 8 ciclos en acetato de sodio 0,25 mol L-1 (pH 8) a 20 mV s-1 y b) Electropolimerización del pirrol sobre cobre a una concentración de 0,5 mol L-1 del monómero a una velocidad de 10 mV s-1 para 1, 30 y 60 ciclos usando como medio una solución de acetato de sodio 0,25 mol L-1 pH 8.
Un primer pico de oxidación es observado alrededor de -0,25 V vs Ag/AgCl, correspondiente a la formación de Cu2O en la superficie del electrodo, seguido por la formación de hidróxidos y óxidos de cobre en el rango de 0 - 1 V vs Ag/AgCl correspondientes a los picos II, III, y IV7,8. En la zona catódica se observan dos picos de reducción en el rango de -1,25 - -0,5 V vs Ag/AgCl asignados a la formación de Cu y Cu O8. Estas reacciones dan lugar a una estructura doble de películas pasivantes que recubren al cobre metálico, ocasionando así la caída de la densidad de corriente de oxidación del cobre que se incrementa conforme aumenta la cantidad de ciclos en la voltamperometría cíclica, figura 2a, ocasionada por el pasivamiento de la placa de cobre. Debido a esto, es posible el crecimiento del polímero sobre la placa de cobre, en la figura 2b se observa este proceso. Es claro que la reacción de disolución del cobre es menor en comparación a las presentadas en el proceso de pasivamiento, esto debido a que sus corrientes anódicas son considerablemente bajas en presencia del monómero. Estas corrientes anódicas se incrementan a un valor aproximado de 90 mV (Ag/AgCl), que es consistente con la oxidación del monómero, un segundo pico es observado a un valor cercano a 1300 mV, esto también correspondiente a una segunda oxidación del pirrol. Similar comportamiento se da para los ciclos consecuentes, donde es notorio el aumento de la densidad de corriente y de la capacitancia del sistema conforme se aumentan los números de ciclos, este comportamiento es típico de la sobredeposición de polímeros conductores, donde el incremento de la conductividad del material y cambios estructurales inducidos durante la oxidación ocasionan estos cambios.
Pasivación del cobre y electropolimerización del Ppy en buffer de fosfato
El voltamperograma obtenido para el cobre metálico, en solución de buffer de fosfato pH 4 a una concentración de Dihidrogenofosfato de Sodio de 0,10 mol L-1 e Hidrógeno fosfato de sodio de 0,10 mol L-1, se muestra en la figura 3a, en ella se observa un evidente incremento en la densidad de corriente anódica en una ventana de potencial de -0,4 - 1.8V, estas elevadas corrientes anódicas concuerdan con la disolución del cobre metálico para formar iones Cu+ y Cu +, en solución para el primer ciclo9. Mientras que en los ciclos siguientes se presenta un considerable decaimiento en la densidad de corriente anódica, que es consistente con la pasivación del electrodo de cobre. Las especies fosfatadas formadas se ligan formando sales insolubles de fosfato de cobre, estas especies forman las películas pasivantes que se adhieren a la superficie del electrodo protegiendo al cobre de la disolución. Dichas especies fosfatadas son principalmente H PO - y en menor proporción HPO 2- y PO 3-, que se acomplejan fácilmente con los óxidos de cobre formando Cu (PO ) 9. Luego de este proceso es posible el crecimiento del polímero sobre la superficie pasivada, en la figura 3b se observa la electropolimerización de pirrol. Es claro que la reacción de disolución del cobre es menor en comparación a las presentadas en el proceso de pasivamiento, esto debido a que sus corrientes anódicas son considerablemente bajas en presencia del monómero. Estas corrientes anódicas se incrementan a un valor aproximado de 90 mV (Ag/AgCl), que es consistente con la oxidación del monómero, un segundo pico es observado a un valor cercano a 1300 mV, esto también correspondiente a una segunda oxidación del pirrol. Similar comportamiento se da para los ciclos consecuentes, donde el aumento de la densidad de corriente y de la capacitancia del sistema conforme se aumentan los números de ciclos es notoria, esto es ocasionado por el crecimiento del polímero sobre la superficie inerte del cobre pasivado.
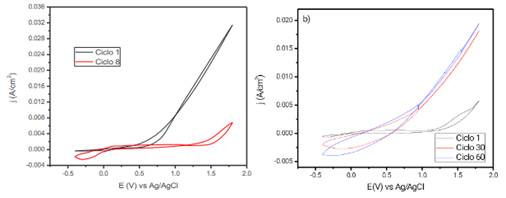
Figura 3 a) Voltamperograma del cobre luego de 1 y 8 ciclos en buffer de fosfato pH 4 a una concentración de Dihidrogenofosfato de Sodio de 0,10 mol L-1 e Hidrógeno fosfato de Sodio de 0,10 mol L-1 a 20 mV s-1 y b) Electropolimerización del pirrol sobre cobre pasivado a una concentración de 0,5 mol L-1 del monómero a una velocidad de 10 mV s-1 para 1, 30 y 60 ciclos en buffer de fosfato.
Pasivación del cobre y electropolimerización del Ppy en ácido oxálico
El voltamperograma obtenido para el cobre en una solución 0,3 mol L-1 de ácido oxálico pH 1.0 se muestran en la figura 4a, en el gráfico se observa que en el primer ciclo aparece un pico intenso de corriente en el potencial cercano a los -70 mV/Ag/AgCl relacionado a el proceso de oxidación del cobre10, con el aumento de número de ciclos voltamperométricos la intensidad de pico disminuye hasta estabilizarse en el ciclo número 8, este comportamiento es muy propio de procesos de pasivamiento del cobre 10,11, el pico de oxidación del cobre baja de un valor de 0,0179 a 0,00244 A cm-2 de densidad de corriente y ocurre debido a la formación de compuestos de cobre insolubles sobre la superficie del electrodo12. Especies como oxalatos de cobre y óxidos son las responsables de este comportamiento, Cu(Ox) y Cu(Ox)2- los cuales se fijan sobre la superficie del electrodo inhibiendo su disolución 11. El pico de reducción observado en los valores catódicos de corriente es atribuido a la reducción del Cu(Ox) y Cu(Ox)2-, a valores aproximados de 150 mV10. La película pasiva permite una posterior etapa de electropolimerzación del Ppy, el cual se realiza en una ventana de potencial entre 0,4 y 0,9 V, en la figura 4b se presenta el voltamperograma correspondiente a este proceso, donde a un potencial de 630 mV inicia un aumento significativo de la densidad de corriente el cual está relacionado a la formación del Ppy. La intensidad de la corriente aumenta conforme aumenta el número de ciclos, deduciéndose que la película formada tiene propiedades conductoras, además con el aumento de espesor es observable por su característico color negro.
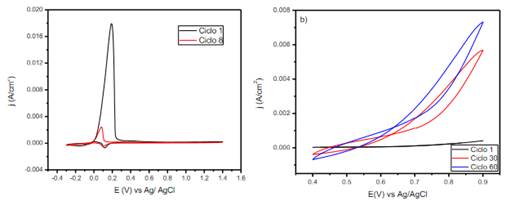
Figura 4 a) Voltamperograma del cobre luego de 1 y 8 ciclos en ácido oxálico 0,3 mol L-1 a pH 1 a una velocidad de 20 mV s-1 y b) Electropolimerización del pirrol sobre cobre a una concentración de 0,5 mol L-1 del monómero a una velocidad de 10 mV s-1 para 1, 30 y 60 ciclos en ácido oxálico 0,3 mol L-1 a pH 1.
Caracterización de las películas de Polipirrol mediante Espectroscopia Raman
En la figura 5 se muestran los espectros correspondientes a las películas obtenidas y los valores de los picos característicos del Ppy se muestran en la tabla 1. El pico observado a un valor de 1540 cm-1 correspondiente a su longitud de onda de vibración, es asignado al estiramiento del monómero pirrol en la estructura del polímero en su forma oxidada, el polipirrol, a través del enlace C=C, este pico es apreciable en los tres espectros mostrados, siendo esto evidencia de la presencia de este grupo funcional en las familias de polipirrol sintetizadas13. Sin embargo, este pico presenta una intensidad notoriamente diferente en la muestra correspondiente al Ppy sintetizado en ácido oxálico, esto debido a que el grupo funcional mencionado se encuentra rodeado de diferentes tipos de compuestos que ocasionan esta ligera variación, el pirrol presenta diferentes tipos de estructuras mostradas en la figura 6, siendo estas diferentes resonancias las que ocasionan este tipo de cambios de intensidad13. Además de esta banda, en una longitud onda de 1310 cm-1 se aprecia otro pico intenso, siendo este asignado al estiramiento provocado por el anillo en su estructura básica14. Las estructuras de polipirrol sintetizadas en bufer fosfato de sodio y acetato de sodio presentan una intensidad similar para esta, sin embargo, la señal obtenida para el polipirrol electropolimerizado varía, esto es consecuencia de la diferente forma de polipirrol lograda y sus formas de vibración14. Por otro lado, la señal obtenida a 1242 cm-1 es atribuida a la deformación fuera del plano correspondiente a la vibración del grupo CH, siendo este pico muy similar en las tres síntesis del polipirrol. El pico que es señalado en una longitud de onda de 1078 cm-1 se asocia a una débil deformación del plano NH, siendo este más intenso en la señal obtenida en la síntesis realizada en ácido oxálico. Finalmente la banda correspondiente a 963 cm-1 corresponde a la deformación provocada por el CH en el plano del pirrol, señal que también es muy intensa en la muestra correspondiente a la síntesis realizada en ácido oxálico15. La espectroscopia Raman da muestra entonces de los picos característicos del polipirrol en las películas formadas en diferentes medios, variando estas señales en intensidad de acuerdo a las diferentes formas obtenidas de este polímero conductor.
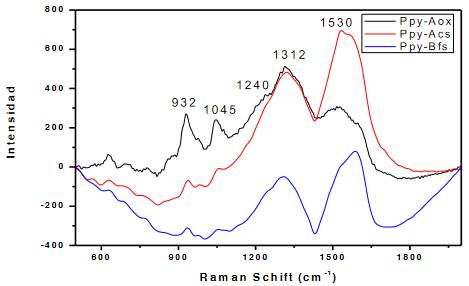
Figura 5 Espectroscopia RAMAN de las películas de Ppy electrodepositadas sobre cobre, utilizando un láser de 785 nm y una potencia de 25%.
Tabla 1 Picos asignados mediante Espectroscopia RAMAN en las películas sintetizadas de Polipirrol.
| Modo vibracional asociado | Raman Schift (cm-1) |
| -C=C- | 1540 |
| Ppy+ | 1310 |
| CH fuera del plano | 1242 |
| NH en el plano | 1078 |
| CH en el plano | 963 |
Evaluación de los parámetros de corrosión mediante el método de Pendientes de Tafel.
Se estudiaron los parámetros de corrosión para cada placa protegida con el polímero Polipirrol (Ppy) en solución de NaCl 3%, se muestran las tablas de los resultados obtenidos y las gráficas de las Pendientes de Tafel para las mejores muestras de cada familia respecto a la velocidad de corrosión.
Tabla 2 . Resultados de las mediciones de polarización potenciodinámica en NaCl 3% de las placas de cobre recubiertas por Ppy en Bufer de fosfato pH 4 a una concentración
| Muestras | ba (V dec-1) | bc (V dec-1) | -E corr (V) | J corr (µA cm-2) | Rp (Ὠcm2) | P(%) | PE% | CR (mm/año) |
| Cobre | 0,089 | 0,055 | 0,17 | 1,796 | 69,3 | - | - | 0,907 |
| 10 ciclos | 0,086 | 0,051 | -0,189 | 0,987 | 128,2 | 0,5 | 45,9 | 0.011 |
| 20 ciclos | 0,078 | 0,041 | -0,149 | 0,585 | 155,2 | 0,682 | 55,3 | 0,014 |
| 30 ciclos | 0,07 | 0,053 | -0,141 | 0,851 | 145,2 | 0,781 | 52,3 | 0,019 |
| 40 ciclos | 0,069 | 0,05 | -0,185 | 0,331 | 212,2 | 0,035 | 67,3 | 0,007 |
| 50 ciclos | 0,072 | 0,442 | -0,165 | 0,665 | 152,1 | 1,176 | 54,4 | 0,184 |
| 60 ciclos | 0,081 | 0,018 | -0,158 | 1,13 | 112,1 | 1,275 | 38,2 | 0,264 |

Figura 7 Curvas de polarización potenciodinámica tomadas en NaCl 3% para una placa de cobre metálico y placa de cobre recubierta por Ppy en solución de Bufer de fosfato pH 4 a una concentración de Dihidrogenofosfato de Sodio de 0,10 mol L-1 e Hidrógeno fosfato de sodio de 0,10 mol L-1.
Tabla 3 . Resultados de las mediciones de polarización potenciodinámica en NaCl 3% de las placas de cobre recubiertas por Ppy en solución de Acetato de Sodio 0,25 mol L-1 pH 8.
| Muestras | ba (V dec-1) | bc (V dec-1) | -E corr (V) | J corr (µA cm- 2) | Rp (Ὠcm2) | P | PE% | CR (mm/año) |
| Cobre | 0,089 | 0,055 | 0,17 | 1,796 | 69,3 | - | - | 0,907 |
| 10 ciclos | 0,03 | 0,084 | -0,0897 | 1,346 | 120,2 | 0,696 | 42,3 | 0,098 |
| 20 ciclos | 0,045 | 0,03 | -0,057 | 1,384 | 141,1 | 0,543 | 51 | 0,089 |
| 30 ciclos | 0,028 | 0,159 | -0,097 | 1,12 | 131,3 | 0,431 | 47,2 | 0,056 |
| 40 ciclos | 0,025 | 0,126 | -0,095 | 1,151 | 142,6 | 0,519 | 51,4 | 0,07 |
| 50 ciclos | 0,041 | 0,1 | -0.074 | 1,946 | 212,7 | 0,126 | 67,4 | 0,045 |
| 60 ciclos | 0,029 | 0,029 | -0,067 | 1,138 | 119,3 | 0,973 | 41,9 | 0,101 |
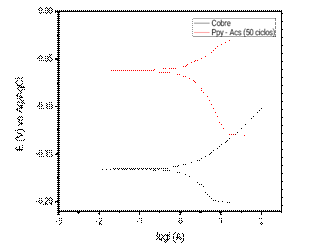
Figura 8 Curvas de polarización potenciodinámica tomadas en NaCl 3% para una placa de cobre metálico y placa de cobre recubierta por Ppy en solución de Acetato de sodio 0,25 mol L-1 pH 8.
Tabla 4 . Resultados de las mediciones de polarización potenciodinámica en NaCl 3% de las placas de cobre recubiertas por Ppy en solución de Ácido oxálico 0,3 mol L-1 a pH 1.
| Muestras | ba (V dec-1) | bc (V dec-1) | -E corr (V) | J corr (µA cm-2) | Rp (Ὠcm2) | P | PE% | CR (mm/año) |
| Cobre | 0,089 | 0,055 | 0,17 | 1,796 | 69,3 | - | - | 0,907 |
| 10 ciclos | 0,084 | 0,045 | -0,131 | 1,407 | 151,1 | 0,19 | 54,1 | 0,033 |
| 20 ciclos | 0,242 | 0,05 | -0,062 | 1,152 | 131,3 | 0,013 | 47,2 | 0,012 |
| 30 ciclos | 0,058 | 0,034 | -0,275 | 1.185 | 128,3 | 0,058 | 46 | 0,02 |
| 40 ciclos | 0,053 | 0,016 | -0,062 | 1,19 | 278,3 | 6,15x10-3 | 75,1 | 0,004 |
| 50 ciclos | 0,065 | 0,049 | -0,096 | 1,169 | 146,2 | 0,049 | 52,6 | 0,016 |
| 60 ciclos | 0,036 | 0,032 | -0,153 | 1,177 | 109,8 | 0,822 | 36,9 | 0,176 |

Figura 9 Curvas de polarización potenciodinámica tomadas en NaCl 3% para una placa de cobre metálico y placa de cobre recubierta por Ppy en solución de Ácido oxálico 0,3 mol L-1 a pH 1.
Los parámetros de corrosión obtenidos, tales como el potencial de corrosión (Ecorr), densidad de corriente de corrosión (jcorr), pendiente anódica de Tafel (ba), pendiente catódica de Tafel (bc) y resistencia a la polarización (Rp), son mostrados en las tablas 2, 3 y 4, medidos para las placas de cobre protegidas por el Ppy y polimerizado en soluciones de buffer de fosfato, acetato de sodio y ácido oxálico respectivamente, así mismo, estos valores fueron calculados usando el software Ivium Technologies. La resistencia a la polarización está relacionada con la densidad de corriente de corrosión, que es directamente proporcional a la velocidad de corrosión por la ecuación de Stearn - Geary, que tiene la siguiente forma16,17:
Estos valores de Rp, se relacionan con la propiedad inhibidora de la corrosión del cobre recubierto y se puede comparar con una muestra blanco (cobre sin protección), la electropolimerización del pirrol sobre el cobre pasivado da como resultado dos efectos, primero es el desplazamiento del potencial de corrosión (Ecorr) a valores más positivos y un aumento del valor de Rp ambos relacionados a una menor tendencia a la corrosión17. Por lo tanto, la resistencia a la polarización es una variable que nos da una idea de la capacidad anticorrosiva de las películas de Ppy formadas. En las muestras se observa un menor valor de Rp en la muestra de cobre (69,3 Ὠcm2) y como máximo valor al medido en la muestra de Ppy crecido en ácido oxálico por 40 ciclos (278,3 Ὠcm2), que nos da muestra de la capacidad anticorrosiva de las películas de Ppy sintetizadas. La densidad de corriente de corrosión guarda relación con la velocidad de corrosión según la siguiente expresión17:
Donde Mcu es el peso molecular del cobre, n es el número de electrones transferidos en la reacción de corrosión y p es la densidad del cobre en (g cm-3). Los valores de la velocidad de corrosión del cobre sin tratamiento y con tratamiento mediante las diferentes familias de Ppy reportados en las tablas 2, 3 y 4 dan como resultado un menor valor de corrosión para la muestra crecida en bufer fosfato por 40 ciclos de 0,007 mm/año, un menor valor para la muestra crecida en acetato de sodio por 50 ciclos de 0,045 mm/año, un menor valor de 0,004 mm/año para la muestra crecida en ácido oxálico por 40 ciclos, los resultados obtenidos para ciclos mayores presentan mayor velocidad de corrosión y esto podría ser atribuido al colapsamiento de la película de Pppy influenciado por el aumento de espesor y estrés entre las capas formadas, la aparición de grietas ocasionaría que el medio agresivo pueda tener contacto con el cobre y reflejarse en las medidas de descenso de los valores de Rp. La velocidad de corrosión del blanco o muestra de cobre metálico es de 0,907 mm/año, en comparación se observa una menor velocidad de corrosión para la muestra de Ppy electrodepositada por 40 ciclos sobre cobre en ácido oxálico disminuyendo en casi 200 veces, esto como resultado de la protección que aporta el Ppy al cobre. Es conocido que las películas de Ppy pueden brindar un efecto estabilizador y acelerador hacia la formación de óxidos protectores en la superficie del cobre11. De igual manera, los enlaces dobles conjugados presentes en la cadena polimérica posibilitan una deslocalización de la carga en los estados dopados y transferencia de electrones hacia metales oxidantes18. Esto ocasiona dos hechos, el primero es asegurar que los compuestos pasivantes formados se mantengan encima de la superficie del cobre, es decir donde han sido formados inicialmente manteniendo así la inactividad en el cobre metálico, y segundo es el papel de barrera contra los iones corrosivos como cloruros y oxígeno que suelen penetrar a través de la superficie del material produciendo la formación de especies solubles que pueden romper la capa de pasivación. Es entonces que los depósitos de Ppy sobre cobre aseguran este hecho en diferentes grados de eficiencia, diferenciándose en la calidad de las películas sintetizadas. En la bibliografía consultada, se evalúa la calidad de estas películas mediante dos parámetros, la porosidad y la eficiencia de protección. Como se ha mencionado, las velocidades de corrosión obtenidas como resultado son muy diferentes, esto como consecuencia de la diferencia de morfología lograda, esto nos indica que la porosidad es primordial para tener una idea de la corrosión de nuestro cobre. Para su cálculo se usó la siguiente ecuación18.
Donde P es la porosidad total, Rp es la resistencia a la polarización del cobre, Rpc es la resistencia a la polarización del cobre protegido, ᵦa es la pendiente de la recta de Tafel anódica para el cobre y ΔEcorr representa la diferencia entre los potenciales de corrosión. La aplicación de esta ecuación necesita asumir que el cobre es la especie electroquímicamente activa, es decir que es propensa a sufrir reacción de oxidación y reacciones de reducción, mientras que el depósito inhibidor es una especie absolutamente inactiva, es teniendo estas consideraciones que el cociente presentado es aproximadamente igual a la porosidad19. Como se puede ver en las tablas 2, 3 y 4, existe una correlación entre la porosidad y la velocidad de corrosión, esto es explicado porque mientras más poroso sea un material, más posibilidad tendrá el medio atacante, en nuestro caso iones cloruro, de tener contacto con el cobre y provocar su corrosión. Es por ello que el menor valor de porosidad encontrado, 6,15x10-3, corresponde también a la placa de cobre que presentó una menor velocidad de corrosión, 0,004 mm/año. La eficiencia de protección, así como porosidad, nos da una idea de la efectividad de inhibición de la corrosión del Ppy depositado sobre cobre. Para el cálculo de este parámetro fue usada la siguiente ecuación19.
Donde PE, representa la eficiencia de protección, Rpc es la resistencia a la polarización del cobre protegido y Rp es la resistencia a la polarización del cobre. Esta ecuación aplicada a los valores obtenidos en nuestras mediciones nos da como mayor valor de eficiencia de protección a la placa de Ppy electrodepositado sobre cobre por 40 ciclos en ácido oxálico, obteniendo un valor de 75.1%, dato que es consecuente que las velocidades y porosidad medidas ya explicadas. La pobre inhibición de la corrosión presentada en el polímero formado en solución de acetato de sodio se atribuye a fenómenos presentes en las estructuras pasivantes formadas, explicado esto por la distorsión Jahn Teller presente en la estructura octaédrica del acetato de cobre, debido a esta interacción y a la lejanía entre un ión acetato en comparación al otro, da como resultado que el proceso de sustitución para el enlazamiento del polímero sobre este compuesto sea un proceso dificultoso, no logrando así fijar de forma efectiva las películas de Ppy sobre el cobre pasivado20. Mientras que el ácido oxálico ha sido reportado en la bibliografía como un excelente entrecruzante y fijador de polímeros en superficies metálicas, y es por ello que la mejor adherencia del polímero en la superficie de sus compuestos pasivantes se sugiere como causa21.
CONCLUSIONES
Se pasivó las placas de cobre usando como medio ácido oxálico (Aox) 0,3 mol L-1 a pH 1, buffer fosfato de sodio (Bfs) pH 4 a una concentración de Dihidrogenofosfato de Sodio de 0,10 mol L-1 e Hidrógeno fosfato de sodio de 0,10 mol L-1 y solución de acetato de sodio (As) 0,25 mol L-1 pH 8. Se sintetizó electroquímicamente el polipirrol en estos medios a una concentración del monómero pirrol de 0,5 mol L-1. Se caracterizó las películas pasivantes del cobre y películas de Ppy usando Espectroscopía Raman y voltamperometría cíclica, mostrando los espectros característicos de óxidos de cobre, especies complejas del cobre, así como los picos de oxidación y reducción de estos. Se estudió las propiedades anticorrosivas del material formado usando las Pendientes de Tafel, dando como resultado una menor velocidad de corrosión en la película formada por 40 ciclos en ácido oxálico 0,3 mol L-1 pH 1.