Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Peruana de Ginecología y Obstetricia
versão On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.62 no.1 Lima jan./mar. 2016
CASO CLÍNICO
Citomegalovirus y embarazo: reporte de dos casos clínicos
Cytomegalovirus infection and pregnancy: report of two cases
Mileidy Egleet Mejias Quintero1,a, José María Huertas González1,a, Haidar Salem Salem 1,b
1 Hospital Gutiérrez Ortega de Valdepeñas. Ciudad Real, España Facultativo Especialista del Área de Ginecología y Obstetricia Jefe del Servicio de Ginecología y Obstetricia
Resumen
La infección por citomegalovirus (CMV) es muy frecuente a nivel mundial y las mujeres están constantemente expuestas al contagio durante el embarazo, con el consecuente riesgo de transmisión vertical. La infección materna suele ser asintomática y solo se sospecha la infección fetal ante el hallazgo de anormalidades fetales en el estudio ecográfico. Al nacer, solo 10 a 15% de los recién nacidos presentan síntomas, siendo las alteraciones auditivas y el desarrollo neurológico los más frecuentemente comprometidos. A día de hoy solo disponemos de medidas higiénico-sanitarias para la prevención de la infección durante la gestación, a la espera de resultados en el desarrollo de una nueva vacuna contra el CMV y de estudios multicéntricos controlados que avalen el uso o no de antivirales e inmunoglobulinas en gestantes infectadas por CMV.
Palabras claves: citomegalovirus; infecciones por citomegalovirus; embarazo; cuidado prenatal.
Abstract
Cytomegalovirus (CMV) infection is the most common cause of congenital infection roldwide; women are constantly exposed to infection during pregnancy with the consequent risk of vertical transmission. Congenital CMV infection is the leading cause of sensorineural hearing loss and neurodevelopmental sequelae. Maternal infection is usually asymptomatic and diagnosis is suspected only by fetal abnormalities detected on ultrasound examination. Only 10 to 15% of affected newborns develop symptoms, being hearing and neural development disorders the most common affections. Currently, only educational and hygienic measures may prevent infection during pregnancy, until the CMV vaccine becomes available. Results of controlled clinical trials on antiviral drugs and immunoglobulins against CMV in infected pregnant women are expected.
Keywords: Cytomegalovirus; cytomegalovirus infections; pregnancy; prenatal care.
Introducción
El citomegalovirus (CMV) es un virus muy común que pertenece a la familia de los Herpesviridae y junto con el Ebstein Barr son los principales responsables de la mononucleosis infecciosa a nivel mundial. El CMV invade principalmente las glándulas salivales y se excreta a través de líquidos corporales, como saliva, sangre, orina, semen y leche materna, por lo que para su transmisión se requiere contacto cercano y directo con una persona infectada. Además, el CMV puede estar presente en órganos trasplantados(1).
Este virus tiene la capacidad de permanecer latente en el organismo durante largos períodos, por lo que es posible que se reactive la infección así como su excreción en líquidos corporales, provocando nueva elevación de los títulos de anticuerpos que, por otro lado, pueden durar toda la vida.
Por otra parte, está descrita la transmisión vertical del CMV de madre a hijo, siendo una de las causas virales más comunes de infecciones congénitas a nivel mundial, tanto en países desarrollados como en vías de desarrollo y en grupos de bajo nivel socio económico(2).
Tiene un período de incubación variable, entre 28 y 60 días, y puede permanecer latente en la célula huésped después de la infección inicial con capacidad de reactivación posterior.
La seroconversión por infección primaria durante la gestación tiene una prevalencia de 1 a 7%, aproximadamente, mientras que la tasa de transmisión fetal es 36%, 40% y 65% en el primer, segundo y tercer trimestre, respectivamente( 1). Sin embargo, la afectación fetal con recién nacidos sintomáticos es menor a mayor edad gestacional, siendo de 25% aproximadamente en el primer trimestre, 5 a 10% en el segundo trimestre y asintomáticos si la infección ocurre a partir de las 28 semanas. También está descrita la transmisión vertical en 5,2% de pacientes con infección viral primaria ocurrida 3 a 6 meses previos a la concepción(1). El feto además puede ser infectado a través de la placenta, durante el parto por las secreciones cervicales o sangre materna, o por medio de la lactancia materna(3,4).
Del total de recién nacidos infectados, solo 10 a 15% presentan síntomas y desarrollan subsecuentemente alteraciones neurológicas, auditivas, visuales y mentales, a mediano y largo plazo, siendo más evidentes al inicio de la edad escolar. El resto de los recién nacidos infectados permanece asintomático.
La mayoría de las mujeres embarazadas adquieren la infección por contacto directo con sus otros hijos, sobre todo si son menores de 3 años, ya que el virus puede permanecer en la saliva u orina durante una media de 18 meses. Otro grupo susceptible de infección es el de aquellas mujeres con riesgo laboral, como las trabajadoras en guarderías u hospitales, o las gestantes inmunocomprometidas.
La embarazada cursa con infección asintomática y el diagnóstico solo se sospecha debido al hallazgo de múltiples anormalidades fetales en el estudio ecográfico fetal(4). Otras mujeres sin embargo pudieran recordar un episodio similar a un cuadro gripal, con fiebre, astenia, lifadenopatías y artromialgias.
El potencial teratógeno del CMV se basa en su capacidad de reducción casi absoluta de varios tipos celulares en distintos órganos, por un efecto directo o indirecto en ellas, asociado a daño vascular o endotelial. El CMV causa una villitis coriónica e infección de la placenta, que actúa como reservorio viral desde donde alcanza la circulación fetal(5), para luego iniciar la replicación viral en los riñones fetales y su posterior excreción en el líquido amniótico(1). El CMV tiene un especial tropismo por el sistema nervioso central, donde es capaz de alterar la migración neuronal desde la zona germinativa periventricular hacia la zona cortical, la cual ocurre entre las 12 y 24 semanas de gestación, ocasionando alteraciones del normal desarrollo del cerebro(3).
La infección congénita por CMV es la causa más común de pérdida auditiva neurosensorial, pérdida de la visión, alteraciones del neurodesarrollo, así como afectación hepática(5-7).
La preexistencia de anticuerpos maternos contra CMV es el principal factor protector contra la infección congénita por CMV, aunque en ocasiones lo sea de forma parcial(1).
Se presenta esta revisión con el objeto de analizar el diagnóstico prenatal y su manejo.
Presentación de casos
A continuación se describe dos casos clínicos valorados en nuestro hospital cuyas gestantes presentaron infección precoz por CMV.
Caso clínico 1
Paciente de 36 años de edad con paridad G2P1001, sin antecedentes personales ni familiares de importancia y cuyo hijo previo era completamente normal. Acudió a control de su segundo embarazo y presentaba serología materna negativa para HIV, toxoplasmosis, hepatitis B, C y sífilis. Inmune para rubéola y cuyo grupo sanguíneo era A Rh negativo, con prueba de Coombs indirecto también negativa.
En la ecografía de las 12 semanas le encontraron una translucencia nucal de 1,6 mm con PAPP-A y beta HCG normal para la edad gestacional.
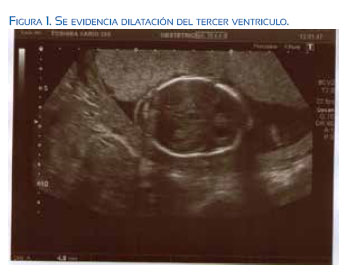
A las 19 semanas más 6 días acudió a valoración ecográfica de las 20 semanas, evidenciándose dilatación de ventrículos cerebrales, sobre todo a expensas de las astas anteriores, un tercer ventrículo dilatado y alto con cuerpo calloso pequeño y fino. La velocidad pico sistólica de la arteria cerebral media (VPS-ACM) era >1,5 MoM, compatible con anemia fetal grave, según las tablas de Mari.
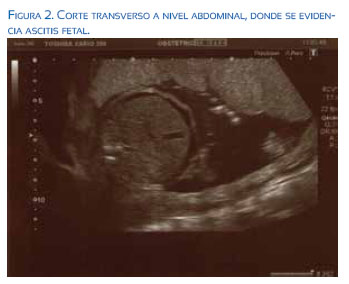
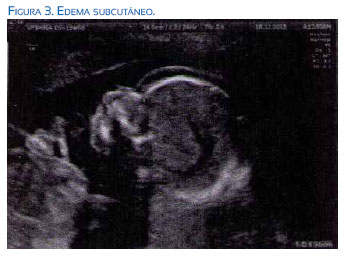
En el resto de la exploración se evidenció edema subcutáneo generalizado, más acusado a nivel del cuello, donde el pliegue nucal medía 6,6 mm. También existía hidrotórax y ascitis con hepatomegalia (figuras 1, 2 y 3).
En vista de los hallazgos ecográficos, se recomendó serología materna para TORCH, asociada a amniocentesis para cariotipo y PCR de CMV, toxoplasmosis y parvovirus B19.
Se obtuvo resultados serológicos y PCR confirmándose la sospecha de infección aguda por CMV. Se informó a la paciente, quien tras deliberación con su pareja decidió acogerse a la interrupción voluntaria del embarazo por malformación grave fetal, contemplada en la ley orgánica 2/2010, en España.
Caso clínico 2
Se trata de paciente de 32 años de edad, también con paridad G1P1001, con parto anterior normal a las 36 semanas de gestación y peso fetal de 2 900 g. No refería antecedentes patológicos de importancia y la serología materna para HIV, toxoplasmosis, hepatitis B, C y sífilis eran negativas, con grupo sanguíneo A Rh+. El resultado del cribado del primer trimestre fue de bajo riesgo con una translucencia nucal de 1,8 mm.
La paciente refería episodio de odinofagia sin fiebre a las 13 semanas de gestación, tras vacunación frente a la gripe.
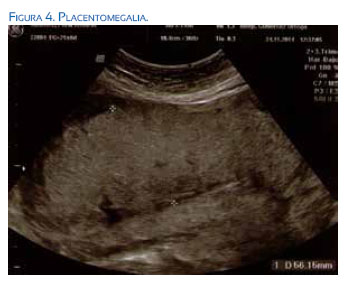
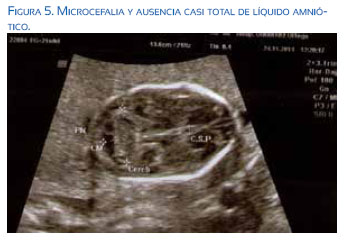
En el estudio ecográfico de las 20 semanas se evidenció feto con una grave restricción del crecimiento intrauterino dada por una biometría fetal acorde a 16 semanas de gestación. Microcefalia significativa, un cuerpo calloso hipodesarrollado y refringencia periventricular aumentada a nivel de los ventrículos laterales, sin observarse calcificaciones parenquimatosas. Destacaba la presencia de atrofia cortical, con hipodesarrollo de las cisuras e hipoplasia cerebelosa. También, se visualizaba cardiomegalia tetracameral sin signos de anemia fetal (VPSACM: 1,4 MoM) y placentomegalia (56 mm). Había además aumento de refringencia intestinal y anhidramnios (figuras 4 y 5).
Se solicitó serología materna para TORCH y se informó a la paciente que los hallazgos ecográficos eran altamente sugestivos de infección congénita por CMV.
Se le explicó las opciones de manejo (expectante, inicio de terapia con inmunoglobulina especifica anti CMV o interrupción de la gestación) y de que el tratamiento con inmunoglobulina estaba en fase experimental y, en este caso, dada la grave afectación cerebral, era probable que no existiera mejoría del pronóstico. Los padres optaron finalmente por la interrupción del embarazo.
Discusión
Para el diagnóstico de la infección por citomegalovirus se requiere seroconversión primaria en el embarazo, la cual debe ser determinada en dos muestras separadas por lo menos de 2 a 3 semanas. La determinación de IgG nos indica que la paciente tuvo contacto con el virus y que contaba con memoria inmunológica. Mientras que la presencia de IgM por sí sola no puede asegurar que la infección sea reciente -ya que los anticuerpos IgM pueden persistir hasta 12 meses después de la primoinfección-, es necesario practicar una prueba de avidez de IgG. La afinidad de los anticuerpos va aumentando conforme pasa el tiempo hasta que se obtienen anticuerpos de alta avidez(5). Es por ello que la prueba de avidez es extremadamente útil en la diferenciación entre infección aguda o crónica por CMV. Una baja avidez <30% nos indica infección materna reciente. Otra prueba que puede ser útil en el diagnóstico materno consiste en la PCR en sangre y orina materna.
Para el diagnóstico de infección congénita, además se requiere detección del virus en líquido amniótico por cultivo viral o detección de ADN viral por PCR, con una sensibilidad de 77% y una especificidad del 100%, según algunos autores(4). La detección del virus por PCR fue clave para el diagnóstico definitivo en la valoración de nuestros casos.
Además, es recomendable obtener la carga viral en el líquido amniótico, porque a mayor carga viral (>105 c/mL) la probabilidad de infección fetal es mayor. En algunos casos puede ser necesaria una cordocentesis, lo que permite la determinación de títulos de anticuerpos tipo IgM e IgG, realizar cultivos virales y detectar anemia y trombocitopenia como signos indirectos de infección en sangre del cordón umbilical. Sin embargo, no deja de ser una prueba invasiva con mayor riesgo de pérdida de la gestación, además de no mejorar significativamente las tasas de sensibilidad y especificidad. Este tipo de pruebas invasivas no deben realizarse en edades gestacionales tempranas (menores de 20 semanas), ya que el feto no es capaz de desarrollar una respuesta inmunológica sino hasta las 23 o 24 semanas; por otro lado, se recomienda hacerla siempre 5 a 6 semanas de la fecha probable de infección materna, pues realizarlo antes podría dar falsos negativos al no existir excreción viral en el líquido amniótico.
Ecográficamente se puede sospechar afectación fetal por CMV al evidenciar trastornos del crecimiento intrauterino, oligohidramnios, polihidramnios, hidropesía, calcificaciones intracraneales e intrahepáticas, hiperecogenicidad intestinal, microcefalia, ventriculomegalia, signos de hemorragia intracraneal y placentomegalia( 5-7). Estos hallazgos solo están presentes en 15 a 52% de los fetos con infección fetal confirmada( 8) y muchos de estos marcadores ecográficos estaban presentes en los casos presentados, lo que permitió orientar la sospecha diagnóstica.
El seguimiento ecográfico de estos fetos debe ser cada 2 a 4 semanas para detectar la presencia de los marcadores ecográficos. En ocasiones, se complementa esta valoración con resonancia magnética (RMN) del feto, ya que puede proporcionar información adicional. Sin embargo, la normalidad de estos estudios en un feto afecto no excluye la posibilidad de alteración de su neurodesarrollo posnatal.
Los recién nacidos sintomáticos cursan con anemia, trombocitopenia, hiperbilirrubinemia, linfocitosis atípica, elevación de las transaminasas, erupción petequial, proteínas elevadas en el LCR, coriorretinitis, pérdida auditiva neurosensorial y convulsiones, calcificaciones periventriculares y ventriculomegalias visibles con RMN cerebral(9).
Debido a que nuestras pacientes se acogieron a su derecho de interrupción voluntaria del embarazo en caso de grave afectación fetal, no fue posible ver la evolución de los mismos.
En cuanto a la profilaxis, dada la prevalencia de esta enfermedad en mujeres en edad fértil y de las graves consecuencias que puede ocasionar en el embarazo, estamos a la espera de la disponibilidad en el mercado de la vacuna para reducir el riesgo de exposición de la embarazada al CMV. El día de hoy solo podemos recomendar medidas higiénicas sanitarias, especialmente en las gestantes en contacto con niños (lavado frecuente de manos después del contacto con niños <3 años, tras cambio de pañales, alimentación o juego, además de evitar besos en la boca o compartir vasos y cubiertos).
En relación al tratamiento, en todas aquellas embarazadas infectadas pero en cuyos feto no se ha detectado infección, se ha planteado el uso de inmunoglobulina 100 U/kg mensual hasta el momento del parto, reportándose solo 16% de infección fetal en madres que recibieron tratamiento, comparado con 40% en quienes no la recibieron(9).
Una vez establecida la infección fetal, hay estudios que han informado el uso de inmunoglobulina a dosis de 200 U/kg de peso del paciente más administración intraamniótica de dosis única de 400 U/kg de peso fetal, con buena respuesta(10).
Según algunos autores, la inmunoglobulina humana intravenosa parece no modificar de forma significativa el curso de la enfermedad en embarazadas con seroconversión reciente(11). Sin embargo, hay revisiones sistemáticas llevadas a cabo recientemente en donde la administración de globulina hiperinmune en embarazadas infectadas revela cierta prevención de la infección fetal con aceptable perfil de seguridad; a pesar de ello, se sugiere mayor evidencia clínica antes de ser recomendado de forma rutinaria(12).
Actualmente hay en curso dos ensayos clínicos controlados para evaluar la eficacia de la administración intravenosa de globulina hiperinmune en la prevención de infección congénita por CMV, por lo que estamos a la espera de esos resultados.(ClinicalTrials.gov number NCT01376778)(13).
Se desconoce los efectos teratogénicos que puedan tener los agentes antivirales en los fetos de mujeres embarazadas, y en algunos estudios no se ha demostrado que disminuya la trasmisión vertical.
En neonatos severamente afectados, el ganciclovir vía endovenosa pudiera tener un efecto beneficioso. Sin embargo, su uso se ha visto limitado por su toxicidad o la aparición de efectos secundarios importantes, aunque de momento los datos son insuficientes(14).
En un artículo reciente se describe el efecto favorable con el uso oral de valganciclovir durante 6 meses, tanto en el neurodesarrollo como en la mejoría de la pérdida auditiva de infantes con infección congénita por CMV(15).
Arav-Boger habla sobre la importancia de la tipificación viral o la determinación de la estructura genómica viral, ya que determinadas cepas pudieran estar relacionadas con el desarrollo de un amplio espectro de anormalidades fetales o desarrollo de secuelas mayores o menores en función de su potencial patogénico o de su capacidad de diseminación en los tejidos de los fetos. Además, la identificación de las mismas permitiría el desarrollo de vacunas tipo específicas, lo que mejoraría su eficacia. Sin embargo, la identificación de un marcador viral en la enfermedad congénita por CMV ha generado más debates que consensos. A pesar de ello, las investigaciones deben continuar a fin de poder mejorar la profilaxis y el tratamiento de esta enfermedad( 16).
En conclusión, ante la sospecha de infección congénita por CMV es importante un adecuado diagnóstico y seguimiento de las gestantes, debido a las importantes secuelas que la infección pueda generar en los fetos. A día de hoy, la intervención más eficaz sigue siendo la profilaxis o la implementación de medidas higiénicas sanitarias por parte de las gestantes de riesgo. En un futuro muy cercano, el estudio del genotipo viral podrá determinar algún predictor o marcador que nos permita reconocer cuáles fetos desarrollarán o no secuelas y si estas se asocian o no a determinadas cepas virales. Además, el desarrollo de nuevas líneas de tratamiento en el campo de los antivirales permitirá reducir las secuelas de estos infantes congénitamente afectados por CMV, mejorando su calidad de vida.
Agradecimientos
A todos aquellos quienes con su incondicional apoyo pusieron su granito de arena para la realización de este trabajo.
Referencias Bibliográficas
1. Sheffield JS, Boppana SB. Cytomegalovirus infection in pregnancy. Uptodate[Internet].2015. [Actualizada 29 de mayo 2015; acceso septiembre 2015]. Disponible en http:// www. uptodate.com. [ Links ]
2. Sever JL. Pediatric cytomegalovirus infections. Clin Appl Immunol Rev. 2002;3(1-2):47-59. doi:10.1016/S1529- 1049(02)00061-2 [ Links ]
3. Malm G, Engman ML. Congenital cytomegalovirus infections. Semin Fetal Neonatal Med. 2007;12(3):154–9. doi:10.1016/j. siny.2007.01.012 . [ Links ]
4. Duff P. Diagnosis and management of CMV infection in pregnancy. Perinatology. 2010;1:1-6. [ Links ]
5. González-García CL, Reyes Méndez MA, Ortega Pierres LE, Rodríguez Sánchez AP, Sandoval Guido V, Sereno Colo JA. Seroprevalencia y detección de infección primaria por citomegalovirus mediante prueba de avidez IgG en el primer trimestre del embarazo. Salud pública de Méx. 2014;56(6):619- 24. [ Links ]
6. Harrison GJ. Current controversies in diagnosis, management, and prevention of congenital cytomegalovirus: updates for the pediatrics practitioner. Pediatr Ann. 2015;44(5):e115-e125. doi: 10.3928/00904481-20150512-11. [ Links ]
7. Wen LZ, Xing W, Liu LQ, Ao LM, Chen SH, Zeng WJ. Cytomegalovirus infection in pregnancy. Int J Gynaecol Obstet. 2002;79(2):111-6. doi:10.1016/S0020-7292(02)00239-4. [ Links ]
8. Johnson J, Anderson B. Screening, prevention and treatment of congenital cytomegalovirus. Obstet Gynecol Clin North Am. 2014;41(4):593-9. doi: 10.1016/j.ogc.2014.08.005. [ Links ]
9. Nigro G, Adler SP, La Torre R, Best AM; Congenital Cytomegalovirus Collaborating Group. Passive immunization during pregnancy for congenital cytomegalovirus infection. N Engl J Med. 2005;353:1350-62. doi: 10.1056/NEJMoa043337. [ Links ]
10. Nigro G, La Torre R, Pentimalli H, Taverna P, Lituania M, de Tejada BM, et al. Regression of fetal cerebral abnormalities by primary cytomegalovirus infection following hyperimmunoglobulin therapy. Prenat Diagn. 2008;28:512-7. [ Links ]
11. Revello MG, Lazzarotto T, Guerra B, Spinillo A, Ferrazzi E, Kustermann A, et al. A randomized trial of hyperimmune globulin to prevent congenital cytomegalovirus. N Engl J Med. 2014;370(14):1316-26. doi: 10.1056/NEJMoa1310214. [ Links ]
12. Hamilton ST, Van Zuylen W, Shand A, Scott GM, Naing Z, Hall B, et al. Prevention of congenital cytomegalovirus complications by maternal and neonatal treatments: a systematic review. Rev Med Virol. 2014;24(6):420-33. doi: 10.1002/ rmv.1814. [ Links ]
13. Interim analysis of the Cytotec Phase III trial in Congenital Cytomegalovirus (CMV) infection shows clear indication of efficacy. Disponible en: http://www.biotest.de/ww/en/pub/ investor_relations/news/newsdetails.cfm?newsID=1025191 [ Links ]
14. Leung AK, Sauve RS, Davies HD. Congenital cytomegalovirus infection. J Natl Med Assoc. 2003;95(3):213-8. [ Links ]
15. Kimberlin DW, Jester PM, Sánchez PJ, Ahmed A, Arav-Boger R, Michael MG, et al. Valganciclovir for symptomatic congenital cytomegalovirus disease. N Engl J Med. 2015;372(10):933-43. doi.org/10.1056/NEJMoa1404599. [ Links ]
16. Arav-Boger R. Strain variation and disease severity in congenital cytomegalovirus infection: in search of a viral market. Infect Dis Clin N Am. 2015;29(3):401-414. doi:10.1016/j. idc.2015.05.009. [ Links ]
Conflicto de intereses: Los autores arriba citados declaran que no existe ningún conflicto de intereses relacionado con el artículo.
Fuente de financiamiento: Autofinanciado. Artículo recibido el 30 de octubre de aceptado para publicación el 9 de diciembre de 2015.
Correspondencia: Mileidy Egleet Mejias Quintero
Dirección: Calle Virgen de los Dolores 43. Valdepeñas, Ciudad Real. Código Postal: 13300 España. mileidymejias4@hotmail.com