Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Peruana de Ginecología y Obstetricia
versão On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.62 no.2 Lima abr./jun. 2016
CONTROVERSIAS EN GINECOLOGÍA Y OBSTETRICIA
Controversias en el tratamiento de la osteoporosis posmenopáusica
Controversies in clinical manage ment of postmenopausal
Wendy Sotelo1, Eduardo Acevedo-Vásquez2
1 Médico Internista y Reumatólogo; Docente Contratada, Universidad Peruana Cayetano Heredia; Clínica San Felipe
2 Médico Internista y Reumatólogo; Profesor Principal, Universidad Nacional Mayor de San Marcos; Académico de Número, Academia Nacional de Medicina; Clínica San Felipe
Resumen
La osteoporosis es la enfermedad ósea más común en el mundo globalizado. Produce un alto impacto en el costo de la Salud Pública debido al incremento en forma progresiva en el correr del tiempo de vida del número de personas que la padecen, originada entre otros factores por la mayor expectativa de vida poblacional y disponer de nuevos procedimientos de diagnóstico, los que han conseguido gran penetración en las atenciones de salud. Las fracturas óseas son la principal consecuencia de esta enfermedad, las que originan dolor crónico, discapacidad y pérdida de la calidad de vida, pudiendo llevar inclusive a la muerte. Existen guías clínicas internacionales vigentes que se basan en evidencias de estudios clínicos aleatorizados y que dan pautas para el tratamiento de la osteoporosis y en especial de la forma posmenopáusica, ofreciendo tanto acciones farmacológicas como no farmacológicas. A raíz de resultados de estudios de seguimiento en gran número de pacientes, se discute en la actualidad aspectos de soporte terapéuticos tradicionales, como el uso y dosis de suplementos de calcio, sosteniéndose que en los que tienen una dieta adecuada de calcio existe un aparente no beneficio en su ingesta y es posible que un grupo de ellos puedan desarrollar eventos adversos como complicaciones, tales como constipación crónica, diverticulitis, litiasis renal o enfermedades cardiovasculares. Del mismo modo se reportan estudios que plantean la sugerencia de un uso con tiempo límite de bifosfonatos, sucediendo además de la pérdida de eficacia, la posibilidad de desarrollar eventos adversos como fracturas femorales atípicas y osteonecrosis de mandíbula. Este último evento adverso también es descrito con el uso de denosumab. O, por otro lado, en los que reciben teriperatida existe la infrecuente posibilidad de desarrollar neoplasias como el osteosarcoma, por lo que la recomendación es que su uso no debe superar los dos años. Finalmente, a raíz de las investigaciones sobre las concentraciones séricas de la vitamina D y su relación con los síntomas y signos que pueden dar su deficiencia, en las personas, y los posibles beneficios con acciones sobre la autoinmunidad, algunas neoplasias y una leve mejora de la masa ósea, da pie a sostener que el suplemento de vitamina D3 debe ser una parte importante en la terapia.
Palabras clave: Osteoporosis, Posmenopáusica; Fractura; Calcio; Neoplasias de Hueso; Bifosfonatos; Vitamina D, Deficiencia.
Abstract
Osteoporosis is the most common bone disease in the globalized world, with high impact on health care costs due to progressive increase in life expectancy and the existence of new diagnostic procedures. Bone fractures are the main consequence of this disease, which cause chronic pain, disability and loss of quality of life, and can even lead to death. Existing international clinical guidelines based on evidence from randomized trials give standards for the treatment of osteoporosis, especially its post-menopausal form, offering both pharmacological and non-pharmacological actions. Based on results from follow-up studies in a large number of patients, we currently discuss aspects of traditional therapeutic support, such as the use and dosage of calcium supplements. It is proposed that there may exist an apparent non-benefit from its intake among those with an adequate level of dietary calcium; it is possible that some of them may develop adverse events such as chronic constipation, diverticulitis, kidney stones or cardiovascular disease. Similarly, some studies suggest to use biphosphonates for a limited period of time, which associates with loss of efficiency and the possibility of adverse events, such as atypical femoral fractures and osteonecrosis of the jaw bone. This last adverse event is also described with the use of denosumab. What is more, among those who receive teriperatide there exists the infrequent possibility of developing neoplasms such as osteosarcoma, so that the recommendation is that its use cannot exceed 2 years. Finally, as a result of research on serum concentrations of vitamin D and their relationship with signs and symptoms that may present in its deficiency, as well as the possible benefits from vitamin D on autoimmunity, some neoplasms and a mild improvement in bone mass, we can affirm that the supplementation with vitamin D3 must be an important part in its therapy.
Keywords: Osteoporosis, Postmenopausal; Bone Fractures; Calcium; Bone Neoplasms; Bisphos phonates; Vitamin D Deficiency.
Introducción
La osteoporosis es la enfermedad ósea más común a nivel mundial, que afecta a 200 millones de personas en el mundo, con un costo de miles de millones de dólares en la atención de los pacientes con osteoporosis, convirtiéndose en un problema de Salud Pública(1). En Estados Unidos de Norteamérica, la osteoporosis afecta aproximadamente a 9,9 millones de norte-americanos y, adicionalmente, 43 millones tienen masa ósea baja, lo que significa que presentan un riesgo incrementado para desarrollar osteoporosis(2). Perú es el cuarto país más numeroso de América del Sur. La osteoporosis es un problema que afecta principalmente a la población de edad avanzada y a las mujeres peruanas posmenopáusicas, es decir, más del 7% de mujeres entre 40 y 60 años y casi el 30% de mujeres mayores de 60 años(3). Se calcula que la población actual de Perú es de 30,4 millones de habitantes, de los cuales el 10,4% (3,1 millones) tiene 60 años o más, y el 4,5% (1,3 millón) tiene 70 años o más. Se estima que para el año 2050 la población total alcanzará 37 millones, de los cuales el 36% (13 millones) tendrá 50 años o más y el 12% (4,5 millones) tendrá 70 años o más(4). Los datos de EsSalud indican una tasa de osteoporosis de 7% de mujeres entre 40 y 60 años y 30% de mujeres mayores de 60 años. EsSalud (el prestador de seguro nacional de salud para los trabajadores) calcula que 12 a 16% de las mujeres peruanas mayores de 50 años sufrirá una fractura de cadera al año(5). En base a la población actual de 2,7 millones de mujeres peruanas de 50 años o más, esto significaría entre 324 000 y 432 000 fracturas por año en este segmento poblacional. Las estadísticas poblacionales proyectan que habrá 7,5 millones de mujeres de 50 años o más en el año 2050. Por lo tanto, podemos extrapolar estos datos para estimar que entre 900 000 y 1,2 millón de mujeres de 50 años o más podrían sufrir una fractura en el año 2050.
En el presente artículo revisaremos los aspectos terapéuticos actuales empleados en el manejo de la osteoporosis postmenopáusica y las recientes controversias originadas en la práctica clínica.
Osteoporosis y su importancia
La osteoporosis se define como una enfermedad caracterizada por la pérdida de la masa ósea con el deterioro del tejido óseo y la disrupción de la microarquitectura ósea, comprometiendo la resistencia ósea y aumentando el riesgo de fracturas(6).
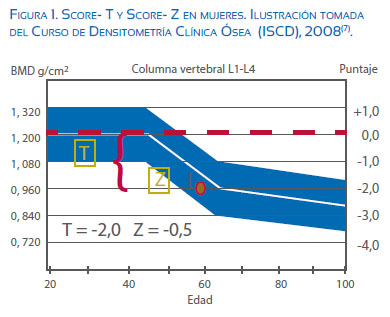
Según la Organización Mundial de la Salud (OMS), la clasificación diagnóstica de osteoporosis se basa en la densidad mineral ósea (DMO) en cadera o columna lumbar, con valor menor o igual a 2,5 desviaciones estándar por debajo del promedio de DMO de la población adulta-joven de referencia (Score-T) medida por DXA (Dual-energy X-ray Absorptiometry)(7).
La disminución de la DMO incrementa el riesgo de fractura. Las fracturas osteoporóticas son de relevancia clínica, debido a las complicaciones que conllevan, como dolor crónico, discapacidad y muerte(8). Se estima que una mujer blanca de más de 50 años de edad tiene un 15 a 20% de riesgo para fractura de cadera y un 50% de riesgo para otras fracturas a lo largo de su vida(9). En el estudio LAVOS (Latin American Vertebral Osteoporosis Study) realizado en 1 922 mujeres pos-menopáusicas mayores de 50 años procedentes de Argentina, Colombia, Brasil, México y Puerto Rico, se encontró una prevalencia de fracturas vertebrales radiográficamente de 11,18%; con prevalencia de fracturas vertebrales asintomáticas de 6,9% en el grupo etario de 50 a 59 años y de 27,8% en pacientes mayores de 80 años(10). Un estudio realizado en Lima, Perú, en el año 2000, determinó una tasa de mortalidad anual del 23,2% después de una fractura de cadera(11). Las tasas de mortalidad fueron más altas en hombres que en mujeres(12).
La evaluación del riesgo de factura se puede medir con la evaluación de los factores de riesgo. La Organización Mundial de la Salud (OMS) desarrolló una herramienta llamada FRAX (Fracture-Risk-Assessment.tool) como predictor de fracturas, que integra factores clínicos de riesgo con la densidad mineral ósea (DMO) del cuello femoral, mediante un programa informático disponible on-line que calcula la probabilidad de fractura a 10 años, de cadera y de las fracturas osteoporóticas más importantes (vertebral, antebrazo, cadera y hombro)(13). En la actualidad no contamos con una base epidemiológica sobre la prevalencia de osteoporosis y de los factores de riesgo asociados de la población peruana que nos permita evaluar el riesgo de fractura mediante esta herramienta; sin embargo, podría recomendarse su uso para determinar el riesgo de fractura en poblaciones con factores de riesgo presentes. Un estudio llevado en el Servicio de Reumatología del Hospital Almenara sugirió que los valores de la masa ósea en antebrazo distal correlacionan adecuadamente con los valores que se hallan a nivel de columna lumbar en personas mayores de 65 años mas no en aquellas menores de 65 años(14).
La mayoría de guías sugieren una evaluación de la DMO a partir de los 65 años de edad. Sin embargo, la evaluación de los factores de riesgo es útil para definir el riesgo absoluto para seleccionar el tratamiento individual de pacientes.
Los pacientes que han tenido fracturas osteoporóticas se encuentran particularmente en riesgo alto para nuevas fracturas. Otros pacientes en riesgo alto para fracturas son los que presentan osteoporosis secundaria debida a hiperparatiroidismo, mieloma múltiple, malabsorción, diabetes mellitus o enfermedad inflamatoria intestinal(15).
¿Quiénes deben recibir tratamiento para osteoporosis?
El tratamiento de la osteoporosis es generalmente recomendado en mujeres posmenopáusicas quienes tienen una DMO con score T de -2,5 o menos en cadera total, cuello femoral o columna lumbar; una historia de fractura de cadera o columna lumbar; o un score de FRAX que indique una probabilidad a 10 años para fractura osteoporótica de cadera >3% o para una fractura osteoporótica mayor >20%(6,16).
¿Las mujeres posmenopáusicas con osteopenia deberían recibir tratamiento?
La osteopenia es una condición definida como masa ósea medida por DXA representada por un score-T entre -1 y -2.5, criterio densitométrico establecido por la OMS para clasificación del punto de vista epidemiológica, más que para su uso en la práctica clínica. Existen estudios como OFELY (The impact of osteoporosis on quality-of-life) que demostró un 48% de fracturas en una población de 671 mujeres posmenopáusicas con criterios densitométricos de osteopenia, mientras que el 44% de fracturas se produjeron en la población femenina con osteoporosis(17). A pesar de estas cifras no hay que olvidar que el riesgo de fractura no viene solo determinado a la baja DMO, sino también a la evidencia de otros factores predisponentes (edad, tratamientos, enfermedades previas personales o familiares, terapias recibidas, estilos de vida, entre otros) pueden tener la misma o mayor potencia en la incidencia de fracturas(18). La toma de decisión terapéutica en pacientes con osteopenia se enfocaría a la prevención del desarrollo de osteoporosis mediante las medidas no farmacológicas con modificación o control de los factores de riesgo asociados.
¿Cómo se trata la osteoporosis en mujeres posmenopáusicas?
En las opciones terapéuticas no farmacológicas podemos intervenir en los factores de riesgo asociados a osteoporosis y a fracturas, como son los estilos de vida.
Factores de riesgo modificables y actividad física
Los ejercicios aeróbicos, de resistencia y con peso pueden incrementar la masa muscular y, transitoriamente, la DMO, reduciendo el riesgo de fracturas. Programas de ejercicios y balance como tai-chi y yoga pueden resultar en mejorar el balance, incrementar el tono muscular y reducir secundariamente el riesgo de fracturas(18). Además de incrementar la actividad física, se recomienda el cese del uso de tabaco y la ingesta de alcohol.
Vitamina D
La vitamina D tiene un rol importante en la absorción intestinal de calcio, salud ósea, fuerza muscular, balance y riesgo de caídas(20). En pacientes con DMO baja o una fractura osteoporótica previa o a quienes se les considere tratamiento para osteoporosis, se recomienda una evaluación simple del estado de vitamina D. Las recomendaciones por la National Osteoporosis Foundation (NOF)(6) de EE UU sugieren la ingesta diaria de 800 a 1 000 UI de vitamina D para adultos mayores de 50 años. Para los humanos la fuente mayor de vitamina D es la exposición a la luz solar; complementariamente, las dietas que incluyen fuentes marinas para la alimentación (algunos peces como el salmón y la caballa pueden contener en 100 gramos entre 500 y 1 000 UI de vitamina D; y los aceites de pescado son fuente de esta vitamina). Por otro lado, existe una serie de alimentos que son fortificados con vitamina D, como los jugos de naranja, panes, yogures y quesos(21). Los laboratorios de nuestro país adoptan como valores para los niveles séricos de concentración de vitamina 25(OH)D los sugeridos por la Universidad de Boston y otras organizaciones o sociedades de Nutrición Clínica, y estos valores son: deficiencia de vitamina D, menos de 50 nmol/L, o 20 ng/mL; insuficiencia, 51–74 nmol/L o 21–29 ng/mL; mientras que son niveles suficientes 30 ng/mL o más(22).
Se ha correlacionado los niveles insuficientes y deficientes de vitamina D con incremento de la hormona PTH, con la subsecuente alta tasa de resorción ósea y riesgo de fracturas. En Perú se realizó un estudio de serie de casos que incluyó 40 pacientes mujeres posmenopáusicas con osteoporosis primaria; se determinó el nivel sérico de 25(OH) vitamina D, encontrándose niveles deficientes de vitamina D (13,98 ± 5,95 ng/mL) en 87,5% de las pacientes(23).
Los adultos jóvenes y de mediana edad obtienen beneficio del incremento de sus estados de vitamina D con la exposición solar y suplementación en la dieta, disminuyendo el riesgo de enfermedades autoinmunes, preeclampsia, cáncer, diabetes mellitus tipo 2, deterioro cognitivo, enfermedad coronaria y enfermedades infecciosas(24,25).
La hipovitaminosis D está asociada consistentemente con el incremento de la disminución de la función muscular y aumento de la consecuente discapacidad. Por el contrario, una suplementación de vitamina D ha demostrado un incremento de la resistencia muscular, especialmente en adultos mayores, con una reducción en el riesgo de caídas, debido a su efecto directo sobre las células musculares(26).
Calcio
Algunas guías, como la de la National Osteoporosis Foundation (NOF)(6), aconseja una dieta que incluya cantidades adecuadas en la ingesta total de calcio (1 000 mg / día para los hombres de 50 a 70 años; 1 200 mg / día para las mujeres mayores de 51 años y hombres de 71 años o más), pudiendo incorporarse suplementos dietéticos si la dieta es considerada in suficiente, recomendación que también sustenta el Instituto de Salud de los EEUU (NIH), sin evidencia de que cantidades mayores de ingesta de calcio con fiera un adicional beneficio en la resistencia ósea. Como es reconocido en la actualidad, la ingesta de calcio tiene un rol menor y de corto plazo sobre la prevención y tratamiento de la osteoporosis(27).
La eficacia del uso de calcio y vitamina D para la prevención de fracturas osteoporóticas es controversial. En un estudio aleatorio por investigadores de la Iniciativa de Salud de la Mujer (WHI) de más de 36 000 mujeres posmenopáusicas, la administración de calcio (suplemento diario de 1 000 mg de calcio elemental) con vitamina D (400 UI diario) no tuvo un efecto significativo sobre las fracturas, con leve incremento de la DMO y riesgo incrementado de litiasis renal(28). Recientes controversias han surgido respecto a la recomendación de suplementar calcio. Se reporta en forma más frecuente que la ingesta que excede a 1 200-1 500 mg diario puede incrementar el riesgo de efectos gastrointestinales, litiasis renal, enfermedad cardiovascular, como infarto agudo de miocardio e ictus. Debido a estos eventos se plantea que la ingesta de calcio tiene un efecto riesgo-beneficio negativo y debería no ser usado en forma rutinaria para la prevención y tratamiento de osteoporosis(29-31). Sin embargo, en relación a la enfermedad cardiovascular existen publicaciones con datos contrarios respecto a este riesgo incrementado de enfermedad cardiovascular con el uso del suplemento de calcio(32-34). Nuestra posición referente al suplemento nutricional de calcio es la optimización de la ingesta diaria en la dieta y para quienes no lo pudieran, usar suplementos de calcio, no sin antes considerar su no uso en aquellos con constipación crónica, diverticulosis intestinal y litiasis intestinal, pudiendo requerir la opinión de un cardiólogo en el caso de existir o tener riesgo de enfermedad cardiovascular.
Terapia farmacológica
Terapia de reemplazo hormonal (TRH)
La supresión de la actividad osteoclástica debido a TRH por estrógenos ha sido utilizada por décadas, y fue el tratamiento principal de prevención y tratamiento de la osteoporosis. En un metaanálisis se demostró que el estrógeno fue significativamente más efectivo que el placebo en preservar e incrementar la DMO, y la des-continuación de estrógenos resultó en pérdida de masa ósea en proporción similar que la vista en la menopausia temprana(35). La TRH está asociada con un incremento del riesgo de eventos adversos a largo plazo, como trastornos tromboembólicos e ictus, así como el incremento del desarrollo de cáncer de mama.
Moduladores de los receptores selectivos de estrógenos (SERMS)
Los SERMs se unen a los receptores de estrógeno con gran afinidad; median eventos transcripcionales como agonistas (sistema óseo y cardiovascular) o antagonistas (mama y en algunos casos endometrio). El raloxifeno fue aprobado para la prevención y tratamiento de la osteoporosis pos-menopáusica (60 mg/d). Los efectos del raloxifeno sobre los marcadores del remodelado óseo han sido más modestos (reducción de 30 a 40%) que con la terapia de bifosfonatos (50 a 70%)(36); de la misma forma, con el resultado de DMO(37). El estudio MORE (Multiple Outcomes of Raloxifene Evaluation) demostró reducir en 30% el riesgo de fracturas vertebrales pero no el riesgo de facturas no vertebrales a 3 años(38) y en el estudio CORE (extensión del estudio MORE) no pudo demostrarse reducción del riesgo de fracturas no vertebrales a los 8 años(39). En el estudio RUTH (Raloxifene Use for The Heart) se halló un riesgo incrementado de tromboembolismo venoso y de ictus fatal(40).
Agentes Antirresortivos
Bifosfonatos
Son los agentes antirresortivos más usados en el mundo para el tratamiento de la osteoporosis. El FIT (Fosamax Intervention Trial) demostró que el grupo tratado con alendronato tuvo una disminución promedio del NTX urinario de 41,9% y del CTX en 52,4% después de 3 años de tratamiento(41,42). Asimismo, el análisis post-hoc del estudio FIT de mujeres con altos niveles basales de propéptido N-terminal del procolágeno tipo 1 (P1PN) demostró una mayor reducción en riesgo de fracturas no vertebrales en repuesta al alendronato con respecto a los niveles bajos de P1PN. Asimismo se encontró una reducción del 47% de nuevas fracturas morfométricas vertebrales y en 51% de fracturas de cadera en individuos con una fractura vertebral previa por lo menos. En el estudio FOSIT (Fosamax International Trial), el alendronato redujo el riesgo de fracturas no vertebrales en 47%(43). El risedronato fue evaluado en el estudio VERT (Vertebral Efficacy with Risedronate Therapy) y demostró reducción de nuevas fracturas vertebrales (49%) y no vertebrales (33%)(44). El ibandronato es otro agente del grupo de los bifosfonatos; evaluado en el estudio BONE (oral Ibandronate Osteoporosis vertebral fracture Trial in North America and Europe), redujo significativamente el riesgo de nuevas fracturas morfométricas vertebrales de 62% y 50% versus placebo. La incidencia de fracturas no vertebrales fue similar entre el grupo de ibandronato y el grupo placebo(45), sin evidencia documentada de beneficio de la disminución del riesgo para fracturas no vertebrales. El estudio HORIZON (Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly)(46) evaluó la eficacia del zoledronato a dosis de 5 mg en 3 años, hallándose una reducción del riesgo de fracturas morfométricas vertebrales de 70% y de cadera en 41%. El estudio de extensión HORIZON-FPT (HORIZON-Pivotal Fracture Trial) demostró el beneficio del tratamiento a 6 años con zoledronato(47). Los efectos adversos más comunes de los bifosfonatos son las molestias gastroesofágicas para las presentaciones orales. Se han reportado casos de osteonecrosis mandibular y fracturas atípicas, sugiriendo estos hallazgos que la terapia no debería superar este tiempo.
¿Hasta cuándo dar bifosfonatos para tratamiento de osteoporosis?
Respecto al tiempo de tratamiento con bifosfonatos, no existe evidencia actual concluyente sobre la duración del tratamiento. Sin embargo, se recomienda individualizar la terapia. Información reciente sugiere que puede efectuarse la suspensión del mismo luego de 5 años de tratamiento según sea el escenario clínico. Esta recomendación se basa en la evidencia de que el bifosfonato se acumula en el hueso y es liberado por meses/ años después de su retiro (efecto antifractura resi-dual). Las pacientes con DMO levemente reducida podrían ser candidatas a suspender el tratamiento por 1 o 2 años. Black y col reportaron que con el uso prolongado de bifosfonatos por más de 10 años se incrementaba la ocurrencia de fracturas diafisiarias femorales o subtrocantéricas(48).
La Administración de Drogas y Alimentos de los EE UU (FDA) evaluó un análisis de tres extensiones de estudios a largo plazo que involucraban bifosfonatos, FLEX (Fracture Intervention Trial Long-term Extension, alendronato), HORIZON-PFT (HORIZON-Pivotal Fracture Trial, zoledronato) y VERT-MN (Vertebral Efficacy with Risedronate Therapy-Multinational, risedronato), y encontraron que las pacientes que habían recibido tratamiento con bifosfonatos por 6 años a más tuvieron una tasa de fractura de 9,3 a 10,6%, mientras que la tasa de fractura para pacientes que pasaron del tratamiento a placebo fue 8,0 a 8,8%. Estos datos elevaron la pregunta de que si el tratamiento continuo con bifosfonatos impartía un beneficio adicional a la prevención de fractura, en relación al cese del tratamiento a los 5 años. Con el reporte de las fracturas femorales atípicas y de osteonecrosis de mandíbula asociadas al uso prolongado de bifosfonatos, el concepto de vacaciones terapéuticas permite minimizar los eventos adversos de los bifosfonatos con el beneficio de la eficacia antifractura persistente en los pacientes(49,50).
Denosumab
Es otro de los agentes antirresortivos usado para el manejo de osteoporosis posmenopáusica. Es un anticuerpo monoclonal que inhibe el RANKL (receptor activator of nuclear factor-kappaB ligand) y, consecuentemente la osteoclastogénesis. El estudio FREEDOM (Fracture Reduction Evaluation of Denosumab in Osteoporosis Every 6 Months) evaluó la eficacia de denosumab en 3 años, con incremento de DMO del 9,4% en columna vertebral y de 4,8% de cadera total, reduciendo el riesgo de nuevas fracturas radiográficas vertebrales en 68%, en cadera total 40% y en no vertebrales 20%. La celulitis fue el evento reportado más frecuentemente (0,3% vs. <0,1% en el grupo placebo)(51). A largo plazo de tratamiento, la DMO de columna vertebral se incrementó en 15,2% y de cadera en 7,5%(52); se reportaron pocos casos de osteonecrosis de mandíbula. En pacientes que descontinuaron el tratamiento con denosumab hubo pérdida rápida de DMO a los 12 meses, lo que supone que no confiere el efecto residual seguido del cese de la terapia.
Agentes Anabólicos
Ranelato de estroncio
Es considerado un agente dual, incrementa la formación ósea y disminuye la resorción ósea, pero el mecanismo de acción es incierto. El estudio SOTI (Spinal Osteoporotic Therapeutical Interventional)(53) demostró una reducción del riesgo en 49% en el primer año de tratamiento con 2 g diarios, y de 41% durante los 3 años de estudio. El estudio TROPOS (TReatment Of Pheripherical Osteoporosis) demostró una reducción del 19% sobre las fracturas no vertebrales y, en mujeres con alto riesgo de fractura de cadera, la reducción de fracturas de cadera fue de 36%(54).
Teriparatida
La administración intermitente de hormona paratiroidea (PTH) a dosis bajas estimula la actividad osteoblástica y formación ósea. Dos péptidos de PTH han sido aprobados para el tratamiento de osteoporosis: teriparatida (PTH 1-34) y PTH 1-84. En un estudio se encontró reducción del riesgo de fractura en 65% y 54% para fracturas vertebral y fracturas no vertebrales, respectivamente(55). El uso concomitante de bifosfonatos podría atenuar la mejoría de la masa ósea en comparación con PTH solo. Sin embargo, la administración de un agente antirresortivo ha sido considerado después del tratamiento para mantener la ganancia ósea lograda(56). Se recomienda máximo un periodo de dos años de tratamiento, porque los estudios preclínicos han mostrado el desarrollo de osteosarcoma en ratas, contraindicado en casos de Enfermedad de Paget o riesgo de osteosarcoma, metástasis ósea e irradiación esquelética. El uso de teriparatida es limitado a casos de osteoporosis severa, por su alto costo.
Otras Terapias Emergentes
Odanacatib
Es un inhibidor de la catepsina K desarrollado para el tratamiento de osteoporosis posmenopáusica. Inhibe la resorción ósea, pero conserva la formación ósea en cierto grado. En un estudio clínico, los marcadores bioquímicos de resorción ósea disminuyeron en 60 a 70%. En un ensayo de fase III que involucró 16 713 mujeres posmenopáusicas de 65 años a más con DMO baja, el riesgo de fractura por fragilidad se redujo significativamente en columna, cadera y otros sitios no vertebrales comparados con el grupo placebo. Odanacatib a dosis de 50 mg semanal ha sido bien tolerado; hasta el momento no se han descrito casos de osteonecrosis de mandíbula, fracturas atípicas y casos de morfea(57).
Anticuerpos contra la esclerostina
La esclerostina inhibe la formación ósea. Estudios con anticuerpos monoclonales contra la esclerostina en animales han demostrado que este fármaco estimula la formación ósea directamente a través del modelamiento óseo, en forma independiente del remodelado óseo y frecuencia de la activación. Adicionalmente, estos anticuerpos estimulan la osteoprotegerina, resultando en una disminución de la resorción ósea, permitiendo un desbalance entre la formación y resorción ósea, con mayor efecto anabólico que teriparatida(58). Romosozumab es un anticuerpo antiesclerostina de presentación en inyectables vía subcutánea, que en mujeres posmenopáusicas con masa ósea baja a dosis de 210 mg mensual durante 12 meses, de mostró un incremento significativo en la DMO (11,3% en columna, 4,1% en cadera total y 3,7% en cuello femoral)m más alto que con alendronato semanal y que con teriparatida. Hubo un incremento transitorio de los marcadores bioquímicos de formación ósea y disminución de los marcadores bioquímicos de resorción ósea(59).
Marcadores bioquímicos del recambio óseo(60)
El tejido óseo es metabólicamente activo y se encuentra en constante resorción y remodelado a través de la vida de un individuo. La osteoporosis ocurre cuando la resorción ósea es mayor, resultando en masa ósea disminuida y deterioro de la microarquitectura ósea. Existen componentes celulares de la matriz ósea categorizados como marcadores bioquímicos de la resorción y formación ósea. Dentro de los marcadores de formación ósea están la fosfatasa alcalina ósea specífica, osteocalcina y propéptidos carboxil y amino terminal del procolágeno tipo 1(P1CP, P1NP). El P1NP es producto específico de la proliferación de osteoblastos y fibroblastos, tiene más ventajas funcionales y es el más recomendado.
Entre los marcadores de resorción ósea contamos con telopéptidos ligados al carboxi y aminoterminales del colágeno tipo 1 (CTX y NTX), considerándose el CTX sérico como el marcador de elección, pero tiene la desventaja que varía con los cambios del ritmo circadiano. El NTX urinario es otro marcador que podría utilizarse para evaluar la resorción ósea.
Los marcadores de remodelado óseo son de utilidad para el monitoreo del tratamiento de osteoporosis. El cambio posterior al tratamiento con agentes antirresortivos o anabólicos pueden reflejar un efecto óseo y podrían ser considerados para evaluar la falla al tratamiento. Considerando el cambio significativo al 95% de confianza, se requiere como cambios mínimos una disminución de al menos 25% luego del tratamiento antirresortivo y un incremento de al menos 25% luego del tratamiento con un agente anabólico(61).
Conclusiones
En el manejo de la osteoporosis posmenopáusica se deben tomar en cuenta las medidas no farmacológicas como la modificación de factores de riesgo para el desarrollo de esta enfermedad y las fracturas, optimizando los cambios a un mejor estilo de vida. El uso de calcio no ha demostrado disminuir significativamente el riesgo de fractura. Recomendamos incrementar su uso en la dieta y confinar su suplementación en pacientes con ingesta baja de calcio. La terapia antirresortiva con bifosfonatos ha demostrado beneficios al disminuir el riesgo de fractura ósea, según características antes anotadas, siendo los recomendados alendronato, ibandronato, zoledronato y risedronato. En el mismo beneficio de acción se encuentra la terapia biológica con denosumab El tiempo estimado de tratamiento con bifosfonatos es calculado hasta 5 años, con el beneficio posterior del periodo de vacaciones terapéuticas, que evita posteriormente el desarrollo de fracturas femorales atípicas y otros eventos adversos. Los agentes anabólicos tienen una participación en el manejo de la osteoporosis para casos de pacientes con fractura, como es el uso de teriparatida. Los nuevos fármacos emergentes para el tratamiento de osteoporosis son prometedores en el futuro.
El manejo de la paciente con osteoporosis pos-menopáusica requiere como cualquier otra enfermedad de actualización constante, ofrecida en los artículos de investigación publicadas en revistas con alto factor de impacto, cursos y congresos médicos que incluyen en su desarrollo esta patología, como los que se dan en los de enfermedades metabólicas óseas, de reumatología y especialidades ligadas a la medicina interna. Es fundamental tener en cuenta que la osteopenia es un proceso fisiológico que se da en la vida de las personas y que no requiere de terapia farmacológica, salvo circunstancias especiales. Del mismo modo la DMO y los marcadores bioquímicos de recambio óseo requieren de una interpretación por el profesional que ha de manejar el caso desde el momento de la primera evaluación y durante el seguimiento de la paciente, los que darán pie, junto a la información obtenida en la historia clínica, del inicio de indicaciones no farmacológicas, de la terapia farmacológica, el tiempo de uso, conocimiento del beneficio, las posibles complicaciones y el/los eventual/es cambio/s de fármacos, si así se considera en el tiempo del seguimiento.
Conflictos de interés: No existen en el presente artículo
Referências bibliográficas
1. Tosteson AN, Melton LJ 3rd, Dawson-Hughes B, Baim S, Favus MJ, et al. Cost-effective osteoporosis treatment thresholds: the United States perspective. Osteoporos Int. 2008 Apr;19(4):437-47. doi: 10.1007/s00198-007-0550-6. [ Links ]
2. Wright NC, Looker A, Saag K, Curtis JR, Delzell ES, Randall S, Dawson-Hughes B. The recent prevalence of osteoporosis and low bone mass based on bone mineral density at the femoral neck or lumbar spine in the United States. J Bone Miner Res. 2014 Nov;29(11):2520-6. doi: 10.1002/jbmr.2269 [ Links ]
3. International Osteoporosis Foundation, Perú. http://www. iofbonehealth.org/sites/default/files/media/PDFs/Regional%20Audits/2012-Latin_America_Audit-Peru-ES_0_0.pdf. [ Links ]
4. United States Census Bureau, International Data Base 2015. http://www.census.gov/population/international/data/ idb/region.php?N=%20Results%20&T=2&A=separate&RT=0&Y=2015&R=-1&C=PE. [ Links ]
5. Boletín Epidemiológico Semanal. Red de Salud Islay. Semana 6 – 2015. http://www.saludarequipa.gob.pe/redislay/boletines/2015/BOLETIN_EPI_SEM_06_2015.pdf [ Links ]
6. Cosman F, De Beur SJ, LeBoff MS , Lewiecki EM, Tanner B, Randall S, Lindsay R; National Osteoporosis Foundation. Clinician’s Guide to Prevention and Treatment of Osteoporosis. Osteoporos Int. 2014 Oct;25(10):2359-81. 10.1007/s00198014-2794-2.
7. The International Society for Clinical Densitometry (ISCD). Clinical Course Syllabus.versión9.2-2009. [ Links ]
8. Colón-Emeric C, Kuchibhatla M, Pieper C, Hawkes W, Fredman L, Magaziner J, Zimmerman S, Lyles KW. The contribution of hip fracture to risk of subsequent fractures: data from two longitudinal studies. Osteoporos Int. 2013 Nov;14(11):879–83. [ Links ]
9. Cummings SR, Melton LJ. Epidemiology and outcomes of osteoporotics fractures. Lancet. 2002;359:1761-7. [ Links ]
10. Clark P, Cons-Molina M, Deleze M, Ragi S, Haddock L, Zanchetta JR, et al. The prevalence of radiographic vertebral fractures in Latin American countries: the Latin American Vertebral Osteoporosis Study (LAVOS). Osteoporosis Int. 2009 Feb;20(2):275-82. doi: 10.1007/s00198-008-0657-4. [ Links ]
11. Miraval Niño de Guzmán T, Segami SI, Chávez CJ y col. Fractura de cadera a trauma mínimo en mayores de 50 años: Morbimortalidad, pronóstico funcional. Rev Per Reumatol. 2000;6:68. [ Links ]
12. Morales-Torres J, Gutiérrez-Ureña S, Osteoporosis Committee of PANLAR. The Burden of Osteoporosis in Latin America. 2004. [ Links ]
13. FRAX. WHO Fracture Risl Assessment Tool. http://www.shef. ac.uk/FRAX/index_SP.htm [ Links ]
14. J Alfaro, R Perich, E Acevedo. Densitometría ósea de antebrazo en la predicción de osteoporosis de columna lumbar y fémur proximal. Rev Med Essalud. 1999;8:7-18. [ Links ]
15. Black DM, Rosen CJ. Clinical Practice. Postmenopausal osteoporosis. N Engl J Med. 2016 Jan 21;374(3):254-62. doi: 10.1056/NEJMcp1513724. [ Links ]
16. Compston J,Bowring C, Cooper A, Cooper C, Davies C, Francis R, Kanis JA, et al. Diagnosis and management of osteoporosis in postmenopausal women and older men in the UK: National Osteoporosis Guideline Group (NOGG) update 2013. Maturitas 2013 Aug;75(4):392-6. doi: 10.1016/j.maturitas.2013.05.013. [ Links ]
17. Sornay-Renndu E, Munoz F, Garnero P. Identification of osteopenic women at high risk of fracture: the OFELY Study. J Bone Miner Res. 2005;20:1813-9. [ Links ]
18. Sosa M, Gómez MJ. El término de osteopenia y el riesgo de fractura. An Med Interna. 2006;23(4):151-2. [ Links ]
19. Hinton PS, Nigh P, Thyfault J. Effectiveness of resistance training or jumping-exercise to increase bone mineral density in men with low bone mass: a 12 month randomized, clinical trial. Bone. 2015 Oct;79:203-12. doi: 10.1016/j. bone.2015.06.008 [ Links ]
20. Avenell A, Mak JCS, O’Conell D. Vitamin D and vitamin D analogues for preventing fractures in postmenopausal women and men. Cochrane Database of Systematic Reviews. 2014, issue 4, Art. No.: CD000227. DOI: 10.1002/14651858. CD000227.pub4.
21. Holick MF. Resurrection of vitamin D deficiency and rickets. J Clin Invest. 2006;116:2062–72. [ Links ]
22. Holick MF. Vitamin D deficiency. N Engl J Med. 2007;357:266–81. [ Links ]
23. Sotelo W, Calvo A. Niveles de vitamina D en mujeres postmenopáusicas con Osteoporosis Primaria. Rev Med Hered. 2011;22:10-14. http://dx.doi.org/10.20453/rmh.v22il.1094. [ Links ]
24. Holick MF. Vitamin D: a d-lightful solution for health. J Investig Med. 2011 Aug; 59(6):872-80. doi: 10.231/JIM. 0b013e318214ea2d. [ Links ]
25. Wacker M, Holick MF. Vitamin D- Effects on skeletal and extraskeletal health and the need for supplementation. Nutrients. 2013 Jan 10;5(1):111-48. doi: 10.3390/nu5010111. [ Links ]
26. Halfon M, Phan O, Teta D. Vitamin D: A review on its effects on muscle strength, the risk of fall, and frailty. Bio Med Research. 2015; ID 953241. http://dx.doi.org/10.1155/2015/95324. [ Links ]
27. Reid IR, Bristow SM, Bolland MJ. Calcium supplements: benefits and risk. J Intern Med. 2015 Oct;278(4):354-68. doi:10.1111/joim.12394. [ Links ]
28. Jackson RD, LaCroix AZ, Gass M, Wallace RB, Robbins J, Lewis CE, Bassford T, et al. Calcium plus vitamin D supplementation and the risk of fracture. N Eng J Med. 2006 Feb 16;354(7):669-83. [ Links ]
29. Reid IR. Cardiovascular effects of calcium supplements. Nutrients. 2013;5:2522-9. [ Links ]
30. Reid IR. Should we prescribe calcium supplements for osteoporosis prevention? J Bone Metab. 2014;21:21-8. [ Links ]
31. Bolland MJ, Leung W, Tai V, Bastin S, Gamble GD, Grey A, Reid IR. Calcium intake and risk of fracture: systematic review. BMJ. 2015 Sep 29;351:h4580. Doi: 10.1136/bmj.h4580. [ Links ]
32. Paik J, Curhan G, Sun Q, Rexrode KM, Manson JE, Rimm EB, Taylor EN. Calcium supplement intake and risk of cardiovascular disease in women. Osteoporos Int. 2014 Aug;25(8):2047-56. doi: 10.1007/s00198-0142732-3. [ Links ]
33. Waldman T, Sarbaziha R, Metz CN, Shufelt C. Calcium supplements and cardiovascular disease: A review. Am J Lifestyle Med. 2015 Jul 1;9(4):298-307. [ Links ]
34. Heaney RP, Kopecky S, Maki K, Hathcock J, Mackay D, Wallace TC. A review of calcium supplements and cardiovascular disease risk. Adv Nut. 2012 Nov 1;3(6):763-71. doi: 10.3945/ an.112.002899. [ Links ]
35. Wells G, Tugwell P, Shea B et al. Meta-analyses of therapies of postmenopausal osteoporosis. V. Meta-analyses of efficacy of hormona replacement therapy in treating and preventing osteoporosis in postmenopausal women. Endocr Rev. 2002;23:529-39. [ Links ]
36. Johnell O, Scheele WH, Lu Y , Reginster JY, Need AG, Seeman E. Additive effects of raloxifene and alendronate on bone density and biochemical markers of bone remodeling in postmenopausal women with osteoporosis. J Clin Endocrinol Metab. 2002 Mar;87(3):985-92. [ Links ]
37. Sambrook PN, Geusens P, Ribot C, Solimano JA, Ferrer-Barriendos J, Gaines K, Verbruggen N, Melton ME. Alendronate produces greater effects than raloxifene on bone density and bone turnover in postmenopausal women with low bone density: results of EFFECT (Efficacy of FOSAMAX versus EVISTA Comparison Trial) International J Intern Med. 2004 Apr;255(4):503-11. [ Links ]
38. Ettinger B, Black DM, Mitlak BH, Knickerbocker RK, Nickelsen T, Genant HK, Christiansen C, Delmas PD, et el. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-years randomized clinical trial. Multiple Outcomes Raloxifene Evaluation (MORE) Investigators. JAMA. 1999 Aug 18;282(7):673-45. [ Links ]
39. Siris ES, Harris ST, Eastell R, et al; Continuing Outcomes Relevant to Evista (CORE) Investigators. Skeletals effects of raloxifene after 8 years: results from the continuing outcomes relevant to Evista (CORE) study. J Bone Miner Res. 2005 Sep;20(9):1514-24. [ Links ]
40. Barrett-Connor E, Mosca L, Collins P, et al; Raloxifene Use for the Heart (RUTH) Trial Investigators. Effects of raloxifene on cardiovascular events and breast cancer in postmenopausal women. N Eng J Med. 2006 Jul 13;355(2):125-37. [ Links ]
41. Bouer DC, Garnero P, Hochberg et al. Fracture Intervention Research Group. Pretreatment levels of bone turnover and the antifracture efficacy of alendronate: the fracture intervention trial. J Bone Miner Res 2006; 21:292-9. [ Links ]
42. Bouer DC, Black DM, Garnero P, et al; Fracture Intervention Trial Study Group. Change in turnover and hip, non-spine, and vertebral fracture in alendronate treated women: the fracture intervention trial. J Bone Miner Res. 2004 Aug;19(8):1250-8. [ Links ]
43. Pols HA, Felsenberg D, Hanley DA, Stepán J, Muñoz-Torres M, Wilkin TJ, Qin-sheng G, et al. Multinational, placebo-controlled, randomized trial of the effects of alendronate on bone density and fracture risk in postmenopausal women with low bone mass: results of the FOSIT study. Fosamax International Trial Study Group. Osteoporos Int. 1999;9(5):461-8. [ Links ]
44. Reginster J, Minne HW, Sorensen OH, Hooper M, Roux C, Brandi ML, Lund B, et al Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. Osteoporos Int. 2000;11(1):83-91. [ Links ]
45. Chesnut III CH, Skag A, Christiansen C, et al; Oral Ibandronate Osteoporosis Vertebral Fracture Trial in North America and Europe (BONE). Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Mineral Res. 2004 Aug;19(8):1241-9. [ Links ]
46. Black DM, Delmas PD, Eastell R, et al; HORIZON Pivotal Fracture Trial. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med. 2007;356(18):1809-22. [ Links ]
47. Black D, Kelly M, Genant H, et al; Fracture Intervention Trial Steering Committee; HORIZON Pivotal Fracture Trial Steering Committee. Bisphosphonates and fractures of the subtrochanteric or diaphyseal femur. N Engl J Med. 2010 May 13;362(19):1761-71. doi: 10.1056/NEJMoa1001086. [ Links ]
48. Black DM, Reid IR, Boonen S, Christina Bucci-Rechtweg, Jane A Cauley, Felicia Cosman, et al. The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON- Pivotal Fracture Trial (PFT). J Bone Miner Res 2012 February; 27(2): 243–54. doi: 10.1002/ jbmr.1494. [ Links ]
49. Laster AJ, Tanner SB. Duration of treatment of postmenopausal osteoporosis: how long to treat and what are the consequences of cessation of treatment? Rheum Dis Clin N Am. 2011 Aug;37(3):323-36, v. doi: 10.1016/j.rdc.2011.07.007. [ Links ]
50. Lim SY, Bolster MB. Current approaches to osteoporosis treatment. Curr Opin Rheumatol. 2015 May;27(3):216-24. doi: 10.1097/BOR.0000000000000169. [ Links ]
51. Cummings SR, San Martin J, McClung MR, et al; FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Eng J Med. 2009 Aug 20;361(8):756-65. doi: 10.1056/NEJMoa0809493. [ Links ]
52. Bone HG, Chapurlat R, Brandi ML, Brown JP, Czerwinski E, Krieg MA, et al. The effect of three or six years of denosumab exposure in women with postmenopausal osteoporosis: results from the FREEDOM extension. J Clin Endocrinol Metab. 2013 Nov;98(11):4483-92. doi: 10.1210/jc.2013-1597. [ Links ]
53. Meunier PJ, Roux C, Seeman E, Ortolani S, Badurski JE, Spector TD, Cannata J, et al. The effects of stronium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Eng J Med. 2004 Jan;350(5):459-68. [ Links ]
54. Reginster JY, Seeman E, De Vernejoul MC, Adami S, Compston J, Phenekos C, et al. Stronium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment Of Peripherical Osteoporosis (TROPOS) study. J Clin Endocrinol Metab. 2005 May;90(5):2816-22. [ Links ]
55. Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, Hodsman AB, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Eng J Med. 2001 May 10;344(19):1434-41. [ Links ]
56. Black DM, Greenspan SL, Ensrud KE , Palermo L, McGowan JA, Lang TF, et al. The effects of parathyroid hormone and alendronate alone or in combination in postmenopausal osteoporosis. N Eng J Med. 2003 Sep 25;349(13):1207-15. [ Links ]
57. Chapurlat RD. Odanacatib: a review of its potential in the management of osteoporosis in postmenopausal women. Ther Adv Musculoskel Dis. 2015 Jun;7(3):103-9. doi: 10.1177/1759720X15580903. [ Links ]
58. Geunses P. New insights into treatment of osteoporosis in postmenopausal women. RMD Open. 2015;1(Suppl):e000051. Doi10.1136/rmdopen-2015-000051. [ Links ]
59. McClung MR, Grauer A, Boonen S, Bolognese MA, Brown JP, Diez-Perez A, Langdahl BL, et al. Romosozumab inpostmenopausal women with low bone mineral density. N Eng J Med. 2014 Jan 30;370(5):412-20. doi: 10.1056/NEJMoa1305224. [ Links ]
60. Wheater G, Elshahaly M, Tuck S, Datta HK, van Laar JM. The clinical utility of bone marker measurements in osteoporosis. J Translational Med. 2013 Aug 29;11:201. doi: 10.1186/1479-5876-11-201. [ Links ]
61. Bandeira F, Costa A, Soares Filho MA, Pimentel L, Lima L, Bilezikian JP.. Bone markers and osteoporosis therapy. Arq Bras Endocrinol Metab. 2014;58(5):504-13. [ Links ]
Correspondencia: Dr. Eduardo Acevedo Vásquez
@ eduardo.acevedo267@gmail.com