Introducción
Las micotoxinas son metabolitos secundarios producidos por una amplia variedad de hongos, que pueden resultar peligrosas para los seres vivos a través de la inhalación, ingesta o contacto con la piel1,2. Dentro del variado grupo de micotoxinas, uno de los más relevantes es el de las aflatoxinas. Estos compuestos son derivados difuranocumarínicos provenientes de la especie Aspergillus y pueden encontrarse en cereales, granos, nueces y otros suplementos alimenticios y su proliferación puede darse en cualquier etapa de la cadena productiva, siendo reconocidas como contaminantes naturales de la comida. Actualmente, la aflatoxina B1 (AFB1) es considerada una de las más tóxicas debido a que puede causar severos daños hepáticos y nefrológicos, además de ser un potente agente carcinogénico3,4.
Debido al gran número de enfermedades que puede causar la AFB1, los organismos de salud internacionales han establecido el límite máximo en el rango de los ppbs5. Por esta razón, se han desarrollado innumerables métodos, basados en técnicas cromatográficas, capaces de detectar AFB1 en matrices biológicas complejas. Entre los métodos más utilizados se encuentran LC-MS/MS y GC/MS pues ofrecen una gran sensibilidad y selectividad; sin embargo, ambos necesitan de largos tiempos de preparación y complejos procesos de extracción de muestras6, personal altamente capacitado y equipos sofisticados.
Además de los métodos cromatográficos, uno de los ensayos más utilizados para la detección de AFB1 son las pruebas de ELISA, debido a su amplia disponibilidad, sencillez y al gran número de muestras que pueden ser analizadas. A pesar de ello, este tipo de ensayos se ven limitados pues requieren del uso de anticuerpos, los cuales suelen tener baja estabilidad y se degradan fácilmente ante variaciones de temperatura y pH, además de ser de un único uso3,4,7.
Frente a las desventajas de los métodos tradicionales, una de las nuevas alternativas para la identificación y cuantificación de toxinas es el uso de aptámeros. Estas cadenas cortas de oligonuleótidos sintéticos biomimetizan a los anticuerpos y son capaces de reconocer con una alta especificidad a un analito en particular. Sin embargo, a diferencia de estos, los aptámeros son más estables y altamente reproducibles, por lo que están siendo cada vez más utilizados para la detección de toxinas2. Además, el hecho de que los aptámeros se sinteticen artificialmente hace que no sólo su costo sea menor, sino que puedan introducirse las modificaciones deseadas de manera sencilla (grupos tiol, fluoróforos, biotina, etc.)8,9.
Por otro lado, las nanopartículas metálicas como los nanotriángulos de oro (AuNTs) poseen propiedades ópticas especiales que permiten el desarrollo de sensores accesibles y sensibles aplicados a la seguridad alimentaria y a la salud pública10-12. Una de estas propiedades ópticas es la resonancia de plasmón superficial localizado (LSPR), cuya banda característica depende del tamaño, forma, material y del ambiente próximo que rodea a la nanopartícula13. En el caso de las nanopartículas de metales nobles, los cambios en la banda LSPR se suelen monitorear en el rango UV-Vis-NIR y se pueden relacionar con el contenido del analito13,14.
En esta investigación se presenta el desarrollo de un nanosensor aptamérico basado en AuNTs para la detección y cuantificación de AFB1 utilizando LSPR. La secuencia de aptámero fue seleccionada a partir de estudios previos realizados15 y donde se añadió un extremo tiolado. Además, los nanosensores aptaméricos fueron evaluados con diferentes solventes y tampones reportados en la literatura16 para su optimización, y se demostró la robustez del sistema al evaluar la respuesta en extractos de muestras reales de kiwicha contaminadas con AFB1.
2. MATERIALES Y METODOS
2.1 REACTIVOS
Todas las soluciones fueron preparadas utilizando agua ultrapura. Metanol y acetonitrilo (grado HPLC), CaCl2, HAuCl4, KCl, KH2PO4, K2HPO4, MgCl2, ácido mercaptopropiónico (MPA), NaCl, Na2S2O3, tris(hidroximetil)aminometano (TRIS), dodecilsulfato de sodio (SDS) y AFB1 fueron adquiridos en Sigma Aldrich (USA). El oligonucleótido de secuencia 5’- GTT-GGG-CAC-GTG-TTG-TCT-CTC-TGT-GTC-TCG-TGC-CCT-TCG-CTA-GGC-CC-(CH2)6-SH 3’ fue adquirido de Eurogentec (Bélgica). Las jeringas con filtro de fibra de vidrio fueron adquiridas de Neogen (USA).
2.2 EQUIPOS
La caracterización de los nanosensores se realizó mediante el uso de un espectrofotómetro UV-Vis-NIR (Genesys 10S, Thermo Scientific-USA) y un microscopio electrónico de transmisión (TEM) (LVEM5, Delong Instruments - República Checa). La funcionalización del sensor se utilizó una centrífuga (Sigma 1-16, Alemania), mientras que para la preparación de los extractos de kiwicha se empleó una centrifuga refrigerada (5430R, Eppendorf - USA). Finalmente, se utilizaron también, una incubadora (MyTemp mini H2200-HC, Benchmark Scientific - USA), agitadores (MVOR-03, SBS-USA) y un baño de ultrasonido (97043-930, VWR-USA)
2.3 SÍNTESIS DE NANOTRIÁNGULOS DE ORO (AUNTS)
Los nanotriángulos de oro (AuNTs) fueron sintetizados usando el protocolo descrito por Pelaz y col. con algunas modificaciones17,18.En primer lugar, se realizó una primera adición de Na2S2O3 (8.75 mL, 0.5 mM) con una bomba de jeringa (flujo 9 mL/min) a una solución acuosa de HAuCl4 (5 mL, 2 mM) bajo agitación mecánica constante. Luego de 9 minutos, se hizo una segunda adición de Na2S2O3 (1 mL, 0.5 mM) y se dejó reaccionar por un periodo de 2 horas a 19-20°C en agitación constante. Pasado este tiempo, se tomó una alícuota de la muestra para la caracterización mediante UV-Vis-NIR y TEM.
2.4 FUNCIONALIZACIÓN DE AUNTS
Los nanosensores aptaméricos (AuNTs@Apt) se prepararon a partir de 500 µL de los AuNTs recién sintetizados, a los que se les adicionó SDS (2.5 μL, 10%). A continuación, para asegurar una adecuada funcionalización se añadieron, en orden, los siguientes reactivos: tampón de fosfato pH 8 (100 μL, 100 mM), solución de aptámero de AFB1 (2.5 μL, 200 μM) y 4 adiciones de solución de NaCl (25 μL en cada adición, 1 M). Finalmente, una solución acuosa de MPA (2 μL, 11.5 mM) fue agregada a la mezcla para aumentar la estabilidad de las nanopartículas al unirse a la superficie libre de las nanoestructuras.
Luego de completar el proceso de funcionalización, el nanosensor (AuNTs@Apt@MPA) fue centrifugado 3 veces a 6000 rpm por 10 minutos. A continuación, se resuspendió el sensor en un volumen final de 1 mL con agua ultrapura.
2.5 DETECCIÓN DE AFB1
Después de la purificación, se diluyeron 100 μL del nanosensor en una solución acuosa que contenía uno de los 4 tampones preparados (ver detalles en Tabla I) en agitación constante por 5 minutos. Posteriormente, se agregó una solución de AFB1 y luego de 10 minutos se midió el espectro UV-Vis-NIR de la solución resultante. Para construir las curvas de calibración LSPR se procesaron los datos en el programa OriginPro (OriginLab, Massachusetts, USA) aplicando un suavizado (orden 5, 51 ptos) y normalizando los espectros a 400 nm. Finalmente, se relacionaron las concentraciones de AFB1 (0 - 780 ppbs) con la diferencia de la integral espectral en el rango de 630 - 1000 nm en ausencia y presencia de la micotoxina (Área = Área0 - ÁreaAFB1).
Para el análisis multivariante por regresión de mínimos cuadrados parciales (PLS) se utilizó el programa Solo (Eigenvector, Seattle, USA). Este análisis permitió comparar la concentración de soluciones de AFB1 reales ([AFB1]real) con las concentraciones de AFB1 predichas por el modelo matemático ([AFB1]pred). El preprocesamiento utilizado fue línea base (mínimos cuadrados ponderados automáticos, orden 2), suavizado (orden 2, 15 ptos) y ponderación de mínimos cuadrados generalizados (GLSW, 0.02), en el rango de 500 a 1000 nm.
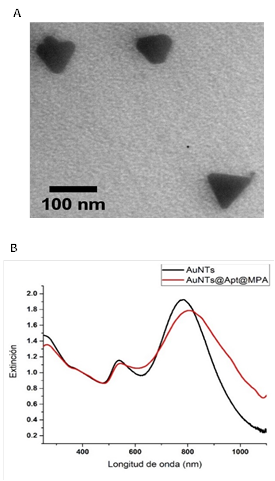
Fig. 1. Caracterización de los AuNTs: A) micrografía TEM de los AuNTs sin funcionalizar, y B) espectros de extinción UV-Vis-NIR de AuNTs sin funcionalizar y AuNTs@Apt@MPA.
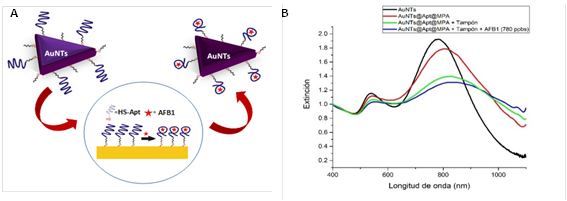
Fig. 2 A) Esquema del proceso de detección de la AFB1 utilizando el nanosensor AuNTs@Apt@MPA. B) Espectros de extinción de los AuNTs, AuNTs@Apt@MPA y AuNTs@Apt@MPA con el tampón de PBS con MgCl2 en ausencia y presencia de AFB1 (780 ppbs).
2.6 PREPARACIÓN DE EXTRACTOS DE KIWICHA
Se pesaron 2.0 gramos de kiwicha en un tubo de centrifuga de 50 mL y se le agregaron 10 mL de la solución de extracción MeOH: H2O (7:3). La suspensión obtenida fue sonicada durante 15 minutos a 10 ºC, y a continuación fue centrifugada durante 30 minutos a 10˚C y 7830 RPM. Luego se extrajo el sobrenadante y se pasó por una jeringa con filtro de fibra de vidrio, recogiéndose finalmente 7.5 mL de extracto.
3. RESULTADOS Y DISCUSIÓN
3.1 CARACTERIZACIÓN DE AUNTS
La caracterización de los nanosensores aptaméricos se llevó a cabo utilizando un microscopio electrónico de transmisión y un espectrofotómetro UV-Vis NIR. Los nanotriángulos tuvieron un tamaño de 52 ± 16 nm de lado y 9±1 nm de borde (Fig. 1A), y un espectro de extinción de la banda localizada a 785 ± 30 nm. Luego de la funcionalización, se obtuvo un nuevo espectro de extinción, gracias al cual se pudo observar un desplazamiento de la banda plasmónica de 4 - 10 nm, indicativo de la unión entre los AuNTs y el aptámero. (Fig. 1B).
3.2 DETECCIÓN DE AFB1 UTILIZANDO AUNTS@APT@MPA
El proceso de detección de la AFB1 se llevó a cabo siguiendo el esquema mostrado de la Fig. 2A y analizando la curva de calibración (Área Promedio vs [AFB1]). Gracias a los espectros de extinción obtenidos se pudieron observar los cambios en el área de la banda plasmónica por el sensor al momento de entrar en contacto con la micotoxina (AFB1). La Fig. 2B muestra la diferencia más drástica, donde la banda plasmónica del sensor AuNTs@Apt@MPA se desplaza a mayores longitudes de onda debido a que el aptámero interacciona con la micotoxina ([AFB1] = 780 ppbs), induciendo un cambio conformacional en la estructura del aptámero que genera una alteración en los alrededores de los nanotriángulos.
Para optimizar el proceso de detección, los ensayos de LSPR fueron evaluados utilizando diferentes solventes orgánicos como MeOH y ACN, los cuales son utilizados comúnmente en los procesos de extracción17. Además, se utilizaron diferentes tampones, como los descritos en la Tabla I, los cuales han sido reportados en la literatura como medios adecuados para favorecer la formación del complejo aptamero-micotoxina debido a sus relativamente bajas constantes de disociación (KD) y, posiblemente, a la presencia de cationes Ca2+ y Mg2+, que permiten estabilizar la nueva conformación del aptámero2,16.
Cada ensayo fue realizado por triplicado y en tres diferentes días, utilizando a su vez diferentes lotes de nanosensores. Los espectros obtenidos fueron analizados siguiendo el protocolo descrito en la metodología y utilizando la región comprendida entre 630-1000 nm para concentraciones de AFB1 de 0 a 780 ppbs. Los resultados obtenidos se encuentran resumidos en la Tabla I, donde se observó que la curva de calibración obtenida (Fig. 3) con el tampón PBS pH 7.5 fue la que evidenció mejor sensibilidad (R2 = 0.98101, límite de detección de 234 ppbs calculado a partir de 3 veces la desviación estándar del segundo punto de la curva).
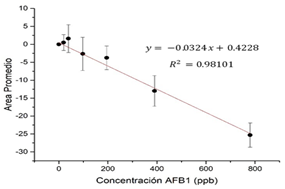
Fig. 3 Curva de calibración LSPR obtenida con el tampón de PBS pH 7.5 para un rango de concentración de 0 -780 ppbs de AFB1.
Teniendo en consideración que el tampón de PBS pH 7.5 tuvo los mejores resultados, los datos obtenidos a partir de sus ensayos fueron analizados también mediante el método de regresión de mínimos cuadrados parciales (PLS). Asimismo, se analizaron 2 sistemas de solventes adicionales preparados a partir del mismo tampón de PBS pH 7.5, el primero de ellos con 1.95% de MeOH y el segundo con 10% de ACN. Los resultados del análisis por PLS se presentan en la Tabla II en donde, en concordancia con lo obtenido previamente, se observó que el modelo matemático de PLS para el tampón de PBS pH 7.5 era adecuado para la detección de AFB1. En los tres casos se obtuvieron resultados muy similares, lo que demuestra la robustez del método. Por ejemplo, en presencia de 0.1% de MeOH se obtuvo un R2 de validación de 0.993 y un RMESCV de 21.9597. La curva de calibración obtenida para este tampón se muestra en la Fig 4.
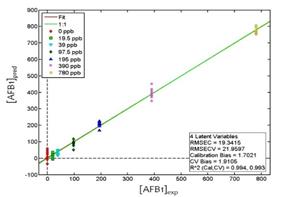
Fig. 4 Análisis PLS para el sistema de detección de AFB1 (0-780 ppbs) utilizando el nanosensor AuNTs@Apt@MPA en la solución tampón de PBS pH 7.5.
3.3 DETECCIÓN DE AFB1 EN MUESTRAS REALES DE KIWICHA
Una vez optimizado el nanosensor y habiendo seleccionado el sistema de solventes basado en el tampón de PBS pH 7.5, se decidió evaluar la respuesta del sensor AuNTs@Apt@MPA en muestras reales de kiwicha. Para ello se evaluó la respuesta del nanosensor con extractos de kiwicha contaminados con una cantidad conocida de AFB1 (0 - 780 ppbs). Los ensayos se realizaron en tres días diferentes, por triplicado y utilizando diferentes lotes de nanosensores, siguiendo el protocolo general de detección de AFB1 para evaluar el posible efecto de la matriz orgánica presente en los extractos.
Los espectros de extinción fueron analizados en el rango de 630 - 1000 nm obteniéndose una curva para las concentraciones de AFB1 de 0 a 532 ppbs cuya pendiente fue de -0.03865 con un R2 de 0.98226. Como se observa en la Fig.5, al comparar los resultados obtenidos con los extractos de kiwicha contaminados con la curva obtenida con las soluciones estándar en el tampón de PBS pH 7.5, se aprecian pendientes muy similares entre sí, sugiriendo que es posible determinar el contenido de AFB1 en extractos de kiwicha con nuestro método de detección, y que este sistema de detección es lo suficientemente robusto, en presencia de una matriz compleja como el extracto de kiwicha.
CONCLUSIONES
En esta investigación se logró obtener un nanosensor aptamérico capaz de detectar AFB1 en el rango de los ppbs, de manera sencilla, accesible y rápida. El sensor fue evaluado en diferentes sistemas de solventes obteniéndose una mejor curva de calibración para el buffer de PBS pH 7.5 con un R2 de 0.98101 en comparación a los otros sistemas de solventes evaluados. Además, el análisis multivariante mediante el método de PLS permitió obtener un modelo adecuado para la detección de AFB1 basado en el tampón de PBS con MgCl2 con un límite de detección de 22 ppbs. Finalmente, al probar el sensor en una matriz compleja como la kiwicha se observó que los resultados obtenidos con los extractos contaminados y los valores de la curva de calibración con las soluciones estándar en el tampón de PBS pH 7.5 poseen pendientes similares (-0.0324 y -0.03865, respectivamente), permitiéndonos concluir que la matriz orgánica compleja proveniente de los extractos no afecta en gran medida los resultados obtenidos. Por tal motivo, los nanosensores aptámericos desarrollados en esta investigación son los primeros pasos para la creación de un sistema de detección de AFB1 sencillo y rápido, aun cuando las muestras estén inmersas en una matriz compleja como la de los extractos de kiwicha.