Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Arnaldoa
versão impressa ISSN 1815-8242versão On-line ISSN 2413-3299
Arnaldoa vol.26 no.2 Trujillo maio/ago. 2019
http://dx.doi.org/10.22497/arnaldoa.261.26208
ARTÍCULOS ORIGINALES
Variabilidad fenotípica de la cianobacteria Brasilonema (Nostocales, Scytonemataceae) en comunidad aerofítica, nuevo registro para el Perú
Phenotypic variability of the cyanobacterium Brasilonema (Nostocales, Scytonemataceae) of aerophytic community, new record for Peru
Haydee Montoya T.1,2; José Gómez C.1,2; Mauro Mariano A.1,2; Enoc Jara P.1,2; Egma Mayta H.1,2 ; Carla Aguilar S.3
1 Museo de Historia Natural, Departamento de Simbiosis Vegetal, UNMSM. Av. Arenales 1256, Apartado 14-0434, Lima, PERÚ.
2 Instituto de Investigación de Ciencias Biológicas, Facultad de CC. Biológicas, UNMSM. Lima, PERÚ haydmon@yahoo.com / jgomezc@unmsm.edu.pe / mmarianoa@unmsm.edu.pe / ejarap@gmail.com / emaytah@unmsm.edu.pe
3 Instituto del Mar del Perú, PERÚ cpaguilars@yahoo.com
Resumen
Los ecosistemas tropicales terrestres exhiben variedad de hábitats como los colonizados por comunidades aerofíticas en la Sierra Central del Perú (3200 m de altitud), localidad de Huancahuasi, departamento de Lima, al oeste de Sudamérica. Se realizaron colecciones cianobacteriales de comunidades aerofíticas y subaerofíticas con biofilms gelatinosos colonizando sustratos con deposiciones de carbonatos y fierro provenientes de efluentes termales con termogradientes entre 35-40 °C y pH entre 6,0 y 6,5. La variabilidad fenotípica en los filamentos de la morfoespecie andina de Brasilonema con su diferenciación morfológica y funcional (constricción de tricomas, dimensiones celulares, espesor y naturaleza del estuche, hormogonios) demostraron su potencial de especies crípticas. Este género con la especie Brasilonema cf. tolantongense constituye nuevo registro para nuestro país. La plasticidad fenotípica de esta especie con la diversidad de morfotipos con estuche y caliptra protectores, ramificaciones y hormogonios constituyen estrategias de vida y ecológicas para su dispersión en hábitats extremófilos aerofíticos contribuyendo a su colonización exitosa.
Palabras clave: aerofítica, biofilms, cultivos, morfotipos, especie críptica.
Abstract
Tropical terrestrial ecosystems have diverse habitats such as the aerophytic communities in the Central Highlands of Peru (3200 m of altitude) at Huancahuasi town, department of Lima, in the western region of South America. We made cyanobacterial collections of aerophytic and subaerophytic communities with gelatinous biofilms which colonized substrates with carbonates and iron cumulations from thermal water effluents with thermogradients between 35 and 40 °C and pH 6.0-6.5. Phenotypic variability in the filaments of the Andean morphospecies of Brasilonema with its morphological and functional differentiation (trichome constriction, celular dimensions, sheath structure and thickness, hormogonia) showed its potential as criptic species. This genus with the Brasilonema cf. tolantongense species is a new record for our country. Phenotypic plasticity of this species with diversity of morphotypes with sheath and calyptra protectors, branches and hormogonia are life and ecological strategies for its dispersion in aerophytic extremophile habitats for successful colonization.
Keywords: aerophytic, biofilms, culture, morphotypes, criptic species.
Introducción
Las Cianobacteria/ Cyanophyta/ Cyanoprokariota constituyen los principales procariontes fototróficos con una notable diversidad cianobacterial bien distribuida en los diferentes ecosistemas de nuestra biósfera. Se ha estimado que las cianobacterias han evolucionado al inicio del Archea hace aproximadamente 3,5 -3,8 billones de años realizando la fotosíntesis aeróbica y contribuyeron en el evento de la gran oxidación atmosférica (Bekker et al., 2004). Investigaciones sobre la diversidad biológica en sistemas geohidrotermales y aerófilos asi como su impacto en los hábitats circundantes se realizan a nivel mundial. La comprensión de las diversas comunidades cianobacteriales como las aerofíticas por estar expuestas directamente a los cambios ambientales y la identificación de las especies se complica por el potencial de su diversidad criptica no obstante constituir importantes poblaciones naturales por su naturaleza fotoautotrófica (Pentecost & Whitton 2012; Flores & Herrero 2014).
En nuestro país megadiverso las fuentes geohidrotermales están bien distribuídas principalmente en el territorio andino central. El valle de Churin y localidades aledañas en el departamento de Lima, poseen peculiares ecosistemas acuáticos minero-medicinales cuyos efluentes son utilizados principalmente por la población como baños termales parte de los cuales son colonizados por cianobacterias y microalgas. El estudio florístico de estas especies, principales colonizadores fotosintéticos de los ecosistemas extremos es aún muy limitado.
La variabilidad morfológica por los análisis fenotípicos de las cianobacterias son importantes por su ecología en diferentes hábitats (diversificación ecológica) y su distribución local así como para la delineación de géneros y especies con sus patrones de distribución biogeográfica (Dvorák et al., 2017). No obstante, la posición taxonómica de varias especies definidas morfológicamente requiere revisión y un enfoque polifásico (Komárek, 2011).
Brasilonema descrito por Fiore et al. (2007) es un género Neotropical considerado monofilético, bien distribuido en comunidades aerofíticas, subaerofíticas, epífitas y cortícolas entre líquenes y musgos siendo la mayoría de las especies reportadas para Brasil (Fiore et al., 2007; Sant Ánna et al., 2011). En la clasificación taxonómica cyanobacterial con el enfoque polifásico, las Nostocales (a nivel de géneros) representan un cluster monofilético de cianobacterias filamentosas con las Scytonemataceae de ramificaciones falsas y presencia de heterocistos intercalares (Komárek et al., 2014; Komárek & Hauer 2011).
En nuestro país se reporta por primera vez Brasilonema para los Andes Centrales, se evaluará su variabilidad fenotípica que contribuirá en su taxonomía cianobacterial en comunidades aerofíticas y subaerofíticas autóctonas. También se presentan las comparaciones con algunas de sus especies pantropicales afines de Brasilonema.
Material y métodos
Las efluentes termales del valle de Churín como los de la localidad de Huancahuasi, pertenecen al área de La Unión localizada en la zona noreste del país, distrito de Pachangara, provincia de Oyón, departamento Lima. Los efluentes son canalizadas para las piscinas y liberadas en el río adyacente Yuracyacu. Las colecciones cianobacterial y microalgal se realizaron durante el verano andino (Agosto, 2013) según la metodología estándar (Prescott 1978; Dillard, 1999). La obtención de las comunidades cianobacteriales aerofíticas y subaerofíticas se realizaron por remoción de las poblaciones expuestas al goteo o corriente leve de caída de aguas con gradientes térmicas. Registros de los parámetros físico–químicos como la temperatura y pH fueron obtenidas simultáneamente. Los datos de la composición química de las aguas termales fueron obtenidas de Steinmuller & Huamani (1999). Cultivos estacionarios mantenidos en el laboratorio periodo de 4 años con las muestras originales permitieron la evaluación de la variabilidad morfológica cianobacterial. Para la determinación de especies se obtuvieron los datos morfométricos, registros ecológicos de poblaciones naturales y de cultivo, microfotografías y consulta de bibliografía especializada.
Resultados
Área de estudio
Las fuentes termales andinas de Huancahuasi en el valle Churín están enclavados en la Cordillera Occidental de los Andes, a 207 km de la ciudad de Lima, ubicadas en los 3270 m.s.n.m. (10° 53’ 49’’ LS y 76° 43’ 16’’ LO). Los manantiales de aguas intermitentes o periódicas afloran con temperaturas entre 53 °C y 55°C. Las aguas sulfato cálcicas con alto contenido de fierro y manganeso han sido canalizados hacia piscinas termales. Comunidades aerófíticas y subaerófíticas con formación de biofilms o matas gelatinosas cianobacteriales colonizan sustratos con deposiciones de carbonatos y fierro sobre columnas de cemento expuestas a goteo o chorro (splash) y los bordes de canales termales con termogradientes entre 35- 40°C y pH entre 6,0 y 6,5.
La influencia de las lluvias andinas (meses de verano y parte del otoño) a su vez tiene un impacto en diversos gradientes térmicos de los efluentes termales. Este fenómeno hídrico estacional facilita la colonización de poblaciones cianobacteriales y microalgales que con el descenso del nivel de las aguas desarrollan expuestas a desecación como costras cianobacteriales o matas superficiales subaéreas membranosas pardo verdosas o violeta parduscas.
Caracterización de la morfoespecie de Brasilonema cf. tolantongense
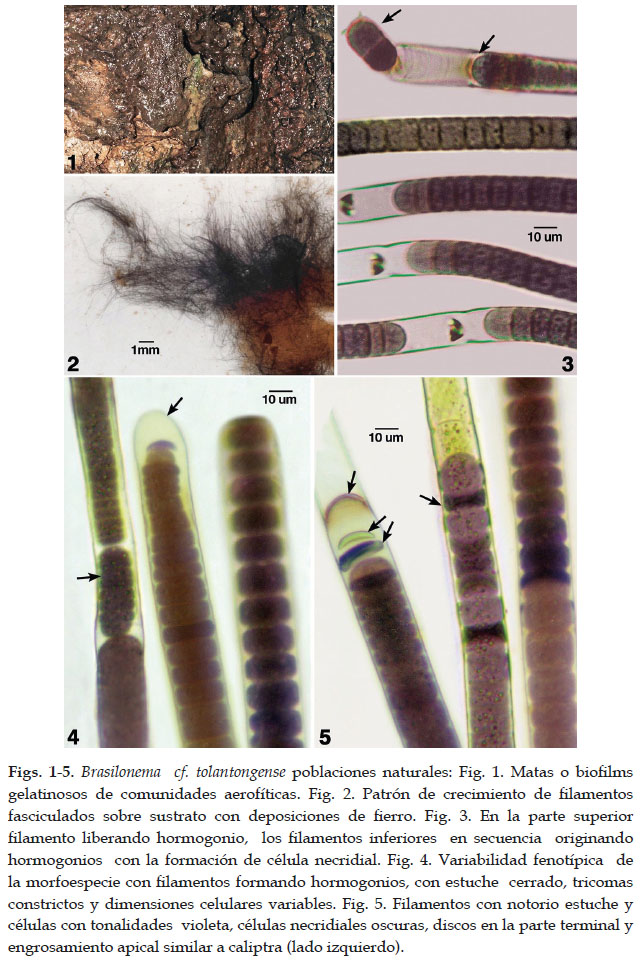
La variabilidad fenotípica Brasilonema con su diferenciación morfológica y funcional reproductiva con características morfológicas bien reconocidas para éste género en poblaciones naturales de la comunidad aerofítica aunada con la de los cultivos estacionarios permitieron una mejor caracterización específica de la morfoespecie de Brasilonema cf. tolantongense de la localidad de Huancahuasi. (Figs. 1-12).
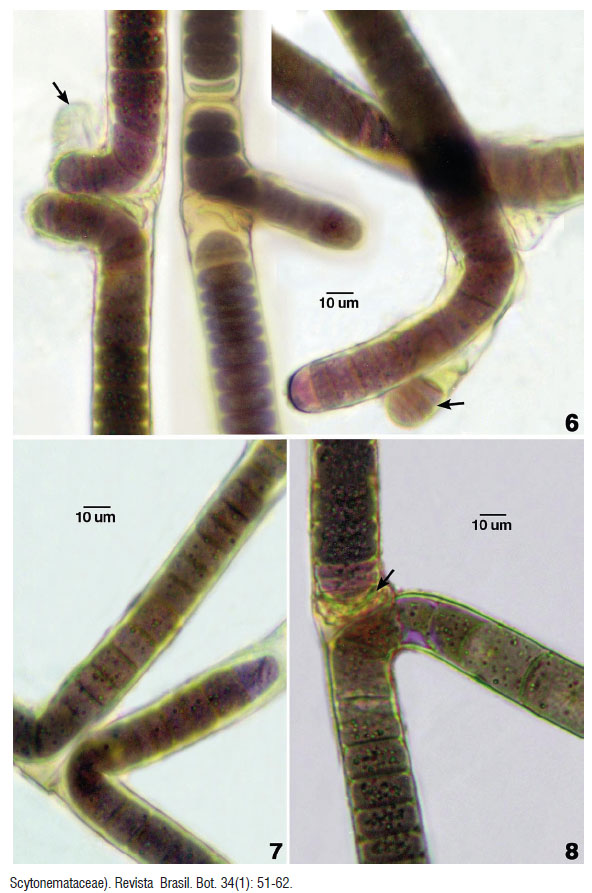
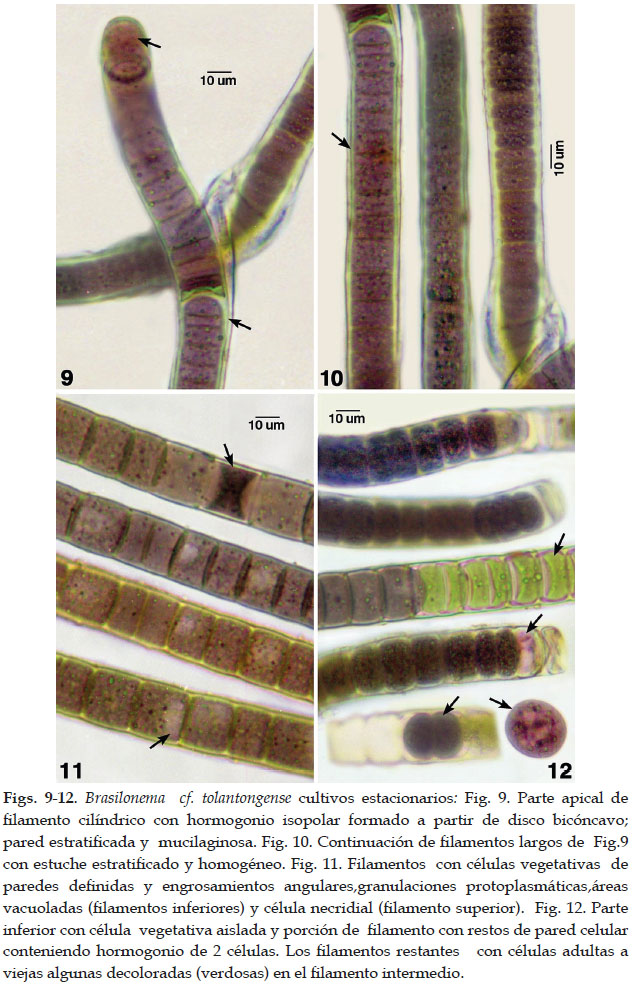
Los talos de la morfoespecie forman matas macroscópicas gelatinosas y aterciopeladas, aplanadas u onduladas, de color pardo claro a oscuro con tonalidades purpúrea oscuro o pardo violeta. Los filamentos largos, densos erguidos, parcialmente fasciculados e irregulares cilíndricos, ondulados, alcanzan de (15)17 - 29 (32) um diámetro. Filamentos con ramificaciones falsas unilaterales o en pares fueron raras en las poblaciones naturales, sin embargo en los cultivos estacionarios (4 años) fueron más frecuentes. Entre los procesos de desarrollo los filamentos se reproducen por la formación de hormogonios que evidenció la producción de estructuras de dispersión. Estos hormogonios fueron tricomas cortos con pocas células. Una vez formados fueron liberados del filamento en un proceso que incluyó la formación de células necridiales.
Tricomas cilíndricos, constrictos a nivel de las paredes transversales en talos adultos, sin embargo en los tricomas jóvenes u hormogonios son mas bien no constrictos o muy ligeramente constrictos. La mayoría de tricomas no atenuados hacia lo ápices o en pocos casos muy levemente como en los originados a partir de hormogonios. Células cilíndricas, discoidales, isodiametricas, variable en longitud, en los filamentos adultos son de mayor tamaño que el diámetro celular. Las células más cortas se reconocieron en los hormogonios y en ramas jóvenes. Células vegetativas de tonalidades parduscas, rosado o violáceas, de (11) 13 - 21(26) um diámetro por 3,2 – 14 (23,5) um de longitud. Protoplasto con granulaciones irregulares y dispersas, de coloración verde brillante, violeta o rosado. Los filamentos y las ramas scitonemoides unilaterales o geminadas exhibieron células con áreas vacuoladas en series o interrumpidas. No se han observado heterocistos en los filamentos de poblaciones naturales y en cultivos estacionarios.
Célula apical redondeada o convexa, rara vez elongada, generalmente al emerger algunas ramificaciones, alcanza de (3) 6 a 8 (9,6) um de longitud. En los filamentos adultos se ha evidenciado la pared externa muy levemente engrosada no tipicamente una caliptra aunque en otros casos con pared doble puede ser reconocida como tal.
Reproducción por fisión, fragmentación y formación de hormogonios originados por células necridiales ( en su mayoría violeta o verde oscuras) , discos bicóncavos o lamelas mucilaginosas irregulares entre células vegetativas. Hormogonios en su mayoría isopolares, rara vez heteropolares. Algunos hormogonios presentan pocas células (2) que facilitan su movimiento y liberación de los filamentos.
Estuche delgado firme o grueso exhibiendo una matriz mucilaginosa, homogéneo o estratificado, incoloro, de 1,5 to 5 um espesor. Algunas veces cerrado en sus extremos o ápices. Paredes celulares engrosadas en los ángulos delimitando las formas celulares adultas.
Formando comunidades aerofíticos y subaerofíticos mesotermales adheridos a sustratos sólidoscomosuperficie cementada con deposiciones de carbonatos y fierro humedecidas. Los filamentos parduscos dominantes pertenecen a Brasilonema y asociados con Pseudophormidium y menor proporción con talos vegetativos de la clorofita Oedogonium sp.
Discusión y conclusiones
Las especies cianobacteriales que son difíciles de separarlas basadas en su morfología son referidas como especies crípticas mientras que las genoespecies (basada en su información genética) similares morfológicamente también son consideradas como crípticas. Sin embargo, las especies crípticas con una caracterización fenotípica polifásica, pueden ser reconocidas taxonómicamente aunque observaciones posteriores de éstos taxa pueden dificultar la asignación apropiada de las especies (Flechtner et al., 2002, Boyer et al., 2002). El número real de las especies de cianobacterias es aún desconocido exactamente, se requiere observación extensiva de su diversidad y distribución en la naturaleza con la subsiguiente cuantificación (Foissner, 2006) y enfoque polifásico.
La variabilidad de caracteres fenotípicos evidenciado en los filamentos andinos de Brasilonema (constricción de tricomas, dimensiones celulares, espesor de estuche uniforme o estratificado) demostraron la presencia de especies crípticas (especiación críptica) o complejo de especies en el material estudiado que se evidenciaron según las condiciones ambientales en poblaciones naturales y en estados sucesionales en cultivos estacionarios.
Los conceptos específicos usando solo morfología o datos ecológicos pueden ser insuficiente para la biodiversidad de las cianobacterias si se ignora las especies cripticas, sin embargo, los criterios morfológicos y ecológicos son importantes. Más aún, cuando algunos caracteres morfológicos como formación de estuche, presencia de heterocistos, o coloración de células pueden ser plásticos (respuesta al entorno) o perdidos en cultivos. La variabilidad del material estudiado es reconocida como diferencias ecológicas entre ecotipos (población natural aerofítica y cultivo estacionario) con características definidas (pared celular, dimensiones) que podrían llevar a su especiación ecológica. En casos de datos insuficientes se requiere posteriores investigaciones y revisiones (Komárek, 2006, 2011; Dvorák et al., 2015). La taxonomía y sistemática de este grupo cianobacterial constituye un gran desafío siendo el enfoque polifásico un sistema progresivo que incluye la combinación de datos morfológicos, ecológicos, ecofisiológicos, moleculares. Sin embargo, algunos análisis de las secuencia del gen 16S rRNA demostraron que la clasificación morfológica corresponde a los taxa filogenéticamente investigados y en otros casos reduce la diversidad existente (Ferris et al., 1996; García-Pichel et al., 1996; Komárek, 2011).
Las especies crípticas y los géneros polifiléticos causados por convergencia seriales representan un problema de certeza en una adecuada identificación morfológica. No siempre la especiación críptica puede no ser reconocida si se usa solo la morfología, sin embargo, en la presente investigación la variabilidad fenotípica de Brasilonema fortalece su identificación. Entre las especies cripticas que han sido identificadas pertenecen a los géneros Microcoleus (Siegesmund et al., 2008), Oculatella (Osorio-Santos et al., 2014) y Phormidium (Casamatta et al., 2003; Hasler et al., 2012) entre otros. Siegesmund et al. (2008) sugirió la presencia de múltiples especies crípticas dentro de la especie Coleofasciculus chthonoplastes que nombraron luego de la revisión del género Microcoleus (cepas marinas) y que aún con sus estudios morfológicos y moleculares la diagnosis de sus especie cripticas sigue siendo problemática. También, establecieron que el aislamiento de las matas filamentosas de C. chthonoplastes puede garantizar y conducir al desarrollo de nuevas especies a futuro. En el caso de la especie Microcoleus vaginatus (Oscillatoriales) de filamentos coloniales y aislada de varios hábitats, la cepa de sedimento fino (epipelon) exhibió variabilidad con la no producción de estuche en la naturaleza o en cultivo (Boyer et al., 2002). Ellos establecieron con los datos morfológicos y las secuencias moleculares la presencia dos taxa morfológicamente similares de Microcoleus vaginatus y M. steenstrupii. En las caracterizaciones morfológicas y moleculares M. vaginatus no demostró variación subespecífica, es decir, su combinación genética, morfológica y uniformidad ecológica la mantiene como especie bien definida. Por el contrario, M. steenstrupii evidenció una variabilidad genética y los análisis filogenéticos señalaron que esta variabilidad no fue congruente con su geografía por lo cual concluyeron que las cepas evaluadas de M. steenstrupii representan varias especies crípticas y que la diversidad genéticas en las morfoespecies de M. steenstrupii representan varias genoespecies. En base a éstos resultados, se puede considerar que el potencial de especies cripticas en Brasilonema con una gran variabilidad fenotípica en la morfoespecies que no permite una clara separación de especies y por lo cual, está siendo reconocida como Brasilonema cf. tolantongense.
La mayoría de las especies del género pantropical Brasilonema son de Brasil, siendo el presente trabajo primer reporte del género para Perú, correspondiente a la zona Andina central (3200 m altitud). Las cadenas montañosas de los Andes no constituyen una barrera o restricción geográfica en la distribución del género, porque al Este de los Andes en la región Amazónica y áreas aledañas (Mata Atlántica) se presentan las especies brasileras de Brasilonema. Sin embargo, para la morfoespecie de Huancahuasi el factor limitante puede ser atribuido a las bajas temperaturas que alcanza hasta la congelación en épocas invernales la Sierra Central. En relación a la descripción de Brasilonema tolantongense existe proximidad con los datos morfométricos, porque sus filamentos alcanzan de 17 a 24,5 um de diámetro y presencia de una caliptra también es un carácter diferencial en esta especie. Sin embargo, los estuches no lamelado o muy ligeramente, tricomas no atenuados y muy ligeramente constrictos o no, han sido reportados por Becerra-Absalon et al. (2013).
La morfoespecie andina a diferencia de B. angustatum Vaccarino & Johansen no tiene marcada atenuación y el estuche es lamelado o estratificado. Sin embargo, son similares en otras características como la coloración de las células, áreas vacuoladas y las ramificaciones. Los autores indicaron para esta especie que los heterocistos no son necesarios para la formación de hormogonios como ocurre en medios con nitrógeno y donde los hormogonios se forman sin los heterocistos. La especie B. angustatum ha sido reportada para las islas Hawaii (Vaccarino & Johansen 2012) con notoria atenuación en los tricomas y con evidencia filogenética que avala que la atenuación ha desarrollado en forma repetida en linajes cianobacteriales separados.
El estuche grueso y mucilaginoso de la morfoespecie evaluada favorece la colonizacion aero y subaerofítica. Por éste carácter tiene similitud con B. ornatum Sant’Anna & Komárek que tiene un estuche desarrollado, tricomas constrictos y no atenuados. Los datos morfométricos de los filamentos de B. ornatum (20-23 um de diámetro) son muy próximos a la morfoespecie estudiada (15)17 - 29 (32) que incluye material de cultivos estacionarios. En éstos cultivos de la morfoespecie, el estuche firme o mucilaginoso aunado a la presencia de una caliptra protectora constituyen una estrategia ecológica al igual que la formación de hormogonios que favorecen su colonización exitosa en comunidades aerofíticas. Según Christmas et al. (2011) la diferenciación de los hormogonios involucra ajustes en la expresión genética en un número de células contiguas en un filamento. Una vez formado el hormogonio es liberado del filamento en un proceso que involucra la formación de necridios (células muertas) por la muerte programada de las células vegetativas próximas al hormogonio como fué visualizado en forma frecuente en los biofilm mucilaginosos.
La especie B. octagenarum que tiene bastante similitud con la morfoespecie de Huancahuasi como las ramificaciónes falsas dispersas en sus poblaciones naturales y el estuche algunas veces lamelado. La mayor diferencia está en que B. octagenarum Aguiar et al. es de menores dimensiones, no presenta constricciones a nivel de las paredes transversales y crece epífita en las hojas de Eucalyptus grandis llegando a causar áreas necróticas (Aguiar et al., 2008).
Los filamentos heterocistados de Brasilonema descubiertos en Brasil por Fiore et al. (2007) y descrita como especie tipo B. bromeliae con sus talos colonizando la parte interna de las hojas de bromelias como Aechmea ornata, Vriesea procera, Wittrockia superba, Nidularium procerum entre otros. La morfoespecie andina de mayores dimensiones que las especies citadas para el género Brasilonema tiene semejanza con B. bromeliae por la casi ausencia de ramas (solo en poblaciones naturales) y se diferencia por los tricomas no o muy ligeramente constrictos, no atenuados e igualmente estuche ligeramente lamelado y las dimensiones menores de B. bromeliae (10-21 um de diámetro) además del hábitat epifítico específico.
Fiore et al. (2007) indicaron que en la evaluación molecular realizada a B. bromeliae los datos del análisis de secuencia de la ficocianina de las cepas de B. bromeliae están en un cluster con las Nostocaceae (Nostoc, Calothrix, Tolypothrix y Fremyella). Además, el árbol filogenético (16S rRNA) mostró que las cepas de Brasilonema tienen un soporte en el cluster con el género Symphyonemopsis, miembro de las Stigonematales. También Brasilonema se ubica en una mayor clade formado por miembros de las Stigonematales (Symphyonema y Mastigocladopsis) y las Nostocales (Scytonema). Por lo cual, establecen que las Nostocaceae y las Stigonematales están muy relacionadas.
Los heterocistos están considerados como células o compartimientos micro- óxicas porque la nitrogenasa (enzima que cataliza la reducción del nitrógeno moleculares) muy sensible al oxígeno (Flores & Herrero, 2014). La diferenciación y su función de los heterocistos ha sido caracterizada molecularmente. En los heterocistos los genes nif se expresan y la maquinaria de la fijación de nitrógeno puede operar. La diferenciación de las células vegetativas en heterocistos tiene lugar en respuesta a una carencia de fuente nitrogenada (iones de nitrato, amonio) donde factores de transcripción actúan promoviendo la expresión de los genes (NtcA, HetR) ambos son reguladores en la morfología y diferenciación funcional del heterocisto. Sin embargo, en otros casos algunas células del filamento consiguen expresar otro gen (patS) que codifica un producto que inhibe la actividad del regulador (HetR) e impide la diferenciación de las células vecinas. Es probable que algún mecanismo de expresión genética este actuando en la morfoespecie estudiada carente de heterocistos, para la no diferenciación del heterocisto.
La carencia de heterocistos tiene relación con lo reportado por Melick et al. (1991) para una cepa no heterocistada de la cianobacteria termofílica Mastigocladus laminosus que exhibe una considerable plasticidad morfológica y posee ramificación verdadera rara (Stigonemataceae) del Mt Erebus de la Antartica. Además, de las 2 formas heterocistadas ya reconocidas para M. laminosus, la cepa HTF (high temperature form) y MTF (mid temperature form), una tercera cepa de M. laminosus denominada ENH (Erebeus no heterocistada) carece de crecimiento en medio de cultivo carente de nitrógeno. Según Herdman (1982) que cepas mutantes carentes de heterocistos puedan surgir espontáneamente en cultivos con nitrógeno donde prosperan géneros heterocistados como Nostoc y Anabaena. Por consiguiente, la ausencia de heterocistos en la morfoespecie andina es un dilema a dilucidar.
FIGURAS
Agradecimientos
Expresamos nuestro agradecimiento a los colegas Blgos. Benjamín Collantes M. investigador de Inka Terra Asociación (ITA), Severo Baldeón M. y Mario Benavente P. del Herbario San Marcos del Museo de Historia Natural, UNMSM por su colaboración durante las salidas de campo en la búsqueda y obtención del material de estudio y fotografías.
Contribución de los autores
H.M.; J.G.; M.M., E.J.; E.M. & C.A. han contribuido en forma similar en los diferentes aspectos de la investigación (logística, colección, selección del material de estudio o biofilms, datos morfométricos, descripción, macro y microfotografías, revisión bibliográfica) hasta elaboración y revisión final del artículo científico.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Citación: Montoya, H.; J. Gómez; M. Mariano; E. Jara, E. Mayta & C. Aguilar. 2019. Variabilidad fenotípica de la cianobacteria Brasilonema (Nostocales, Scytonemataceae) en comunidad aerofítica, nuevo registro para el Perú. Arnaldoa 26 (2): 643-656 http://doi.org/10.22497/arnaldoa.262.26208
Literatura Citada
Aguiar, R.; M. F. Fiore; M. W. Franco; M. C. Ventrella; A. S. Lorenzi; C. A. Vanetti & A. C. Alfenas. 2008. A novel epiphytic cyanobacterial species from the genus Brasilonema causing damage to Eucalyptus leaves. J. Phycol.44:1322-1334. [ Links ]
Becerra-Absalon, I.; B. Rodarte; K. Osorio; L. Alba- Lois; Segal-Kischinevzky & G. Montejano. 2013. A new species of Brasilonema (Scytonemataceae, Cyanoprokaryota) from Tolantongo, Hidalgo, Central Mexico. Fottea 13(1): 25-38. [ Links ]
Bekker, A.; H. D. Holland & P. L. Wang. 2004. Dating the rise of atmospheric oxygen. Nature 427:117- 120. [ Links ]
Boyer , S. L.; J. R. Johansen; V. R. Flechtner & G. L. Howard. 2002. Phylogeny and genetic variance in terrestrial Microcoleus (Cyanophyceae) species based on sequence analysis of the 16S rRNA gene and associated 16S-23S ITS region. J. Phycol. 38:1222-1235. [ Links ]
Casamatta, D. A.; M. L. Vis & R. G. Sheath. 2003. Cryptic species in cyanobacterial systematic: a case study of Phormidium retzii (Oscillatoriales) using 16S rDNA and RAPD analyses. Aquat. Bot. 77: 295-309. [ Links ]
Christman, H. D.; E. L. Campbell & J. C. Meeks. 2011. Global transcription profiles of the nitrogen stress response resulting in heterocyst or hormogonium development in Nostoc punctiforme. J. Bacteriol. 193: 6874-6886. [ Links ]
Dillard, G.E. 1999. Common freshwater algae of the United Sates. Cramer. Stuttgart. 173p. [ Links ]
Dvorák, P.; A. Poulicková; P. Hasler; M. Belli; D. A. Casamatta & A. Papini. 2015. Species concepts and speciation factors in cyanobacteria, with connection to the problems of diversity and classification. Biodivers. Conserv. 24:739-757. [ Links ]
Dvorák, P.; D. A. Casamatta; P. Hasler; E. Jahodárová; A. R. Norwich & A. Poulicková. 2017. Diversity of the Cyanobacteria. 3-46 p. In Hasler, P. C (ed.) Modern topics in the phototrophic prokaryotes. Environmental and applied aspects. Springer Intern. Publish. Switzerland. 489p. [ Links ]
Ferris, M.; A. Ruff-Roberts; E. Kopczynski; M. Bateson & D. Ward. 1996. Enrichment culture and microscopy conceal diverse thermophilic Synechococcus populations in a single hot spring microbial mat habitat. Appl. Environ. Microbiol. 62: 1045-1050. [ Links ]
Fiore, M. F.; C. L. Sant’Anna; M. T. Azevedo; J. Komárek; J. Kastovsky; J. Sulek & A. S. Lorenzi. 2007. The cyanobacterial genus Brasilonema, gen. nov., a molecular and phenotypic evaluation. J.Phycol. 43:789-798.
Flechtner, V. R.; S. L. Boyer; J. R. Johansen & M. L. DeNoble. 2002. Spirirestis rafaelensis gen. et sp. nov. (Cyanophyceae) a new cyanobacterial genus from arid soils. Nova Hedw. 74:1-24. [ Links ]
Flores, E. & A. Herrero. 2014. The cyanobacteria: morphological diversity in a photoautotrophic lifestyle. Perspectives in Phycology. 1(2): 63-72. [ Links ]
Foissner, W. 2006. Biogeography and dispersal of micro- organisms: a review emphasizing protists. Acta Protozool. 45: 111-136. [ Links ]
Garcia-Pichel, F.; L. Prufert-Bebout & G. Muyzer. 1996. Phenotypic and phylogenetic analyses shows Microcoleus chtonoplastes to be a cosmopolitan cyanobacterium. Appl. Environ. Microb. 62: 3284-3291. [ Links ]
Hasler, P.; P. Dvorák; J. R. Johansen; M. Kitner; V. Ondrej & A. Poulicková. 2012. Morphological and molecular study of epipelic filamentous genera Phormidium, Microcoleus and Geitlerinema ( Oscillatoriales, Cyanophyta/Cyanobacteria). Fottea 12 (2): 341-356. [ Links ]
Herdman, M. 1982. Evolution and genetic properties of cyanobacterial genomes. In Carr, N.G. & Whitton B.A. ( eds.). The Biology of Cyanobacteria. Blackwell. Oxford. 263 - 305p. [ Links ]
Komárek, J. 2006. Cyanobacterial Taxonomy: Currents problems and prospects for the integration of traditional and molecular approaches. Algae. Vol. 21(4): 349-375. [ Links ]
Komárek, J. & T. Hauer. 2011. CyanoDB.cz - On- line database of cyanobacterial genera. - Word- wide electronic publication , University of South Bohemia & Institute of Botany. ASCR. http://www.cyanodb.cz. [ Links ]
Komárek, J. 2011. Introduction to the 18th IAC Symposium in Ceské Budejovice 2010, Czech Republic. Some current problems of modern cyanobacterial taxonomy. Fottea 11(1): 1-7. [ Links ]
Komárek, J.; J. Kastovsky; J. Mares & J. Johansen. 2014. Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach. Preslia 86: 295-335. [ Links ]
Melick, D. R.; P. A. Broady & K. S. Rowan. 1991. Morphological and physiological characteristics of a non-heterocystous strain of the cyanobacterium Mastigocladus laminosus Cohn from fumarolic soil on Mt Erebus, Antartica. Polar Biol. 11: 81-89. [ Links ]
Osorio-Santos, K.; N. Pietrasiak; M. Bohunicka; L. H. Miscoe; L. Kovácik; M. P. Martin & J. R. Johansen. 2014. Seven new species of Oculatella (Pseudanabaenales, Cyanobacteria). Eur. J. Phycol. 49: 450-470. [ Links ]
Pentecost, A. & B. A. Whitton. 2012. Subaerial Cyanobacteria. In Whitton, B. A. (ed.). 291-316p. Ecology of Cyanobacteria II: Their diversity in space and time.Springer Science. [ Links ]
Prescott, G. W. 1978. How to know the freshwater algae. Wm. C. Brown Co. Publishers. Iowa. 293p. [ Links ]
Sant’Anna, C. L.; M. T. Azevedo; M. F. Fiore; A. S. Lorenzi; J. Kastovsky & J. Komárek. 2011. Subgeneric diversity of Brasilonema (Cyanobacteria, Scytonemataceae). Revista Brasil. Bot. 34(1): 51-62.
Siegesmund, M. A.; J. R. Johansen; U. Karsten & T. Friedl. 2008. Coleofasciculus gen. nov.(cyanobacteria): morphological and molecular criteria for revision of the genus Microcoleus Gomont. J. Phycol. 44: 1572-1585. [ Links ]
Steinmuller, K. & A. Huamani. 1999. Aguas termales y minerales en el centro del Perú. Bol.21. Serie D. Instituto Geológico Minero y Metalúrgico (INGEMET). Lima. 53p. [ Links ]
Recibido: 1-IV-2019;
Aceptado: 15-V-2019;
Publicado online: 15-VIII-2019;
Publicado impreso: 31-VIII-2019