INTRODUCCIÓN
Las células progenitoras hematopoyéticas (CPH) se originan en la médula ósea (MO), poseen marcadores celulares específicos como el antígeno CD34, y gracias a su capacidad multipotente, se usan en el trasplante con el objetivo de reconstituir la médula ósea 1.
El trasplante autólogo de células pro genitoras hematopoyéticas (TA-CPH) es un procedimiento terapéutico eficaz ampliamente utilizado en trastornos hematológicos como linfoma, mieloma múltiple, entre otros 1,2,3, lográndose la reconstitución del sistema hematopoyético por CPH del mismo paciente post quimioterapia de gran intensidad 1. La sangre periférica (SP) constituye hoy en día la fuente principal de obtención de CPH para este tipo de trasplante 4,5,6,7.
Las CPH son movilizadas de la medula ósea a la sangre periférica mediante la administración de diversas citocinas o fármacos movilizadores, generalmente el factor estimulante de colonias granulocíticas (G-CSF) solo o en combinación con quimioterapia 8,9,10. Luego de la movilización, las CPH son recolectadas de la SP por medio de un procedimiento llamado aféresis sanguínea, mediante el cual se hace circular la sangre del paciente por un separador celular automático de flujo continuo 4,9. El equipo separará los leucocitos del tipo mononuclear (dentro de las que se encuentran las CPH) de los otros componentes sanguíneos, devolviendo al torrente sanguíneo los demás elementos que no se desean recolectar.
La identificación y cuantificación de las CPH, por la expresión del marcador CD34 en su superficie, se realiza por citometría de flujo. Este es un método de análisis celular multiparamétrico mediante el cual las células sanguíneas son incididas por un haz de luz láser que permite identificar a diferentes poblaciones celulares, dependiendo de las proteínas que se expresen en su superficie 11.
El número de CPH movilizadas en la SP se correlaciona con el número de células CD34+ recolectadas en la aféresis. Por eso es considerado el mejor predictor del rendimiento de recolección de células CD34+ 12, empleándose como referencia para identificar el momento óptimo para realizar el procedimiento de aféresis y obtener el mayor número de células CD34+ recolectadas. Esta aplicación permite realizar intervenciones oportunas a los posibles pobres movilizadores, evitando procedimientos de aféresis insatisfactorios, reduciendo los costos y complicaciones asociados a una removilización además del retraso del trasplante 13. Son considerados pobres movilizadores los pacientes con <10 células CD34+/μL en sangre periférica 4,6,11.
El recuento mínimo (en el producto recolectado por aféresis) para el trasplante es de 2 × 106 células CD34+ por kilogramo de peso del paciente. Este recuento permite lograr un injerto multilinaje exitoso y consistente, así como una recuperación hematopoyética sostenida 4,6,7,9. Aunque dosis superiores (> 5 × 106 células CD34+/kg) se han asociado con una recuperación hematopoyética más rápida, una reducción en los requerimientos transfusionales, menos infecciones y períodos más cortos de hospitalización, puede ser difícil obtener este rendimiento en pacientes de edad avanzada y que han recibido tratamiento intensivo 4,6.
Es importante establecer la celularidad mínima de CPH en SP para realizar la aféresis y lograr una recolección exitosa de CPH (≥ 2 ×106 células CD34+/kg). En base a la experiencia obtenida en el desarrollo de los procedimientos en cada institución, se ha constatado variaciones ligadas al régimen de movilización utilizado, equipamiento utilizado (tipo de separador celular y citómetro de flujo), volúmenes de sangre procesados, patología más prevalente, entre otros. Sin embargo, pocos son los estudios que han establecido un punto de corte de células CD34+ para identificar a los pacientes en los que la recolección sería efectiva y aquellos en los que habría una alta probabilidad de fracaso.
El objetivo del presente estudio fue determinar el número más discriminatorio de células CD34+ en sangre periférica para predecir el éxito de la recolección de CPH (≥ 2 ×106 células CD34+/ kg) por aféresis en pacientes candidatos a trasplante autólogo de progenitores hematopoyéticos en el Hospital Edgardo Rebagliati Martins.
MÉTODOS
Diseño y población
Estudio observacional, analítico y retrospectivo. Por muestreo no probabilístico consecutivo, se incluyeron en el estudio a los pacientes candidatos a TACPH que efectuaron la aféresis de células mononucleares entre julio del 2020 y julio del 2023 en el Hospital Edgardo Rebagliati Martins EsSalud (Lima, Perú). Además, se requirió que tengan historia clínica completa e informe de citometría de flujo del número de células CD34+/μL en sangre periférica tras la movilización y del recuento de células CD34+/kg en el producto recolectado por aféresis. No se incluyeron gestantes o pacientes que estén dando de lactar. Si el paciente fue sometido a más de una leucoaféresis consecutiva, se tomó solo los valores de CPH en sangre periférica y recolectadas del producto de la primera aféresis.
Movilización y recolección de CPH
Para la movilización de progenitores hematopoyéticos se utilizaron 3 esquemas: (i) Solo Filgastrim (G-CSF) a una dosis de 10 mcg/Kg dividido en 2 dosis durante 5 días, con intención de colecta en el día 5, (ii) Filgastrim asociado a quimioterapia: filgastrim a una dosis de 10 mcg/Kg dividido en 2 dosis de forma diaria después del esquema de quimioterapia regular, con intención de colecta al momento de la recuperación hematológica con leucocitos > 1000, y (iii) Filgastrim asociado a ciclofosfamida: filgastrim a una dosis de 10 mcg/Kg dividido en 2 dosis diariamente desde el día posterior a la administración de ciclofosfamida a una dosis de 1,5 g/m2 con intención de colecta en el día 8.
El uso y selección de la quimioterapia, como parte del régimen de movilización, dependió del diagnóstico del paciente, su estado clínico y el criterio del médico hematólogo tratante. La aféresis se efectuó con ≥ 10 células CD34+/μL en sangre periférica.
El procedimiento de recolección de CPH se realizó por los médicos patólogos clínicos del servicio de medicina transfusional a través de catetes venosos periféricos o centrales utilizando un separador automatizado Spectra Optia® (Terumo, BCT, Lakewood, CO, EE. UU) según las instrucciones del fabricante. Se procesó de 2,5 a 3 veces el volumen total de sangre del paciente a una velocidad de 60 a 70 ml/min.
Se utilizó una solución anticoagulante de citrato dextrosa fórmula A (ACD-A) en una relación de volumen de entrada/ anticoagulante de 12 a 24:1. La velocidad máxima de infusión de ACD-A se fijó en 1,2 ml/min/l de volumen sanguíneo total.
El conteo de células CD34+, tanto de sangre periférica como en el producto de la leucoaferesis, se realizó usando el citómetro de flujo Exbio, CD34 Quantifi-FlowEx Kit (República Checa). Se usaron anticuerpos monoclonales anti-CD34 humanos conjugados con ficoeritrina (PE) y anticuerpos monoclonales CD45 conjugados con isotiocianato de fluoresceína (FITC) siguiendo las pautas de la Sociedad Internacional de Hematoterapia e Ingeniería de Injertos (ISHAGE) 14.
La recolección exitosa de CPH fue definida cuando se obtuvo ≥ 2 x 106 células CD34+/kg de peso del paciente en la aféresis y el fracaso en la recolección de CPH cuando se obtuvo un recuento < 2 x 106 células CD34+/kg.
Análisis de datos
Las variables categóricas fueron descritas con frecuencias absolutas y relativas. Las variables numéricas fueron presentadas como media y desviación estándar o mediana y rango, previa evaluación de la distribución normal de los datos utilizando la inspección visual del histograma y la prueba de Shapiro-Wilk.
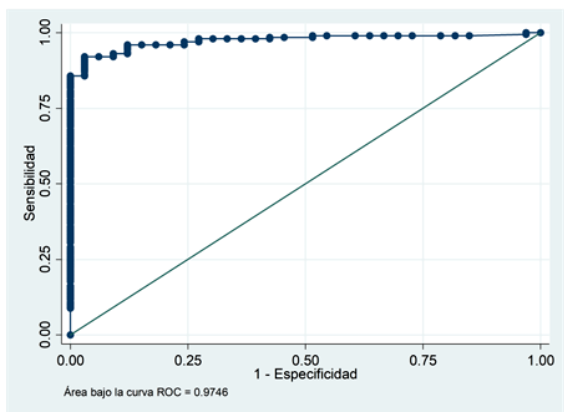
Se realizó la curva de características operativas del receptor (ROC) para identificar el mínimo número de CPH en sangre periférica necesarios para una recolección exitosa de CPH (≥ 2 ×106 células CD34+/kg) en el producto de la primera aféresis. También se determinó los rendimientos diagnósticos (sensibilidad y especificidad) de los valores seleccionados, acorde al índice de Youden más alto.
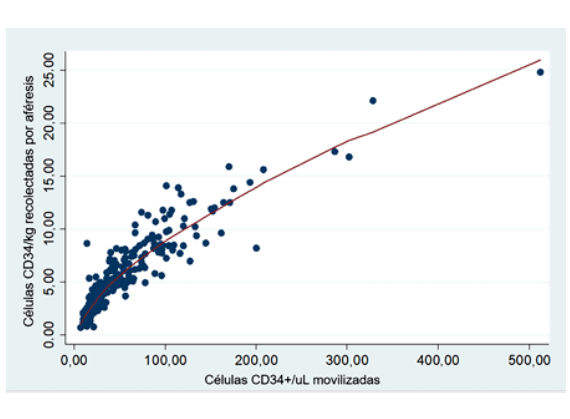
Se utilizó el coeficiente de correlación de orden de rangos de Spearman para corroborar la asociación del número de células CD34+ movilizadas en sangre periférica con el número de células CD34+ recolectadas en el producto de aféresis. La significación estadística se estableció para un valor de p<0,05 y se calculó el intervalo de confianza del 95% (IC del 95%). Para el procesamiento y análisis de la base de datos se utilizó el programa estadístico Stata versión 14 (StataCorp, College Station, TX, USA).
Aspectos éticos
El estudio se realizó de acuerdo con la declaración de Helsinki, las buenas prácticas clínicas y la normativa nacional aplicable. Pasó por la evaluación y aprobación del Comité de Ética del Hospital Edgardo Rebagliati Martins previo al inicio de su ejecución. Debido a la naturaleza retrospectiva del estudio no se requirió del consentimiento informado de los pacientes o sujetos de estudio. Este estudio garantizó la confidencialidad de los datos sensibles obtenidos de los pacientes.
RESULTADOS
Características de los pacientes
A 258 pacientes se les realizó la aféresis de CPH para el trasplante autólogo. Fueron excluidos 22 pacientes por tener registros incompletos en la historia clínica. Ingresaron al análisis de datos 236 pacientes. 144 (61%) fueron hombres, la mediana de edad fue de 58 años (rango; 3 - 74). Respecto a la distribución por enfermedad, 161 (68,2%) pacientes tenían mieloma múltiple, 48 (20,3%) tenían linfoma no Hodgkin, 12 (5%) tenían linfoma de Hodgkin, 6 (2,5%) tenían leucemia mieloide aguda, 3 (1,3%) tenían leucemia promielocítica, 3 (1,3%) tenían neuroblastoma, 1(0,4%) tenía leucemia linfática crónica, 1(0,4%) tenía síndrome de Poems y 1(0,4%) tenía carcinoma embrionario testicular (Tabla 1).
Tabla 1. Características de los 236 pacientes sometidos a aféresis de células progenitoras hematopoyéticas para el trasplante autólogo
| Característica | Frecuencia absoluta (%) |
|---|---|
| Edad (años) a | 58(3 a 74) |
| <18 | 10 (4,2) |
| ≥18 | 226 (95,8) |
| Sexo | |
| Masculino | 144 (61) |
| Femenino | 92 (39) |
| Diagnóstico | |
| Mieloma multiple | 161 (68,2) |
| Linfoma no Hodking | 48 (20,3) |
| Linfoma Hodking | 12 (5) |
| Otros | 15 (6,5) |
| Esquema de movilización | |
| Filgastrim | 14 (5,9) |
| Ciclofosfamida + Filgastrim | 222 (94,1) |
| CPH movilizadas a | 39,85 (9,39 a 512) |
| CPH recolectadas a | 5 (0,73 a 24,8) |
a Mediana (rango), CPH: Células progenitoras hematopoyéticas.
Respecto al régimen de movilización, 222 pacientes (94,1%) recibieron filgastrim asociado a ciclofosfamida y 14 pacientes (5,9%) solo filgastrim. De los pacientes movilizados solo con filgastrim, 12 (85,7%) pacientes tuvieron una recolección exitosa.
La mediana del número de progenitores hematopoyéticos en sangre periférica fue de 39,85 células CD34+/μL (rango; 9,39 - 512) y la mediana del número de CPH recolectados fue de 5 x 106 células CD34+/kg (rango; 0,73 - 24,8).
Recolección de CPH
En 202 (85,6%) de los pacientes se recolectaron ≥ 2 x 106 células CD34+/kg, 86 (36,4%) recolectaron entre 2 y 5 x 106 células CD34+/kg y 116 (49,2%) recolectaron > 5 x 106 células CD34+/kg.
De los 34 pacientes (14,4%) con recolección de progenitores hematopoyéticos < 2 x 106 células CD34+/kg, 20 (58,8%) tenían mieloma múltiple, 11 (32,3%) tenían linfoma no Hodking, 2 (5,8%) tenían leucemia mieloide aguda y 1 (2,9%) tenía carcinoma embrionario testicular. La mediana de CPH en sangre periférica fue de 12,3 células CD34+/μL (rango; 9,39 a 21,4) y la mediana de células recolectadas fue de 1,45 x 106 células CD34+/kg (rango; 0,81 a 1,23). El fracaso en la recolección de CPH se presentó en el 23,4% de los pacientes con linfoma no Hodking y en el 12,3% de los pacientes con mieloma múltiple.
Número de células CD34+ para una recolección exitosa
En el análisis de la curva ROC (Figura 1), el número mínimo de CPH en sangre periférica para recolectar ≥ 2 ×106 células CD34+/kg en el producto de la primera aféresis en los 236 pacientes fue de 18,38 células CD34+/μL, con una sensibilidad de 94,1% (IC95%: 87,5% - 95,4%), especificidad de 96,9% (IC95%: 79,8% - 99,3%) y área bajo la curva de 0,97 (IC95%: 79,8% -99,3%). En los pacientes con mieloma múltiple el punto de corte fue de 18,13 células CD34+/μL con una sensibilidad de 97,9% (IC95%: 94% - 99,6%), especificidad de 89,4% (IC95%: 66,9% - 98,7%) y área bajo la curva de 0,95 (IC95%: 90% - 100%).
Además, en cada aféresis se encontró una clara correlación positiva entre el número de CPH en sangre periférica y las células CD34+ recolectadas (Figura 2), con un coeficiente de correlación r = 0,84 (p < 0,001). La prevalencia de fracaso en la recolección fue del 1% en pacientes con >20 células CD34+/μL en sangre periférica, del 20% entre aquellos con 15 a 20 células CD34+/μL, del 82,3% entre aquellos con 10 a 14 células CD34+/μL y del 100% para pacientes con menos de 10 células CD34+/μL en sangre periférica.
DISCUSIÓN
En el Hospital Edgardo Rebagliati Martins encontramos que 18,38 células CD34+/μL en sangre periférica tuvo un valor discriminatorio para predecir el éxito o el fracaso de la recolección de células CD34+ en la primera aféresis de células mononucleares en candidatos a TA-CPH. Este valor es cercano a lo encontrado por Pusic et al.6) quienes estiman un punto de corte de 20 células CD34+/ μL para alcanzar ≥ 2 x 106 células CD34+/ kg en la primera aféresis. En los 1040 pacientes de este estudio, el 48% tuvo linfoma no hodking y el 38% mieloma múltiple, además tuvieron regímenes de movilización en el 93% de los casos de filgastrim asociado a quimioterapia y solo filgastrim en el 7%.
Cortes inferiores fueron reportados por otros estudios. Por ejemplo, Sancho et al.15 determinan como suficientes 13,8 células CD34+/μL para lograr una recolección ≥ 2 x 106 células/Kg. Este estudio fue realizado en 397 pacientes con rango de edad de 4 a 70 años, el 33% tenía mieloma múltiple y 28% linfoma no hodking, respecto a la movilización, el 87% de los casos recibió filgastrim y el 13% filgastrim asociado a quimioterapia. El estudio de Sinha et al.16 en 1556 pacientes determinó un mínimo de 11 células CD34+/μL para recolectar ≥ 2 x 106 células CD34+/Kg. El 36% de estos pacientes tuvieron linfoma no hodking y otro 36% mieloma múltiple; en todos los casos, el régimen de movilización fue de únicamente filgastrim. Finalmente, Szwajcer et al.17 determinaron en su estudio de 41 pacientes que 10 células CD34+/ul eran suficiente para una recolección exitosa. El 48% de sus pacientes tuvo linfoma y 36% mieloma múltiple, siendo el régimen de movilización predominante el de filgastrim asociado a quimioterapia. Todas estas diferencias podrían estar relacionadas al régimen de movilización utilizado, reserva medular, líneas de quimioterapia recibidas, comorbilidades, equipamiento utilizado, personal encargado, entre otros.
Es ideal lograr un recuento mínimo de 2 x 106 células CD34+/kg en la primera recolección, pues de no alcanzarlo hay más probabilidades de fracasar en una segunda movilización independientemente del régimen y la enfermedad subyacente. Además, cuando se combinan las recolecciones de la primera y segunda movilizaciones, aproximadamente el 30% de los pacientes no lograron recolectar suficientes células para el trasplante6.
Con las estrategias de movilización establecidas en nuestro centro, se encontró que el 85,6% de los pacientes lograron una recolección exitosa en la primera leucoaféresis. No se indicó el uso de plerixafor en ningún esquema, y el régimen de movilización más utilizado fue el de filgastrim asociado a ciclofosfamida (90,1%).
La recolección frustra de CPH se encontró en el 14,4% de las aféresis, cifras similares a los reportes de Mendrone et al.18, Oliveiri et at.19 y Pusic et al.6 quienes reportan recolecciones insatisfactorias en el 13,7%, 15,3% y 18,7% de sus leucoféresis respectivamente. En todos estos estudios los regímenes de movilización de quimioterapia más filgastrim fueron predominantes. Por otro lado, Sancho et al.15 determinaron un 29% de pobres movilizadores, cifras más altas probablemente asociadas a que el 87% de sus pacientes usaron solo filgastrim. Reportes con cifras más bajas han sido descritos por Hassan et al.20 quienes encuentran un 9,2% de pobres movilizadores en pacientes con mieloma múltiple y linfoma. Así también, Wuchter et al.21 describen un 5% de pobres recolecciones, sin embargo, entre sus regímenes de movilización el 11% de los pacientes usó plerixaford, lo que probablemente se asocie a sus resultados.
Respecto a las tasas de fracaso en la recolección por enfermedades, se encontró que el 12,3% de los pacientes con mieloma múltiple tenían recolecciones insatisfactorias. Esta cifra fue superior a lo encontrado por Pusic et al.6) quienes reportaron un 6,2% de fracaso en la recolección para esta patología. Por otro lado, el 23,4% de los pacientes con linfoma tenían una recolección subóptima, cifras cercanas a las encontradas por Pavone et al.22 quienes estiman un 17,9 % de fracaso en la recolección en estos pacientes.
Se confirma también la correlación lineal entre el recuento de células CD34+/uL en sangre periférica al finalizar la movilización y el número de células CD34+ recolectadas, reafirmando la utilidad del número de células CD34+ movilizadas a sangre periférica como predictor de recolección de CPH a fin de identificar el momento óptimo para iniciar la leucoaféresis.
Las limitaciones del presente estudio incluyen su carácter retrospectivo y la heterogeneidad de la muestra, sin embargo, consideramos que la uniformidad del personal asistencial en el servicio de Medicina Transfusional, así como como la estandarización en la medida de las células CD34+ y sistematización de los procedimientos de aféresis (uso del mismo citómetro de flujo y separador celular en todos los casos) proporcionan valor adicional.
En conclusión, este estudio estableció un valor de 18,38 células CD34+/μL como punto de corte para una recolección exitosa de CPH. Además, el umbral para los pacientes con mieloma múltiple fue de 18,13 células CD34+/μL. Estos hallazgos confirman la utilidad del conteo de CPH en sangre periférica como parámetro predictor para una recolección exitosa de células CD34+.