Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Peruana de Medicina Experimental y Salud Publica
versão impressa ISSN 1726-4634
Rev Peru Med Exp Salud Publica v.20 n.1 Lima ene./mar. 2004
TRABAJOS ORIGINALES
Evaluación del uso de una prueba rápida inmunocromatográfica en promotores de salud para el diagnóstico de la malaria en áreas rurales de la Amazonia peruana*
César Cabezas S 1 ; Nancy Arróspide V 1 ; Wilmer Marquiño Q 1 ; Sonia Gutiérrez S 1 ; Ever Álvarez M 2 ; Jorge Chuquipiondo R 2 ; Tomasa Ruiz A 2 ; Martín Daza M 2 ; Gladys Chuquipiondo L 2 1 Instituto Nacional de Salud, Lima, Perú. * Este estudio contó con el apoyo técnico-financiero del Proyecto VIGÍA "Enfrentando las Amenazas de las Enfermedades
2 Región de Salud Loreto, Iquitos, Perú.
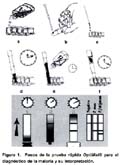
RESUMEN Objetivo: Evaluar la concordancia de los resultados obtenidos por promotores de salud de áreas rurales de la Amazonia peruana con los obtenidos por profesionales de laboratorio, al aplicar una prueba rápida inmunocromatográfica para el diagnóstico de la malaria. Material y métodos: Se evaluó la concordancia entre los resultados de la aplicación de una prueba rápida (OptiMal®) ejecutada por promotores de salud de 20 comunidades rurales de la selva de Iquitos (Loreto), en comparación con la ejecutada por profesionales de laboratorio. Esta evaluación se realizó en dos etapas: la primera en el laboratorio, se examinaron 618 muestras con concentraciones conocidas de parásitos y la segunda en el campo, en donde se examinaron 419 pacientes. La prueba utilizada se basa en la detección de la deshidrogenasa láctica del Plasmodium falciparum y del P. vivax, mediante tiras reactivas. Resultados: En la primera etapa, de las 618 muestras examinadas 121 fueron negativas y 497 positivas (251 para P. falciparum y 246 para P. vivax). Al comparar los dos grupos, se encontró una sensibilidad de 88,5%, especificidad de 90,1% e índice de concordancia Kappa de 0,689. En la segunda etapa, de los 419 pacientes febriles, 156 correspondieron a casos de malaria (53 por P. falciparum y 103 por P. vivax). La sensibilidad, especificidad e índice Kappa fueron 94,4%, 96,5% y 0,909 respectivamente. El tiempo promedio de ejecución de la prueba por parte del promotor de salud fue de 25 minutos. Conclusiones: Se encontró concordancia en los resultados de ambos grupos. El estudio muestra que el uso de pruebas rápidas sería una alternativa apropiada y aplicable para el diagnóstico oportuno de la malaria en áreas rurales de la selva con limitado acceso a los servicios de salud. Palabras clave: Malaria/diagnóstico; Técnicas y Procedimientos de Laboratorio; Perú (fuente: BIREME). ABSTRACT Objective: To assess concordance of the results obtained by village health promoters compared to those obtained by laboratory professionals in rural Amazon areas during the application of a rapid immunochromatographic test for diagnosing malaria. Material and methods: The concordance of the results of the rapid immunochromatographic test for diagnosing malaria (OptiMalÒ) performed by village health promoters from 20 rural communities near Iquitos (Loreto) compared to the results obtained by laboratory professionals was assessed in two steps: in the laboratory, where 618 samples with known parasite concentrations were assessed, and in the field, where samples from 419 patients were assessed. The test is based on the detection of Plasmodium falciparum and P. vivax lactate dehydrogenase using reactive strips. Results: In the laboratory stage, 618 samples with known parasite concentrations were evaluated, 121 of them were negative and 497 were positive (251 for P. falciparum and 246 for P. vivax). In the second stage in the field, 419 febrile patients were evaluated. Of these, 156 had malaria (53 P. falciparum and 103 P. vivax). The results obtained by village health promoters and laboratory professionals were compared. Sensitivity, specificity and concordance Kappa indexes were 88,5%, 90,1% and 0,689, respectively. Sensitivity, specificity and Kappa indexes were 94,4%, 96,5% and 0,909, respectively. The average time for performing the test by the village health promoters was 25 minutes. Conclusions: A good concordance in results obtained by both groups was found. This study shows that the use of rapid diagnosis tests would be an appropriate and useful alternative for the early diagnosis of malaria in jungle rural areas with limited access to health services. Key words: Malaria/diagnosis; Laboratory Techniques and Procedures; Peru (fuente: BIREME). INTRODUCCIÓN Dos aspectos importantes en la implementación de la estrategia global para el control de la malaria lo constituyen el diagnóstico y el tratamiento oportuno de los casos1. El diagnóstico debe ser rápido para dar un tratamiento apropiado, considerando su disponibilidad, validez y costo-efectividad. Por muchos años, el examen microscópico usando la gota gruesa y el extendido de sangre han sido considerados como los métodos de referencia para el diagnóstico de la malaria. Por ello, los programas de control han invertido considerable tiempo y recursos para asegurar este tipo de diagnóstico, aún en las áreas más alejadas, sin lograrlo en todos los casos. En zonas hiperendémicas como África, este método puede tener un valor limitado para confirmar la enfermedad clínica a causa de la elevada prevalencia de portadores del parásito; sin embargo, los exámenes microscópicos son pertinentes para diagnosticar el fracaso del tratamiento y la malaria grave. El diagnóstico microscópico es también conveniente para detectar los casos de malaria no complicada en zonas de transmisión inestable o durante temporadas de baja transmisión, particularmente en áreas donde se comparte la presencia de Plasmodium falciparum y de Plasmodium vivax, que requieren tratamientos diferenciados2. La sensibilidad del examen microscópico de la gota gruesa es muy alta, pudiendo tener una detección fiable de densidades parasitarias de hasta 5 parásitos/mL3-4. Pese a la sencillez de la prueba y de los costos directos relativamente bajos, el diagnóstico microscópico resulta todavía relativamente caro, porque requiere una infraestructura adecuada para mantener insumos y equipo, adiestrar a los trabajadores de salud y garantizar una buena calidad del servicio5. Como consecuencia de tales factores, el diagnóstico microscópico sistemático ha tenido una calidad inapropiada y poco confiable en varios países. Adicionalmente, en áreas rurales de difícil acceso cuando es necesario enviar la muestra de gota gruesa a un laboratorio central, los resultados del examen de gota gruesa pueden demorar en promedio de una a tres semanas. Por estas razones, cuando hay dificultades para el diagnóstico de laboratorio, se recurre al tratamiento basado en el diagnóstico clínico presuntivo de la malaria, sobre todo en áreas rurales. Es importante considerar también que en áreas maláricas se dan muchos casos de enfermedades febriles de etiología viral, las que clínicamente pueden ser confundidas con malaria y recibir tratamiento antimalárico6-7. En el Perú durante el año 1998 se registraron 247 229 casos confirmados de malaria, correspondiendo 65,9% a P. vivax y 34,1% a P. falciparum 8-9. Ese mismo año en todo el país se procesaron dos millones de gotas gruesas de pacientes febriles con una positividad promedio de 18%, y de las cuales 53% correspondieron a las áreas rurales con problemas de accesibilidad10-11. Si no se cuenta con un diagnóstico oportuno, que permita diferenciar la infección por P. vivax y P. falciparum, el tratamiento de casos con diagnóstico clínico presuntivo puede conllevar a un uso no racional de estos medicamentos. Este uso inadecuado eleva los costos de tratamiento, pues se tratan a todos los febriles, condicionando así la aparición de la resistencia a medicamentos, lo cual pone en peligro la vida del paciente con P. falciparum. Es pertinente destacar que en la Amazonia peruana se ha determinado una resistencia mayor de 30% para la cloroquina y sulfadoxina/pirimetamina 10. Varias opciones al diagnóstico microscópico tradicional de malaria han sido sugeridas en los últimos años. Algunas de ellas por su alto costo o por su complejidad quedan restringidas a laboratorios de referencia, como por ejemplo las basadas en técnicas de inmunofluorescencia y por reacción en cadena de la polimerasa (PCR)12-13. Recientemente, se ha desarrollado la prueba de captura de antígenos que detecta proteínas ricas en histidina del P. falciparum (pfHRP-2). Evaluaciones de estas pruebas en el campo han mostrado una sensibilidad de 95% y una especificidad entre 81 y 99%14-17, y parecen mostrar baja reacción cruzada con la de otras especies de Plasmodium. Aunque el umbral de detección es tan bajo como de 10 parásitos/mL, estas pruebas también dan resultados positivos en presencia de gametocitos inmaduros y por un período tan largo como 10 a 14 días posteriores a un tratamiento antimalárico satisfactorio2. Una prueba promisoria desarrollada últimamente se basa en la detección de la enzima deshidrogenasa del ácido láctico del Plasmodium (OptiMal®). La sensibilidad de esta prueba está entre 85 y 90% y la especificidad de 95%18-21. Además, tiene la ventaja que puede detectar en forma simultánea y diferenciada tanto a P. falciparum como a P. vivax. Esta prueba es positiva en presencia de gametocitos, pero evidencias recogidas sugieren que no persiste positividad de la prueba luego del tratamiento antimalárico22-23. Considerando la disponibilidad de pruebas diagnósticas rápidas que son sensibles, específicas, simples y costo-efectivas, que resultan aplicables en áreas con dificultades de acceso al diagnóstico microscópico, donde adicionalmente se presentan casos de síndrome febril que no corresponden a malaria y existe evidencia de resistencia a antimaláricos, se justifica la determinación de un diagnóstico específico oportuno. El presente estudio fue realizado usando una prueba inmunocromatográfica basada en la determinación de la deshidrogenasa láctica del P. vivax y P. falciparum (OptiMal®) para el diagnóstico de la malaria con el objetivo de mostrar la concordancia entre los resultados obtenidos por promotores de salud en comparación con los resultados obtenidos por personal de laboratorio (profesional y técnico), con la misma prueba y en las mismas condiciones de laboratorio y de campo. MATERIAL Y MÉTODOS ÁREA DE ESTUDIO El estudio se llevó a cabo en Iquitos, capital del Departamento de Loreto, durante el mes de julio de 1999. Participaron 20 promotores de salud procedentes de 20 comunidades ubicadas en las cuencas de los ríos Alto Nanay, Momón y Amazonas. La supervisión estuvo a cargo de dos profesionales de laboratorio y dos médicos del Instituto Nacional de Salud, además del apoyo de tres técnicos de laboratorio. ETAPAS DEL ESTUDIO La primera etapa se realizó en el Laboratorio Referencial de Iquitos, donde se capacitó a los promotores en el uso de las pruebas rápidas. Se procesaron 618 muestras en total, se consideró además como período de entrenamiento antes del trabajo de campo (segunda etapa). Cada uno de los 20 promotores de salud procesó 30 pruebas rápidas OptiMal® para el diagnóstico de la malaria, usando muestras de sangre preparadas con concentraciones de parásitos conocidas. Para esta etapa se consideró baja densidad a concentraciones entre 50 y 150 parásitos/mL y alta densidad a concentraciones entre 350 y 500 parásitos/mL Un tercer grupo de muestras de sangre no contenían parásitos (controles negativos). En esta etapa, los promotores fueron supervisados por personal del laboratorio. La segunda etapa se llevó a cabo distribuyendo a los 20 promotores de salud en cuatro centros de atención de pacientes: Hospital de Apoyo de Iquitos, Centro de Salud de Moronacocha, Centro de Salud de San Juan y Centro de Salud de Bellavista Nanay. Se incluyeron pacientes mayores de 2 años, febriles (temperatura axilar mayor o igual a 37,5°C), con sospecha de malaria no complicada que acudieron a dichos establecimientos de salud. Los mismos promotores que participaron en la primera etapa captaron un total de 419 pacientes febriles (en promedio 21 pacientes por promotor) para la ejecución de la segunda etapa. Se obtuvo aproximada-mente 50 mL de muestra de sangre periférica por punción digital a partir de la cual se procesaron dos láminas de gota gruesa y seguidamente se obtuvo la sangre para la realización de la prueba rápida OptiMal®. Las muestras de gota gruesa fueron coloreadas con Giemsa al 5%24 y luego leídas con objetivo de inmersión de 1000X aumentos. Estas fueron examinadas por microscopistas experimentados y los resultados se reportaron a los clínicos para ser utilizado posteriormente como control de comparación de las tiras de OptiMal®. Una segunda lámina de gota gruesa fue llevada al Instituto Nacional de Salud en Lima, para una segunda lectura. Las láminas fueron consideradas negativas luego de haber examinado 100 campos microscópicos25. Cada muestra fue obtenida de acuerdo con las instrucciones de la prueba rápida y procesada de inmediato por los promotores de salud. Las pruebas se hicieron por grupos de hasta cinco muestras de acuerdo con la llegada de pacientes febriles. Para el procesamiento e interpretación de la prueba se siguieron los pasos mencionados en la descripción. Las primeras tres muestras fueron procesadas e interpretadas por el promotor junto con el profesional de laboratorio. Las demás fueron procesadas completamente por el promotor bajo observación del profesional, pero sin directa supervisión. Paralelamente, el profesional procesó el mismo número de muestras evaluadas por el promotor. Las pruebas fueron leídas a los 20 minutos de realizado el ensayo. Los resultados se anotaron en sus respectivos formatos. Terminado el estudio de campo, el profesional de laboratorio realizó la lectura de las tiras reactivas y el resultado se comparó con los resultados obtenidos por el promotor. REVISIÓN DE LAS TIRAS REACTIVAS La reactividad de las tiras fue ensayada con muestras preparadas en laboratorio cuyas densidades parasitarias eran de 100 parásitos/mL, 400 parásitos/mL y muestras negativas. Se tomó aleatoriamente una tira por cada kit de un total de 10 reactivos. El total de tiras evaluadas dieron resultados adecuados de positividad para P. falciparum y P. vivax o resultados negativos, de acuerdo con las muestras positivas y controles negativos establecidos para la prueba. Los kits se utilizaron durante el período adecuado para su uso, antes de la fecha de expiración consignada por el fabricante. DESCRIPCIÓN DE LA PRUEBA La prueba rápida se basa en la determinación de la deshidrogenasa láctica (OptiMal®) del P. vivax y del P. falciparum; el procedimiento es el siguiente (Figura 1): a) Se depositan dos gotas de reactivo A (20 mL de solución tampón) en un primer recipiente configurado en la placa; b) Seguidamente se realiza una punción digital y se obtiene una muestra de sangre (aproximadamente entre 10 y 20 mL) con la ayuda de una micropipeta desechable; c) La muestra de sangre se coloca y homogeiniza en el recipiente con el reactivo A; d) La tira reactiva se sumerge en el recipiente por 10 minutos; e) Paralelamente se colocan 4 gotas del reactivo B (80 mL de solución tampón) en un segundo recipiente; f) Después de 10 minutos se transfiere la tira reactiva al segundo recipiente que contiene la solución tampón, y permanece 10 minutos adicionales; g) Luego se realiza la lectura e interpretación de la prueba. INTERPRETACIÓN DE LA LECTURA La tira reactiva utilizada contiene dos zonas de reacción con diferentes anticuerpos. El primero, un anticuerpo monoespecífico que reconoce solamente la enzima deshidrogenasa láctica del parásito P. falciparum está ubicado en la zona inferior o terminal de la tira. El segundo anticuerpo específico está presente inmediatamente por encima del anterior y reconoce la enzima deshidrogenas láctica del P. vivax. Una tercera zona de reacción está ubicada en la zona superior de la tira, y contiene anticuerpos que capturan el exceso de conjugado, además sirve como un control para el ensayo. La interpretación de las bandas fue la siguiente, de acuerdo con el protocolo establecido: a. Positivo a P. falciparum: presencia de una banda control más dos bandas. CONSIDERACIONES ÉTICAS La toma de muestras para el desarrollo de las pruebas rápidas no difiere de aquel utilizado para hacer la gota gruesa y no constituye un riesgo adicional, dado que es un procedimiento de rutina en los servicios del salud. El tratamiento antimalárico se dio de acuerdo con las normas del Ministerio de Salud del Perú. A cada uno de los pacientes incorporados en el estudio se les explicó acerca de éste y de los procedimientos a ser realizados. Luego de aceptar, los participantes firmaron una hoja de consentimiento escrita. En el caso de los niños, fueron los padres o apoderados quienes firmaron la hoja de consentimiento. MANEJO DE DATOS Y ANÁLISIS ESTADÍSTICO La información obtenida en el estudio fue almacenada y procesada en una base de datos utilizando el programa SPSS 6,0. Se evaluó la sensibilidad, especificidad, valores predictivos positivo y negativo, así como el índice Kappa entre los resultados obtenidos por promotores de salud y técnicos de laboratorio, y los obtenidos por profesionales de laboratorio. Para el cálculo del índice Kappa (K) se usó la siguiente fórmula: Índice Kapa = Po - Pe / 1 - Pe Donde: Po = Concordancia observada y Pe = Concordancia esperada. El índice Kappa (k) se clasificó en cinco grupos, asignando a cada nivel de concordancia un valor de índice Kappa: Deficiente (< 0,20); Regular (0,21 - 0,40); Moderado (0,41 - 0,60); Bueno (0,61 - 0,80) y Muy bueno (0,81 - 1,00). RESULTADOS En la primera etapa del estudio, del total de 618 muestras 121 fueron negativas y 497 positivas para malaria, correspondiendo 251 a P. falciparum y 246 a P. vivax. Los niveles de concordancia en los resultados finales del procedimiento correspondieron a un índice Kappa de 0,689 (buena concordancia) para los promotores de salud y de 0,824 (muy buena concordancia) para los técnicos de laboratorio, cuando el procedimiento se comparó con los profesionales de laboratorio. La sensibilidad, especificidad y valores predictivos positivos y negativos se muestran en la tabla 1. El tiempo promedio empleado por los promotores para la realización de la prueba y su interpretación fue de 25 minutos. En la segunda etapa del estudio se evaluaron 419 pacientes que acudieron a los centros de atención establecidos. De ellos, 156 resultaron positivos para malaria en el examen de gota gruesa, 53 corresponden a P. falciparum y 103 a P. vivax. En la interpretación de los resultados de las tiras reactivas, tanto los promotores de salud como el profesional de laboratorio tuvieron por coincidencia el mismo número de lecturas positivas y negativas (160 y 259, respectivamente) (Tabla 2). Sin embargo, en el grupo de promotores se detectaron nueve falsos positivos dentro del total de lecturas positivas, y nueve falsos negativos en el grupo de lecturas negativas. La concordancia en la interpretación de los resultados obtenidos entre promotores de salud y profesionales de laboratorio en esta parte del estudio correspondió a un índice Kappa de 0,909. De igual modo se muestra una alta sensibilidad (94,4%) y especificidad (96,5%). Los valores predictivo positivo y negativo, se muestran en la tabla 2. Todos los promotores de salud manifestaron que la prueba es sencilla y mostraron interés para su aplicación en sus comunidades. DISCUSIÓN Actualmente se disponen de pruebas rápidas para el diagnóstico de la malaria validadas tanto para P. falciparum como para P. vivax18-19. Su aplicación en la práctica médica y particularmente dentro de la salud pública debe considerar algunas propiedades importantes de estas pruebas, tales como su espectro para el diagnóstico. Ello debe incluir las especies más prevalentes en determinadas áreas, como es el caso del Perú donde las macrorregiones norte y amazónica comparten la presencia de las especies P. vivax y P. falciparum. Por otro lado, es importante tener en cuenta el análisis costo-efectivo de la aplicación de estas pruebas, considerando el incremento de la red de laboratorios con capacidad de procesar la gota gruesa, así como la accesibilidad de los pacientes a los servicios en las áreas maláricas. Estudios realizados en otros países han mostrado una alta sensibilidad y especificidad para pruebas rápidas, tanto en las que se basan en la determinación de proteínas ricas en histidina (HRP) de P. falciparum14-15, como en las que detectan deshidrogenasa láctica del Plasmodium (pDHL) de P. falciparum y P. vivax 20-21. A inicios del año 1998, en Iquitos, Perú, se evaluaron las pruebas rápidas OptiMal ® y el pfHRP-2 modificado por el Programa de Tecnología Apropiada en Salud (PTAS). Se encontró para el primero una sensibilidad de 97,8% y una especificidad de 93,2%, mientras que para el segundo 97,1% y 97,2%, respectivamente26. Diferencias cualitativas entre estas pruebas atribuyen algunas ventajas relativas a las pruebas basadas en la detección de la pDHL, principalmente por su mayor espectro para detectar tanto P. falciparum y P. vivax, además de permitir conocer la viabilidad del parásito en el paciente en el que se realiza el diagnóstico, cuando se utiliza esta prueba21. Teniendo en cuenta esta capacidad para detectar las dos especies más prevalentes de la malaria en el Perú, así como la relativa facilidad de su realización en el campo por un promotor de salud, se eligió la prueba OptiMal que detecta la pDHL de estas especies de Plasmodium. Los resultados obtenidos en este estudio por los promotores de salud muestran una alta concordancia en la interpretación de sus resultados cuando se comparan estos resultados con los realizados por profesionales de laboratorio, habiéndose encontrado un índice Kappa de 0,689 (buena concordancia) cuando se hicieron las evaluaciones en la primera etapa y un índice Kappa de 0,909 (muy buena concordancia) en las pruebas realizadas durante la segunda etapa, según los parámetros establecidos. Esta mejora en la concordancia del índice Kappa en la segunda etapa con respecto de la primera, probablemente se debe a que los promotores ya estaban familiarizados con la técnica y tenían mayor precisión en la realización del procedimiento, así como en la interpretación de la lectura. Estos resultados son similares a los encontrados por Premji et al 27 en Tanzania utilizando otra prueba diagnóstica rápida, donde muestran una muy buena concordancia en la sensibilidad y especificidad de la pruebas in vivo cuando comparan el procedimiento e interpretación realizados por trabajadores de salud rurales con la del personal de laboratorio entrenado. Otro estudio realizado en la India encontró una sensibilidad de 100% y especificidad de 84,5%28. En ambos casos se utilizaron las pruebas rápidas basadas en la determinación de proteínas ricas en histidina (pfHRP-2) para la detección de P. falciparum, pues son áreas donde la prevalencia de esta especie es muy alta y la utilidad de este tipo de prueba es mayor. En países como el nuestro donde coexisten las infecciones por P. falciparum y P. vivax, es necesario el uso de pruebas que permitan detectar a ambos parásitos. La alta concordancia encontrada con esta prueba demuestra su eficacia como un método apropiado para el diagnóstico de la malaria en zonas rurales de la Amazonia y norte peruano. En el Perú el porcentaje de positividad para la malaria en pacientes febriles con sospecha clínica varía entre 10 y 20%10-11. La presencia de enfermedades febriles, generalmente arbovirosis, y la falta de disponibilidad de un diagnóstico microscópico adecuado inducen a un diagnóstico clínico errado de la malaria, lo cual conduce a un tratamiento y gastos innecesarios en antimaláricos9. Adicionalmente, la aparición de la resistencia a drogas antimaláricas en los últimos años constituye un factor de riesgo por una mayor mortalidad por la malaria, si no se cuenta con diagnóstico y tratamiento oportunos y adecuados. Estos problemas pueden ser superados si se usa una prueba rápida y de fácil aplicación e interpretación, como la utilizada en el presente estudio. Con respecto a la evaluación de costos, Konradsen et al29 en Sri Lanka encontraron que los costos en dólares americanos de tratamientos antimaláricos brindados por los establecimientos de salud centrales eran menores que los brindados en los consultorios móviles y los centros de tratamiento de aldeas ($ 1,29, $ 2,78 y $ 2,04 por caso de malaria tratado, respectivamente), constituyendo las últimas opciones un mayor costo para el estado, pero considerablemente más baratas para las familias. En el Perú, un estudio sobre el impacto económico de la malaria ha mostrado un costo estimado de $ 34 millones de dólares americanos para el año 1998. De esta suma, $ 24 millones (70,3%) corresponde al gasto de las familias, 70% de las cuales son pobres y pierden a causa de la malaria una tercera parte de sus ingresos anuales, principalmente en tiempo perdido y en transporte a los centros de atención30. El contar con un diagnóstico oportuno en el lugar de residencia de los pobladores de áreas rurales permitiría un tratamiento precoz y oportuno. Ello reduciría significativamente el costo que significa la malaria para estas familias, además de la morbimortalidad por esta enfermedad, si consideramos que un factor de riesgo importante para que ello ocurra es el retraso en la administración del tratamiento adecuado. A pesar de todas estas ventajas es importante comentar algunos inconvenientes relativos de las pruebas disponibles actualmente que detectan la deshidrogenasa láctica del Plasmodium. El costo en dólares americanos por prueba es de aproximadamente $ 2,00, el cual es alto si lo comparamos con el costo individual de la gota gruesa, pero este costo aparentemente alto por prueba puede ser relativo si se tiene en cuenta la morbilidad y mortalidad debido al retraso en el tratamiento y el costo que significa la malaria para las familias que residen en áreas rurales de la Amazonia. Si la disponibilidad de estas pruebas es selectivamente ubicada en áreas críticas, representaría un costo justificado. Mills et al15 evaluaron una prueba con el mismo principio de detección del P. falciparum, pero con un menor costo, lo cual haría más accesible a este tipo de pruebas en países pobres donde la malaria es un problema de salud pública. Es necesario realizar estudios económicos complementarios para que la aplicación de esta medida resulte efectiva. Un segundo inconveniente sería la necesidad de cadena de frío para el almacenaje de las tiras reactivas en áreas rurales donde las condiciones son limitadas. Se sabe que actualmente se elaboran tiras reactivas que no requieren este proceso de mantenimiento. Ello permitiría que estas pruebas puedan ser llevadas a tales zonas sin inconvenientes para su mantenimiento ni para la calidad del resultado. Actualmente hay un creciente número de pruebas y en mejoramiento continuo de aspectos como la facilidad de su ejecución, que estarían superando las limitaciones descritas y puedan permitir su aplicación en el campo, particularmente en zonas rurales de la Amazonia, donde las condiciones pueden resultar adversas tanto para mantener sus propiedades primigenias, como para su aplicación efectiva31-32. La capacidad de los promotores de salud para realizar la prueba no constituye un problema. La sola condición de saber leer y escribir, sumado a un entrenamiento breve y simple en la aplicación e interpretación del procedimiento permitiría contar con un diagnóstico adecuado en las áreas donde se desempeñan. Los resultados obtenidos en este estudio pueden ser tomados en cuenta para que mediante el uso de estas pruebas diagnósticas rápidas en áreas rurales seleccionadas mejore el diagnóstico y se brinde un tratamiento oportuno de la malaria, para lo cual es necesario ampliar estudios en las mismas comunidades donde se desempeñan los promotores de salud. En conclusión, encontramos una alta concordancia entre los resultados obtenidos por los promotores de salud al aplicar la prueba rápida OptiMal® frente a los profesionales de laboratorio; existe aceptabilidad y un rápido aprendizaje en el uso de pruebas rápidas para el diagnóstico de la malaria en los promotores de salud de 20 comunidades rurales de Iquitos. En áreas rurales de la selva, con dificultades para el acceso al diagnóstico microscópico, donde además se presentan casos de síndrome febril no diagnosticados, resulta pertinente la aplicación de pruebas diagnósticas rápidas con el fin de brindar un tratamiento antimalárico oportuno y eficaz. AGRADECIMIENTOS Al Dr. Trenton Ruebush del Centers for Disease Control and Prevention (CDC); a los doctores Jaime Chang, Víctor Zamora, Luz Vásquez y Rubén Naupay Guzukuma. REFERENCIAS BIBLIOGRÁFICAS 1. World Health Organization. A global strategy for malaria control. Geneva: WHO; 1993. [ Links ] 2. World Health Organization. A rapid dipstick antigen capture assay for the diagnosis of falciparum malaria. Bull World Health Organ 1996; 74(1):47-54. [ Links ] 3. Wilcox A. Manual for the microscopical diagnosis of malaria in man. Bull Natl Inst Health 1951;180:1-49. [ Links ] 4. Lema OE, Carter JY, Nagelkerke N, Wangai MW, Kitenge P, Gikunda SM, et al. Comparison of five methods of malaria detection in the outpatient setting. Am J Trop Med Hyg 1999; 60(2):177-82. [ Links ] 5. World Health Organization. Implementation of the global malaria control strategy: report of a WHO Study Group. WHO Technical Report Series Nº 839. Geneva: WHO; 1993. [ Links ] 6. Baudon D, Gazin P, Rea D, Carnevale P. A study of malaria morbidity in a rural area of Burkina Faso (West Africa). Trans R Soc Trop Med Hyg 1985; 79(2):283-4. [ Links ] 7. Genton B, Smith T, Baea K, Narara A, al-Yaman F, Beck HP, et al. Malaria: How useful are clinical criteria for improving the diagnosis in a highly endemic area? Trans R Soc Trop Med Hyg 1994; 88(5):537-41. [ Links ] 8. World Health Organization. World Malaria situation in 1994. Part I. Population at risk. Wkly Epidemiol Rec 1997; 72(36):269-74. [ Links ] 9. Perú, Ministerio de Salud. Informe de gestión del Programa Nacional de Control de Malaria y Otras Enfermedades Metaxénicas. Lima: Ministerio de Salud del Perú; 1998. [ Links ] 10. Perú, Ministerio de Salud. Evaluación del Programa de Control de Malaria y Otras Enfermedades Metaxénicas. Iquitos: Región de Salud Loreto; 1999. [ Links ] 11. Perú, Ministerio de Salud. Boletín de malaria, periodo de alta transmisión. Iquitos: Región de Salud Loreto; 1997-1998. [ Links ] 12. Kawamoto F. Rapid diagnosis of malaria by fluorescence microscopy with light microscope and interference filter. Lancet 1991; 337(8735):200-2. [ Links ] 13. Arai M, Mizukoshi C, Kubochi F, Kakutani T, Wataya Y. Detection of Plasmodium falciparum in human blood by a nested polymerase chain reaction. Am J Trop Med Hyg 1994; 51(5):617-26. [ Links ] 14. Beadle C, Long GW, Weiss WR, McElroy PD, Maret SM, Oloo AJ, et al. Diagnosis of malaria by detection of Plasmodium falciparum HRP-2 antigen with a rapid dipstick antigen-capture assay. Lancet 1994; 343(8897):564-8. [ Links ] 15. Mills CD, Burgess DC, Taylor HJ, Kain KC. Evaluation of rapid and inexpensive dipstick assay for the diagnosis of Plasmodium falciparum malaria. Bull World Health Organ 1999; 77(7):553-9. [ Links ] 16. Di Perri G, Olliaro P, Nardi S, Allegranzi B, Deganello R, Vento s, et al. The ParaSight-F rapid dipstick antigen capture assay for monitoring parasite clearance after drug treatment of Plasmodium falciparum malaria. Trans R Soc Trop Med Hyg 1997; 91(4):403-5. [ Links ] 17. Shiff CJ, Premji Z, Minjas JN. The rapid manual ParaSight-F test. A new diagnostic tool for Plamodium falciparum infection. Trans R Soc Trop Med Hyg 1993; 87(6):646-8. [ Links ] 18. Palmer CJ, Validum L, Lindo J, Campa A, Validum C, Makler M, et al. Field evaluation of the OptiMAL rapid malaria diagnostic test during anti-malarial therapy in Guyana. Trans R Soc Trop Med Hyg 1999; 93(5):517-8. [ Links ] 19. Cooke AH, Chiodini PL, Doherty T, Moody AH, Ries J, Pinder M, et al. Comparison of a parasite lactate dehydrogenase-based immunochromatographic antigen detection assay (OptiMal) ® with microscopy for the detection of malaria parasites in human blood samples. Am J Trop Med Hyg 1999; 60(2):173-6. [ Links ] 20. Quintana M, Piper R, Boling HL, Makler M, Sherman C, Gill E, et al. Malaria diagnosis by dipstick assay in a honduran population with coendemic Plasmodium falciparum and Plasmodium vivax. Am J Trop Med Hyg 1988; 59(6):868-71. [ Links ] 21. Piper R, Lebras J, Wentworth L, Hunt-Cooke A, Houze S, Chidini P, et al. Immuno capture diagnostic assays for malaria utilizing Plasmodium lactate dehydrogenase (pLDH). Am J Trop Med Hyg 1999; 60(1):109-18. [ Links ] 22. Palmer CJ, Lindo JF, Klaskala WI, Quesada JA, Kaminsky R, Baum MK, et al. Evaluation of the OptiMal test for rapid diagnosis of Plasmodium vivax and Plasmodium falciparum malaria. J Clin Microbiol 1998; 36(1):203-6. [ Links ] 23. Makler MT, Hinrichs DJ. Measurement of the lactate dehydrogenase actvity of Plasmodium as an assessment of parasitemia. Am J Trop Med Hyg 1993; 48(2):205-10. [ Links ] 24. Instituto Nacional de Salud. Manual de procedimien-tos técnicos para el diagnóstico de malaria. Serie Normas Técnicas Nº. 14. Lima: Instituto Nacional de Salud; 1997. [ Links ] 25. Organización Mundial de la Salud. Manual para el diagnóstico microscópico de la malaria. 4ta ed. Publicación Científica Nro. 276; 1975. [ Links ] 26. Stennies GM, Marquiño W, Pardavé B, et al. Assessment of two immunocromatographic tests for the rapid diagnosis of Plasmodium falciparum and Plasmodium vivax in Iquitos, Perú, 1998. Am J Trop Med Hyg 1998; 59(Suppl):112-3. [ Links ] 27. Premji Z, Minjas JN, Shiff CJ. Laboratory diagnosis of malaria by village health workers using the rapid manual ParaSight-F test. Trans R Soc Trop Med Hyg 1994; 88(4):418. [ Links ] 28. Singh N, Valecha N, Sharma VP. Malaria diagnosis by field workers using an immunochromatographic test. Trans R Soc Trop Med Hyg 1997;91(4):396-7. [ Links ] 29. Konradsen F, Steele P, Perea D, van der Hoek, Amerasinghe PH, Amerasinghe FP. Cost of malaria control in Sri Lanka. Bull World Health Organ 1999; 77(4):301-9. [ Links ] 30. Perú, Ministerio de Salud. Impacto económico de la malaria en el Perú. Lima: Proyecto Vigía; 1999. [ Links ] 31. Craig MH, Bredenkamp BL, Williams CH, Rossouw EJ, Kelly VJ, Kleinschmidt I, et al. Field and laboratory comparative evaluation of ten rapid malaria diagnostic tests. Trans R Soc Trop Med Hyg 2002; 96(3):258-65. [ Links ] 32. Mason DP, Kawamoto F, Lin K, Laoboonchai A, Wongsrichanalai C. A comparison of two rapid field immunochromatographic tests to expert microscopy in the diagnosis of malaria. Acta Trop 2002; 82(1):51-9. [ Links ] Correspondencia: César Cabezas S.
b. Positivo a P. vivax: presencia de una banda control más una banda.
c. Negativo: presencia solamente de banda de control (al inicio de la tira).
Instituto Nacional de Salud.
Dirección: Capac Yupanqui 1400, Jesús María. Lima, Perú.
Teléfono: (511) 471-9920 anexo 127
Correo electrónico: ccabezas@ins.gob.pe