Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Sociedad Química del Perú
versão impressa ISSN 1810-634X
Rev. Soc. Quím. Perú v.77 n.1 Lima jan./mar. 2011
TRABAJOS ORIGINALES
Síntesis de catalizadores nanoestructurados basados en óxido de Mn para la eliminación de n-hexano
Sinthesys of nanostructured catalysts based on Mn oxide for n-hexane elimination
Gino Picassoa* ; María del Rosario Sun Koub ; Ivonne Salazara ; Alcides Lópeza
a Facultad de Ciencias, Universidad Nacional de Ingeniería, Av. Túpac Amaru 210, Rímac, Lima- Perú, gpicasso@uni.edu.pe
b Pontifica Universidad Católica del Perú, Av. Universitaria 1801, San-Miguel, Lima-Perú, msun@pucp.edu.pe
RESUMEN
Se sintetizaron catalizadores nanoestructurados basados en óxidos de Mn por el método solgel y óxidos de Mn másicos por el método de precipitación. Adicionalmente se prepararon catalizadores a base de nanopartículas (NP's) de óxido de Mn soportadas en bentonita (montmorillonita) por impregnación incipiente.
Antes de la calcinación se realizaron algunos análisis TEM a las muestras sintetizadas para observar el efecto peptizante del ácido acético. Las micrografías revelaron que la muestra preparada a partir del precursor nitrato de manganeso (0,06M) presentó la mayor monodispersión. Luego de la calcinación de las NP's, se realizó un estudio para evaluar el grado de dispersión obtenida por la acción peptizante del ácido acético. Las micrografías TEM de las muestras preparadas a partir de precursor nitrato revelaron que el efecto peptizante aumentó al incrementarse la concentración de ácido acético. El análisis XRD mostró que las muestras másicas y las nanoparticuladas de óxido de Mn presentaron picos de difracción correspondientes a las especies Mn2O3, Mn3O4 y MnO2 con presencia mayoritaria de Mn2O3 y la espinela Mn3O4. Finalmente, los óxidos de Mn nanoparticulados se incorporaron a la estructura de la bentonita purificada (montmorillonita) por impregnación incipiente.
Los óxidos de Mn másicos y soportados fueron probados como catalizadores en la combustión de nhexano en un reactor de lecho fijo. La muestra nanoparticulada soportada en bentonita mostró menor actividad que la del óxido de Mn puro, pero mayor respecto a la actividad obtenida con el soporte (arcilla bentonita) sin componente activo, debido posiblemente al grado de dispersión de las nanopartículas de óxido de Mn dentro de la estructura laminar de la bentonita de partida.
Palabras clave: Óxido de Mn nanoparticulado, sol-gel, bentonita, combustión de n-hexano.
ABSTRACT
Nanostructured Mn oxide based catalysts were synthesized by solgel method and corresponding bulk samples were prepared by precipitation procedure. In addition, some nanostructured samples based on Mn oxide supported on bentonite (montmorillinite) were prepared by incipient impregnation.
Prior to calcination, the system was submitted by TEM analysis in order to study the peptizating effect of acetic acid.
Some essays with the unsupported and supported samples were performed for nhexane combustion in a fixed bed reactor. Activity of bentonite supported sample was lower than its unsupported bulk sample counterpart; however the performance was higher than the corresponding to the support without active component probably due to more suitable structure position of nanoparticles into layered framework of starting bentonite.
Key words: Nanosized Mn oxide, sol-gel, bentonite, combustion of n-hexane.
INTRODUCCIÓN
La eliminación total de los compuestos orgánicos volátiles (COV's), como nhexano, sin generación de subproductos o intermedios de reacción, requiere de tecnologías altamente eficaces que garanticen su remoción a la menor temperatura posible con el subsiguiente ahorro energético. La combustión catalítica es una alternativa eficiente para el tratamiento de COV's respecto la incineración térmica debido fundamentalmente a: 1) las bajas temperaturas de operación, evitando de esta manera la contaminación secundaria, y 2) las altas conversiones alcanzadas en el proceso1. Para este trabajo, los óxidos de manganeso son, entre los compuestos metálicos de transición, los materiales más eficientes y amigables con el medio ambiente. Entre sus características más relevantes están: (i) La presencia de varios estados de oxidación, permitiendo una buena movilidad del oxígeno superficial. (ii) Suficiente estabilidad térmica. (iii) Presentan buena resistencia al envenenamiento por haluros, y (iv) poca volatilidad2. Los óxidos de Mn presentan una estructura típica de la bertolita2 con oxígenos lábiles en la red permitiendo al Mn actuar como agente reductor: Mn2+Mn3+ Mn4+ o como agente oxidante Mn4+Mn3+ Mn2+. Se ha mostrado también que los óxidos de Mn con estructura tipo espinela de valencia mixta (Mn3O4) han presentado mayor eficiencia como catalizador combustor que MnO2, Mn2O3, debido posiblemente, a interacciones de intercambio electrónico en los orbitales "d" que controlan el paramagnetismo en el material3,4. Dicho óxido mixto, Mn3O4, ha sido empleado como un catalizador en diversas reacciones de oxidación y reducción; por ejemplo, en la oxidación de metano y de monóxido de carbono5 y en la reducción catalítica selectiva del nitrobenceno6. Además, la aplicación catalítica del Mn3O4 se ha extendido para la combustión de compuestos orgánicos por ser catalizadores activos y estables a temperaturas entre 373 y 773 K7.
Catalizadores basados en otros óxidos, como Mn2O3, han sido aplicados para remover monóxido de carbono y óxidos de nitrógeno de los tubos de escape de autos8 y como agente almacenador de oxígeno9. El óxido α-Mn2O3 (bixbita) ha sido usado como catalizador combustor ya que puede absorber oxígeno y actuar en una atmósfera oxidante, como semiconductores tipo "p"; ello debido a la posibilidad del catión Mn de tener diferentes estados de oxidación.
Varios estudios han mostrado que el método de preparación de catalizadores basados en óxidos de Mn, ya sea en forma pura10, soportada en arcillas modificadas con Al y Zr11 y promocionada con metales alcalinos12, tienen una gran importancia en la eficiencia de la reacción de combustión de los COV`s. Sin embargo, la investigación sobre catalizadores basados en óxidos de Mn nanoparticulados para la combustión de COV's es bastante limitada, aunque se encuentran algunos trabajos relacionados con la preparación de nanocristales de óxidos de Mn puros13, soportados en sílica14 y como material dopante de óxidos de Sn15
El objetivo de este trabajo está orientado a la obtención de catalizadores activos, térmicamente estables y selectivos hacia el CO2. Con este fin, se han preparado catalizadores basados en óxidos de Mn másicos y nanoparticulados soportados sobre bentonita que es una arcilla natural. El uso de la arcilla como soporte se debió a que podría lograrse una mejor dispersión de las nanopartículas del óxido de Mn sobre la estructura laminar de la arcilla lo que podría influir en el aumento de la eficiencia de la reacción de combustión de nhexano. En este estudio, la elección del compuesto orgánico volátil (nhexano) fue realizada considerando primero, su gran amplia aplicación como disolvente en la industria química y segundo, por el interés de reducir su concentración residual por debajo de los límites permisibles, en ambientes laborales cerrados. Este trabajo ha considerado también el estudio de la influencia que podía presentar la estructura cristalográfica de las muestras, el tamaño de la partícula y el rol de la bentonita como soporte en la actividad de los catalizadores.
PARTE EXPERIMENTAL
Preparación de las nanopartículas de óxido de Mn
Las nanopartículas (NP's) de óxido de Mn fueron sintetizadas por el método solgel16 mediante una hidrólisis forzada empleando un álcali, NaOH, que fue adicionado gradualmente a las soluciones de las sales precursoras de Mn empleadas en este trabajo: Mn (NO3)2 .4H2O (MERCK, 98,5%) y Mn (COOCH3)2.4H2O (MERCK, 99,5%), respectivamente.
En ambos casos se usó NaOH(ac) como agente precipitante empleando una relación molar estequiométrica de sal precursora:álcali de 1:2 con el objeto de producir una hidrólisis forzada del sistema y favorecer el proceso de nucleación. Para controlar la precipitación de los óxidos se utilizó una solución de ácido acético al 60% en volumen (agente peptizante) preparado a partir de ácido acético glacial (BAKER, 99,8%). La peptización se realizó a un pH comprendido entre 2,5 y 3,5; intervalo en el cual se obtuvo buena dispersión en todos los sistemas estudiados. La calcinación de todas las muestras se realizó con una velocidad calentamiento de 2ºC por min y empleando la siguiente secuencia de calentamiento (rampa) a partir de la temperatura ambiental: 100ºC por 30 min, luego 200 ºC por 30 min y finalmente 300 ºC por 2 h. Con fines de comparación se preparó una muestra másica de óxido de Mn por precipitación a partir de un precursor nitrato y una solución amoniacal (PANREAC, solución amoniacal 1415%), como agente precipitante.
Un compendio de las concentraciones de las soluciones precursoras, así como del volumen del agente peptizante y el pH final del proceso de peptización se muestra en la tabla 1.
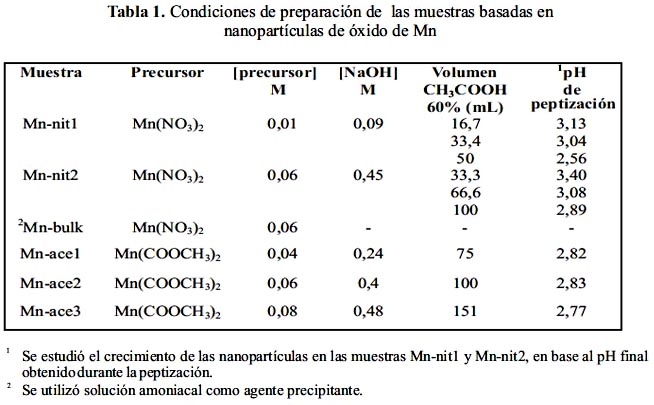
Preparación de las muestras soportadas
Preparación y purificación de la arcilla
Se trabajó con una bentonita suministrada por la empresa Agregados Calcáreos (Perú) cuyos análisis previos mostraron que se correspondía con una arcilla sódica con alto contenido de montmorrillonita, de color pardo claro, con una capacidad de cambio catiónico (CEC) de 60 meq/100 g de arcilla seca. Posteriormente, este material fue sometido a diversos procesos de purificación (para eliminar impurezas como feldespatos, cuarzo, mica y materia orgánica), y sedimentación controlada para obtener la fracción montmorrillonítica pura menor de 2 micras.
Incorporación de las nanopartículas de óxido de Mn sobre la arcilla
La incorporación de las nanopartículas de óxido de Mn sobre la arcilla se realizó por impregnación; para ello se partió de una suspensión de arcilla (1g. de arcilla por 50 mL de agua destilada), a la cual se agregó en pequeñas proporciones la suspensión acidificada que contenía las nanopartículas de óxido de Mn; la mezcla fue mantenida bajo agitación constante a temperatura ambiente, evitando de esta manera la formación de grumos. La cantidad de arcilla por precursor se calculó manteniendo una relación constante de metal/arcilla de 4 mmol/g16. La mezcla se calentó hasta 35ºC y se mantuvo en agitación con un tiempo de contacto de aproximadamente 24 h . Luego, el producto final obtenido fue filtrado y secado a 100ºC por 30min. Finalmente, el material resultante se calcinó en las mismas condiciones que las muestras no soportadas.
Un compendio de las condiciones experimentales utilizadas en la preparación de las muestras soportadas se encuentra en la tabla 2.

Caracterización y evaluación de la actividad catalítica
Los equipos empleados para realizar la caracterización textural (superficie específica-SBET, tamaño de poros e isoterma de adsorción) fueron: Pulse Chemisorb 2700 y Micromeritics modelo ASAP 2000. En todos los casos se utilizó N2 como adsorbato a la temperatura del nitrógeno líquido (196 °C). Previo a la adsorción, las muestras fueron desgasificadas al vacío durante una noche a 200 °C.
El análisis estructural fue efectuado mediante difracción de rayos X (XRD) en un difractómetro de la marca Rugaku/Max System. El equipo está provisto de un ánodo rotatorio. Se utilizó un monocromador de grafito con el objeto de seleccionar la radiación CuKα del ánodo de cobre (λ=1,5418 Å) y se trabajó con ángulos de barrido entre 3 y 100º, a una velocidad de corrimiento de 0,04 º/s.
Para determinar el tamaño de las nanopartículas se utilizó un microscopio electrónico de transmisión (TEM, transmission electron microscopy) Modelo Philips EM 300G que tiene un límite de resolución ideal para detectar nanopartículas en el rango 5 – 30 nm. La energía de los electrones fue de 80 KeV. El protocolo experimental aplicado a las muestras fue el siguiente: Se preparó una solución conteniendo las nanopartículas, la cual fue sometida a ultra sonido por 5 minutos y luego fue depositada sobre una rejilla especial para el microscopio electrónico que posee una membrana de soporte de parlodion para homogenizar la suspensión. El equipo fue calibrado usando nanopartículas deAu como muestra patrón.
Los ensayos para evaluar la actividad de los catalizadores en la combustión catalítica de nhexano se llevaron a cabo en un reactor tubular de cuarzo de 8 mm de diámetro interno y 300 mm de longitud, introducido en un horno eléctrico que operaba a presión atmosférica. En todos los ensayos se cuidó de establecer las condiciones de reacción que garantizarán ausencia de resistencias difusionales (externa e interna) a la transferencia de materia. La posibilidad de formación de puntos calientes en el lecho catalítico fue reducido gracias a la dilución de la masa del catalizador (100 mg) con 200 mg de cuarzo pulverizado hasta el mismo rango de tamaño de partícula que el de los catalizadores (160 – 320 μm). Aproximadamente en el centro del lecho (de unos 10 mm de longitud), se insertó un termopar para la medida y el control de la temperatura de reacción.
Todos los ensayos se realizaron con una concentración inicial de nhexano de 2000 ppmv en aire sintético (Praxair, 99,999%) y una velocidad espacial basada en la masa de catalizador y caudal total (WHSV) de 80 h1. El sistema experimental utilizado para la alimentación del compuesto orgánico volátil (nhexano), así como el método de análisis ha sido descrito en trabajos previos17, 18.
RESULTADOS Y DISCUSIÓN
Caracterización físico química de las muestras
Los catalizadores calcinados resultantes de diferentes condiciones de preparación fueron analizados por XRD para conocer la evolución de las fases cristalinas. En la figura 1 se presentan los difractogramas obtenidos con la muestra de óxido de Mn másico (Mnbulk), nanoparticulado (Mnnit2) y soportado en bentonita (Mnnit2/b). Los difractogramas de las dos primeras muestras revelaron la presencia de picos de difracción correspondientes a las especies Mn3O4, Mn2O3 y MnO2 (fichas: JCDS 80
-0382 para Mn3O4, JCDS 33-0900 para Mn2O3 y JCDS 24-0735 para MnO2), indicando que las condiciones de preparación de los catalizadores han conducido a la formación de un sistema multifàsico que confirmó la naturaleza multivalente del Mn. En la figura 1 se observa, además, que los picos de difracción de mayor intensidad corresponden a las fases mayoritarias Mn2O3 y Mn3O4, que confirma resultados obtenidos en trabajos previos18, 19.
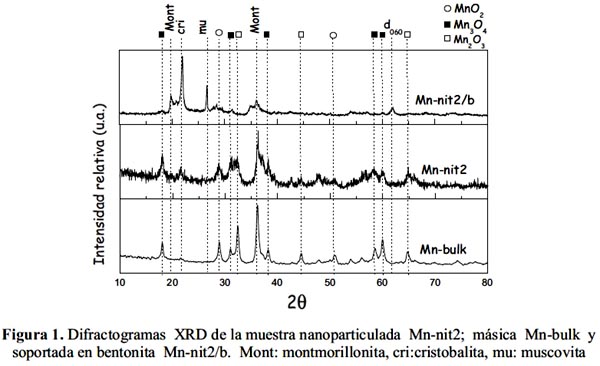
La comparación de los difractogramas XRD de la muestra másica (Mnbulk) con la obtenida de su homóloga nanoparticulada (Mn
-nit2), muestra en el primero una mejor definición de los picos de difracción y un mayor tamaño de los granos cristalinos que refleja mayor crecimiento de las partículas en contraste con la muestra nanoparticulada (menos cristalina), posiblemente el menor tamaño de la partícula se debió a la presencia del peptizante que mitigó el crecimiento de grano luego de la etapa de nucleación.El análisis XRD de la muestra soportada sobre bentonita (Mnnit2/b) reveló la presencia de picos de difracción que correspondían a una arcilla esmectítica del tipo montmorillonita (fichas ASTM 13-259 y 29-1498), con presencia en bajas concentraciones de otros minerales huéspedes: muscovita, cristobalita que pueden estar presentes en la arcilla natural. No se ha observado en este último caso picos característicos al óxido de Mn, indicando probablemente que las partículas del óxido de Mn estarían dispersas en la estructura laminar de la arcilla y que el tamaño de las partículas fue lo suficientemente pequeño para no ser detectadas por la técnica XRD.
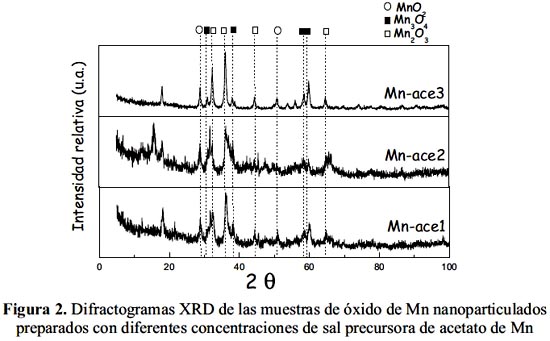
En la figura 2 se presentan los difractogramas de las nanopartículas de óxido de Mn preparadas con diferente cantidad de sal precursora de acetato de Mn. Como se observa, las muestras con pequeñas cantidades de acetato (0,04 y 0,06 M) aparentemente no afectan la forma del perfil del difractograma; sin embargo, la muestra Mn-ace3 con mayor cantidad de acetato (0,08 M) presenta los picos mejor definidos, indicando una mayor cristalización del grano. Por tanto, se puede establecer que la mayor presencia de precursor acetato en la etapa de preparación mejora la formación de las diferentes fases del Mn, haciendo que la estructura sea más cristalina.
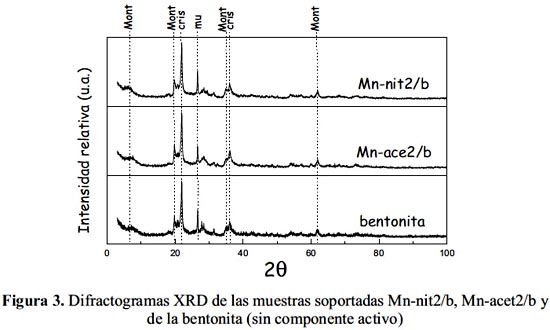
En la figura 3 se comparan los difractogramas XRD de las muestras Mn-ace2/b y Mn-nit2/b, preparadas con diferentes sales precursoras y soportadas en bentonita. Como se observa, los difractogramas de las muestras Mn-ace2/b y Mn-nit2/b son similares al de la bentonita. De este análisis se puede inferir que el tipo de sal precursora de Mn usado en la síntesis de las NP's no ha modificado la estructura cristalográfica matriz de la arcilla de partida.
Con el fin de evaluar la evolución del tamaño de las nanopartículas en solución durante la síntesis a partir del precursor de la sal de nitrato y previo a la calcinación de las muestras, se realizó mediante la técnica TEM (figura 4), un estudio del efecto peptizante del ácido acético evaluándolo en función al grado de dispersión y tamaño de las partículas.
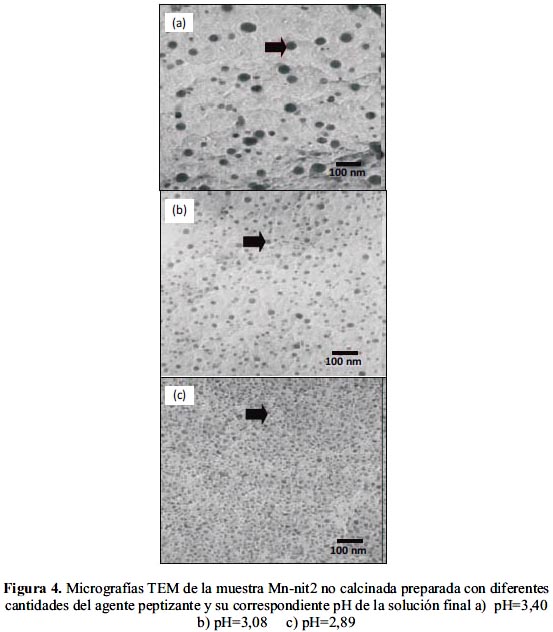
Como se observa en la figura 4, en el caso de la muestra Mn-nit2 no calcinada, el tamaño de partícula disminuye de 43 nm pasando por 23 nm hasta llegar finalmente a 17 nm cuando el pH de la solución fue de 3,40; 3,08 y 2,89, respectivamente; es decir, el efecto peptizante se incrementa con la formación de partículas más pequeñas al aumentarse la concentración de ácido acético. Se ha seleccionado la muestra Mn-nit2 frente a la muestra Mn-nit1 por la mayor monodispersión de partículas obtenida y por generar un menor tamaño promedio de las partículas dispersas con la adición del agente peptizante.
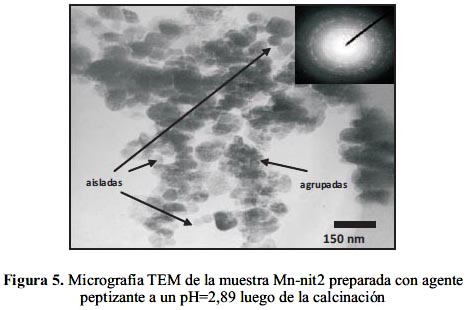
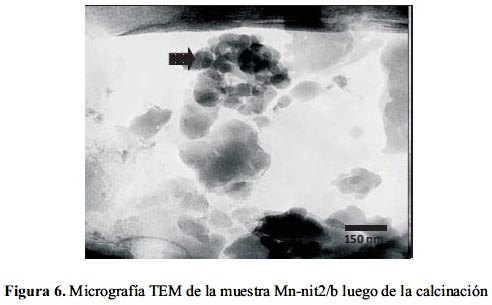
El tamaño de las partículas de los óxidos aumentó por efecto térmico hasta 50 nm (figura 5) después de realizada la calcinación de la muestra Mn-nit2 con pH=2,89 (figura 4c). Este tamaño se mantuvo también para las nanopartículas de óxido de Mn depositadas sobre la estructura de la bentonita (figura 6).
En forma similar, se realizó el estudio de la evolución del tamaño de partícula en las muestras preparadas a partir del acetato de Mn después de la calcinación. Como se observa en las figuras 7, 8 y 9, el tamaño promedio de partícula crece de 15 nm en la muestra obtenida con 0,04 M de acetato de Mn, hasta aproximadamente 20-25 nm en la muestra con 0,06 M de acetato para finalmente crecer hasta 50 nm en la muestra preparada a partir de 0,08 M (comportamiento similar al obtenido por el ion nitrato).


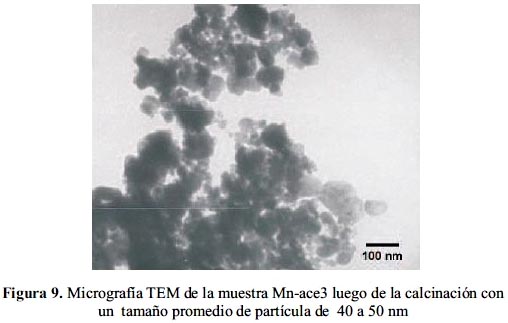
Los resultados indican que el tamaño de partícula aumentó a medida que la concentración del acetato se incrementó, ello debido posiblemente a un menor control del proceso de la hidrólisis. Por tanto, el tamaño promedio de partícula de las muestras calcinadas preparadas a partir de la sal de acetato de Mn fue dependiente de la concentración del precursor.
Al comparar las micrografías TEM de las muestras Mn-nit2 con Mn-ace2 (figuras 5 y 8), ambas calcinadas y preparadas a partir de la misma concentración del agente precursor, se observa en el primer caso mayor monodispersión de partículas esferoidales en contraste con la polidispersión de partículas de forma no definida en las muestras preparadas con ion acetato, aunque ambos poseen en promedio un tamaño similar. Adicionalmente, se encontró que el ion nitrato presentaba una mayor capacidad para producir una hidrólisis más rápida, por ser mejor grupo saliente que el ion acetato. Por estas razones, en los ensayos de actividad para la combustión de hexano fue seleccionada la muestra preparada a partir de 0,06 M de nitrato de Mn (Mn-nit2) como catalizador.
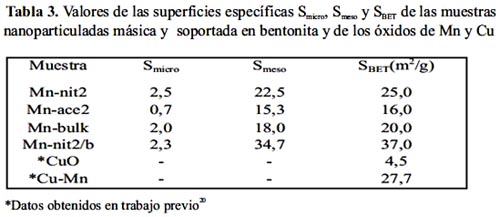
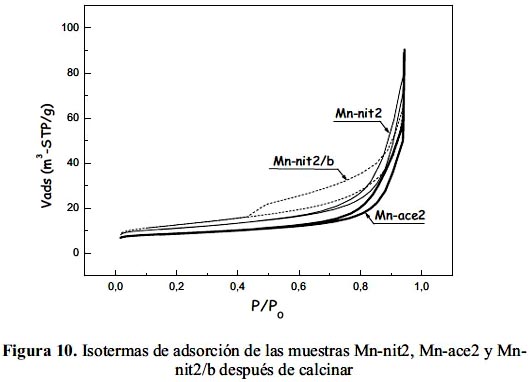
Los valores de la superficie BET de las muestras nanoparticuladas calcinadas Mn-nit2 y Mn-ace2 y soportada en bentonita Mn-nit2/b se presentan en la tabla 3. Las muestras Mn-nit2 y Mn-ace2 no soportadas presentaron una isoterma típica correspondiente a una superficie mesoporosa de tipo IV (según clasificación de la IUPAC) y el ciclo de histéresis se asoció al tipo H1 correspondiente a poros cilíndricos. Todas las muestras presentaron muy poco microporosidad, en especial la preparada con acetato (Mn-ace2). La muestra nanoparticulada preparada a partir de precursor nitrato (Mn-nit2) presentó una superficie mayor respecto a la del acetato (Mn-ace2), por lo que constituyó un argumento adicional para su aplicación en los ensayos catalíticos. Por otro lado, la isoterma de la muestra soportada Mn-nit2/b también fue del tipo IV pero el ciclo de histéresis fue del tipo H3 correspondiente a un material mesoporoso con poros laminares (figura 10). Dicha muestra soportada también mostró tener mayor área superficial que las dos anteriores, lo que sería lógico considerando la estructura laminar de la arcilla de partida. Adicionalmente, en la tabla 3 se ha incluido los datos de la superficie específica del óxido de cobre (CuO) y del óxido mixto equimolar CuMn preparados por coprecipitación a partir de precursor nitrato (obtenidos en trabajo previo20), en este caso se observa que el sistema formado por el óxido mixto ha presentado mayor área superficial que los óxidos simples de Mn (Mn-bulk) y de Cu (CuO).
Estudio de la actividad catalítica en la combustión de nhexano
Se realizaron algunos ensayos con óxido de Mn másico fresco (sin ensayo previo) para verificar la actividad y estabilidad del sistema en la combustión de nhexano. Como se observa en la figura 11, la muestra de óxido de Mn luego de 24 h de contacto y mantenida a T=240 ºC (correspondiente a 50% de conversión), presentó pérdida de actividad, evidenciado por el desplazamiento de la curva de ignición hacia temperaturas mayores. Después de 48 y 72 h de contacto, las curvas obtenidas fueron similares en esta muestra, comportamiento que también se observó en trabajo previo19 para un catalizador másico de óxido de Mn calcinado a 350 ºC por 3 h.
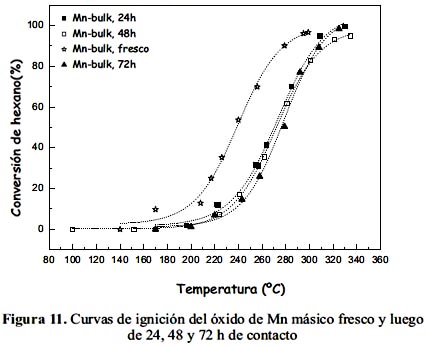
Por otro lado, a pesar de que el catalizador presentaba una estructura conformada por diferentes fases o multifase (observado en los XRD de la figura 1), los ensayos de actividad han mostrado que pierde estabilidad debido posiblemente a procesos de sinterización y/o la formación de residuos carbonosos en la superficie del catalizador19. Es necesario resaltar que en este catalizador de Mn, la combustión completa de nhexano se obtuvo a una temperatura menor de 300 ºC (figura 11), indicando que fue comparativamente más activo que un catalizador de cerio (CeO2), un óxido también reducible y estudiado en trabajo previo para la misma reacción en la que se obtuvo temperaturas mayores a 300°C19. La mayor actividad de los catalizadores de óxido de Mn se explica por las propiedades rédox del Mn y la facilidad de almacenamiento de oxígeno en la estructura del óxido20.
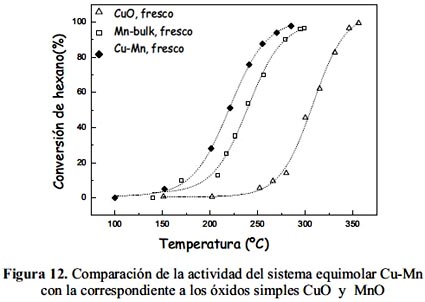
Con fines comparativos se realizaron ensayos con el catalizador conformado por el sistema mixto equimolar Cu-Mn preparado en trabajo previo20 para verificar el rol de la interacción Cu-Mn en el sistema mixto. La actividad de la muestra fresca Cu-Mn comparada con la obtenida a partir de catalizadores de óxidos simples fue mayor como se muestra en la figura 12. Esto revela el efecto sinérgico favorable del Cu con el Mn en la estructura del óxido, además de una mayor superficie específica del óxido mixto presente respecto a la de los óxidos simples (tabla 3).
A pesar que el sistema Cu-Mn pierde actividad después de un tiempo de contacto de 24 h a la T = 220 ºC en atmósfera de reacción, ésta no es severa y comparativamente la muestra es más activa que los catalizadores análogos másicos basados en óxidos simples que estuvieron también 24 horas en atmósfera de reacción, como se observa en la figura 13. Se realizó otro experimento (no se muestran los resultados) a T=345 ºC (95% de conversión) hasta el día siguiente y no se observó mayor desactivación.
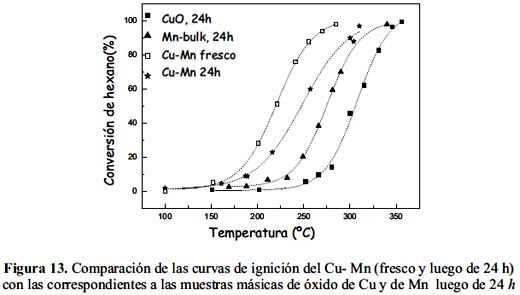
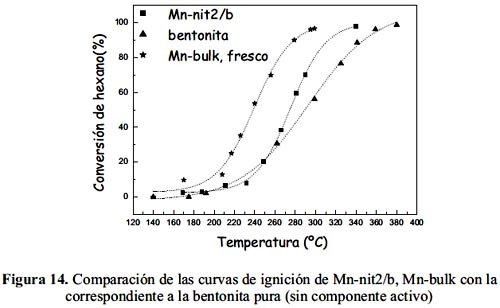
La muestra Mn-nit2/b soportada en bentonita fue más activa que el soporte solo (arcilla bentonita), lo que indica que la dispersión de la fase activa en una estructura laminar y porosa, contribuye favorablemente en la actividad (figura 14). Sin embargo, la muestra Mn-bulk fresca resultó ser más activa inicialmente que la muestra soportada Mn-nit2/b (figura 14), que es explicable considerando que el componente activo en la muestra másica se encuentra en estado puro y en mayor cantidad que en la muestra soportada nanoparticulada donde se encuentra más disperso. Sin embargo, como se pudo observar la muestra másica pierde actividad (figura 11), en tanto que la muestra soportada no presentó pérdida de actividad luego de 24 h en atmósfera de reacción, por lo que desde el punto de vista de estabilidad térmica la aplicación del catalizador Mn-nit2/b podría resultar prometedor en este tipo de reacción.
CONCLUSIONES
Se han sintetizado nanopartículas basadas en óxido de Mn por el método sol-gel considerando diversas variables experimentales en la preparación: tipo de precursor, concentración inicial de reactantes y cantidad de agente peptizante, que influyeron en el tamaño y dispersión de las mismas.
El análisis XRD reveló la composición policristalina en todas las muestras calcinadas (nanoparticuladas y másicas) conformado por las especies Mn2O3, Mn3O4 y MnO2 con presencia mayoritaria de Mn2O3 y de la espinela Mn3O4. En la muestra nanoparticulada soportada en bentonita, el difractograma XRD mostró que se trataba de una bentonita sódica pero no se evidenció la presencia del componente metálico (óxido de Mn), ni alteración de la estructura matriz de la arcilla, lo que indicaría una buena dispersión del componente activo en la estructura laminar
En el caso de las muestras calcinadas preparadas a partir de precursor acetato, el análisis TEM reveló que el tamaño y polidispersión obtenida fue dependiente de la concentración inicial del precursor mientras que las preparadas a partir de precursor nitrato presentó una tendencia hacia la monodispersión y el tamaño promedio final de las partículas luego de la calcinación fue de 50 nm.
Todas las muestras presentaron una superficie mesoporosa, presentando mayor área específica la muestra soportada en bentonita (Mn-nit2/b).
Los ensayos de actividad en la combustión de nhexano mostraron que el catalizador másico presentó pérdida de actividad luego de 24 h de contacto en atmósfera de reacción. La actividad fue mayor en el catalizador basado en óxido mixto equimolar de Cu-Mn incluso luego de permanecer 24 h en atmósfera de reacción. El catalizador de óxido de Mn nanoparticulado soportado en bentonita mostró tener menor actividad que el óxido de Mn másico pero presentó mayor estabilidad térmica.
AGRADECIMIENTO
Los autores agradecen al CONCYTEC (PROYECTO PROCYT 3102009CONCYTEC OAJ) y al Instituto de Investigación de la Facultad de Ciencias de la Universidad Nacional de Ingeniería por la ayuda financiera otorgada a este trabajo. También se extiende el agradecimiento a la Pontificia Universidad Católica del Perú y a la Universidad de Zaragoza por el apoyo logístico para la preparación de las muestras y la realización de los ensayos de actividad de los catalizadores.
BIBLIOGRAFÍA
1. Spivey J., Complete catalytic oxidation of volatile organics, Ind. Eng. Chem. Res. 26, 2165-2180 (1987).
2. Garetto T., Legorburu I., Montes M, editores. Eliminación de emisiones atmosféricas de COV's por catálisis y adsorción. Monografía multiautoral. Programa CYTED, pag. 37-49 (2008).
3. Hasan M.A., Zaki M.I., Paupelety L., Kumasi K., Promotion of the hydrogen peroxide decomposition activity of manganese oxide catalysts, Appl. Catal. A. 181, 171-179 (1999).
4. Delimaris D., Ioannides T., VOC oxidation over Mn-Ox–CeO2 catalysts prepared by a combustion method, Appl. Catal. A. 84, 303-312 (2008).
5. Stobbe E.R., De Boer B.A., Geus J.W., The reduction and oxidation behaviour of manganese oxides, Catal. Today 47, 161-167 (1999).
6. Grootendorst E., Verbeek Y., Ponec V., The role of the Mars and Van Krevelen mechanism in the selective oxidation of Nitrosobenzene and the deoxygenation of nitrobenzene on oxidic catalysts, J. Catal. 157, 706-712 (1995).
7. Baldi M., Finocchio E., Milella F., Busca G., Catalytic combustion of C3 hydrocarbons and oxygenates over Mn-3O4, Appl. Catal. B 16, 43-51 (1998).
8. Zhang H. M., Teraoka Y., Yamazoe H., Effects of preparation methods on the methane combustion activity of supported Mn-2O3 and LaMn-O3 catalysts, Catal. Today 6, 155-162 (1989).
9. Chang Y.F., McCarty J.G., Novel oxygen storage components for advanced catalysts for emission control in natural gas fueled vehicles, Catal. Today 30, 163-170 (1996).
10. Santos V.P., Pereira M.F.R., Órfão J.J.M., Figueiredo J.L., The role of lattice oxygen on the activity of manganese oxides towards the oxidation of volatile organic compounds, Appl. Catal. B, 99, 353-363 (2010).
11. Gandía L. M., Vicente M. A., Gil A., Complete oxidation of acetone over manganese oxide catalysts supported on aluminaand zirconiapillared clays, Appl. Catal. B: Environ. 38, 295-307 (2002).
12. Kim S.C., Shim W.G., Catalytic combustion of VOCs over a series of manganese oxide catalysts, Appl. Catal. B, 98, 180-185 (2010).
13. Yang L.X., Zhu Y.J., Tong H., Wang W.W., Cheng G.F., Low temperature synthesis of Mn-3O4 polyhedral nanocrystals and magnetic study, J. Solid State Chemistry 179, 1225-1229 (2006).
14. Todorova S., Kolev H., Holgado J.P., Kadinov G., Bonev Ch., Pereñíguez R., Caballero A, Complete nhexane oxidation over supported Mn–Co catalysts, Appl. Catal. B, 94, 46-54 (2010).
15. Tian Z.M., Yuan S.L., Je J.H., Li P., Zhang S.Q., Wang C.H., Wang Y.Q., Yin S.Y., Liu L., Structure and magnetic properties in Mn doped SnO2 nanoparticles synthesized by chemical coprecipitation method, J. Alloys and Compounds 466, 26-30 (2008).
16. Li J., Mu Z., Xu X., Tian H., Duan M., Li L., Hao Z., Qiao S., Lu G., A new and generic preparation method of mesoporous clay composites containing dispersed metal oxide nanoparticles, Microporous and Mesoporous Materials 114, 214–221, (2008).
17. Picasso G., Sun Kou M.R., Gómez G., Hermoza E., López A., Pina M.P., Heguido J., Catalizadores nanoestructurados basados en óxidos de Fe para la combustión de nhexano, Revista de la Sociedad Química del Perú, v. 75, Nº 2, p. 163-176 (2009).
18. Picasso G., Gutiérrez M., Pina M. P., Herguido J. Preparation and characterization of CeZr and CeMn based oxides for nhexane combustion: Application to catalytic membrane reactors, Chem. Eng. J. 126, 119-130 (2007).
19. Picasso G., Tesis para obtener el grado de Doctor en Ciencias Químicas: "Combustión de compuestos orgánicos volátiles en reactores de membrana catalítica mesoporosa basados en óxidos metálicos. Estudio cinético y simulación", Universidad de Zaragoza (2005).
20. Picasso G., Sun Kou M.R., Pina M.P., Herguido J., Irusta S., López de Castillo R., Apolinario G., Arzamendi G., Gandía L, Eliminación de etilmetilcetona en lecho fijo con óxidos mixtos equimolares de FeMn y CuMn másicos y soportados en arcillas modificadas, Revista de la Sociedad Química del Perú, v. 73, Nº 2, p. 66-84 (2007).
Recibido el 19-11-2010
Aprobado el 12-01-2011













