Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Sociedad Química del Perú
versão impressa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.81 no.4 Lima out./dic. 2015
TRABAJOS ORIGINALES
Síntesis de catalizadores basados en Co-Mn para la combustión de n-hexano
Synthesis of catalysts based on Co-Mn oxides for combustion of n-Hexane
Gino Picassoa*, José Quijanoa, Rosario Sun Koub
a Laboratorio de Investigación de Fisicoquímica (LABINFIS). Facultad de Ciencias. Universidad Nacional de Ingeniería. Av. Túpac Amaru 210. Rímac. Lima-Perú *gpicasso@uni.edu.pe
b Sección Química. Departamento de Ciencias. Pontifica Universidad Católica del Perú. Av. Universitaria 1801. San Miguel. Lima 32
RESUMEN
La combustión catalítica de n-hexano se ha estudiado utilizando diversos óxidos mixtos basados en Co-Mn por las propiedades rédox de estos materiales. Los catalizadores se prepararon mediante el método de co-precipitación usando un tiempo de envejecimiento 24 h, partiendo de precursores a base de nitrato de Co2+ y Mn2+, en las proporciones molares Co/Mn de 5; 2; 1; 0,5 y 0,2. Los óxidos obtenidos fueron caracterizados por sorción de N2, por difracción de rayos X (XRD), por espectroscopía infrarroja de transformada de Fourier (FTIR) y por reducción a temperatura programada (TPR). Las isotermas de sorción de N2 indicaron que son materiales micro-mesoporososo con poros tipo cilíndricos. El análisis XRD reveló la presencia de fases cristalinas correspondientes a las especies mixtas tipo espinela MnCo2O4 y tetragonal, atribuido a (CoMn)(CoMn)2O4. El análisis FTIR mostró señales desplazadas combinadas en las muestras mixtas, reflejando interacción metálica. El análisis TPR reveló mejor reducibilidad en las muestras mixtas comparado con los oxidos simples puros. Las curvas de ignición mostraron que el enriquecimiento de Co en la composición del catalizador mejoró la actividad, siendo el catalizador Co/Mn=5 el más activo, debido probablemente a la mejor superficie y mejor reducibilidad alcanzada.
Palabras clave: Combustión catalítica, n-hexano, Co-Mn.
ABSTRACT
Catalytic combustion of n-hexane was studied over various mixed oxides based on Co-Mn by the redox properties of these materials. The catalysts were prepared by coprecipitation applying an aging time of 24h, from nitrate precursor of Co2+ and Mn2+ with molar Co/Mn ratios corresponded to 5; 2; 1; 0,5 and 0,2. The oxides were characterized by N2 sorption (BET technique), X-ray diffraction (XRD), infrared Fourier transform spectroscopy (FTIR) and temperature programmed reduction (TPR). The isotherms of N2-sorption were of type IV corresponded to micro-mesoporous material, with the presence of cilindric pores. X-ray analysis revealed the presence of mixed phases corresponding to spinel MnCo2O4 and tetragonal (CoMn)(CoMn)2O4. FTIR spectroscopy showed combined signals in the mixed samples, revealing metallic interaction. TPR analysis showed better reducibility in mixed samples in relation with the simple ones. The ignition curves for Co-Mn samples depicted better activities with the enrichment of Co compound in mixed samples, being the sample Co/Mn=5 the most efficiency, probably attributable to the best surface and the highest reducibility.
Keywords: Catalytic combustion, n-hexane, Co-Mn.
INTRODUCCIÓN
Los compuestos orgánicos volátiles (COV´s) son considerados como una clase importante de contaminantes del aire, que se definen según la Comisión Económica para Europa de las Naciones Unidas del año 1991 como "Compuestos orgánicos producidos por el hombre, distintos del metano, que son capaces de producir oxidantes fotoquímicos por reacción con óxidos de nitrógeno en presencia de luz solar". La oxidación catalítica es una de las más importantes y prometedoras opciones para la eliminación de los COV´s, porque los procesos se realizan a temperaturas de operación menores de 500°C, disminuyendo drásticamente la presencia de óxidos de nitrógeno generados por la contaminación térmica1.
El n-hexano es un líquido incoloro, volátil, inflamable (Teb=68,7ºC), con olor característico, similar a la gasolina. Es un disolvente altamente inflamable muy usado en reacciones de polimerización y en la formulación de algunos productos adhesivos, lacas, cementos y pinturas. Es un componente importante de la gasolina de automóviles, muy utilizado como desnaturalizante de alcohol y en termómetros para temperaturas bajas en lugar de mercurio. Su presencia en la atmósfera está regulada por normas ambientales en la mayor parte de los países2 y en el Perú, se realiza a través del Ministerio de Salud (MINSA)3. Por esta razón, el desarrollo de métodos para eliminar n-hexano es pertinente y necesario.
Los óxidos de manganeso presentan propiedades catalíticas atribuidas a la habilidad del Mn de formar óxidos dentro de un amplio rango de estructuras y fases cristalinas (β- MnO2, γ- MnO2, α-MnO2, γ-Mn2O3, α-Mn2O3 y Mn5O8), donde los átomos de Mn se encuentran en diferentes estados de oxidación. Los óxidos de manganeso son también conocidos por su capacidad de almacenar oxígeno en su red cristalina y por la formación de estructuras sólidas amorfas, que presentan vacancias y promueve las reacciones de oxidación4. Se ha estudiado la oxidación del dióxido de manganeso para la combustión catalizada de metano, y se sugirió que una alta concentración de Mn3+ podría resultar en enlaces Mn-O débiles, lo que podría asegurar una buena actividad catalítica5. Catalizadores basados en otras especies de óxidos de Mn soportados en zirconia, como Mn2O3, han sido aplicados para remover monóxido de carbono y óxidos de nitrógeno de los tubos de escape de autos5 y como agente almacenador de oxígeno6,7. El óxido α-Mn2O3 también ha sido usado como catalizador y combustor ya que puede absorber oxígeno y actuar en una atmósfera oxidante, debido a la posibilidad del catión Mn+3 de enlazarse formado diferentes centros activos7,8.
Por otro lado, los óxidos de cobalto se presentan como los materiales más prometedores en la remoción de CO debido a la presencia de oxígeno móvil en la estructura de la espinela Co3O49. La alta actividad de este óxido en la oxidación de CO es atribuida a la débil fuerza en el enlace Co-O, la cual crea una fácil interacción entre los oxígenos de la red cristalina con los reactantes9,10. Entre las especies de óxidos de cobalto, se reportó que el Co3O4 es un buen candidato para la combustión catalítica, evaluándose su actividad para diferentes COV´s11. Al comparar los trabajos realizados con óxidos de cobalto en diferentes soportes se encontró que los catalizadores de Co3O4 soportados en ZrO212, tienen mayor actividad en comparación con los catalizadores de Co3O4 soportados en Al2O313. Se estudiaron, además, sistemas Co3O4/ CeO2 y Co3O4/ CeO2-ZrO2 con un 30% (en peso) de la espinela, encontrándose que la ceria y la ceria-zirconia ayudan a dispersar la fase activa sobre el soporte y promueven la oxidación a baja temperatura14-15. La literatura señala que los óxidos tipo Co3O4 constituyen los mejores catalizadores para la oxidación catalítica de tolueno y de propeno16.
También se ha reportado que las estructuras tipo hidrotalcitas, preparadas por la modificación de la composición química de los óxidos, tanto de manganeso como de cobalto con cobre, han presentado mejores actividades respecto a los óxidos simples, para la combustión catalítica de COV´s17. Adicionalmente, los complejos metálicos del tipo Cu/CoMgAl y Mn-Co-Al han mostrado buena actividad catalítica para la combustión completa de etanol y tolueno18,19 y en forma similar los sistemas tipo Co-O-Mn, tuvieron un buen comportamiento catalítico en la combustión completa de tolueno20.
En este trabajo se preparó catalizadores basados en óxidos mixtos de Co-Mn por co-precipitación, empleando bicarbonato de sodio y nitrato de amonio como agentes precipitantes, con un tiempo de envejecimiento de 24h. El objeto de este trabajo fue determinar la influencia del efecto sinérgico de los componentes del catalizador en las propiedades catalíticas, así como de las variables experimentales de la síntesis, en la formación de la fase activa de los catalizadores, en su estructura cristalina y características texturales, para poder obtener un sistema mixto activo, selectivo y estable en la reacción de combustión completa de n-hexano.
PARTE EXPERIMENTAL
Materiales de partida
Los reactivos de partida usados para la preparación de los catalizadores basados en óxidos mixtos de Co-Mn, se detallan en la Tabla 1.
Preparación de los catalizadores
Se preparó catalizadores basados en óxidos mixtos de Co-Mn mediante el método de co-precipitación a partir de soluciones molares de 0,10M a base de sales de Co2+ y Mn2+ (ecuación 1), mezclados en cantidades predeterminadas para obtener las muestras mixtas de Cox Mnycon las relaciones molares Co/Mn correspondientes a 5; 2; 1; 0,5 y 0,2. Las soluciones de las sales metálicas se precipitaron con ayuda de soluciones 0,1M de NaHCO3 y NH4NO3 18-20 (ecuación 2). La solución metálica mixta preparada se agitó, teniendo una primera serie agitando durante 4 h y otra durante 1 hora a un pH entre 7 a 8,5, correspondiente a la precipitación total para los diferentes óxidos, usando un pHmetro digital con un electrodo de referencia de plata/cloruro de plata (Ag/AgCl). Se dejó envejecer durante 24h, luego se filtró al vacío los polvos obtenidos (bomba de vacío BODECO Germany R-300), enjuagándolos con 100 mL de agua destilada por 4 veces para remover los restos de iones sodio Na+ que puedan quedar en el precipitado. Luego, el sólido remanente se enjuagó con etanol para eliminar algún compuesto orgánico presente en la superficie, se secó a 25°C durante 24h en ambiente deshidrantante. Finalmente, se calcinó en aire en un horno TERMOLINE TZ4ST, precalentado inicialmente a 250°C hasta la temperatura de 550°C durante 4h, empleando una rampa de calentamiento de 10°C/min. Las reacciones químicas correspondientes fueron las siguientes:
Co(NO3)2.6H2O + Mn(NO3)2.4H2O + H2O(l) → Co2+ + Mn2++ 4NO3 - + 11H2O(l) Ec. 1
xCo2++yMn2++2NH4NO3+2NaHCO3 → ↓Co x Mny + 2CO3 2- +2Na++2NH4 ++2H++2NO3 Ec.2
Los óxidos obtenidos fueron representados como Cox Mny, donde "x" e "y" representan la composición molar correspondiente al cobalto y al manganeso, respectivamente. Los métodos de caracterización empleados con las muestras fueron los siguientes:
Análisis termogravimétrico (TGA)
Se aplicó la técnica TGA para el registro de manera continua de la pérdida de masa del carbonato producido en la ecuación (2), en función de la temperatura; el análisis se realizó en atmósfera controlada de nitrógeno. Se utilizó un equipo SDT Q600 V 20,9, utilizando una masa inicial de muestra de 25 a 50 mg, con una rampa de temperatura de 20°C hasta 800°C y con una velocidad de calentamiento de 5°C/min.
Sorción de N2 (método BET)
La técnica de sorción de N2 sirve para la medición de la superficie específica; para este ensayo se utilizó un equipo Micromeritics GEMINI-VII serie t, ubicado en el Laboratorio de Investigación de Fisicoquímica de la Facultad de Ciencias (LABINFIS-UNI). Se utilizó N2 como gas de análisis (N2, 99%) y nitrógeno líquido con punto de ebullición a 77 K como refrigerante. Los puntos de equilibrio se obtuvieron siguiendo el programa GAS MICROMERITICS con un total de 30 a 50 puntos y con un tiempo de equilibrio de 6s en cada punto. Previo a la adsorción, las muestras fueron desgasificadas en ambiente inerte durante 2 h a 250 °C.
Espectroscopía infrarroja con transformada de Fourier (FTIR)
La técnica FTIR se usó para la identificación de los grupos funcionales y modos de vibración presentes en las muestras preparadas en forma de pastilla con KBr. Se utilizó un espectrómetro FTIR marca IR Prestige21 Shimadzu, ubicado en la Facultad de Ciencias (UNI), cuyo espectro se obtuvo con el programa ACD/SpecViewer, registrando los picos característicos de enlaces que presenten resonancia en un amplio rango de longitud de onda entre los 4000 a 400 cm-1 y con una resolución de 4 cm-1.
Difracción de rayos X (XRD)
La técnica XRD se utilizó para la identificación cristalográfica de las fases cristalinas presentes en las muestras. El análisis XRD se realizó en un equipo RIGAKU Modelo Miniflex, ubicado en el IPEN, con tubo de Cu y filtro de Ni, con 30kV y 15mA; se usó un monocromador de grafito con el objeto de seleccionar la radiación CuKα del ánodo de cobre, y se ha trabajado con ángulos de barrido entre 5 y 100º con una velocidad del goniómetro de 0,04 º/s.
Análisis de temperatura programada de reducción (TPR)
Los experimentos de reducción a temperatura programada (TPR) se realizaron en un equipo Micromeritics CHEMISORB 2720, ubicado en LABINFIS-UNI. Las medidas se realizaron con las muestras pretratadas a 200 ºC por 2h en ambiente inerte para extraer el agua e impurezas y luego calentando las muestras desde 25 hasta los 900 °C en atmósfera reductora (10% de H2 en N2) y con una rampa de calentamiento de 10ºC por minuto. Para la calibración del instrumento se usó una muestra de Ag2O estandarizada, que presenta un pico característico de consumo de H2 a 140 ºC.
Medición de la actividad catalítica
La actividad de los óxidos mixtos se evaluó en un reactor de lecho fijo, consistente en un tubo de cuarzo con frita del mismo material donde se colocó 100 mg de catalizador mezclado con 200 mg de cuarzo, para mitigar los puntos calientes. La corriente de alimentación al reactor se obtuvo con una serie de saturadores a 0ºC para obtener una concentración inicial de n-hexano de 2000 ppm con una velocidad espacial respecto a la masa de 80 h-1 y un flujo de alimentación de 100mL/min. Los flujos de gas en régimen estacionario se fijó en el sistema de reacción mediante reguladores másicos ALICAT, previamente calibrados, que registran los flujos digitalmente. Los productos de la reacción catalítica se analizaron con el detector FID del cromatógrafo de gases VARIAN GC-450, usando una columna empacada CARBOWAX. Las curvas de ignición se obtuvieron graficando la relación entre la temperatura de combustión y el porcentaje de conversión de n-hexano a CO2 y H2O. En este trabajo no se observó productos de combustión incompleta. El esquema detallado del equipo se ha mostrado en un trabajo previo21.
RESULTADOS Y DISCUSIÓN
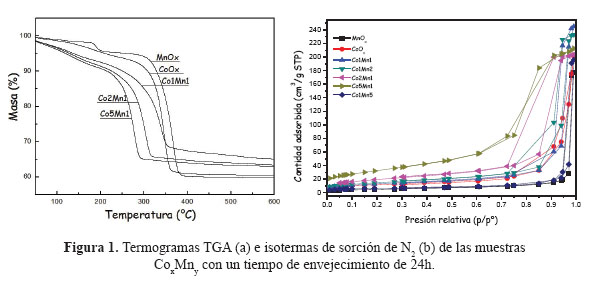
Los análisis termogravimétricos se realizaron en atmósfera inerte de N2, con el objetivo de determinar la temperatura de descomposición de los carbonatos y su transformación en óxidos (Ec.3). Los termogramas TGA de las muestras con un tiempo de envejecimiento de 24h se presentan en la Figura 1a.
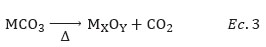
Como se observa en la Figura 1a, la temperatura de descomposición de los carbonatos se encuentra entre 300 a 400°C. Por esta razón, la temperatura de calcinación fijada para todas las muestras fue de 550 ºC, considerando que a partir de esta temperatura no se observó pérdida de masa en ninguna de las muestras. Como ejemplo representativo, el porcentaje de pérdida de masa, así como las reacciones de descomposición del óxido mixto Co1Mn2 con las correspondientes a los óxidos puros CoOx y MnOx se presentan en la Tabla 2. Se observa que los porcentajes de pérdidas de masa teóricos coinciden, en general, con los experimentales.
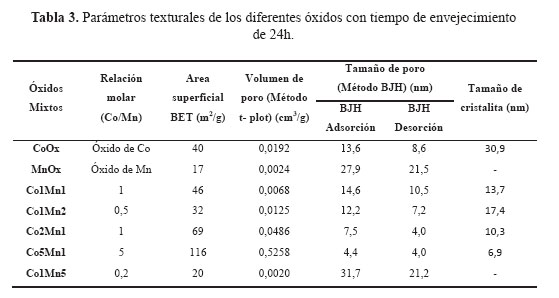
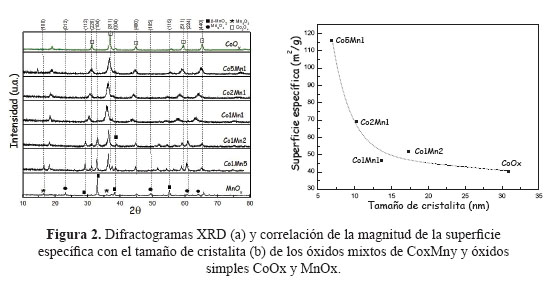
En la Tabla 3 se presentan los resultados de las superficies específicas de los catalizadores basados en óxidos mixtos Cox Mny con un tiempo de envejecimiento de 24h. En todas las muestras, las isotermas de sorción de N2 son del tipo IV correspondientes a materiales micro-mesoporosos con mayor presencia de poros cilíndricos (Figura 1b). Como se observa de la Tabla 3, existe una tendencia a incrementarse la superficie específica con el aumento del contenido molar de cobalto, llegando a un valor máximo de 116 m2/g para la muestra Co5Mn1 en comparación con las muestras Co1Mn1 y Co2Mn1 que presentan una superficie específica de 46 y 69 m2/g, respectivamnente. Además, con estos catalizadores (Co1Mn1, Co2Mn1, Co5Mn1) se observa que con el incremento del contenido de Co se produce una disminución de tamaño de poro debido posiblemente a la formación de especies de Co más pequeñas (Tabla 3).
Los difractogramas XRD de las muestras Cox Mny se presentan en la Figura 3a. El XRD correspondiente al óxido puro de cobalto CoOX presenta los picos caracteristicos a 2Ө = 31,37; 36,88; 44,87; 59,39 y 65,29 que corresponden con la formación de la espinela Co3O4 (JCPDS card nº. 43-1003), con ausencia de la fase CoO. Los picos de difracción de las muestras Co5Mn1, Co2Mn1, Co1Mn1, Co1Mn2, Co1Mn5 presentan un corrimiento hacia menores ángulos a medida que aumenta la composición molar de Mn en la estructura, con la consiguiente expansión del parámetro de red de la celda unitaria debido posiblemente al mayor tamaño de las especies Mn+2 (r=0,080 pm) y Mn+3 (r=0,066 pm) frente a las especies más pequeñas Co+2 (r=0,072 pm) y Co+3 (r=0,063pm), formando una estructura espinela poco distorsionada22. En las muestras Co1Mn1, Co2Mn1, Co5Mn1, la distorsión se puede verificar por la disminución del tamaño de la cristalita (Figura 3b) con el aumento del contenido de Co, a diferencia de las muestras Co1Mn2, Co1Mn5, ricas en Mn, que presentaron una cristalinidad similar a la espinela Co3O4. Se observó una buena correlación de la reducción de la superficie específica con el tamaño de cristalita (Figura 3b). Otra carácterística importante es el aumento de la superficie específica del sistema Cox Mny respecto al correspondiente a MnOx, que es poco cristalino (Tabla 3, fig.2). Las distorsiones observadas en los difractogramas de las muestras CoxMny respecto a la espinela Co3O4 son un indicativo de la ausencia de una segregación de las fases, lo que permite poder descartar la formación de una mezcla simple de óxidos individuales.
El XRD correspondiente a la muestra MnOX presenta al óxido de manganeso puro con los picos de difracción a 2Ө = 28,9; 33,5; 37,3 y 56,8 que corresponden a la fase pirolusita β -MnO2 (PDF-00-004-0779, pirolusita), a la fase tipo hausmanita Mn3O4 (JCPDS N° 24-0734), las señales 2Ө = 18,5; 35,7 y 58,1 también son atribuidas a la fase Mn5O8 (JCPDS N° 39 a 1218)23, pero estas señales se solapan en las otras especies de óxido de manganeso.
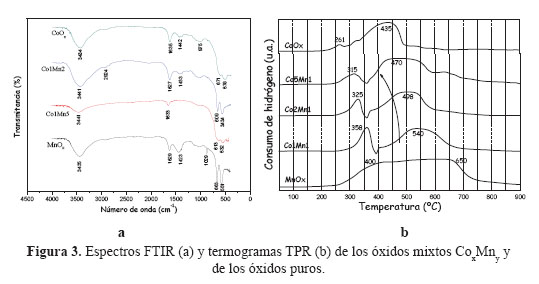
Los espectros FTIR de los óxidos CoxMny se muestran en la Figura 3a, en donde se observa un pico ancho aproximadamente a 3500 cm-1, que se atribuiye a los modos vibracionales de los grupos OH- unidos a las capas de Mn y Co18. Se observa una pequeña banda (≈2924 cm-1), que se debe a la unión del hidrógeno del agua con los aniones carbonatos remantes CO32-. Los picos entre 1423 y 1442 cm-1 se pueden atribuir a la vibración antisimétrica de CO32-. Las bandas de CO se desplazan para reducir los números de onda cuando el cobalto sustituye progresivamente al Mn.
La banda ancha alrededor de los 875 cm-1 en Co1Mn2, CoOx y MnOx, es asignada al ángulo de deformación H-O-H de las moléculas de agua formadas en la capa intermedia de los óxidos.
Los picos observados en la región entre 550-600 cm-1 se atribuye a la vibración tensional Co+3-O y en la región 650-700 cm-1, a la vibración tensional Co+2-O. El ligero corrimiento de los espectros FTIR en las muestras mixtas respecto a la muestra CoOx hacia menores frecuencias se puede atribuir a una disminución en la fuerza del enlace Co-O en Co3O4, que es otro indicativo de la presencia de especies mixtas Co-Mn24.
Los termogramas TPR correspondientes a los óxidos mixtos se diferencian sustancialmente de su contraparte atribuidos a los óxidos puros (Figura 3b). El perfil TPR de MnOx muestra una banda ancha en lugar de picos diferenciados que puede ser debido a la reducción del MnO2 en varios estadios de oxidación21. En el caso del CoOx, el TPR muestra la presencia de 2 picos: uno pequeño, a 261ºC y otro bastante ancho, a 435ºC, correspondiente a la reducción del Co+3 a Co+2 y del Co+2 a Co, respectivamente.
Los TPR de los óxidos mixtos presentan 2 picos, como en la muestra Co1Mn1 que se desplazan a menores temperaturas a medida que aumenta la composición del Co en la muestra mixta, ello indicaría que con el aumento de Co se mejora el grado de reducibilidad de los óxidos mixtos. La evolución en los termogramas se podría atribuir a la reducción de las diferentes especies del sistema mixto, y no con la reducción de una segregación de óxidos puros, confirmando el análisis XRD discutido anteriormente.
Actividad catalítica
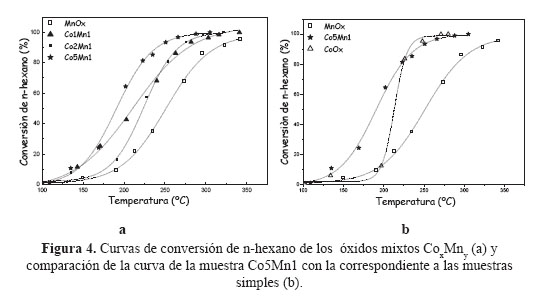
En la Figura 4a se presenta las curvas de ignición en la combustión de n-hexano obtenidas con los óxidos mixtos de Co-Mn con un tiempo de envejecimiento de 24h. Se observa una mayor actividad en los catalizadores con un mayor contenido de Co en la estructura del óxido mixto, debido posiblemente a un aumento de la superficie específica, por ejemplo en las muestras MnOx, Co1Mn1, Co2Mn, Co5Mn1, las superficies son 17, 46, 69 y 116, respectivamente (Tabla 3). Adicionalmente, comparando los TPR del MnOx puro con el Co5Mn1 se observa una mejora en el nivel de reducibilidad (Figura 3b) que facilita la participación del oxígeno de red del catalizador promocionando la combustión completa del n-hexano. En referencia al CoOx puro, a pesar que la superficie del mismo es mucho menor que la correspondiente al Co5Mn1 (40 vs 116 m2/g), las temperaturas de combustión completa del n-hexano son similares (Figura 4b). En este caso, el factor controlante no parece ser la superficie sino la conformación estructural de la espinela formada y la facilidad de transferir oxígeno estructural, que se verificó por las menores temperaturas de reducción de la muestra CoOx respecto a la muestra Co5Mn1 (Figura 3b). Adicionalmente, un aspecto importante, como apuntan algunos autores 23,24, es el método de preparación que favoreció la formación de especies finamente divididas de CoOx en gran proporción con la formación simultánea de especies Co+2 y Co+3 y el enriquecimiento en especies de oxígeno superficial, factores que han contribuido a un aumento en la capacidad de reducibilidad de estas muestras.
CONCLUSIONES
1. Se han prepararon óxidos mixtos basados en Co-Mn por el método de co-precipitación con tiempo envejecimiento de 24h, que ha permitido obtener áreas superficiales BET mayores conforme la proporción molar de Co aumenta en la composicón del óxido. El análisis TGA permitió obtener la temperatura a la cual los carbonatos se descomponen, siendo esta temperatura alrededor de los 400°C.
2. El espectro FTIR de los óxidos mixtos mostró picos caracteristicos en la región entre 550-700 cm-1, que representan los modos de vibración de los enlaces Co+3-O y Co+2-O en posiciones desplazadas respecto a los espectros FTIR del óxido puro CoOx. Los difratogramas XRD revelaron la formación de una estructura tipo espinela para el óxido de cobalto puro y una estructura espinela poco distorsionada en los óxidos mixtos, lo que al parecer ha sido adecuada para mejorar su actividad catalítica. El análisis TPR de las muestras mixtas mostró una tendencia al aumento en la reducibilidad con el aumento de la composición molar del Co, confirmando la presencia de especies mixtas en diferentes estados de oxidación.
3. Las curvas de ignición mostraron una mayor actividad en los catalizadores con mayor presencia del Co en la composición molar del óxido mixto debido probablemente al aumento de la superficie específica y de la capacidad reductora obtenida.
AGRADECIMIENTO
Los autores agradecen al Instituto de Investigación (IGI-UNI) y a la Facultad de Ciencias de la Universidad Nacional de Ingeniería por la subvención económica recibida para la realización de este trabajo.
BIBLIOGRAFÍA
1. Everaert K., Baeyens J., Catalytic combustion of volatile organic compounds, J. Hazard. Mater. 2004; 109 (1-3): 113–139.
2. Norma Oficial Mexicana NOM-047-SSA1-2011, Salud ambiental- Indices biológicos de exposición para el personal ocupacionalmente expuestos a sustancias químicas.
3. MINSA, Decreto Ministerial N° 07-048071-002 que contiene los límites permisibles y efectos sobre la salud de sustancias químicas (n- hexano).
4. Kim S., Shim S., Catalytic combustion of VOC´s over a series of manganese oxide catalysts, Appl. Catal. B 2010; 98: 180–185.
5. Zhang H. M., Teraoka Y., Yamazoe H., Effects of preparation methods on the methane combustion activity of supported Mn2O3 and LaMn-O3 catalysts, Catal. Today. 1989; 6, 155-162.
6. Craciun R., Nentwick B., Hadjiivanov K., Knozinger H., Structure and redox properties of MnOx/Yttrium-stabilized zirconia (YSZ) catalyst and its used in CO and CH4 oxidation, Appl. Catal. A 2003; 243: 67–79
7. Chang Y.F., McCarty J.G., Novel oxygen storage components for advanced catalysts for emission control in natural gas fueled vehicles, Catal.Today 1996; 30, 163-170.
8. Lamaita L., Peluso M., Sambeth J., Thomas H., Mineli G., Porta P., A theoretical and experimental study of manganese oxides used as catalysts for VOCs emission reduction. Catal. Today 2005; 107:133–138.
9. Lou Y., Wang L., Zhao Z., Zhang Y., Lu G., Guo Y., Low-temperature CO oxidation over Co3O4-based catalysts: Significant promoting effect of Bi2O3 on Co3O4 catalyst, Appl. Catal. B 2014; 146: 43- 49.
10. T. Garcia, S. Agouram, J.F. Sanchez-Royo, R. Murillo, A.M. Mastral, A. Aranda, I. Vazquez, A. Dejoz, B. Solsona, Deep oxidation of volatile organic compounds using ordered cobalt oxides prepared by a nanocasting route, Appl. Catal. A 2010; 386: 16–27
11. Hosseini A., Niaei A., Salari D., Nabavi S., Nanocrystalline AMn2O4 (A = Co, Ni, Cu) spinels for remediation of volatile organic compounds—synthesis, characterization and catalytic performance, Ceram. Int. 2012; 38: 1655-1661
12. Wyrwalski F., Lamonier J.F., Siffert S., Gengembre L., Aboukais A., Modified Co3O4/ZrO2 catalysts for VOC emissions abatement, Catal. Today 2007;119: 332–337.
13. Konova P.,Stoyanova M., Naydenov A., Christoskova S., Mehandjiev D., Catalytic oxidation of VOCs and CO by ozone over alumina supported cobalt oxide, Appl. Catal. A 2006; 298: 109–114.
14. Todorova S., Kadinov G., Tenchev K., Caballero A., Holgado J., Catalysts for n-Hexane and CO Oxidation for Co3O4+CeO2/SiO2, Catal. Lett. 2009; 129: 149–155.
15. Tang C., Kuo C.C., Kuo M., Wang C.B., Chien H.B., Influence of pretreatment conditions on low-temperature carbon monoxide oxidation over CeO2/Co3O4 catalysts, Appl. Catal. A 2006; 309: 37–43.
16. Fierro J.L.G. (Ed.), Metal oxides.Chemistry and Applications, CRC Press, New York, (2006).
17. Aguilera D., Perez A., Molina R., Moreno S., Cu–Mn and Co–Mn catalysts synthesized from hydrotalcites and their use in the oxidation of VOCs, Appl. Catal. B 2011; 104: 144–150.
18. Perez A., Montes M., Molina R., Moreno S., Cooperative effect of Ce and Pr in the catalytic combustion of ethanol in mixed Cu/CoMgAl oxides obtained from hydrotalcites, Appl. Catal. A 2011; 408: 96–104.
19. Castaño, M., Molina, R., Moreno, S., Mn–Co–Al–Mg mixed oxides by auto-combustion method and their use as catalysts in the total oxidation of toluene, J. Mol. Catal. A 2013; 370: 167– 174.
20. Li J., Liang, S., Hao J., Catalytic performance of manganese cobalt oxides on methane combustion at low temperature, Appl. Catal. B 2009: 307-312.
21. Picasso G., Cruz R., Sun Kou R., Preparation by co-precipitation of Ce-Mn based catalysts for combustion of n-hexane, Mat. Res. Bull. 2015; 70: 621-632.
22. Puértolas B., Smith A., Vázquez I., Dejoz A., Moragues A., Garcia T., Solsona B., The different catalytic behavior in the propane total oxidation of cobalt and manganese oxides prepared by a wet combustion procedure, Chem. Eng. J. 2013; 229: 547–55851–60.
23. Todoroba, S., Kolev H. Holgado J.P., Kadinov G., Bonev Ch., Pereñiguez R., Caballero A., Complete n-hexane oxidation over supported Mn-Co catalysts. Appl. Catal. B 2010; 94: 46-54.
24. Todoroba, S., Naydenov A., Kolev, H., Holgado, J.P., Ivanov, G., Kadinov G., Caballero A., Mechanism of complete n-hexane oxidation on silica supported cobalt and manganese catalysts. Appl. Catal. A 2012; 413-414: 43-51.
Recibido el 08-12-2015
Aprobado el 14-12-2015