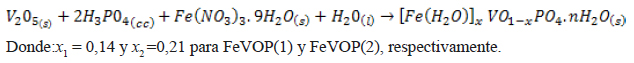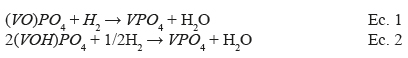Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Sociedad Química del Perú
versão impressa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.85 no.1 Lima jan./mar. 2019
TRABAJOS ORIGINALES
Preparación de catalizadores basados en vanadil fosfatos de Fe soportados sobre γ-Al2O3 para la deshidrogenación oxidativa del etano
Preparation of catalysts on Fe vanadyl phosphates supported on γ-Al2O3 for oxidative dehydrogenation of ethane
Iván Baldeón, Rosario Sun-Koub, Gino Picassoa*
a Laboratorio de Investigación de Fisicoquímica (LABINFIS-UNI), Facultad de Ciencias, Universidad Nacional de Ingeniería, Av. Túpac Amaru 210, Rímac, Lima, Perú, *gpicasso@uni.edu.pe
b Departamento de Ciencias - Sección Química. Pontificia Universidad Católica del Perú. Avenida Universitaria 1801 - Lima 32.
RESUMEN
Se han preparado catalizadores basados en vanadil fosfatos para la deshidrogenación oxidativa (ODH) de etano a etileno. Los catalizadores másicos VOP (VOPO4.2H2O), FeVOP(1) (Fe0.14VO0.86PO4) y FeVOP(2) (Fe0.21VO0.79PO4) fueron sintetizados por el método de Ladwig que consiste en la preparación del vanadilfosfato en reflujo con el ácido fosfórico. Los catalizadores soportados sobre γ-Al2O3 (FeVOP-Al) fueron preparados mediante el método de impregnación húmeda incipiente. A partir de los resultados de XRD, los catalizadores másicos presentaron estructuras cristalinas descritas por el ordenamiento de los tetraedros de PO4 y de los octaédricos VO6. El análisis TPR reveló que la introducción del Fe a la estructura del VOP forma especies menos reducibles, y en el caso de los soportados, el incremento de la fase activa aumentó linealmente con el consumo de H2. La influencia del soporte de γ-Al2O3 en los catalizadores preparados basados en hierro vanadil fosfato permitió la formación de centros activos y selectivos a etileno en la reacción ODH del etano, como consecuencia de la formación de sitios ácidos débiles e intermedios y a interacciones catalizador-soporte. La actividad y selectividad a etileno en la mejor muestra soportada creció hasta 46,8 y 27,3 % frente a un valor de 9,8 y 21,4 % en la muestra másica equivalente.
Palabras clave: FeVOP, ODH, etano, selectividad a etileno.
ABSTRACT
Catalysts based on vanadyl phosphates have been prepared for the oxidative dehydrogenation (ODH) of ethane to ethylene. The bulk catalysts VOP (VOPO4.2H2O), FeVOP(1) (Fe0.14VO0.86PO4) and FeVOP(2) (Fe0.21VO0.79PO4) have been synthesized by the Ladwig method, which consists in the preparation of vanadyl phosphate under reflux with phosphoric acid. The catalysts supported on γ-Al2O3 (FeVOP-Al) were prepared by the wet impregnation method. From XRD, the bulk catalysts presented crystalline structures described by the arrangement of the tetrahedral of PO4 and of the octahedral VO6. The TPR analysis revealed that the introduction of Fe to the structure of the VOP forms less reducible species and in the case of the supported samples, the increase of the active phase linearly increased the consumption of H2. The γ-Al2O3 support to the iron-vanadyl-phosphate catalysts allowed the formation of ethylene and active centers in the ODH of ethane due to the formation of weak and intermediate acid sites and the catalyst-support interactions. The activity and selectivity of reaction to ethylene in the best supported sample increased up to 46,8 and 27,3% against the equivalent bulk catalyst that was 9,8% and 21,4 %.
Key word: FeVOP, ODH, ethane, selectivity to ethylene.
INTRODUCCIÓN
El etileno es una materia prima importante para la industria química, que tradicionalmente es producido por craqueo a vapor a partir de etano, que es el segundo hidrocarburo con mayor presencia en el gas natural después del metano1. Sin embargo, el craqueo a vapor adolece muchas limitaciones como son las elevadas presiones y temperaturas de trabajo2. Una alternativa prometedora a este proceso es la deshidrogenación oxidativa (ODH) del etano mediante catalizadores basados en óxidos metálicos, que permite minimizar los gastos de energía y presión3. La reacción catalítica de ODH de alcanos inferiores, tales como etano, propano y butano resulta atractiva debido al interés en la explotación eficiente de los alcanos.
Un factor clave en la preparación de catalizadores eficientes para la reacción ODH de alcanos es el aislamiento de los sitios activos; por lo tanto, la sustitución isomorfa de especies activas de metal, por ejemplo, vanadio, en materiales microporosos y mesoporosos es una estrategia atractiva para el diseño de nuevos catalizadores para esta reacción. El principal inconveniente de estos sistemas es que no siempre mantienen la estructura si se incorporan altos contenidos de metal; además, las especies vanadio incorporados a veces pueden ser retirados fácilmente de la estructura durante la reacción. En muchos casos, el catalizador se ha conseguido simplemente depositando la fase activa por impregnación sobre soportes con alta área superficial como γ-alumina4.
Óxidos de vanadio-fósforo se emplean como catalizadores en varias reacciones de oxidación de hidrocarburos5,6. Los nuevos materiales obtenidos por sustitución de grupos de ortofosfato de vanadio con metales trivalentes tales como Fe3+ tienen propiedades catalíticas interesantes, mejorando la actividad catalítica de los sistemas de VOP en reacciones de oxidación7. Las propiedades físico-químicas de los catalizadores también han sido investigadas con el fin de definir las características que determinan los mejores rendimientos catalíticos8.
Catalizadores de óxido de vanadio y fósforo han sido investigados para la deshidrogenación oxidativa parcial de hidrocarburos ligeros. Las especies juegan un papel importante en la abstracción de átomos de alcanos. Sin embargo, fases de vanadil fosfato han recibido menos atención en la deshidrogenación oxidativa de alcanos. Algunos trabajos detallan información de la correlación entre las propiedades físico-químicas y la actividad catalítica en la ODH de etano a etileno con el uso de catalizadores basados en vanadil fosfato (VOP)9.
Se han aplicado en trabajos anteriores catalizadores a base de vanadio para deshidrogenación oxidativa de etano10-13, que mostraron buena actividad y eficiencia. Este trabajo tiene como objetivo el desarrollo y la aplicación de catalizadores basados en hierro vanadil fosfato, soportados en γ-alúmina para la obtención de etileno a partir de la deshidrogenación oxidativa de etano. Este trabajo propone estudiar la influencia en la actividad y selectividad a etileno de la concentración de hierro y vanadio en el catalizador másico y de los porcentajes de carga metálica en el catalizador soportado en γ-alúmina. Con este objetivo, se usó un reactor de lecho fijo tubular en el cual se deposita el catalizador entre rellenos de lana de cuarzo para retener las partículas de catalizador. Esta configuración permitió obtener una tasa de permeabilidad alta, permitiendo controlar los flujos de gases a distintas velocidades, es decir, el tiempo de contacto del catalizador con los gases.
PARTE EXPERIMENTAL
Preparación de catalizadores basados en vanadil fosfatos de hierro (FeVOP) másicos y soportados en γ-Al2O3.
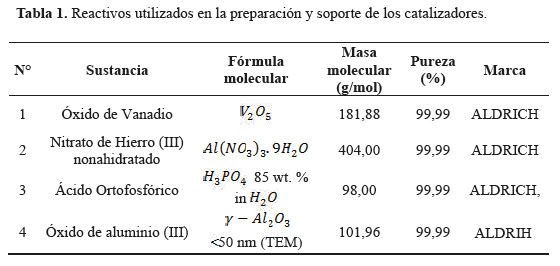
Los materiales de partida para la preparación de los catalizadores fueron óxido de vanadio, nitrato de hierro (III) nonahidratado, ácido ortofosfórico, óxido de aluminio (III), todos precedentes de SIGMA-ALDRICH y agua desionizada (MiliQ). El catalizador vanadil fosfato VOP (VOPO4.2H2O) fue preparado por el método de Ladwig14. Los catalizadores vanadil fosfatos de hierro de diferente composición: FeVOP(1) (Fe0.14VO0.86PO4) y FeVOP(2) (Fe0.21VO0.79PO4) fueron sintetizados por el método de reflujo siguiendo un procedimiento modificado de síntesis propuesto por Ladwig que se fundamenta en la siguiente reacción:
La síntesis se realizó en un balón de reacción equipado con un condensador de bolas y una plancha de calentamiento. Se pesó 3,0 g de pentóxido de vanadio y se agregó al balón de reacción que contenía 37 mL de agua desionizada en agitación durante una hora; luego se agregó 16,5 mL de ácido fosfórico (85 % wt) y una cantidad de Fe(NO3)3.9H2O seguido de otra adición de 35 mL de agua desionizada y se puso a reflujo (T ≈ 150°C). Luego de 16 horas se interrumpió el reflujo y se filtró. El sólido obtenido se lavó con cuatro alícuotas de 100 mL de agua destilada, seguido por filtración a vacío.
El catalizador másico FeVOP(1) obtuvo en estudio previo un mejor rendimiento en la reacción ODH del etano, por eso fue soportado en distintas proporciones sobre γ-Al2O3 (con cargas de 5%, 10%, 15%, 20% y 25% en peso de catalizador sobre el soporte) mediante el método de impregnación húmeda incipiente y, luego, todos los catalizadores preparados fueron calcinados con una rampa de calentamiento de 2°C/min hasta la temperatura de 550 °C por 4 h
Un resumen de la descripción de los reactivos utilizados en la preparación de los catalizadores se presenta en la tabla 1.
Un resumen de los catalizadores masicos y soportados sobre se presenta en la tabla 2.
RESULTADOS Y DISCUSIÓN
A.- Caracterización de los catalizadores
1.- Análisis por difracción de rayos X (XRD)
El análisis XRD se realizó en un difractómetro marca BRUKER, Modelo D8-FOCUS con detector PSD Lynxeye que opera con un tubo de Cu cuya radiación tiene una longitud de onda correspondiente a Kα de Cu (λ= 1,5406 Å). El rango de barrido 2θ de se realizó entre 5-60° con un tamaño de paso de 0,02° y un tiempo de paso de 0,5 s. El generador de Rayos-X tiene un voltaje de salida del tubo de 40 kV con una corriente de 40 mA. Este equipo pertenece a la Facultad de Ciencias Físicas de la Universidad Nacional Mayor de San Marcos (Laboratorio de Difracción de Rayos-X). Adicionalmente, se determinó el tamaño de cristalita mediante la aplicación de la ecuación de Scherrer y la distancia interplanar, a partir de la aplicación de la ecuación de la ley de Bragg.
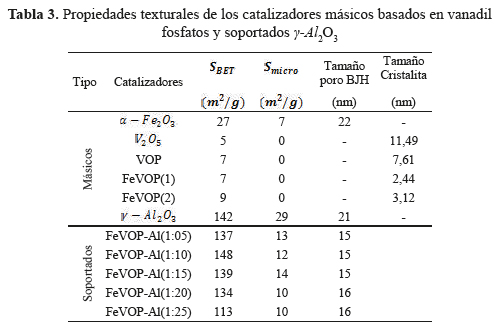
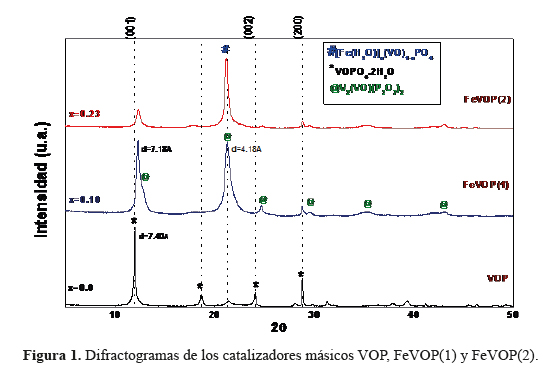
Los difractogramas XRD del compuesto de partida V2O5 mostraron picos bien definidos con alto grado de cristalinidad, característicos de la fase ortorrómbica shcherbinaite, que es una forma común del óxido de vanadio (JCPDS 00-041-1426). La muestra VOP describió una estructura tetragonal en capas formada por tetraedros de PO enlazadas a los grupos VO, que están dispuestas de tal manera como para crear "bolsas" en la región entre capas. Cada átomo de vanadio, siendo pentacoordinado con átomos de oxígeno, es capaz de unirse a una molécula básica, a modo de completar una coordinación octaédrica distorsionada15. Los difractogramas de los catalizadores FeVOP(1) y FeVOP(2) mostraron un perfil de sólidos cristalinos que presentaron un ensanchamiento de picos de difracción respecto al catalizador másico VOP16, debido a una disminución del tamaño de cristalita con el contenido de hierro en su estructura (tabla 3). Los picos de VOP son característicos de la especie VOPO4.2H2O (JCPDS 36-14729) cuyos picos en las posiciones angulares de 11,9°, 23,9° y 28,7° corresponden a los planos (001), (002) y (200), respectivamente; en esta fase hidratada la coordinación entre los átomos de las capas adyacentes se produce a través del enlace V-OH 17. Este razonamiento también se puede realizar para los catalizadores FeVOP(1) y FeVOP(2) donde la inserción de Fe en la estructura presume la sustitución de sitios de (V - O)+3 por cationes de Fe+3, generándose nuevas fases que tienen además interesantes propiedades catalíticas.
La figura 1 muestra también que el pico en la posición 2Θ1 disminuye de intensidad en la muestra FeVOP(2) respecto al correspondiente a FeVOP(1), que puede explicarse tomando en cuenta que el catalizador FeVOP(2) posee una mayor cantidad de Fe en su estructura respecto al FeVOP(1), formando una nueva fase que algunos autores sugieren por la formación de [Fe(H2O)]x(VO)1 xPO416. El difractograma atribuido al catalizador FeVOP1) muestra que el pico en 2Θ& presenta un hombro al lado derecho, además de la existente ([Fe(H2O)]x(VO)1-xPO4), identificada en la figura 1 como la fase @ perteneciente al vanadio vanadil fosfato V (VO)(P2O7)2 (JCPDS 01-079-0041) con picos de difracción característicos en 12,5°, 21,2°, 24,7°, 29,8°, 35,5°, y 43,0°. La proximidad de picos característicos en 2Θ Θ = 12.31 y 2Θ = 24.7° hace que la especie con menor intensidad de pico forme un hombro. La presencia de esta fase justifica la aparición de picos en 2Θ = 24.7°, 29,8°, 35,5°, y 43,0° en los difractogramas de los catalizadores FeVOP(1) y el FeVOP(2).
2.- Sorción de N2 (método BET)
Para la medición de la superficie específica se usó el equipo Micromeritics GEMINI- VII serie t ubicado en el Laboratorio de Investigación de Fisicoquímica de la Facultad de Ciencias (UNI), que permite el registro de la isoterma de adsorción en todo el rango de presiones parciales P/P0. Se utilizó N2 como gas de análisis (gas N2, 99% LINDE) y nitrógeno líquido (TECNOGAS) con punto de ebullición a -195,79 °C como refrigerante para la condensación del N2. El área BET se calculó en el rango de presiones P/P0 entre < 0,05 a 0,33> correspondiente a la adsorción de una monocapa. Los puntos de equilibrio se midieron siguiendo el programa GAS MICROMERITICS con un total de 50 puntos y con un tiempo de equilibrio en cada punto de 7 s. Previo a la adsorción, las muestras fueron desgasificadas al vacío durante 2 h a 250 °C con el propósito de eliminar la humedad y las impurezas superficiales. El tamaño de poro fue calculado por el método de Barrett, Joyner y Halenda (BJH).
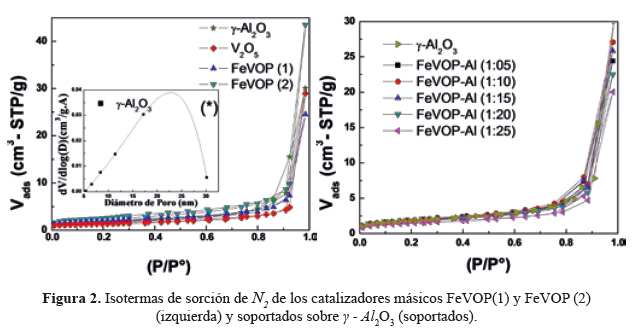
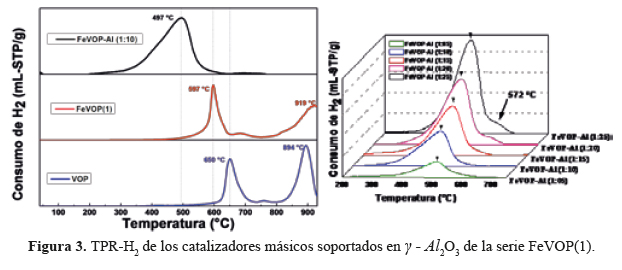
Las isotermas de sorción de N2 de las muestras V2O5, FeVOP(1) , FeVOP(2) y del soporte de la figura 2 son del tipo IV, característicos de sólidos micro-mesoporosos con bucle de histéresis tipo H1 correspondiente a poros cilíndricos. La tabla 2 muestra una diferencia considerable entre los valores de la superficie específica entre los catalizadores másicos (<10 m2/g) respecto al soporte catalítico y a los catalizadores soportados en γ - Al2O3 (S ~140 m2/g). Los catalizadores soportados presentan mayor superficie mesoporosa con tamaño de poros uniformes (<15-16> nm).
3.- Reducción a temperatura programada (TPR)
Para la identificación de las especies reducidas se usó la técnica de reducción a temperatura programada. El instrumento usado fue el equipo Micromeritics-Chemisorb 2720. Los experimentos fueron realizados en un reactor usando 40 mg de muestra bajo atmosfera reductora (10 % H2 en N2) y con un calentamiento de 25 a 700 ºC a 10 ºC por minuto. Previo a los tests, las muestras fueron desgasificadas al vacio durante 2 h a 250 °C para eliminar las impurezas. Para los calculos cuantitativos se ha usado una muestra estandar de Ag2O.
Como se observa en la figura 3a, la muestra VOP se reduce a temperaturas mayores a 600°C, atribuido a la reducción superficial de las especies de V+5 y V+4, que pasan a ser reducidas a V+3 ((VO)2P2O7), como se muestran en las ecuaciones 1 y 2. Por los consumos de hidrogeno, el pico en la posición a ~650°C es atribuido posiblemente a la reducción de las especies de V+4 a V+3 según la ecuación 2 y el pico a 894 °C, a la reducción de las especies de V+5 a V+3, según la ecuación 118-21. Las especies de V+3 se reducen a temperaturas más elevadas que 900°C16.
Para todos los catalizadores, la relación H/V sale menor que 2 (tabla 4), que indica la presencia simultánea de las especies de V+4 y V+5 22. La muestra FeVOP resultó ser más reducible que el VOP, probablemente debido a la alta porosidad del FeVOP que facilita la difusión del H en la muestra22. Los catalizadores soportados fueron más reducibles y esto muestra el efecto dispersor del soporte, que por interacción con la fase activa influye en las propiedades redox de la fase activa22. Como se observa en la tabla 4, el consumo de hidrógeno (mol de H por g de catalizador) para la muestra soportada FeVOP-Al(1:10) es aproximadamente 4 veces mayor que las másicas, sugiriendo una fuerte interacción de la fase activa con el soporte. En el caso de los catalizadores soportados (figura 3b), el perfil TPR sugiere que la reducción se realiza en 2 pasos con un perfil similar en todos los catalizadores con un corrimiento ligero de los picos de reducción hacia bajas temperaturas con el aumento de la composición del componente activo. El pico de reducción mayoritario se encuentra alrededor de 500 °C y el otro, a 572 °C.
4.- Espectroscopia Láser Raman (LRS)
Los espectros Raman de las muestras másicas se realizaron en un equipo de la marca Horiba modelo Yvon XPLORA, usando una cámara CCD como detector, un objetivo con un aumento de 50X, las ranuras de difracción de 1800l/mm y la apertura a la difracción de 500 lm. Cada ranura de difracción tuvo una extensión de 100 lm s y se usó un filtro D1. Se utilizó láser verde con longitud de onda 532 nm sobre un rango de 100-1700 cm-1. La potencia del láser fue de 10mW para los catalizadores VOP, FeVOP (1) y FeVOP(2) y una potencia de 50 mW para el V2O5. Este equipo pertenece al Laboratorio de Investigación de Electroquímica Aplicada de la Universidad Nacional de Ingeniería.
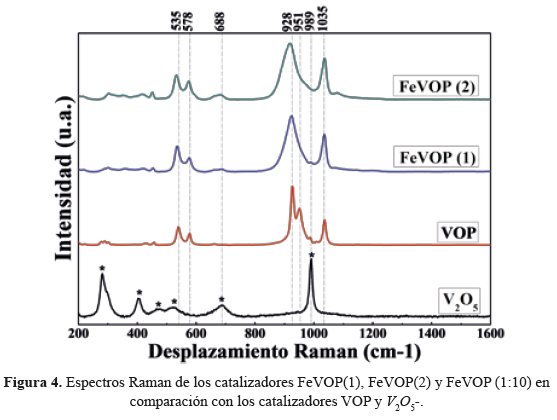
Los espectros Raman de los catalizadores VOP, FeVOP(1) y FeVOP(2), mostrados en la figura 4, tienen picos y bandas Raman similares; donde los picos ubicados alrededor de 540 son asignados a las vibraciones por tensión del enlace O - P - O mientras que los picos en 928 y 951 cm-1 se les atribuye a la vibración por flexión del enlace O - P - O en PO . La banda a 1035 cm-1 se ha asignado a la tensión del enlace doble V = O de la especie de vanadilo que posee un enlace corto V = O y tres enlaces puente V - O que tienen su modo de vibración por tensión en 688 cm-1 23.
El pico característico en 989 cm-1, perteneciente al pentóxido de vanadio, puede ser observado en los espectros de los catalizadores másicos VOP, FeVOP(1) y FeVOP(2), esto hace suponer la existencia en los catalizadores másicos de la especie V2O5, que tienen enlaces cortos V - O con modos vibracionales en 989 cm-1 sin reaccionar, sin embargo, la proporción en la que se encuentran estas especies son lo suficientemente pequeñas que no muestran picos intensos en sus respectivos espectros Raman, por ejemplo, en el espectro Raman del FeVOP(2), este pico es casi imperceptible. La inserción de Fe+3 en la estructura, trae como consecuencia la disminución en la cristalinidad de los catalizadores másicos, lo que presumiblemente genera un cambio de frecuencias de vibración, este hecho queda comprobado en los espectros Raman, donde se observa que con la adición de Fe, los picos Raman sufren un ligero corrimiento a menores energías; este desplazamiento a frecuencias más bajas genera bandas más débiles y anchas, lo que explica la desaparición por traslape de los dos picos del espectro Raman del VOP (928 y 951 cm-1) formándose una sola banda ancha con pico máximo en ~ 928 cm-1 para los espectros de los catalizadores FeVOP(1) y FeVOP(2), que puede ser atribuido a la especie VO(H2PO4)2 formado con mayor grado durante la preparación del catalizador9. El pico a 1035 probablemente sea atribuido a la especie [Fe(H2O)]x(VO)1-xPO4 como también lo detectó el análisis XRD16.
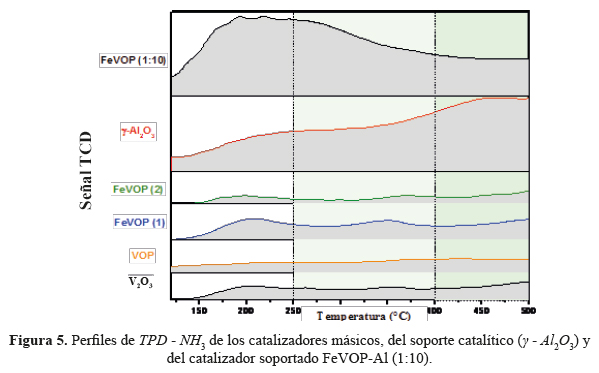
5.- Desorción a temperatura programada con NH3 (TPD-NH3).
La acidez de las muestras se midió mediante una desorción programada de la temperatura de NH (TPD-NH ). Las muestras se cargaron en un tubo de cuarzo en forma de U (50 mg). El pretratamiento de los 50 mg de muestra se llevó a cabo de la siguiente manera: se realizó una purga con helio durante una hora a 100 ºC. Posteriormente, se inyectó gas amoníaco para dar paso a la adsorción durante 30 minutos a la misma temperatura y, finalmente, otra purga se fabricó con helio durante una hora para eliminar las moléculas de amoníaco que no fueron adsorbidas por la muestra. La desorción procedió a calentar el horno con una rampa de 15 °C / min de 100 °C a 500 °C bajo flujo de He y se mantuvo a la temperatura final durante media hora hasta que la señal regresó a la línea de base. La cantidad desorbida de NH se controló mediante un detector de conductividad térmica (TCD) utilizando el software V1.03 TPX ChemiSoft
En la figura 5 se observan picos en tres zonas de desorción entre 100-250°C (sitios ácidos débiles), de 250 – 400°C (sitios ácidos medios) y de 400-500°C para los sitios ácidos fuertes que se le atribuyen a la quimisorción de NH3, entre los cuales no es posible discriminar entre la acidez de Bronsted y Lewis24. Los catalizadores másicos presentan una baja adsorción de NH comparadas con el catalizador soportado FeVOP-Al (1:10) en el que se aumenta considerablemente la cantidad de sitios ácidos medios y débiles. La actividad catalítica de los catalizadores en la ODH de etano depende en gran medida de la cantidad de sitios ácidos y la fuerza de estos sitios. Los perfiles de TDP - NH3 muestran que el catalizador soportado FeVOP-Al (1:10) posee mayor cantidad de sitios ácidos débiles y medios, respecto a los otros catalizadores y que el soporte catalítico γ - Al2O3 aumenta considerablemente la cantidad de sitios ácidos. Esta característica del catalizador soportado será crucial para la formación de sitios selectivos a la oxidación parcial a etileno en la reacción ODH del etano, como se muestra en el siguiente acápite.
B.- Evaluación catalítica del sistema de reacción para la deshidrogenación oxidativa del etano de los óxidos simples puros y mixtos
Actividad catalítica obtenida en la deshidrogenación oxidativa del etano (ODH)
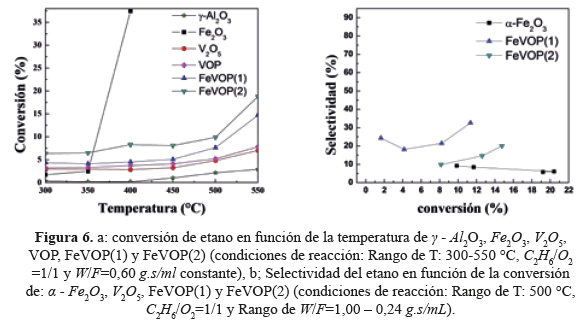
Los catalizadores sintetizados fueron estudiados a temperaturas entre 350 °C y 550 °C. Los resultados obtenidos muestran que la actividad de los catalizadores másicos es influenciada por las propiedades ácidas debido, probablemente, a la presencia de grupos VO, que actúan como sitios de ácido de Lewis. La presencia de estos sitios ácidos se hace evidente al considerar la estructura de fosfato de vanadilo VOPO4.2H2O (VOP) que tiene una estructura tetragonal formada por tetraedros vinculados a los grupos de VO. Las muestras másicas FeVOP(1) y FeVOP(2) fueron más activos que su contraparte VOP (figura 6a).
Como se indicó en la caracterización por Raman, la inserción de Fe+3 en la estructura VOP generó una diminución en la cristalinidad de los catalizadores másicos, verificado por un cambio de frecuencias de vibración. La distorsión manifiesta en el catalizador por la presencia del Fe es clara, por lo que su influencia en la actividad en la ODH de etano es una manifestación de la interacción sinérgica de los componentes estructurales del catalizador. La figura 6a muestra además que la conversión de etano aumenta con la temperatura, que es de esperar considerando la influencia de la acidez superficial, como normalmente ocurre en el caso de la combustión de compuestos orgánicos volátiles. La estabilidad química de la γ - Al2 O3 se evidencia en la figura 6a donde se observa que a elevadas temperaturas (~550°C) apenas supera el 2 % de conversión de etano.
Los resultados muestran también que la adición de Fe+3 a la estructura VOP mejora las propiedades catalíticas en el Fe VOP (1) respecto al catalizador VOP. Esto podría explicarse a la gran labilidad de oxígenos que tienen los óxidos de hierro, y que la disposición del metal en la superficie del catalizador le brinda propiedades reductoras; con esto, la combinación en un catalizador de óxidos de vanadio y hierro nos brinda un efecto sinérgico cuya actividad catalítica puede ser controlada por la cantidad de hierro contenido en el catalizador.
Respecto a la selectividad, la introducción del Fe a la estructura compacta del VOP mejoró la selectividad a etileno hasta un 30 % (figura 6b). La adición controlada de hierro causa un efecto positivo en la actividad catalítica, y se puede observar tanto en la conversión como en la selectividad del catalizador másico FeVOP(1) respecto a los otros catalizadores másicos. Para la reacción de ODH se deben considerar varios aspectos: por ejemplo, la fuerza de unión entre el oxígeno y el catalizador aumenta la conversión de etano pero disminuye la selectividad; por eso un aumento en composición del Fe3+ con mayor capacidad de retención del oxígeno hace menos selectiva la oxidación a etileno (figura 6b).
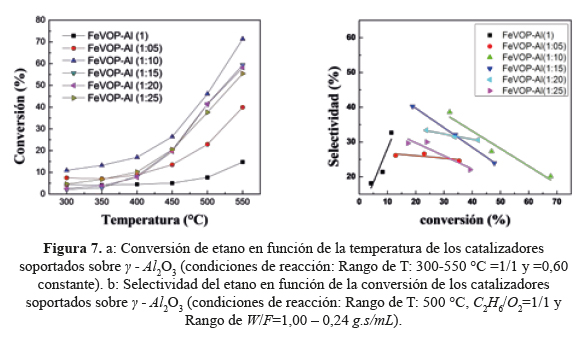
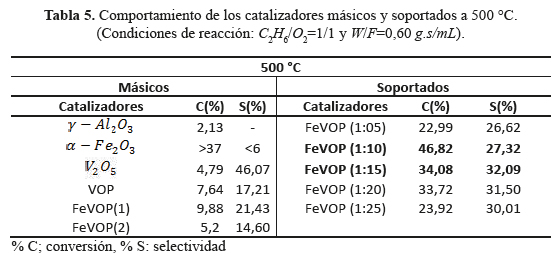
Los catalizadores másicos estudiados tuvieron baja conversión (<10%) debido probablemente a los pocos sitios ácidos débiles e intermedios (figura 5) y áreas superficiales pequeñas (entre 7 y 9 m2/g), que no permitió el desarrollo de sitios activos para la reacción de deshidrogenación oxidativa del etano. Con el objetivo de mejorar la superficie y la dispersión metálica, los catalizadores FeVOP(1) (másico con mejor actividad catalítica) fueron soportados en a distintas proporciones e investigados respecto a su actividad catalítica y selectividad. El aumento de la carga de FeVOP en el soporte (del 1 al 10 %) mejoró la conversión para luego disminuir con el aumento de carga (figura 7). Lo mismo ocurrió con la selectividad hasta obtener selectividades del orden de 40 % con 35 % de conversión. Se postula un cambio en la composición superficial del V con el aumento de carga que se verificará con el XPS. El rendimiento a etileno de los catalizadores soportados al 10 y 15 % fue también el más alto, como se observa en la tabla 5.
Una característica importante en el soporte de los catalizadores másicos para la reacción deshidrogenacion oxidativa es el incremento en el numero y fuerza de sitios ácidos intermedios y débiles de Lewis; según los resultados de la deserción de NH3, el soporte catalitico utilizado, gamma alumina, tiene mas cantidad de sitios acidos que cualquiera de los catalizadores masicos investigados, y que esta cantidad de sitios acidos débiles y medios se incremento a mas del doble cuando el FeVOP(1) es soportado sobre la γ-Al2O3 (figura 5). El aumento de la fase activa sobre el soporte estuvo acompañado de un aumento lineal del consumo de H2 (relacionada con los procesos de difusión de H2 sobre la superficie del catalizador) pero disminuyo la relación H/V (tabla 4) por lo que algunos autores9 sugieren que hay un cambio en la composición de las concentraciones de V+4 y V+5, especies que se detectaron por XRD y análisis Raman. Se estipula que el enriquecimiento de las especies iónicas V+4 y V+5, en la fase activa, son las responsables de la selectividad a etileno en la hidrogenación ODH del etano9,18,22, como se comprobó en este trabajo aumentando drásticamente la conversión y selectividad a etileno en la muestra másica FeVOP(1) de 9,8 y 21,4 % a un valor de 46,8 y 27,3 % en la muestra soportada equivalente FeVOP (1:10) (tabla 5).
CONCLUSIONES
1. Se prepararon catalizadores de vanadil fosfato y hierro vanadil fosfato mediante el método Ladwig modificado, que permitió la formación de centros activos y selectivos como consecuencia de la formación de sitios ácidos débiles e intermedios.
2. La alta dispersión de la fase activa permitió la concentración de sitios ácidos débiles e intermedios que fue crucial en la mejora de la selectividad a etileno. Además, la mayor carga de la fase activa en el soporte significó la formación de especies reducibles a temperaturas intermedias que son las responsables de fomentar la formación de oxígenos nucleofílicos.
3. Las muestras de hierro vanadil fosfato soportadas sobre γ-alúmina mejoraron drásticamente en actividad y selectividad a etileno con relación a los catalizadores másicos debido a una disminución de la relación H/V, relacionada probablemente con un aumento en la composición superficial de las especies V+4 y V+5 en la fase activa.
AGRADECIMIENTOS
Los autores agradecen al Fondo de Innovación de Ciencia y Tecnología (Proyecto Nº 229-INNOVATE PERÚ), a la Oficina de Gestión de la Investigación (OGI-UNI) y a la Facultad de Ciencias de la Universidad Nacional de Ingeniería, por el apoyo económico concedido para la realización de este trabajo durante el año 2018.
REFERENCIAS BIBLIOGRÁFICAS
1. Gartner C, Van Veen A, Lercher J. Oxidative Dehydrogenation of Ethane: Common Principles and Mechanistic Aspects. ChemCatChem. 2013; 5:1–23. [ Links ]
2. Bañares M. Supported metal oxide and other catalysts for ethane conversion: a review. Catal Today. 1999, 51: 319-348. [ Links ]
3. McFarland EW, Metiu H. Catalysis by Doped Oxides. Chem Rev. 2013: 113(6): 4391- 4427. [ Links ]
4. Bakare I, Mohamed S, Al-Ghamdi S, Rassak S, Hossain M, De Lasa H. Fluidized bed ODH of ethane to ethylene over VOx-MOx/γ-Al O catalyst: Desorption kinetics and catalytic activity. Chem Eng J. 2015: 278: 207–216. [ Links ]
5. Chen X, Dang D, An H, Chu B, Cheng Y. MnOx promoted phase-pure M1 MoVNbTe oxide for ethane oxidative dehydrogenation. J Taiwan Inst Chem E. 2018. doi: 10.1016/j.jtice.2018.10.004. [ Links ]
6. Khan MY, Al-Ghamdi S, Razzak SA, Hossain MM, De Lasa H. Fluidized bed oxidative dehydrogenation of ethane to ethylene over VOx/Ce-γAl2O3 catalysts: Reduction kinetics and catalyst activity. Mol Catal. 2017; 443: 78-91. [ Links ]
7. Bagnasco G, Benes L, Galli P, Massucci MA, Patrono P, Turco M, et al. TG/DTA, XRD and NH3-TPD Characterization of Layered VOPO •2H O and its Fe3+-Substituted Compound. J Therm Anal, 1998; 52: 615-630.
8. Casaletto MP, Lisi L, Mattogno G, Patrono P, Ruoppolo G. An XPS study of titania- supported vanadyl phosphate catalysts for the oxidative dehydrogenation of ethane. Appl Catal A. 2004; 267: 157-164. [ Links ]
9. Ivars-Barceló F, Hutchings GJ, Bartley JK, Taylor SH, Sutter P, Amorós P, et al. Relationship between bulk phase, near surface and outermost atomic layer of VPO catalysts and their catalytic performance in the oxidative dehydrogenation of ethane. J Catal. 2017, 354: 236–24. [ Links ]
10. Martínez-Huerta MV, Gao X, Tian H, Wachs IE, Fierro JLG, Bañares MA. Oxidative dehydrogenation of ethane to ethylene over alumina-supported vanadium oxide catalysts: Relationship between molecular structures and chemical. Catal Today. 2006; 118: 279- 287. [ Links ]
11. Solsona B, Dejoz A, García T, Concepcion P, López Nieto JM, Vázquez MI, et al. Molybdenum-vanadium supported on mesoporous alumina catalysts for the oxidative dehydrogenation of ethane. Catal Today. 2006; 117: 228-233. [ Links ]
12. Lisi L, Ruoppolo G, Casaletto MP, Galli P, Massucci MA, Patrono P, et al. Vanadium- metal (IV) phosphates as catalysts for the oxidative dehydrogenation of ethane. J Mol Catal A. 2005; 232: 127-134. [ Links ]
13. Heracleous E, Machli M, Lemonidou AA, Vasalos IA. Oxidative Dehydrogenation of Ethane and Propane over Vanadia and Molybdena Supported Catalysts. J Mol Catal A. 2005; 232: 29-39. [ Links ]
14. Ladwig G. Uber die Konstitution des VPO5(*nH2O). Anorg Allg Chem. 1965; 338: 266-178. [ Links ]
15. Wade Jr LG, Química orgánica Volumen 2. Séptima edición, México D.F.: Pearson; 2012. pp. 668-670. [ Links ]
16. Borah P, Ramesh A, Datta A. Dispersion of VOPO4·2H2O on different supports through exfoliation and their catalytic activity for the selective oxidation of cyclohexane. Catal Comm. 2010; 12: 110-115. [ Links ]
17. Vuurman M, Stufkens D, Goutam Deob A, Wachs I. Combined Raman and IR study of MOX-V2O5/Al2O3 (MO, = MoO3 WO3 NiO, COO) catalysts under dehydrated conditions. J Chem Soc., Faraday Trans. 1996; 92(17): 3259-3265. [ Links ]
18. Casaletto MP, Lisi L, Mattogno G, Patrono P, Ruoppolo G, Russo G. Oxidative dehydrogenation of ethane on γ-Al O supported vanadyl and iron vanadyl phosphates: Physico-chemical characterisation and catalytic activity. Appl Catal A. 2002, 226(1–2): 41-48. [ Links ]
19. Zhu Y, Li J, Fan Xie X. Effect of different VOPO phase catalysts on oxidative dehydrogenation of cyclohexane in acetic acid. J Molec Catal A. 2006; 246: 185-189. [ Links ]
20. Chen Z, Chen Q, Wang H, Zhang R, Zhou H, Chen L, et al. A β-VOPO /ε-VOPO composite Li-ion battery cathode. Electroch Comm. 2014; 46: 67-70.
21. Azmi M, Ishihara T, Nishiguchi H. Vanadyl phosphates of VOPO rechargeable batteries. J Power Sources. 2003; 119-121: 273-277.
22. Ciambelli P, Lisi L, Patrono P, Ruoppolo G, Russo G. VOPO .2H O and Fe(H O)x(VO)1- xPO .2H O supported on TiO2 as catalysts for oxidative hydrogenation of ethane. Catal Lett. 2002; 82(3-4):243-247. [ Links ]
23. Royer S, Duprez D. Catalytic Oxidation of Carbon Monoxide over Transition Metal Oxides. ChemCatChem. 2011; 3: 24 – 65. [ Links ]
24. Hardcastlet FD, Wachs IE. Determination of Vanadium-Oxygen Bond Distances and Bond Orders by Raman Spectroscopy. J Phys Chem. 1991: 95(13): 5031-5041. [ Links ]
Recibido el 23-11-18
Aprobado el 25-03-19 69