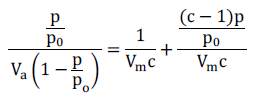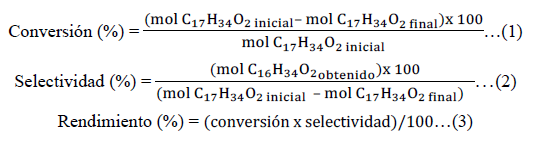Introducción
El consumo de energía es una necesidad básica para la subsistencia del hombre, pues los combustibles a base de petróleo, el gas natural y el carbón siguen siendo principalmente los más usados. Un sustituyente amigable con el medio ambiente es el biodiesel que se obtiene a través de la transesterificación de ácidos grasos siendo una alternativa de fácil degradación, renovable y no tóxico1. Se han empleado diversas materias primas para su obtención, siendo los más destacados la palma, la soya y el girasol. En el Perú la mayor fuente de aceite vegetal es la palma, cuyo uso es como aceite comestible y potencialmente para obtener biodiesel. Para mejorar las propiedades del biodiesel de palma hay que retirar la fracción de palmitato de metilo, y para dar un mayor valor agregado a este, puede transformarse mediante hidrogenación catalítica selectiva en alcohol cetílico, un producto con amplia aplicación en la industria cosmética, también como agente antiadherente y espesante2,3.
La hidrogenación de ésteres metílicos fue estudiada por Huang, C. y col., que realizaron experimentos para la hidrogenación de palmitato de metilo en un reactor batch con presión de hidrógeno gaseoso hasta 5,5 MPa desde los 250 ºC hasta los 300 ºC y agitación a 1000 rpm. A 270 ºC, el catalizador de Pd-Cu/diatomita mostró su mejor rendimiento obteniendo una conversión de 98,8 % y una selectividad de 83,9 % a alcohol cetílico4. La fase activa utilizada para la hidrogenación corresponden a los metales de transición del grupo VIII B como el Pt, Rh y Ru, pues son capaces de quimisorber disociativamente el hidrógeno molecular5. Además, la adición de un segundo metal como el Fe, Sn, Cu, Ni promueve la actividad en posición carbonílica desfavoreciendo la hidrogenación de los enlaces C=C 6-8.
Los soportes basados en óxidos reducibles como el TiO2, WO3 y MoO3 mejoran la actividad y selectividad de reacciones de hidrogenación, este efecto se atribuye a la interacción fuerte metal-soporte (efecto SMSI) debido a que la reducción del soporte a altas temperaturas permite la migración de especies TiOx (para el caso de la titania) sobre la superficie del catalizador, ocasionando su interacción con el metal soportado9,10. La síntesis de soportes ha sido muy estudiada, entre ellas, el método sol-gel ha sobresalido porque permite mejorar sus propiedades superficiales 11-13, por ejemplo, el estudiado por Shee D., y col. que aplicaron el método sol-gel para la síntesis de varios óxidos mixtos, permitiendo aumentar la estabilidad térmica y el área superficial de 90 % TiO2-SiO2 (212 m2g-1) con respecto al método de impregnación incipiente (120 m2g-1)14.
En la actualidad, el uso de alcohol cetílico obtenido de la grasa de las ballenas ha ocasionado la disminución de la población de esta especie marina, generando un desbalance en el equilibrio biológico y el rechazo de las sociedades protectoras de animales. Por ello, este trabajo propone la obtención artificial del alcohol cetílico mediante métodos catalíticos a partir de una fuente vegetal como el aceite de palma, que, por un lado, permite aumentar el valor agregado del aceite de palma y por el otro, desarrollar una tecnología económica ideal para preservar las especies cetáceas y la biodiversidad marina.
Parte experimental
Síntesis del soporte por el método sol-gel
El soporte presenta un rol importante para la actividad y selectividad catalítica de la reacción debido a su capacidad de dispersar la fase metálica con el fin de aumentar los sitios activos para mejorar la actividad de la reacción. La síntesis de la titania por el método sol gel fue escogido en este trabajo porque permite obtener soportes con mejores propiedades texturales. La preparación fue la siguiente: En 274 mL de 2-propanol como solvente, se ajustó la temperatura entre 0 y 5 ºC en un baño de hielo para impedir la reacción en la disolución. Inmediatamente, se agregó 18,5 mL de tetraisopropóxido de titanio manteniendo la agitación constante. A continuación, se introdujo en la disolución por goteo lento 24 mL de una solución de ácido nítrico(cc): agua (1:23 mL), observando la formación del sol hasta la formación del gel. Luego, el gel se dejó reposar por 24 h a temperatura ambiente, después a 60ºC se evaporó el solvente. Finalmente, se calcinó a 450ºC por 5 h con rampa de 1ºC/min y el polvo obtenido se tamizó en una malla de 100μm.
Preparación del catalizador soportado por coimpregnación húmeda
Los catalizadores soportados se prepararon por el método de coimpregnación húmeda. Se pesó 1 g de soporte de TiO2 sol-gel. Luego, se agregaron diferentes disoluciones acuosas de las sales de Ru y Fe, según la Tabla 1. Se llevó la mezcla a ultrasonido por 15 minutos y agitación constante por 2 h para evitar la aglomeración de las partículas y promover la dispersión homogénea del metal activo sobre el soporte, respectivamente. La mezcla se colocó en un rotavapor hasta la sequedad y se lavó con etanol tres veces. Después, se calcinó el sólido a 400 ºC por 5 h empleando una rampa de 1 ºC/min y el polvo obtenido se tamizó en malla de 100μm. Finalmente, se redujo el sólido con flujo de 10 % H2/N2 en fase gaseosa a 350 ºC por 4 h. El catalizador reducido fue almacenado hasta su uso en atmósfera inerte (He) para evitar la oxidación.
Caracterización del soporte y los catalizadores
Análisis termogravimétrico (TGA).
Para el análisis termogravimétrico del soporte se tuvo que tomar la muestra en su etapa de gel para estudiar la hidrólisis, condensación y calcinación durante el proceso sol-gel. La variación de la masa con respecto a la temperatura fue analizada por esta técnica usando el equipo Perkin Elmer simaltenous thermal analyzer (STA 6000). La muestra se calentó desde los 35 ºC hasta los 600 ºC con una rampa de 10 ºC/min en una atmósfera de N2(g) con flujo de 20 mL /min.
Espectroscopia IR (FITR).
El espectro IR muestra los grupos funcionales del soporte. Las vibraciones de estos grupos son asignados de acuerdo con su longitud de onda característica. Los análisis IR fueron realizados en un equipo FTIR- Alpha Fourier Transform Infrared Spectrometer-Bruker. Se obtuvieron los espectros IR a diferentes tratamientos térmicos de 60, 200 y 350 ºC para el soporte para verificar la presencia del solvente desplazado a diferentes temperaturas.
Tabla 1 Catalizadores basados en Ru-Fe soportados en TiO2, donde Ru(a)Fe(b), a:b es la relación molar entre Ru:Fe.
| % Carga | Peso en g | Peso en g |
| metálica/Catalizador* | RuCl3.xH2O | FeCl3.6H2O |
| 10 % Ru(1) | 0,2052 | - |
| 1 % Ru(4)Fe(1) | 0,0180 | 0,0059 |
| 5 % Ru(4)Fe(1) | 0,0902 | 0,0294 |
| 10 % Ru(4)Fe(1) | 0,1803 | 0,0588 |
| 10 % Ru(1)Fe(1) | 0,1322 | 0,1723 |
*La carga metálica se calculó por el porcentaje en peso de todo el metal con respecto al peso del soporte
Sorción de N2 (método BET)
El análisis superficial se realizó luego de la etapa de calcinación en el equipo Micromeritics GEMINI VII utilizando N2 como gas de análisis (gas N2, 99 % LINDE) y nitrógeno líquido (TECNOGAS) con punto de ebullición a -195,79 °C como refrigerante para la condensación del N2 a 77 K. Antes de la caracterización se desgasificó a 200 ºC en flujo de He durante 2 h. El área BET se calculó en el rango de presiones p/p0 entre <0,05 a 0,33> correspondiente a la adsorción de una monocapa. Los puntos de equilibrio se midieron siguiendo el programa GAS MICROMERITICS con un total de 50 puntos en el rango: 0,09 ≤ P/Po ≤ 0,98 y con un tiempo de equilibrio en cada punto de 7 s. Para calcular el área superficial se usó el método de Brunnauer-Emmett-Teller (BET) según la ecuación 15:
Donde Va= volumen adsorbido a una presión, p; Vm= volumen adsorbido en la monocapa; p0= presión saturada del N2; c = constante relacionada con el calor de adsorción.
Difracción de rayos X (XRD)
La difracción de rayos X muestra las fases cristalinas que existen en los sólidos. Para los análisis se usó un equipo de difracción de rayos X - D2 PHASER BRUKER y se empleó la radiación correspondiente a la transición de CuKα (λ = 0.154184 nm) con un rango angular 2θ de 10 a 80º a 0,05 º/s, 30 kV y 10 mA.
Reducción a temperatura programada-H2 (TPR)
La reducción de los catalizadores fueron analizadas por la técnica de reducción a temperatura programada usando un equipo TPR/TPD ChemiSorb 2720 Micromeritics provisto de un detector de termoconductividad. El material se calentó hasta los 200ºC con un flujo de He por 30 min para desgasificar. Luego el sistema se enfrió hasta la temperatura ambiental usando una corriente de 50 ml/min de hidrógeno (10%H2/N2) y finalmente se calentó con una rampa de 10 ºC/min hasta los 800ºC.
Desorción a temperatura programada de H2 (TPD-H2)
Los perfiles de desorción de H2 (TPD-H2) fueron analizadas por la técnica de desorción a temperatura programada usando un equipo TPR/TPD ChemiSorb 2720 Micromeritics provisto de un detector de termoconductividad. El material se calentó hasta los 200ºC con un flujo de He por 30 min para desgasificar, luego se incrementó la temperatura hasta 350ºC por 4 h en flujo de 50 mL /min de H2 (10%H2/N2) y después se enfrió hasta la temperatura ambiental. Finalmente, se calentó hasta 800 °C con una rampa de 10 ºC/min con un flujo de He a 50 mL /min.
Cromatografía de gases (GC)
El registro cuantificado de los productos de reacción fue realizado en un cromatógrafo de gases GC-Varian-450, equipado con un detector de ionización de flama (FID) y una columna capilar Superlcowax 10, (30 m x 0,53 mm x 0,25 μm). La cuantificación es mediante un estándar externo.
Actividad de los catalizadores
El estudio de la actividad se realizó en un reactor tipo batch. Se agregó al reactor 6 g de palmitato de metilo, 80 mL de dodecano, 200 mg de catalizador y una pastilla magnética. Luego, se abrió la llave de N2(g) hasta los 400 psi con agitación a 1000 rpm y se dejó reposar 1 h. En caso de fuga de gas se volvió a ajustar el reactor hasta asegurar la total hermeticidad del sistema. Después, se despresurizó el reactor hasta presión atmosférica para purgar el nitrógeno inicial. Finalmente, se abrió la llave de H2(g) hasta los 420 psi y se calentó hasta los 280 ºC llegando a los 5,5 MPa. Se tomó una muestra cada hora de la reacción mediante una válvula de muestreo para la cuantificación de los productos de reacción en el cromatógrafo de gases luego de centrifugarlas para sedimentar el residuo de catalizador remanente. La conversión, selectividad y rendimiento se determinaron por las expresiones 1, 2 y 3, respectivamente.
En la tabla 2 se presenta un resumen de las condiciones de hidrogenación del palmitato de metilo que se usó en este trabajo.
RESULTADOS Y DISCUSIÓN
Caracterización del soporte por sorción de N2 (método BET), DRX, TGA y FTIR
Análisis termogravimétrico (TGA)
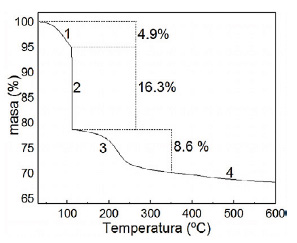
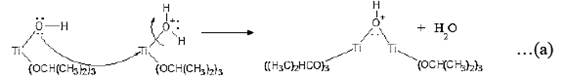
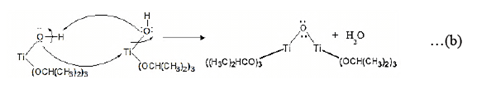
El análisis termogravimétrico mostró tres etapas del método sol-gel desde la formación del sol hasta su óxido. La síntesis del soporte comienza con la hidrólisis que tiene como subproducto a 2 - propanol siendo su punto de ebullición de 82 ºC, por ello, la pérdida de la masa en el tramo 1 (4,9 % en peso) se atribuyó a su evaporación (ecuación 1). En la sinéresis se encoge el gel causando la condensación de las moléculas de agua observándose una descomposición térmica lineal a los 100 ºC (ecuaciones 2 y 3), ocasionando la siguiente pérdida de masa en el tramo 2 (16,3% en peso). La formación de enlaces Ti-O-Ti en la etapa de polimerización presenta enlaces isopropoxi unidos al átomo de Ti (ecuación 4), los cuales son eliminados por evaporación y combustión desde los 100 hasta los 350 ºC como se muestra en el tramo 3 (8,6 % en peso). Finalmente, en el tramo 4 se presenta la formación del óxido en la etapa de calcinación desde los 350 hasta los 600 ºC siendo aproximadamente estable la masa con respecto al aumento de la temperatura16.
Espectroscopía FTIR
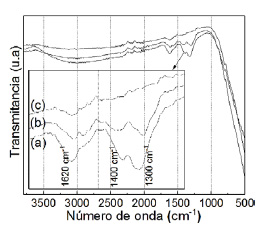
A los 60 ºC, en el espectro IR aparecen bandas en posiciones a 1300 - 1400 y 1620 cm-1, que son asociados a las vibraciones de los enlaces C-C y C-O de los ligandos isopropoxi unidos al Ti y una banda por debajo de los 600 cm-1, que es característica de los óxidos metálicos O-Ti-O. A los 200 ºC, aún se siguen observando los bandas, pero con menos intensidad. Sin embargo, a los 350 ºC desaparecen quedando solo la banda del óxido metálico, por lo que esta temperatura se fijó como mínima de calcinación para el soporte.
Sorción de N2 (método BET)
El análisis de sorción N2 muestra las áreas superficiales de TiO2 calcinadas a 450 y 500 ºC para ser comparadas con el comercial.
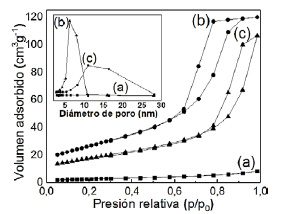
Figura 3 Isotermas de sorción N2 y distribución del tamaño promedio de poro por el método BJH de: (a)TiO2 comercial, TiO2 sol-gel calcinadas a (b)450 ºC y (c)500 ºC.
Al analizar las isotermas de adsorción, la muestra de TiO2 comercial presenta una isoterma del tipo IV y su región de sorción presenta poca histéresis, característico de los sólidos mesoporosos de baja área superficial. Sin embargo, el TiO2 sol-gel presenta isotermas de tipo IV (según IUPAC), lo que indica un sólido con superficie mesoporosa con un loop de histéresis tipo H1, característico de poros cilíndricos. Los soportes calcinados a 450 ºC y 500 ºC empiezan su histéresis en 0,6 y 0,7 de presión relativa, respectivamente. Como se observa, el análisis textural mostró gran aumento del área superficial del TiO2 (96 m2g-1) preparado por el método sol - gel calcinado a 450 ºC con respecto al comercial (9 m2g-1), un aumento significativo del volumen de poro del TiO2 sol-gel (0,19 cm-3g-1) contra el comercial (0,01 cm-3g-1). Además, la figura 3 muestra la distribución promedio del tamaño de poro (según BJH) más homogénea en la superficie de la titania sol-gel. En este trabajo se usó el soporte TiO2 sol-gel para asegurar mejor dispersión metálica en la preparación de los catalizadores. En la tabla 3 se presenta un resumen de las características texturales de los soportes estudiados.
Tabla 3 Datos de la superficies específicas, el diámetro promedio, volumen de poro, porcentaje de fase anatasa y tamaño de cristalita de TiO2 (Ecuación Debye-Scherrer)
| Soporte | Temperatura de calcinación | S BET (m2g-1) | Diámetro promedio de poro (nm) | Volumen de poro (cm3g-1) | % Anatasa | D (nm) |
|---|---|---|---|---|---|---|
| TiO2 - Comercial | - | 9 | 5 | 0,01 | 99 | 41 |
| TiO2 sol-gel | 500 ºC | 63 | 10 | 0,17 | 66 | 14 |
| TiO2 sol-gel | 450 ºC | 96 | 8 | 0,19 | 80 | 8 |
Difracción de rayos X (XRD)
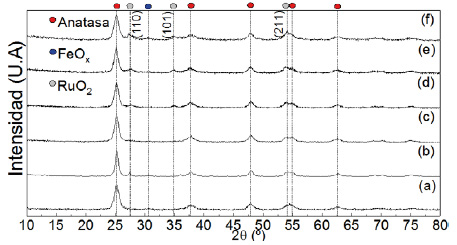
La figura 4 muestra los difractogramas de los soportes de titania comercial y sintetizado por sol-gel, calcinados a 450 y 500 ºC. El soporte presenta como fase predominante a la anatasa con picos principales en 25,3º, 36,9º, 37.8º, 38.6º, 48,1º, 53.9º y 55,1º atribuidos a los planos (101), (103), (040), (112), (200), (211) y (220), respectivamente. Se encontraron picos relacionados a la fase rutilo en el difractograma del soporte calcinado a 500 ºC a los 27,5º correspondiente al plano (110). El tamaño de cristalita se calculó en base al pico de mayor intensidad usando la fórmula de Debye-Scherrer. A mayor temperatura de calcinación se observó el ensanchamiento en los picos de difracción debido a la formación de partículas más pequeñas con mayor área superficial.
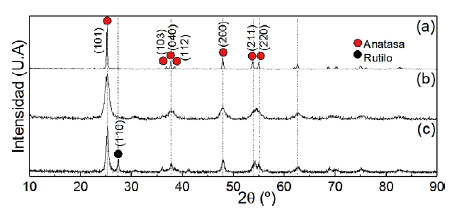
Figura 4 Difractogramas de los soportes: (a)TiO2 comercial y TiO2 sol-gel calcinado a (b)450ºC y (c)500 ºC.
Los difractogramas muestran características cristalinas correspondientes a las fases anatasa y rutilo, y la intensidad de la fase anatasa es mayor en el comercial. El porcentaje de las fases cristalinas contenidas en las muestras se determinó utilizando la ecuación de Spurr:
Donde PA es el porcentaje de la fase anatasa; IA la intensidad integral del pico (101) de la fase anatasa; IR la intensidad integral del pico (110) de la fase rutilo, obteniendo de fase anatasa un porcentaje de 80 % en el TiO2 sol-gel calcinado a 450 ºC y 99 % en el comercial. Al aumentar la temperatura del soporte el % anatasa disminuyó (tabla 3). Se seleccionó el sol-gel calcinado a 450°C por tener mejor superficie y un % decuado de anatasa según referencias15.
Caracterización de los catalizadores por sorción de N2, DRX, TPR y TPD-H2
Sorción N2 (método BET).
La figura 5 muestra los análisis BET de los catalizadores calcinados a 400 ºC utilizados en este trabajo de investigación. El aumento de la carga metálica produce una disminución en el área superficial y el volumen de poro de los catalizadores lo cual indica que la fase activa se depositó en los poros del soporte. Todos los catalizadores en la figura 5 presentan isotermas de tipo IV, característico de las superficies micro-mesoporosas, con mayor proporción en la fase mesoporosa y con ciclos de histéresis tipo H1, correspondiente a poros cilíndricos16. La tabla 4 resume las características texturales de los catalizadores soportados.
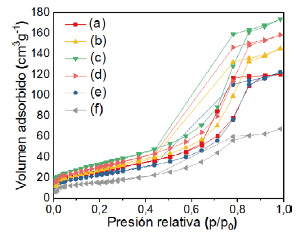
Figura 5 Isotermas de sorción de N2 de: (b)10%Ru(0), (c)1%Ru(4)Fe(1), (d)5%Ru(4)Fe(1), (e)10%Ru(4)Fe(1), (f)10%Ru(1)Fe(1) comparados con el (a)TiO2.
Tabla 4 Superficie específica, diámetro promedio de poro (método BJH), volumen de poro de los catalizadores soportados en TiO2 sol gel y tamaño de cristalita (D).
| Catalizador | SBET (m2g-1) | Diámetro poro (nm) | Volumen de poro (cm3g-1) | D(nm) |
| 10 %Ru(1) | 102 | 9 | 0,24 | 9,0 |
| 1 %Ru(4)Fe(1) | 120 | 9 | 0,27 | 8,7 |
| 5 %Ru(4)Fe(1) | 99 | 9 | 0,22 | 8,7 |
| 10 %Ru(4)Fe(1) | 82 | 9 | 0,19 | 9,2 |
Difracción de rayos X (XRD)
Los difractogramas de los catalizadores soportados muestran picos de RuO2 a los 28º (110), 35º (101) y 54º (211) de baja intensidad, por ende, a pesar de su alta carga metálica, se encuentran altamente dispersos en los poros del soporte con posibles aglomeraciones en la superficie17. Al aumentar la carga metálica del 1, 5 y 10 % aparece el pico correspondiente a RuO2. Los difractogramas presentan la misma estructura de la fase anatasa de la titania con un aumento del tamaño de cristalita a medida que aumenta la carga metálica. En catalizador con mayor carga de Fe (en la figura 6, el difractograma f) a los 30,6º se presenta un pico posiblemente debido a las especies de FeOx adsorbidos en el soporte.
Reducción a temperatura programada (TPR-H2)
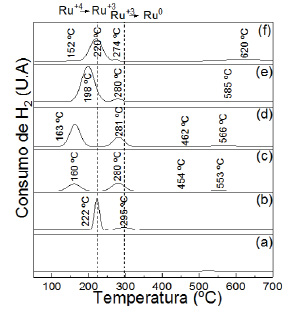
En la figura 7 el perfil de reducción para el catalizador monometálico de 10 % Ru(1) muestra un pico máximo a 222 ºC y un pico de leve intensidad a los 295 ºC, que son atribuidos a la reducción de los estados de oxidación de +4 a +3 y +3 a 0 para el Ru, respectivamente. Para los óxidos mixtos, el aumento de la carga metálica (1, 5 y 10 % - c, d y e en la figura 7) ocasiona el desplazamiento de los picos hacia altas temperaturas. Considerando la misma
carga metálica al comparar los catalizadores 10%Ru(4)Fe(1), (muestra e) y 10%Ru(1)Fe(1) (muestra f) se observa un desplazamiento de los picos a mayores temperaturas, al aumentar la presencia de hierro en el catalizador posiblemente debido a interacciones metal-soporte18. Como se observa, el TiO2 no presenta ningún pico de reducción hasta los 700 ºC. Según los termogramas TPR se ha establecido 350°C como temperatura de reducción para todos los catalizadores soportados pues a esta temperatura se asegura la total reducción a Ru metálico.
Desorción a temperatura programada (TPD-H2)
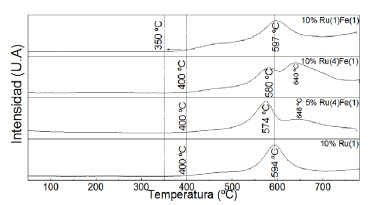
Los perfiles de desorción de hidrógeno muestran la existencia de 3 sitios de adsorción de hidrógeno para los catalizadores mixtos y solo 2 sitios de absorción para su contraparte monometálica. El primer sitio de adsorción de hidrógeno se debe a la desorción entre los 400 y 500 ºC la cual se atribuye a los hidrógenos quimisorbidos por la fase activa, debido a su alta temperatura de desorción indica una fuerte quimisorción entre H y Ru. A los 594 ºC se presenta un pico de mayor intensidad, indicando que en este segundo sitio la adsorción es lenta y hay acumulación de hidrógeno que se difunde en el soporte evidenciando una interacción metal-soporte para el catalizador monometálico18. Para los catalizadores mixtos se presenta un tercer sitio de adsorción con un pico máximo a los 648 ºC, posiblemente debido a la influencia de Fe. La temperatura de reacción para la hidrogenación de palmitato de metilo se realiza a los 280 ºC que, como se observa en la figura 8, la desorción de hidrógeno inicia todavía a los 400 ºC, indicando que la fase activa esta saturada de hidrógeno; esto podría favorecer la actividad en la reacción.
Actividad catalítica de los catalizadores
Los productos de reacción de la hidrogenación del palmitato de metilo obtenidos en el presente trabajo fueron alcohol cetílico, pentadecano y hexadecano La conversión de palmitato de metilo para los catalizadores fue mayor para el catalizador 10% Ru(4)Fe(1) en 4 h de reacción, debido a que presenta mayor cantidad de fase activa (Ru) depositado en el soporte. Además, los perfiles de reducción de las muestras mixtas mostraron que el consumo de hidrógeno es directamente proporcional a la carga metálica y los perfiles de desorción de hidrógeno revelaron el efecto de una posible interacción metal-soporte. La adición de Fe para el catalizador de 10% Ru(4)Fe(1) promovió la selectividad hacia alcohol cetílico, debido a que presenta orbitales “d” vacíos, los cuales actúan como sitios ácidos de Lewis, activando el grupo carbonilo (C=O) presente en las moléculas de palmitato de metilo19.
Efecto de la carga metálica
La figura 9 muestra el efecto de la carga metálica sobre la conversión y selectividad para la hidrogenación de palmitato de metilo. El catalizador de más baja carga metálica, 1% Ru(4) Fe(1), presenta la conversión más baja de 18 % y baja selectividad de 4 %, sin embargo, al aumentar la carga metálica la conversión y selectividad aumentan gradualmente hasta 90 % y 12 %, respectivamente, para el catalizador 10% RuFe(4:1). Por tanto, el rendimiento del alcohol cetílico alcanza el 10,8 % a 4 h de reacción. Los resultados de la reacción de hidrogenación de palmitato de metilo evaluando el efecto de la carga metálica son mostrados en la tabla 5.
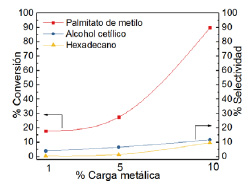
Figura 9 Efecto de la carga metálica de los catalizadores mixtos en la conversión y selectividad para la hidrogenación de palmitato de metilo a 4 h de reacción.
Tabla 5 Conversión y selectividad de los catalizadores en la hidrogenación de palmitato de metilo a 4 h de reacción.
| Catalizador (h) | Conversión palmitato de metilo (%) | Selectividad alcohol cetílico (%) | % Rendimiento alcohol cetílico | Selectividad hexadecano (%) |
| 1 % RuFe(4:1) | 18 | 3,9 | 0,7 | 1 |
| 5 % RuFe(4:1) | 28 | 6,6 | 1,8 | 2 |
| 10 % RuFe(4:1) | 90 | 12 | 10,8 | 10 |
Efecto de la relación molar Ru/Fe
La figura 10 muestra el efecto de la relación molar Ru/Fe sobre la conversión y selectividad hacia alcohol cetílico para la hidrogenación de palmitato de metilo. Se fijó una carga metálica de 10 % y se evaluó distintas relaciones molares Ru/Fe. El catalizador monometálico 10 % Ru(1)Fe(0) presenta 100 % de conversión, pero no es selectivo debido a la hidrogenólisis hacia hidrocarburos como pentadecano y hexadecano. Si bien, la adición de Fe aumenta la selectividad hasta 12 % para el catalizador 10 % Ru(4)Fe(1), sin embargo, para el catalizador de 10 % Ru(1)Fe(1) disminuye la selectividad debido probablemente a la presencia de aglomeraciones de FeOx evidenciado en su difractograma (figura 6) y posiblemente inhiben la actividad hidrogenante del Ru debido al desplazamiento hacia bajas temperaturas de desorción de hidrógeno de los catalizadores soportados a 350 ºC respecto al catalizador monometálico en su primer sitio de adsorción (figura 8). Las actividades y selectividades hacia alcohol cetílico en la hidrogenación del palmitato de metilo evaluando el efecto de la relación molar Ru/Fe se presentan en la tabla 6.
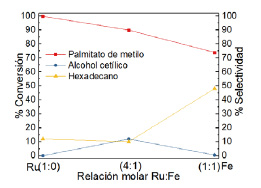
Figura 10 Efecto de la relación molar entre Ru:Fe en la conversión y selectividad para la hidrogenación de palmitato de metilo a 4 h de reacción.
Tabla 6 Efecto de la relación molar Ru/Fe en la conversión y selectividad a alcohol cetílico de los catalizadores soportados en la hidrogenación de palmitato de metilo a 4 h de reacción.
| Catalizador (h) | (%) | Selectividad alcohol cetílico (%) | % Rendimiento alcohol cetílico | Selectividad hexadecano (%) |
| 10 % Ru(1)Fe(1) | 74 | 0,5 | 0,4 | 48 |
| 10 % Ru(4)Fe(1) | 90 | 12 | 10,8 | 10 |
| 10 % Ru(1)Fe(0) | 100 | 0 | 0 | 37 |
Efecto de la interacción metal-soporte
La titania es un óxido reducible que puede promover interacciones metal-soporte en la superficie, evidenciado en los perfiles TPD de H2. Este efecto consiste en la exposición del soporte a alta temperatura y presión de H2 molecular, esto conlleva a la reducción de los iones Ti+4 hacia Ti+3 lo cual provoca una interacción con el metal activo Ru creando vacantes superficiales, las cuales favorecen la formación de sitios ácidos selectivos para la hidrogenación específica en posición carbonílica del palmitato de metilo20. El palmitato de metilo (C17H34O2) es un metiléster con un enlace doble en el grupo carbonilo (C=O), donde los pares libres de electrones presentes en el oxígeno son atraídos por los sitios ácidos creados por las vacantes superficiales en el soporte y el promotor de Fe. Entonces, la superficie del catalizador es descrita por la interacción metal-soporte y la quimisorción del hidrógeno por el Ru, evidenciado por los perfiles TPD-H2 (figura 8).
CONCLUSIONES
La titania preparada por el método sol-gel presentó mejores propiedades texturales: superficie específica (96 m2g-1), volumen de poro (0,19 cm3g-1) y una mejor distribución promedio del tamaño de poro para mejorar la deposición dispersa de la fase activa. Los difractogramas de los catalizadores mostraron que los metales depositados en la superficie del soporte se encuentran altamente dispersos en los poros con posibles aglomeraciones en la superficie del soporte. Los perfiles de desorción de hidrógeno revelaron una interacción metal-soporte mejorando la actividad catalítica. El catalizador 10 % Ru(4)Fe(1) tiene un alto consumo de hidrógeno, según su perfil de reducción para el metal activo, presentando una actividad del 90 % para la hidrogenación del palmitato de metilo y una selectividad máxima del 12 %, con un rendimiento del 10,8 % hacia alcohol cetílico. La adición de Fe como promotor mejoró drásticamente la selectividad hasta 12 %, en comparación con su contraparte monometálica, debido a la formación de sitios ácidos alrededor de Ru promoviendo la hidrogenación en posición carbonílica.