Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130X
Rev Med Hered v.6 n.3 Lima abr. 1995
Infecciones causadas por Candida spp. Resistente al fluconazol en pacientes con el síndrome de inmunodeficiencia adquirida (SIDA). Reporte de un caso.
Infection due to Candida spp. resistant to fluconazole, in patients with AIDS. A case report
Moreno José *, Scerpella Ernesto*, Rastogi Arcana*, Sasken Harvey**.
*Sección de Inmunología Especial del Departamento de Medicina. Escuela de Medicina, Universidad de Miami. Miami – Florida. USA.
**Departamento de Patología. Escuela de Medicina, Universidad de Miami. Miami – Florida. USA.
SUMMARY
Large, ulcerative lesions over the skin scalp, and oral mucosa were observed in a patient with acquired immunodeficiency syndrome (AIDS) receiving chronic suppressive therapy with fluconazole. Candida glabrata was recovered in culture from biopsy material, and was found to be resistant to reported frequency of infections with Candida spp. resistant to fluconazole has increased in recent years. We review the literature regardin fluconazole resistant infections in patients with AIDS, discuss the possible mechanisms of resistance, and management options.
KEYWORDS: AIDS, Candida, fluconazole.
INTRODUCCION
En años recientes se ha observado un aumento marcado en las infecciones causadas por Candida spp. (incluye C. albicans y otras especies de Candida), infecciones que tienden a ocurrir especialmente en huéspedes inmunocomprometidos. En los Estados Unidos en particular ha habido un aumento de más de 400 por ciento en la frecuencia reportada de candidemias entre 1980 y 1989 (1). Al mismo tiempo, la candidiasis orofaríngea se ha constituído en la infección que más frecuentemente afecta a los pacientes infectados con el virus de la inmunodeficiencia humana (VIH) (2).
Fluconazol es un agente triazol hidrosoluble con una biodisponibilidad de más del 90% cuando se administra oralmente, que debido a su alta eficacia y tolerabilidad se ha convertido en una de las drogas más usadas para el tratamiento de las infecciones causadas por Candida spp(3). En el caso de los pacientes con infección avanzada por VIH o con el síndrome de inmunodeficiencia (SIDA), la candidiasis orofaríngea es una infección muy difícil de erradicar, que muchas veces adquiere carácter de cronicidad con contiguas recaídas. Cuando a pesar del uso de diversos agentes tópicos o de ketoconazol no es posible lograr controlar la enfermedad, el uso continuo o intermitente a largo plazo de fluconazol se vuelve prácticamente mandatario como única alternativa al uso de anfotericina B, debido a la baja toxicidad del fluconazol la posibilidad de administración por vía oral (4,6). El uso difundido, a larga escala, y a veces indiscriminado del fluconazol en pacientes VIH-positivos (o con SIDA) es una materia de creciente preocupación debido a la posibilidad de que puedan emerger (o ser seleccionadas) especies de hongos resistentes al fluconazol (7,9); y también debido a la posibilidad de que podamos comenzar a ver en nuestros pacientes presentaciones atípicas de una enfermedad que de otra manera es bastante común y bastante fácil de reconocer.
En el presente trabajo describimos un paciente con SIDA quien desarrolló infección severa con una cepa de Cándida resistente al fluconazol e itraconazol, y cuya presentación clínica fue extremadamente atípica. Asimismo, intentaremos poner en perspectiva información reciente aparecida en la literatura referente a las infecciones causas por Cándida spp. Resistentes al fluconazol en pacientes VIH positivos.
Caso clínico
El paciente era un varón de 43 años conocido por ser VHI positivo desde 1986, quien se presenta en enero de 1994 con un cuadro clínico de 4 semanas de evolución caracterizado por odinofagia y la presencia de una extensa candidiasis pseudomembranosa de la cavidad oral. En paciente había estado tomando fluconazol (200 mg/día, vía oral) desde junio de 1992 para tratamiento de una candidiasis oral recurrente. Al momento de presentación, su conteo de células CD4+ era de 3 células/mm3. Al examen físico, se evidenció la presencia de candidiasis oral de tipo pseudomembranoso además de una ulceración de 1 cm en la mucosa bucal izquierda y una úlcera de 2 cm en la mucosa oral derecha cubierta con un material blanquecino. No se observó evidencia de esofagitis en el esofagograma baritado. Al paciente se le inició terapia con anfotericina B intravenosa, con mejoría inicial de sus síntomas después de 4 días de tratamiento. Sin embargo, una biopsia de la lesión en la mucosa oral derecha demostró tejido necrótico con presencia de elementos filamentosos en gran número, sugestivos de la presencia de Actinomyces spp. Se iniciaron discusiones y consultas acerca de la necesidad de emplear penicilina en altas dosis en consideración de que Actinomyces pudiera ser la causa de las lesiones orales ulcerativas. Sin embargo, en ese momento el paciente decidió abandonar el hospital en contra del consejo de sus médicos.
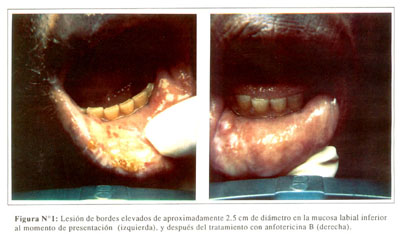
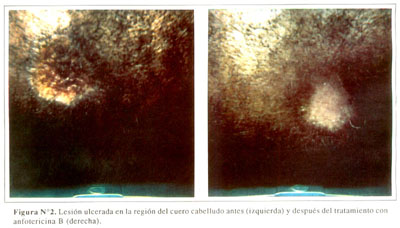
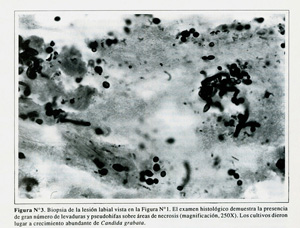
El paciente en mayo en 1994 con una historia de por lo menos 4 semanas caracterizada por la aparición de lesiones orales recurrentes que le ocasionaban un dolor severo. En esta ocasión, el examen físico reveló una lesión de bordes elevados de aproximadamente 2.5 cm de diámetro en la mocosa labial inferior, en una ubicación diferente con respecto a las lesiones observamos meses antes ( Figura Nº1, izquierda). También se observaron varias ulceraciones superficiales a lo largo de la línea de la encía. Además, se observaron otras lesiones ulceradas en la región inguinal derecha, perineo y cuero cabelludo ( Figura Nº2, izquierda). El paciente fue tratado inicialmente con penicilina intravenosa y fluconazol vía oral (400 mg/d) por varios días sin obtener mejoría, por lo que se obtuvo una biopsia de la lesión en la mucosa labial. El examen histológico de la biopsia demostró la presencia de un gran número de lavaduras y pseudohifas sobre áreas de necrosis ( Figura Nº3). Los cultivos obtenidos de las lesiones orales y perineales dieron lugar a crecimiento abundante de Candida glabrata.
El paciente fue tratado nuevamente con anfotericina B intravenosa, recibiendo una dosis total de 800 mg. La lesión labial sanó casi por completo ( Figura Nº1, derecha), y las otras lesiones mostraron de un 60% a 70% de mejoría ( Figura Nº2, derecha). Las pruebas de susceptibilidad demostraron que C. glabrata tenía una concentración mínima inhibitoria (MIC) para fluconazol de 50 µg/ml, y para itraconazol de 16µ/ml. De acuerdo a las definiciones usadas por nuestro laboratorio de referencia (10), el organismo en este caso fue clasificado como resistente a ambos, fluconazol e itraconazol. El MIC para ketoconazol fue de 0.8µg/ml (susceptible).
DISCUSION
Candidiasis es probablemente la infección más frecuente en pacientes infectados con VIH. Además de la localización orofaríngea, también se observa con bastante frecuencia compromiso de la mucosas vaginal y esofágica. Las medicaciones disponibles para el tratamiento de las infecciones por Candida spp. Son razonablemente efectivas, aunque rara vez curativas en esta situación, y por ello es que se ha venido utilizando un muchos casos terapia de mantenimiento con fluconazol (6). El uso prolongado del fluconazol en pacientes VIH positivos puede explicar en parte el creciente problema de resistencia clínica y micológica observado con esta droga (11-12).
En este grupo es importante aclarar que cuando hablamos de resistencia del fluconazol para resolver los signos y síntomas de la infección. Cuando hablamos de resistencia micológica nos referimos a la falla del fluconazol en erradicar el hongo (persistencia de cultivos positivos) o a la presencia de un MIC elevado, hallazgos ambos difíciles de interpretar o de menor importancia si es que el paciente mejora clínicamente. Existe cierta dificultad en interpretar MICs en el caso de hongos debido a la gran variabilidad en los métodos utilizado (10,13), y en todos los casos en que se analicen MICs siempre debe existir una corrección con el resultado clinico obtenido.
Los ejemplos más claros de resistencia al fluconazol han sido vistos en pacientes con VIH y SIDA, en quienes se ha observado que la resistencia al fluconazol parece ligada a los estadios avanzados del SIDA, y a la dosis total acumulada recibida (14). A partir del año 1991 han aparecido en la literatura por lo menos 30 publicaciones reportando la ocurrencia de resistencia al fluconazol en pacientes recibiendo tratamiento para candidiasis orofaríngea. De estos reportes se puede concluir que el escenario típico incluye pacientes con SIDA avanzando (CD4+ usualmente por debajo de 50 células/mm3) que presentan recurrencias frecuentes de candidiasis en la cavidad oral y que vienen recibiendo terapia de mantenimiento (o han recibido cursos repetidos de tratamiento) con fluconazol debido a la falla de otros medicamentos. Eventualmente una de estas recurrencias deja de responder a las dosis usuales de fluconazol (100-200 mg/día), por lo que la dosis es duplicada, obteniéndose una mejoría temporal. Al poco tiempo el paciente deja de responder a esta nueva dosis y el proceso se repite, llegándose a dosis tan altas como 800 mg/d o más, a las que el paciente ya no responde. Si se hacen los cultivos apropiados en ese momento, encontramos que el paciente es portador de una Candida cuyo MIC para fluconazol está generalmente por encima de 64µg/ml.
La presencia de Candida spp. Resistentes al fluconazol en pacientes con SIDA puede ser explicada de tres diferentes maneras: 1) el organismo inicialmente presente es susceptible, pero a través de una sucesión de mutaciones se convierte en resistente; 2) el paciente está inicialmente colonizado o infectado con múltiples cepas de Candida (resistentes y sensibles) y es la especie que es inherentemente resistente la que es seleccionada; y 3) el organismo inicialmente presente es inherente resistente.
La primera posibilidad probablemente se aplica a la gran mayoría de los pacientes con SIDA, y ha sido bien documentado que cepas inicialmente sensibles al fluconazol pueden, a través de una serie mutaciones, incrementar gradualmente el MIC para fluconazol (lo que correlaciona con el incremento gradual de la dosis utilizadas para el tratamiento). La tercera posibilidad (resistencia inicial) parece ocurrir infrecuentemente en el caso de Candida albicans, pero puede ser vista cuando la cepa infectante es no-albicans (como es el caso de C. Krusei, C. tropicales y otras). Los MICs de las especies no-albicans tienden a ser elevados desde un inicio, y la presencia de cualquiera de ellas está asociada a una mayor posibilidad de resistencia clínica. Nuestro paciente se presentó con extensas lesiones ulcerativas en la mucosa oral, piel, y cuero cabelludo. Una presentación tan atípica de candidiasis no ha sido reportada anteriormente, y puede ser debida a las características del organismo involucrado, y puede ser debida a las características del organismo involucrado (en este caso C. glabrata) en combinación con el grado avanzado de inmunosupresión de este paciente. Creemos también que el uso previo y continuado de fluconazol ayudó a su selección. Candida glabrata (conocida también como Torulopsis glabrata), es una de las especies no-albicans más frecuentemente aisladas en la presencia de enfermedad clínicamente resistente al uso de fluconazol (12-15).
Desde el punto de vista práctico, cuando confrontamos pacientes con SIDA y candidiasis orofaríngea o esofágicas que no responde al uso de fluconazol en las dosis usuales (50-200 mg/d) debemos considerar varios factores, como: 1) es candidiasis el diagnóstico correcto?. Otras posibles etiologías infecciosas (herpes simples, citomegalovirus) y no infecciosas (linfomas, úlceras idiopáticas, sarcoma de Kaposi) deben ser consideradas; 2) si el paciente está tomando las medicaciones prescritas; 3) ¿existe alguna interacción con otra droga (ejemplo rifampicina) que pueda hacer menos efectivo al fluconazol?.
Si ninguno de estos factores es identificado, las alternativas para tratamiento son el uso de fluconazol en dosis elevadas (400-800 mg/d), teniendo en cuenta que el incremento del MIC para fluconazol usualmente ocurre en forma gradual, y en muchos casos es posible lograr una buena respuesta clínica elevando la dosis de tratamiento de esta manera. Alternativamente, se puede utilizar itraconazole o ketoconazole, siendo conscientes de que inusualmente puede ocurrir resistencia cruzada con algunas de estas drogas como en el caso de nuestro paciente. Como último recurso, o si la condición del paciente así lo exige (enfermedad grave), se puede utilizar anfotericina B por vía intravenosa.
Sea que fluconazol es la causa o estímulo para las mutaciones que confieren la resistencia al mismo, o sea que la selección de la cepa resistente es en cierta forma un efecto del uso de esta droga, lo cierto es que la resistencia a fluconazol es ya un problema para muchos pacientes con SIDA. Es probablemente necesario abandonar la práctica de tratar a todos los pacientes crónicamente (profilaxis primaria o secundaria) con fluconazol. El uso intermitente (sólo en presencia de una infección asintomática), en dosis altas (por encima de 200mg/k) y por tiempo corto (5-7 días), puede ser una alternativa preferible para minimizar la aparición de resistencia.
REFERENCIAS BIBLIOGRAFICAS
1. Banerjee SN, Emori TG, Culver DH, et al. Secular trends in nosocomial primary bloodstream infections in the United States, 1980-1989. Am J Med 1991; 91 (suppl 3 B): 86S-89S. [ Links ]
2. Glatt AE, Chirgwin K, Landesmann SH. Treatment of infections associated with immunodeficiency virus. N Engl J Med 1988; 318: 1439-1448. [ Links ]
3. Richardson K, Cooper K, Marriott MS, Tarbit MH, Troke PF, Whittle PJ. Discovery of fluconazole, a novel antifungal agent. Rev Infect Dis 1990; 12(Suppl3): S267-S271. [ Links ]
4. Nightingale SD, Cal SX, Peterson DM, et al. Primary prophylaxis with fluconazole against systemic fungal infections in HIV-Positive patients. AIDS 1992; 6: 191-194. [ Links ]
5. Steven DA, Greene SI, Lang OS. Thrush can be prevented in patients with acquired immunodeficiency syndrome and the acquired immunodeficiency syndrome-relate complex. Arch Intern Med 1991; 151: 2458-2464. [ Links ]
6. Just-Nubling G, Gentschew G, Meibner K, Odewal J, Staszewski S, Helm EB, Stile W, Fluconazole prophylaxis of recurrent oral candidiasis in HIV-Positive patients. Eur J Clin Microbiol Infect Dis 1991; 10: 917-921. [ Links ]
7. Sanguineti A, Carmichael JK, Campbell K. Fluconazole-resistant Candida albicans after long-term suppressive therapy. Arch Intern Med 1993; 153: 1122-1124. [ Links ]
8. Fox R, Neal KR, Leen CLS, Ellis ME, Mandal BK. Fluconazole resistant Candida in AIDS. J Infect 1991; 22: 201-204. [ Links ]
9. Willocks L, Leen CLS, Brettle RP, Urquhart D, Russell TB, Milne LJR. Fluconazole resistance in AIDS patients. J Antimicrob Chemother 1991; 28: 937-939. [ Links ]
10. National Committee for Clinical Laboratory Standards. Reference method for broth dilution antifugal susceptibility testing for yeasts: proposed standard M27-P. Villanova Pa, : National committee for Clinical Laboratory Standars; 1992. [ Links ]
11. Wheat LJ, Goldman M. Antifugal prophylaxis in AIDS: should it be the standard of care? AIDS Clin Care 1994; 6: 27-30. [ Links ]
12. Walsh T, Peter J, Damron S. Higham C, et al. Emergence of resistance to fluconazole in HIV-infected children. En: Infectious Diseases Society of America, Program and abstracts of the Infectious Diseases Society of America. Annual Meeting. Orlando, Florida: Infectious Diseases Society of America; 1994. [ Links ]
13. Rex JH, P faller MA. Rinaldi MG, Polak A. Galgiani JN. Antifungual susceptibility testing. Clin Microbiol Rev 1993; 6: 367-381. [ Links ]
14. Rex JH, Rinaldi MG, Pfaller MA. Resistance of candida specie to fluconazole. Antimicrob Agents Chemother 1995; 39: 1-8. [ Links ]
15. Nguyen MH, Peacock J, Morris AJ, Tanner DC, Nguyen ML, Snydman DR, Yu VL. The changing face of candidemia: results of large scale prospective multicenter study. En: American Society for Microbiology. Program and abstracts of the 34th Interscience Conference on Antimicrobials Agents and Chemotherapy. Orlando, Florida: American Society for Microbiology; 1994. [ Links ]
Correspondencia:
Ernesto G. Scerpella, MD.
University of Miami School of Medicine
Section of Special Immunology (D-90A).
P.O. Box 016960. Miami, FL 33101.
Teléfono: 305-548-4598
Fax: 305-547-4037.