INTRODUCCIÓN
La desmineralización y la remineralización del esmalte dental son procesos cíclicos y dinámicos que ocurren en la boca 1-3 La desmineralización es el proceso mediante el cual los minerales, como el calcio y el fosfato, son disueltos de la superficie del esmalte debido a la acción de los ácidos, debilitando así la estructura del diente. Por otro lado, la remineralización es el proceso de reposición de los minerales perdidos durante la desmineralización; en este proceso, la acción de la saliva juega un rol fundamental, ya que regresa los calcios y fosfatos perdidos al tejido dental (4, 5).
Estos procesos son especialmente importantes en dos enfermedades bucales altamente prevalentes, que son la caries y la erosión dental. La erosión dental es un proceso en el cual los tejidos dentales se desgastan debido a la acción de ácidos, ya sea de origen extrínseco o intrínseco. El origen extrínseco proviene de los ácidos de la dieta, el consumo excesivo de bebidas carbonatadas o ácidas o algunos hábitos; y el origen intrínseco proviene del reflujo ácido del estómago y vómitos frecuentes. En tanto que la caries dental es causada principalmente por bacterias que producen ácidos a partir de azúcares y almidones en la boca (6, 7). La saliva juega un papel importante en la remineralización del esmalte dental, ya que ayuda a regular el pH de la boca y estimula el flujo salival. Un pH alcalino y un aumento del flujo salival favorecen la remineralización al desplazar el equilibrio químico hacia la precipitación de minerales y al proporcionar los minerales necesarios para la formación de cristales de hidroxiapatita 8
Existen pacientes que pueden tener problemas de sequedad bucal producto principalmente de la disminución de la secreción salival, frecuente en personas de edad avanzada y en pacientes con tratamiento farmacológico. En estos pacientes se aprecia aumento del riesgo de desarrollar caries, enfermedad periodontal, candidiasis, entre otros. En este contexto, el empleo de saliva artificial está indicado como paliativo, en tanto se resuelvan las causas etiológicas de la xerostomía (9, 10).
La saliva artificial puede tener propiedades remineralizantes gracias a su contenido de minerales, como el calcio y el fosfato, que son esenciales en el proceso de remineralización del esmalte dental, promoviendo así la formación de cristales de hidroxiapatita y mejorando la resistencia del esmalte a la descomposición ácida causada por las bacterias en la placa dental o el ataque ácido de diversos agentes (7, 11).
Los sustitutos de saliva han demostrado ser útiles para el alivio de la boca seca. Son confeccionados con un pH neutro y contienen electrolitos en concentración similar a la saliva normal. Su matriz corresponde a mucina o metilcelulosa. Los productos basados en mucina son mejor tolerados y presentan una duración mayor. Se encuentran disponibles como sprays, enjuagues y gel 12
Una saliva artificial presente en el mercado peruano es el Salival® Solución, que es un preparado de saliva sintética semejante a la mezcla de la secreción de los tres pares de glándulas salivales (parótida, submaxilar y sublingual). Se caracteriza por ser un líquido incoloro, algo opalescente y viscoso. Su composición es muy semejante a la saliva natural, especialmente a sus iones inorgánicos Ca++, Mg++, K++ y Cl- y en la relación porcentual de estos iones con respecto al elevado volumen acuoso purificado. Asimismo, tiene una viscosidad y un pH equivalentes a la saliva natural.
El presente estudio in vitro tuvo como objetivo evaluar el efecto remineralizante de una saliva sintética en el esmalte dental bovino erosionado.
MATERIALES Y MÉTODOS
Muestras
Se compraron las cabezas de los bovinos beneficiados por razones comerciales, es decir, destinados al consumo. Luego se procedió con la extracción de los incisivos mandibulares permanentes. Los dientes seleccionados estuvieron libres de fisuras, fracturas, hipoplasia y lesiones de mancha blanca; posteriormente, se almacenaron en una solución de timol al 0,1 % (pH 7,0). Basados en estudios previos realizados, se determinó utilizar 10 muestras de esmalte bovino por grupo de estudio (13, 14). Se preparó 50 bloques de esmalte de dientes de bovino (4 mm × 4 mm × 1 mm) a partir de la superficie vestibular de la corona bovina. Los especímenes se cortaron utilizando un disco de diamante de baja velocidad. Las superficies se pulieron usando lijas de agua de granulación 600, 800, 1000, 1200, 1500, 1800 y 2000 para obtener una superficie homogénea en todas las muestras. Finalmente, estas se encajonaron en resina acrílica para facilitar su manipulación, y se mantuvieron en 100 % de humedad con agua destilada hasta el comienzo del experimento.
Grupos de estudio
Las muestras fueron divididas aleatoriamente en cinco grupos de estudio según el tratamiento:
Grupo A: Colgate Total® (pasta de dientes que contiene fluoruro)
Grupo B: MI Paste Plus® (pasta de dientes que contiene fosfopéptido de caseína- fosfato de calcio amorfo [CPP-ACP] con fluoruro)
Grupo C: Salival® Solución (saliva sintética)
Grupo D: Control agua destilada
Grupo E: Control muestras de esmalte sin tratamiento ni ciclo ácido
Procedimientos
Todos los especímenes de los grupos A, B, C y D recibieron ataques ácidos, sumergiendo el esmalte bovino de todas las muestras (diez por grupo) en un recipiente con 6 mL de ácido cítrico al 0,5 % durante 2 min a temperatura ambiente a las 0, 8, 24 y 32 horas. Se lavó con agua destilada luego de cada ataque ácido. Las muestras del grupo E no recibieron ataque ácido.
Después de cada ataque ácido, se aplicó las pastas de dientes correspondientes a cada grupo de tratamiento durante 3 minutos con un cepillo eléctrico y luego se lavó con agua destilada.
Durante todo el proceso, las muestras de los grupos A, B y C se conservaron en saliva artificial, la misma que se cambió diariamente. Por otro lado, las muestras correspondientes al grupo D se conservaron en agua destilada hasta el siguiente ataque ácido. Las muestras del grupo E se conservaron en agua destilada. Luego se procedió a evaluar el grado de mineralización mediante microscopía Raman y la microdureza superficial mediante microdureza Vickers.
Grado de mineralización
Se evaluó el grado de mineralización con microscopía Raman, utilizando para ello un microscopio Raman confocal alpha 350RA (WITec GmbH, Ulm, Alemania) del Laboratorio de Micología y Biotecnología «Marcel Gutiérrez-Correa» de la Universidad Nacional Agraria La Molina, equipado con un láser de 785 nm de longitud de onda (50 mW de potencia) y un espectrómetro UHTS (300 líneas/mm) con cámara CCD como detector.
En cada muestra se midió 20 puntos equidistantes a lo largo de una línea de 85 μm, y en cada punto se tomó 20 espectros Raman de 0,1 s cada uno y se promediaron. La ubicación de la zona de estudio en cada espécimen se llevó a cabo usando un objetivo Zeiss EC de 50 aumentos e iluminación Köhler de luz blanca LED con la que cuenta el microscopio Raman.
Se obtuvieron los espectros característicos del esmalte dental con base en la concentración de los compuestos moleculares. Se contabilizó el valor otorgado al área del pico correspondiente al modo vibracional del ion fosfato v1 para calcular el grado de mineralización normalizando todos los valores respecto al encontrado en el grupo E.
Microdureza superficial
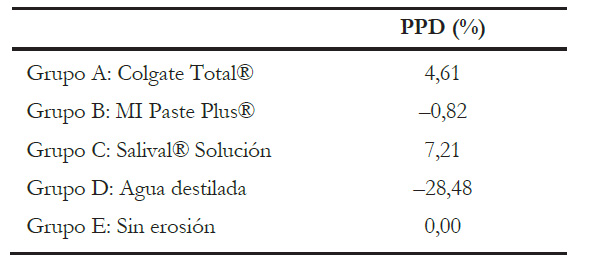
Se evaluó la dureza superficial, utilizando un microdurómetro Vickers marca LG (HV 1000). Se midió la microdureza después del ciclo ácido con 50 g de presión por 5 segundos. Se registró 5 medidas de microdureza por cada espécimen y se obtuvieron los valores en kg/mm2. Además, se analizó el porcentaje de pérdida de dureza (PPD) respecto al grupo E.
Análisis estadístico
En el análisis estadístico de los datos de microdureza y cantidad relativa de mineral obtenidos por ensayos de dureza Vickers y microscopía Raman, respectivamente, se utilizó el software STATA 16 (StataCorp LLC, Texas, EE. UU.). Para la estadística descriptiva se consideraron los valores medios y las desviaciones estándar de cada grupo de estudio, así como gráficos de caja para una mejor observación de los datos. Para la estadística inferencial, primero se realizó el test de Bartlett para evaluar la homocedasticidad. Una vez verificada la homogeneidad de varianzas, se procedió a realizar la prueba de ANOVA de un factor para encontrar diferencias entre grupos con una significancia del 5 % (p = 0,05). Seguidamente, se realizó el postest de Bonferroni para comparar las medias entre grupos.
RESULTADOS
La figura 1 muestra el diagrama de cajas en cuanto al grado de mineralización mediante microscopía Raman, en el cual se puede observar que la actividad remineralizante en esmalte de bovino, producida por la saliva artificial Salival® Solución, es similar a las pastas Colgate Total® y MI Paste Plus®.

Figura 1 Diagrama de cajas del grado de mineralización en los grupos estudiados. La estrella indica el grupo con diferencias significativas respecto a los demás al nivel de 0,05.
En la tabla 1, se presentan los valores de media y desviación estándar de los grados de mineralización obtenidos. El test ANOVA determinó que existían diferencias significativas entre los grupos, y mediante el postest de Bonferroni se pudo ver que el grupo de especímenes sometidos a ciclo erosivo y almacenados en agua destilada presentó diferencias significativas respecto al grupo control sin erosión (p < 0,05), mientras que los demás grupos (Colgate Total®, MI Paste Plus y Salival® Solución) no mostraron diferencias significativas frente a dicho grupo control.
Tabla 1 Estadísticos descriptivos de los resultados obtenidos de grado de mineralización en los grupos estudiados.
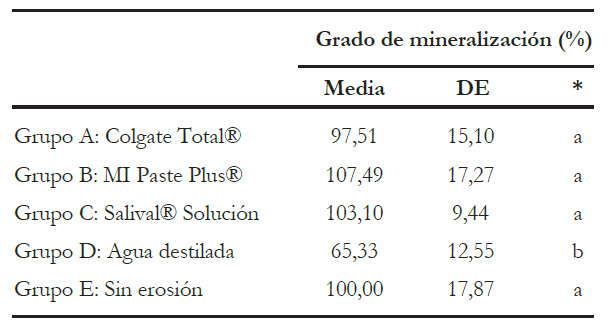
* Comparación entre grupos mediante ANOVA y el postest de Bonferroni. Letras diferentes representan grupos con diferencias significativas (p < 0,05).
La figura 2 muestra el diagrama de cajas en cuanto a la microdureza superficial, en la cual, de manera similar al caso anterior, la prueba ANOVA determinó que existían diferencias significativas entre los grupos; y mediante el postest de Bonferroni se pudo ver que el grupo de especímenes sometidos a ciclo erosivo y almacenados en agua destilada presentó valores de microdureza con diferencias significativas respecto al grupo control sin erosión (p < 0,05). Por otra parte, los demás grupos (Colgate Total®, MI Paste Plus® y Salival® Solución) no mostraron diferencias significativas frente a dicho grupo control.
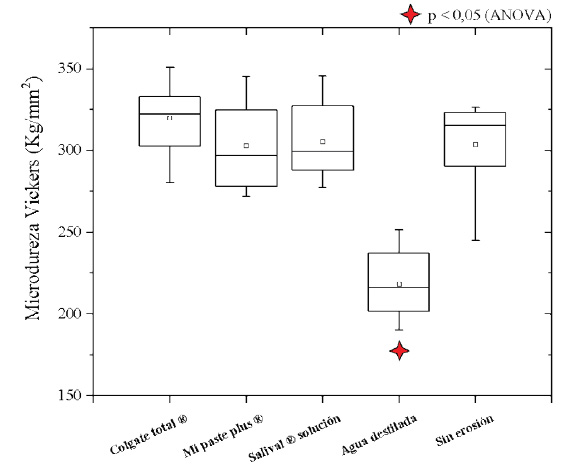
Figura 2 Diagrama de cajas de la microdureza Vickers en los grupos estudiados. La estrella indica el grupo con diferencias significativas respecto a los demás al nivel de 0,05.
Los valores de media y desviación estándar se presentan en la tabla 2. Además, la tabla 3 muestra el PPD. En ella se puede observar que el grupo D sometido a ciclo erosivo y almacenado en agua destilada pierde un 28,48 % de microdureza superficial significativamente en comparación con el grupo control sin ciclo erosivo.
Tabla 2 Estadísticos descriptivos de los resultados obtenidos de microdureza Vickers en los grupos estudiados.
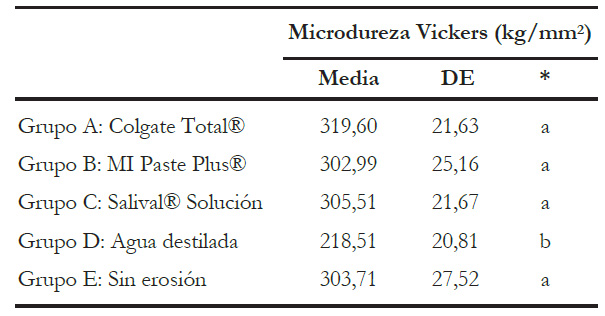
* Comparación entre grupos mediante ANOVA y el postest de Bonferroni. Letras diferentes representan grupos con diferencias significativas (p < 0,05).
DISCUSIÓN
El objetivo de este estudio fue evaluar in vitro el efecto remineralizante de una saliva sintética mediante la evaluación del grado de mineralización del esmalte y la microdureza superficial, utilizándose para ello esmalte de bovino previamente sometido a ciclo erosivo. Encontramos que el efecto que produce la saliva sintética Salival® Solución es similar a las pastas comerciales Colgate Total® y MI Paste Plus®.
Un agente remineralizante se puede definir como una sustancia capaz de promover la remineralización del tejido dental 15 La saliva es el agente remineralizante natural por excelencia 7 y, al mismo tiempo, un vehículo clave para fomentar la remineralización del esmalte a través de otros agentes remineralizantes. Bajo condiciones fisiológicas, logra, de manera eficiente, mantener el equilibrio entre la sustancia dental y la biopelícula; y en condiciones adversas, cuando por deficiente remoción de la biopelícula o ingesta de azúcares, entre otros, el pH tiende a disminuir, busca revertir el proceso de desmineralización. La desmineralización es un proceso reversible; por lo tanto, los cristales de hidroxiapatita (HA) parcialmente desmineralizados en los dientes pueden crecer hasta su tamaño original si están expuestos a ambientes orales que favorezcan la remineralización 16
La saliva contiene minerales como el calcio y el fosfato en concentraciones adecuadas para remineralizar el esmalte dental. Estos minerales se depositan en la superficie del esmalte y ayudan a fortalecerlo, compensando la pérdida de minerales durante la desmineralización 17-19 Distintos estudios mostraron que la sobresaturación de un sustituto de la saliva con calcio y fosfatos aumenta significativamente su capacidad para remineralizar las sustancias duras dentarias (17, 18). Así también, los suplementos de fluoruro parecen desempeñar un papel importante en el mantenimiento de la estructura cristalina (16-19). Después de un ataque ácido, el fluido salival amortigua los H+ producidos por las bacterias. Cuando el pH es superior a 5,5, de manera natural se presenta remineralización, ya que la saliva está sobresaturada de Ca+2, PO4ˉ3 y Fˉ con respecto al mineral dental 20
La saliva tiene un pH básico que puede neutralizar los ácidos producidos por las bacterias en la placa dental. Esto ayuda a reducir la acidez en la boca y a prevenir la desmineralización del esmalte dental (7, 9-11).
En los últimos años se ha empezado a exigir un efecto remineralizante a los sustitutos de la saliva, pues algunos de estos tienen un pH considerablemente inferior al valor límite por debajo del cual se sabe que aparece una desmineralización del esmalte (aproximadamente pH 5,5) o de la dentina (aproximadamente pH 6-6,5). Sin embargo, varios estudios han mostrado que no existe una correlación definitiva entre el pH de un sustituto de la saliva y su efecto sobre los tejidos duros dentarios (9, 10).
La gama amplia de productos disponibles actualmente y las distintas formas farmacéuticas facilitan la elección del producto más adecuado para cada paciente, pero se deben recomendar preferiblemente aquellos con un pH neutro, con suplementos de fluoruro y un contenido lo más elevado posible en calcio y fosfatos 11 De acuerdo con las especificaciones de Laboratorios Unidos S. A. (LUSA), Salival® Solución tiene en su composición por cada 100 mL: cloruro de sodio (0,084 g), cloruro de potasio (0,120 g), cloruro de calcio dihidratado (0,015 g), cloruro de magnesio hexahidratado (0,005 g), carboximetilcelulosa sódica (0,375 g), propilenglicol (4,000 g), metilparabeno (0,100 g), propilparabeno (0,010 g) y agua purificada c.s.p. (100,00 mL).
La saliva contiene enzimas y proteínas antimicrobianas que pueden ayudar a controlar el crecimiento de bacterias en la placa dental, lo que contribuye a prevenir la formación de caries y a mantener un ambiente oral saludable 7 Por otro lado, algunos sustitutos de la saliva contienen polímeros como sustancias básicas, los cuales parecen influir tanto en la desmineralización como en la remineralización de los tejidos duros dentarios debido a sus propiedades formadoras de película. Además, las mucinas y la carboximetilcelulosa pueden fijar el calcio y limitar, por tanto, el poder remineralizante de un sustituto de la saliva (12, 21-23).
En el presente estudio, el efecto remineralizante logrado por Salival® Solución no difiere significativamente de la situación inicial previa al inicio del ciclo ácido, lográndose la reminealización del esmalte. De otro lado, contrasta significativamente con la muestra control que fue conservada en agua destilada, donde se nota la fuerte desmineralización producida por el ácido cítrico.
Si bien la remineralización mediada por flúor es la piedra angular de las filosofías actuales del manejo de la caries, se han comercializado o se están desarrollando nuevas estrategias que afirman promover una remineralización más profunda de las lesiones, reducir los riesgos potenciales asociados con los productos de cuidado oral con alto contenido de flúor, y facilitar el control de la caries durante toda la vida. Estos sistemas remineralizantes sin flúor pueden clasificarse en tecnologías regenerativas de esmalte biomimético y en enfoques que reparan las lesiones de caries al mejorar la eficacia del fluoruro 24
En el mercado, encontramos principalmente pastas dentales con flúor, pero también hay productos dentales remineralizantes sin flúor. Actualmente, la mayoría de los sistemas remineralizantes sin fluoruro disponibles comercialmente están destinados a mejorar la eficacia del fluoruro, minimizando los potenciales riesgos asociados con el flúor. Estas formulaciones son una alternativa prometedora; sin embargo, es necesario investigar y caracterizar sus capacidades remineralizantes. Estos estudios son especialmente necesarios para los productos que ya están en el mercado, como la nanohidroxiapatita (nHA), el fosfopéptido de caseína-fosfato de calcio amorfo (CPP-ACP), el fosfato tricálcico, el fosfosilicato de calcio y sodio, los fosfatos de calcio amorfo (ACP), los polifosfatos y el trimetafosfato de sodio 24
Los resultados de este estudio muestran comparativamente con las pastas comerciales que el efecto del uso de la saliva artificial utilizada confiere efecto similar a lo obtenido por pastas dentales con flúor y con CPP-ACP, desde el punto de vista de la remineralización del esmalte.
Los resultados muestran mayor remineralización en el grupo expuesto solo a la saliva sintética. Se debe hacer notar que las muestras que fueron sometidas a las pastas dentales tuvieron proceso de cepillado luego de cada ataque ácido antes de ser sometidas a saliva artificial y que el uso del cepillo eléctrico pudo haber generado cierta pérdida adicional de minerales, en relación con cepillos mecánicos (25, 26).
Carey 27 evaluó la remineralización ex vivo en dientes humanos usando la saliva artificial SalivaMAX® supersaturada de fosfato de calcio y obtuvo un marcado aumento en la remineralización que proporciona alivio para la xerostomía y la mucositis, permitiéndoles remineralizar las lesiones tempranas del esmalte sin el requisito de ciclos de pH ácido.
Estos hallazgos muestran que el uso de la saliva artificial Salival® Solución es efectivo para la remineralización del esmalte en condiciones in vitro y que potencialmente podría complementar la actividad de las pastas dentales.
Como limitaciones de este estudio in vitro, podemos mencionar que, si bien en la metodología se uniformiza para todas las muestras el uso de una saliva artificial, no se toman en cuenta las variaciones que podrían presentarse en la fisiología oral y en las características particulares de la saliva presentes en los individuos, por lo que, a la luz de los resultados, se recomienda complementar este estudio con estudios in vivo y estudios clínicos.











 texto en
texto en