Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.28 n.3 Lima jul./set. 2008
ARTÍCULOS DE REVISIÓN
Helicobacter pylori y cáncer gástrico
Helicobarte pylori and gastric Cáncer
Alberto Ramírez Ramos1 y Rolando Sánchez Sánchez2
1 Profesor Emérito – Investigador Universidad Peruana Cayetano Heredia.
2 Médico Residente de Medicina Interna Universidad de Alabama en Birmingham, USA
RESUMEN
Desde el hallazgo e identificación del Helicobacter pylori en material de tejido gástrico por Marshall y Warrent en 1983, nuestro conocimiento sobre esta infección ha evolucionado notablemente. Se acepta al momento actual, su rol su rol dentro de la multifactoriedad de la patología ulcero péptica gastroduodenal y el adenocarcinoma y MALToma gástrico, permaneciendo aun controversial su relación con algunas enfermedades extraintestinales.
Múltiples estudios han demostrado una asociación entre la infección del estómago por el H. pylori y el Maltoma gástrico. Aproximadamente 65 a 80% de casos de adenocarcinoma del estómago distal son atribuidos a la infección por H. pylori. Sin embargo, carcinogenesis gástrica no puede ser solo explicada por la infección por el H. pylori. De los infectados por esta bacteria solo un mínimo porcentaje desarrolla adenocarcinoma gástrico (2-5%). La mayoría presentan lesiones benignas. Existe pues una marcada variación individual del resultado de esta infección en los pacientes. Esta variación individual y poblacional se debería a la compleja interacción de factores genéticos, del medio ambiente, bacterianos, alimentarios y nivel socio económico que explican los diferentes resultados a los que se llega con la infección. En este artículo hacemos una revisión de los conceptos aceptados en relación al cáncer gástrico, al H. pylori, las correlaciones y enigmas descritos entre ambos, las variaciones geográficas reportadas y las diversas hipótesis sobre el mecanismo carcinogénico del Helicobacter pylori.
Palabra clave: Helicobacter pylori, cáncer gástrico.
ABSTRACT
Since its discovery and identification in gastric tissue by Marshall and Warren in 1983, our knowledge about the effects of Helicobacter pylori infection has grown considerably. Its role in the multifactorial pathology of peptic ulcer disease (gastrodudodenal ulcer disease), gastric adenocarcinoma, and MALT lymphoma is now widely accepted while its involvement in extraintestinal disease is still controversial.
The correlation between the colonization of the stomach by H. pylori and gastric lymphoma has been demonstrated in multiple studies. Between 65 and 80% of distal gastric adenocarcinomas are attributed to H. pylori infection. However, gastric carcinogenesis cannot be explained by H. pylori infection alone. Among those individuals infected by this bacteria, only a small percentage (2-5%) ever develops gastric cancer, the majority exhibit benign lesions. There is a wide individual variation in the outcome of this infection in patients. This individual and population specific variation is due to the intricate relationship between genetics, the environment, bacterial virulence, diet, and socio-economic status and it explains the multiple outcomes of this infection. In this article, we conduct a review of the widely accepted theories regarding gastric cancer, Helicobacter pylori, the correlations and enigmas between them, the reported geographical variations, and the various proposed hypotheses on the carcinogenic mechanism of Helicobacter pylori.
Keywords: Helicobacter pylori, gastric cancer.
INTRODUCCIÓN
En 1983 Marshall y Warren reportaron a la comunidad científica el hallazgo en el estómago de pacientes con gastritis y úlcera péptica de una bacteria espirilada Gram negativa a la que denominaron Campylobacter like organism (organismo parecido al Campylobacter) y que hoy conocemos como Helicobacter pylori,1. Esta comunicación fue recibida con gran escepticismo pues hasta entonces se afirmaba que en el estómago no podía sobrevivir ningún microorganismo, debido al pH gástrico ácido, existiendo solo la posibilidad de que hayan gérmenes de paso y que los microorganismos descritos por estos autores australianos se debían a contaminación"2.
Pasó casi una década de incredulidad y controversias hasta que la evidencia acumulada durante ese tiempo sobre el rol patógeno de esta bacteria dentro de la multifactoriedad de la úlcera péptica, gástrica y duodenal, motivó que en el Congreso Mundial de Gastroenterología, realizado en Australia en 1990, se recomendara la erradicación del Helicobacter pylori en todo paciente con úlcera gástrica o duodenal en que se demostrara su presencia"2.
A partir de entonces, vino una explosión de comunicaciones sobre resultados de investigación en diversos campos: Microbiología, Biología Molecular, Epidemiología, mecanismos de patogenicidad, métodos diagnósticos, esquemas de tratamiento, recurrencia, reinfección y vacunación.
De otro lado, frente a la heterogeneidad de resultados de las investigaciones en cada uno de estos campos, y por ende a las controversias resultantes, se iniciaron los consensos para unificar criterios sobre la acción patógena, métodos de diagnóstico, esquemas de tratamiento, entre otros aspectos: Consenso de los Institutos Nacionales de Salud de los Estados Unidos de Norte América (1994), Consenso Latinoamericano (1999), Consenso de Maastricht (1997, 2002 y 2008), Consenso de Colegio Americano de Gastroenterología (2007)2.
Se llega así al momento actual en que se acepta que la infección por esta bacteria desempeña un papel importante en la génesis de la gastritis, úlcera péptica duodenal, úlcera péptica gástrica, cáncer gástrico y linfoma tipo MALT3.
En relación al rol que puede jugar el Helicobacter pylori dentro de la multifactoriedad etiopatogénica del cáncer gástrico, se han publicado muchas evidencias epidemiológicas, habiéndose postulado varias hipótesis para explicarlas. De otro lado, se han expuesto diversos denominados enigmas o variaciones geográficas.
Consideramos que desde el punto de vista epidemiológico no es difícil establecer conclusiones con sustento estadístico. Lo que generalmente es difícil es explicar satisfactoriamente estas relaciones y es el caso también del vínculo Helicobacter pylori - cáncer gástrico - epidemiología.
Se han publicado valiosas revisiones y aportes sobre el tema del cáncer gástrico y Helicobacter pylori3,4,5,6,7, y últimamente novedosas hipótesis en relación al rol que pueden jugar los polimorfismos de citoquinas en el aspecto genético, los genes supresores de tumores, los genotipos bacterianos etc. 8,9,10,11, por lo que creemos pertinente hacer esta revisión en la que trataremos los siguientes aspectos:
-
Conceptos aceptados en relación al Cáncer Gástrico.
-
Conceptos aceptados en relación al Helicobacter pylori.
-
Correlaciones positivas y enigmas Helicobacter pylori.
-
Cáncer Gástrico desde el punto de vista epidemiológico.
-
Variaciones geográficas del cáncer gástrico.
-
Hipótesis planteadas.
a) CONCEPTOS ACEPTADOS EN RELACIÓN AL CÁNCER GÁSTRICO
El adenocarcinoma gástrico (ADCA) es una de las pocas neoplasias malignas para la cual se ha establecido que agentes infecciosos tienen un reconocido e importante rol etiológico 12.
El cáncer gástrico es la cuarta neoplasia maligna más común en el mundo y la segunda causa de muerte por cáncer anualmente, totalizando más de un millón de defunciones por año, siendo el adenocarcinoma del estómago el tumor más frecuente (95%)13.
La incidencia del cáncer gástrico varía en diferentes países y en el mismo país, en diferentes regiones. Se considera población de riesgo aquella en la que la incidencia de cáncer gástrico es mayor de 20/100 mil habitantes13.
Se considera que la presencia de esta bacteria es un factor necesario en la cadena de la carcinogénesis en la mayoría de pacientes que desarrollan ADCA gástrico intestinal o diferenciado13. La revisión sistemática de estudios de casos y controles revela que aproximadamente 65 a 80% de casos de ADCA no cardial (del estómago distal) son atribuidos a la infección por Helicobacter pylori13. En un estudio prospectivo realizado en Taiwán, con un seguimiento de 6.3 años, el cáncer gástrico se desarrolló en 1.3% de pacientes infectados por Helicobacter pylori y 0% en no infectados10.
En otro estudio prospectivo grande en población japonesa, con un seguimiento de 7.8 años, se observó que el 2.9% de los pacientes infectados con Helicobacter pylori desarrollaban cáncer gástrico comparados con 0% en el grupo de los no infectados. En esta población, el cáncer gástrico se desarrollaría en el 5% de personas infectadas por Helicobacter pylori, en un período de 10 años14.
La carcinogénesis gástrica no puede ser sólo explicada por la infección por el Helicobacter pylori. Existe una marcada variación individual del resultado de la infección por esta bacteria en los pacientes. De los infectados por Helicobacter pylori, solo una minoría desarrollan cáncer gástrico (2-5%). La mayoría desarrollan lesiones no neoplásicas10.
La infección por Helicobacter pylori se asocia a una compleja interacción de factores genéticos, del medio ambiente (alimentarios) y bacterianos que explican los diferentes resultados a los que se llega con la infección. Un ejemplo de ello, es que existen algunos países con altas prevalencias de Helicobacter pylori que tienen una baja prevalencia de cáncer gástrico10.
Pese a la erradicación de la infección puede todavía producirse un cáncer gástrico debido a la continua progresión de las lesiones pre-cancerosas. Esto podría deberse a que toma un buen tiempo para que el cáncer gástrico adquiera suficiente tamaño para ser reconocido endoscópicamente.
Estos cánceres pueden ya estar presentes antes de la erradicación. De otro lado la infección prolongada por Helicobacter pylori puede causar cambios irreversibles en la mucosa gástrica, caso en el que puede desarrollarse cáncer gástrico sin la presencia de la bacteria; por lo que sería óptimo erradicar la bacteria15 antes de la producción de dichas lesiones.
Sin embargo aún no se ha determinado la edad óptima de erradicación13.
El ADCA es de dos tipos: intestinal o diferenciado y difuso o no diferenciado los cuales tienen distinta apariencia morfológica, patogénica y genética12.
El tipo intestinal es el más frecuente en las poblaciones de alto riesgo. Mientras la infección empieza en la infancia, hay un largo periodo de latencia y los cánceres son clínicamente diagnosticados tres o cuatro décadas después.
Durante este período tiene lugar un prolongado proceso pre-canceroso representado por una cascada de eventos, histopatológicamente secuenciales: gastritis crónica activa no atrófica; gastritis atrófica multifocal; metaplasia intestinal (completa y luego incompleta); displasia y carcinoma invasivo (Figura 1).
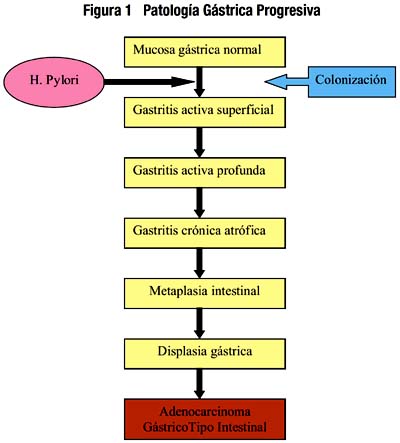
Estudios epidemiológicos y diversos meta-análisis muestran una fuerte correlación entre la serología positiva para Helicobacter pylori y la incidencia de cáncer gástrico16,17,18.
El cáncer de tipo difuso, al igual que el intestinal, puede también ser inducido por la infección por Helicobacter pylori.
Sin embargo hay diferencias importantes entre estas dos variantes, una de ellas es que el cáncer intestinal se caracteriza por una serie de estadios pre-neoplásicos que no se ven en el cáncer difuso. En contraste con el cáncer intestinal, los carcinomas difusos no tienen una lesión pre-cancerosa claramente definida, aún aquellos asociados con la infección por este micro organismo19.
Desde el punto de vista epidemiológico tanto el cáncer intestinal como difuso están disminuyendo en la mayoría de países, aunque la declinación es más marcada en los carcinomas intestinales12.
El cáncer gástrico proximal y gastroesofágico tendrían mecanismos patogénicos similares, a diferencia del carcinoma distal8.
b) CONCEPTOS ACEPTADOS EN RELACIÓN AL H PYLORI
El Helicobacter pylori es una bacteria gram negativa, espirilada y microaerofílica1.
Condiciona la infección bacteriana crónica más común del ser humano, afectando el 60% de la población en países desarrollados y 80% en naciones en vías de desarrollo2.
Existen diferentes cepas bacterianas, cada una con diferentes factores de virulencia (factores de adhesión, toxinas, enzimas, etc). Estos factores de virulencia son los que le permiten adaptarse al medio gástrico y causar un daño continuo en las células del estómago2.
Existen cepas más virulentas que producen una proteína citotóxica asociada al gen A (Cag A +; Vac A +). La infección con estas cepas se ha asociado con mayor daño epitelial y una mayor producción de citoquinas pro-inflamatorias11.
Más del 90% de las cepas de Helicobacter pylori en Lima Perú son CagA+, que se ha relacionado a incremento de riesgo a desarrollar inflamación crónica y cáncer gástrico 20. La infección se adquiere durante la niñez, a edades más tempranas en los países en vías de desarrollo. Las vías postuladas para la transmisión son: fecal-oral, oral-oral, gastro-oral2.
La historia natural de la infección es bastante variable, y aunque todos los pacientes infectados desarrollan una gastritis crónica, no todos desarrollan enfermedad clínica, siendo muchos de ellos asintomáticos. Factores ambientales, bacterianos y del huésped (respuesta inflamatoria generada), determinan la evolución natural de la infección2.
Se ha demostrado que esta infección desempeña un papel importante en la gastritis, ulcera gástrica y duodenal, carcinoma gástrico y Maltoma3. También se ha postulado asociación a enfermedades extraintestinales, aunque la evidencia en este aspecto es aún insuficiente2.
Su prevalencia varía de país a país, e incluso dentro de una misma nación. Está disminuyendo en países desarrollados. En el Perú, en pacientes de nivel socio económicos medio y alto, en los últimos 20 años ha disminuido de 80 a 50%, manteniéndose en 80% en el nivel socio económico bajo2,20,21,22.
Existen diferentes métodos de diagnóstico aprobados para su detección, siendo clasificados en invasivos y no invasivos según el uso o requerimiento de la endoscopía gástrica2.
La bilis tiene un efecto supresor para el crecimiento del Helicobacter pylori y tiene el potencial de erradicar el microorganismo en pacientes con gastrectomía subtotal23.
Se han ensayado diferentes esquemas de tratamiento, sin haberse encontrado el esquema ideal, debido a la resistencia bacteriana a los antibióticos y a una pobre adherencia de los pacientes por los esquemas complejos. Actualmente se cuenta con esquemas de primera, segunda y tercera línea para tratamiento. Se siguen investigando nuevos esquemas2.
En 1994 la Agencia Internacional para Investigación en Cáncer (IARC) y la Organización Mundial de la Salud (WHO) clasificaron al Helicobacter pylori como carcinógeno del grupo 1 (Chang)10.
El sistema más ampliamente utilizado para clasificar los agentes carcinógenos es el de IARC, que es parte de la Organización Mundial de la Salud (WHO). En los últimos 30 años, la IARC ha evaluado el potencial cancerígeno de cerca de 900 candidatos probables, colocándolos en uno de los grupos siguientes:
-
Grupo 1: Carcinógeno para el ser humano Hay pruebas suficientes que confirman que puede causar cáncer a los seres humanos.
-
Grupo 2A: Probablemente carcinógeno para el ser humano Hay pruebas suficientes de que puede causar cáncer a los humanos, pero actualmente no son concluyentes.
-
Grupo 2B: Posiblemente carcinógeno para el ser humano Hay algunas pruebas de que puede causar cáncer a los humanos, pero de momento están lejos de ser concluyentes.
-
Grupo 3: No puede ser clasificado respecto a su carcinogenicidad para el ser humano Actualmente no hay ninguna prueba de que cause cáncer a los humanos.
-
Grupo 4: Probablemente no carcinógeno para el ser humano Hay pruebas suficientes de que no causa cáncer a los humanos.
c) CORRELACIONES POSITIVAS Y ENIGMAS ENTRE HELICOBACTER PYLORI Y CÁNCER GÁSTRICO
Cáncer experimental: Estudios en modelos animales evaluando la presencia de Helicobacter pylori y el desarrollo de Cáncer Gástrico.
Watanabe et al. En 1998 estableció que la infección por largo período con esta bacteria en roedores mongoleanos generaba adenocarcinoma gástrico24.
Estudios epidemiológicos de corte transversal evaluando la presencia de H. pylori en pacientes con cáncer gástrico
Estudio EUROGAST, 17 poblaciones de 13 diferentes países (USA, Japón y 11 países europeos), se observó un riesgo de 6 veces mayor de desarrollar cáncer gástrico en pacientes infectados con Helicobacter pylori comparados con los no infectados16.
Meta-análisis de estudios de cohorte y casos-control observaron que la presencia de serología positiva para Helicobacter pylori se asociaba con un incremento dos veces mayor en el riesgo de desarrollar cáncer gástrico17,18
Estudios prospectivos evaluando el riesgo de desarrollar cáncer gástrico en pacientes con Helicobacter pylori
Uemura et al., en 1526 pacientes japoneses. Luego de 7.8 años 2.9 % de los pacientes con H. pylori y 0% de los no infectados desarrollaron cáncer gástrico14.
Ping-I Hsu, et al., en 1225 pacientes taiwaneses. Luego de 6.3 años 1.3 % de los pacientes con H. pylori y 0% de los no infectados desarrollaron carcinoma gástrico10.
Enigma Asiático
La prevalencia de H. pylori es alta en países asiáticos como la India. En Bangladesh sin embargo la incidencia de cáncer gástrico es baja10.
Enigma Africano
Algunos estudios epidemiológicos en África revelan que la infección con H. pylori no correlaciona con el riesgo de desarrollar cáncer gástrico10
d) VARIACIONES GEOGRÁFICAS EN LA EPIDEMIOLOGÍA DEL CÁNCER GÁSTRICO
En el Perú, en un estudio en pacientes de nivel socio económico alto, se reportó una elevada prevalencia de úlcera duodenal y una baja prevalencia de cáncer gástrico, similar a lo observado en países desarrollados3,7,25.
En el Perú, la prevalencia de la infección del estómago por Helicobacter pylori ha disminuido en el curso de las últimas décadas, así como las enfermedades asociadas a ella (gastritis crónica activa, úlcera péptica y cáncer gástrico)20, 21, 22.
En el Perú los niños se están infectando a edades mayores. El promedio de edad para adquirir la infección ha cambiado de 12 a 18 meses en 1990 a 2.4 años en el 2002. Esto puede dar como resultado una menor duración de la infección, lo que lleva a un menor riesgo de desarrollar metaplasia intestinal y cáncer gástrico2,20.
En el Perú, la infección por Helicobacter pylori empieza en la niñez temprana y es altamente prevalente y persistente a lo largo de la vida2,20.
En Irán, Tibet y el sur de China, se observa una alta prevalencia de úlcera duodenal y baja prevalencia de cáncer gástrico, mientras que en el norte de China ocurre lo contrario.
En Tibet y Bangladesh la frecuencia con la que aparece la gastritis crónica atrófica es baja3,25.
En países del área andina, Colombia y Bolivia tienden a tener prevalencias bajas de úlceras duodenal y altas de cáncer gástrico, al igual que en el Perú. En Costa Rica, Uruguay y Argentina, se tiende a observar una elevada prevalencia de úlcera duodenal y bajas prevalencias de cáncer gástrico y gastritis crónica atrófica25.
Los países con más alto riesgo de cáncer gástrico son Costa Rica, Rusia rural, China, Chile y Japón. Esto contrasta con países con muy baja incidencia como Inglaterra, Noruega, Canadá, Israel, Francia, Suiza, Dinamarca y Cuba26.
En algunos países como en EEUU ha habido una persistente y progresiva disminución de la incidencia y mortalidad por cáncer gástrico (26).
En Chile se ha observado un significativo incremento de cáncer gástrico indiferenciado y difuso y una disminución de tipo intestinal o diferenciado26.
En Chile se observa también un incremento del cáncer gástrico del tercio superior25. Asimismo, como en el resto del mundo el cáncer gástrico es más prevalente en hombres con una relación 1.7:1. En relación a la edad debajo de los 35 años es menor e incrementa progresivamente a partir de esa edad hasta los 80 años26.
En pacientes dispépticos del Reino Unido y Noruega, países con una frecuencia moderada de infección por Helicobacter pylory, la prevalencia de úlcera duodenal y la relación prevalencia ulcera duodenal/ulcera gástrica son altas, mientras que la prevalencia de cáncer gástrico es baja 3,7,25.
En Malasia el cáncer gástrico es el segundo en orden de frecuencia, después del cáncer del colon. Malasia es un lugar multinacional, asiático, representado por tres razas: malasia, china e india. Estas razas se han mantenido relativamente puras, pese a vivir en el mismo ambiente, con sus propias costumbres de vida, dietarias, etc. En un estudio en estas poblaciones, la raza china fue un factor de riesgo independiente para cáncer gástrico27.
El estudio de la infección por Helicobacter pylori en el desarrollo del cáncer gástrico difiere en varios grupos étnicos. La prevalencia de infección por Helicobacter pylori es elevada en varios países asiáticos, como la India y Bangladesh, sin embargo la incidencia de cáncer gástrico en esos países es la más baja del mundo10,27.
Estudios epidemiológicos en África revelan que la infección por Helicobacter pylori no correlaciona con el riesgo de cáncer gástrico10,27.
Este enigma africano y asiático es una muestra de la etiología multifactorial del cáncer gástrico. La dieta ha sido un factor de interés, particularmente en relación al cáncer gástrico. Existen las siguientes observaciones reportadas:
-
En los hindúes la ingesta de curry es alta. El curcumin que es un activo ingrediente de polvo de turmeric, usados en los currys, se ha mostrado que tiene un efecto protector contra la gastritis crónica atrófica27.
-
Entre los chinos (y no entre los malasios e hindúes), hay la creencia de que las frutas frescas y vegetales son alimentos fríos y muchos evitan ingerirlos porque puede agravar el reumatismo y otras dolencias sobretodo en personas mayores 27.
-
En general la dieta de los chinos, japoneses y coreanos tienen un alto contenido de sal, hay estudios que demuestran que los alimentos salados y conservados poseen un efecto carcinógenico27.
c) HIPÓTESIS PLANTEADAS
Se han propuesto muchas hipótesis tratando de explicar el rol del Helicobacter pylori en la iniciación del cáncer, pero el mecanismo exacto aún permanece incomprendido. El inicio de la carcinogénesis se ha vinculado al estrés oxidativo generado por la sintasa del ácido nítrico, que es producido por células inflamatorias en respuesta a la inflamación. Estos compuestos son mutagénicos y pueden inducir anormalidades en el DNA de las células epiteliales, habiéndose encontrado en el citoplasma de células displásicas y carcinoma gástrico 12,19.
El Helicobacter pylori causa un incremento en la proliferación celular y daño del DNA y reduce los potenciales factores protectores como la vitamina C en la secreción gástrica 8,12.
En un estudio prospectivo hecho en el Japón se ha observado que los sujetos infectados por Helicobacter pylori con metaplasia intestinal, tienen 6.5 veces más riesgo de desarrollar cáncer gástrico9.
Aproximadamente 50% de los cánceres de tipo intestinal tienen alteraciones en genes propuestos como genes supresores de tumores (TP53, TP73, APC, TFF, entre otros) 12.
Una observación importante es que el cáncer no se desarrollaría en las células epiteliales gástricas per se, sino en células derivadas de la médula ósea que se diferencian en células gástricas en presencia del Helicobacter pylori, hipótesis planteada con el nombre de migración de células de la médula ósea12.
1) Activación de neutrófilos
La activación y migración de neutrófilos (CD11a/ CD18 y CD11b/CD18) hacia el tejido gástrico inducida por la infección por Helicobacter pylori, resulta en la produccicón de oxido nítrico, junto con metabolitos tales como el superoxido y iones hidroxilo, que lesionan el DNA, originando mutaciones y transformación maligna en las células de este tejido8.
2) Hipoclorhidria y ácido ascórbico
Como consecuencia de la gastritis atrófica y la metaplasia generada por la infección por el Helicobacter pylori, disminuye la secreción de ácido por las células parietales y se eleva el pH gástrico, proliferando bacterias reductoras que forman nitritos que interactúan con otros compuestos nitrogenados, que poseen efecto carcinogénico.
El ácido ascórbico puede bloquear esta reacción de nitrosación 8,12. En relación a esta acción del ácido ascórbico, se ha observado una disminución del nivel de ácido ascórbico en el jugo gástrico, en la gastritis crónica con pH elevado e infección por Helicobacter pylori. Asimismo, pacientes con metaplasia intestinal tienen niveles bajos séricos de ácido ascórbico comparados con pacientes sanos. De otro lado se ha observado que la ingesta de ácido ascórbico se asocia con la disminución de riesgo de cáncer gástrico8.
3) Etapas de apoptosis
Hay dos procesos importantes en la carcinogenesis: la apoptosis o muerte celular programada y la hiperproliferación. Luego del daño del DNA se produce apoptosis como un mecanismo de protección para prevenir la replicación del DNA mutado.
La gastritis atrófica con destrucción y pérdida de glándulas puede ser el resultado de apoptosis. Se ha reportado incremento de la apoptosis central, en sujetos infectados por Helicobacter pylori, fenómenos que regresionan luego de la erradicación28,29.
4) Cepas bacterianas
La infección por ciertas cepas virulentas aumenta la inflamación y el riesgo de cáncer, dando soporte a la hipótesis de una compleja interacción entre el huésped y la bacteria para el desarrollo de patología gastrointestinal8.
Las cepas que expresan los genes Cag A y VacA poseen una mayor virulencia y han sido asociadas a un mayor daño epitelial, mayor inflamación de la mucosa mediada por la producción de interleuquina 8 y el desarrollo de úlcera péptica y adenocarcinoma gástrico8.
Por otro lado, las cepas que poseen el gen DupA, incrementan el riesgo de desarrollar úlcera péptica duodenal pero al mismo tiempo parecen disminuir el riesgo de cáncer gástrico8.
5) Polimorfismos de citoquinas
Ciertos polimorfismos en la interleuquina 1 beta y otras citoquinas como el factor de necrosis tumoral (TNF - A) incrementan el riesgo de desarrollar adenocarcinoma gástrico, al inducir una respuesta de tipo atrófica e hipoclorhidria en la mucosa gástrica en respuesta a la infección por el Helicobacter pylori.
En un estudio comparando polimorfismos de IL-1 Beta en 393 pacientes con cáncer gástrico y 430 controles, se observó que dos polimorfismos específicos (IL-1B- 31T y IL- 1RN*2) se asociaban con hipoclorhidria y atrofia gástrica. En otro estudio realizado en Asia, se observó que el alelo proinflamatorio IL-1B-511T tendría un rol importante en el desarrollo de metaplasia intestinal y por lo tanto adenocarcinoma gástrico en la población china8,9.
Un estudio en Europa muestra que la combinación de ciertos genotipos del huésped y bacterianos confiere un mayor riesgo de desarrollar cáncer gástrico. Aquellos pacientes con polimorfismos de alto riesgo (ILIB-511/IL-IRN*2) y bacterias virulentas (Cag-A+ / Vac As1) tienen el más alto riesgo de desarrollar cambios histológicos severos en la mucosa gástrica8,9.
Estos y otros estudios similares sugieren que polimorfismos genéticos influencian la expresión de citoquinas, la inflamación gástrica y el riesgo de desarrollar lesiones pre cancerosas en los infectados por H pylori. El riesgo se incrementa si la infección es por cepas virulentas como las que expresan los genes CagA y VacA8,9.
6) Factores nutricionales, dietarios y socio económicos
Factores geográficos de tipo nutricional, probablemente modulan la conversión de la gastritis crónica activa, en sus estadios tempranos a gastritis crónica atrófica: dietas bajas en vitaminas antioxidantes y otros micronutrientes25.
Se ha demostrado que durante la inflamación están presentes grandes cantidades de radicales libres, en los tejidos afectados. Los radicales libres son generados por leucocitos polimorfonucleares y monocitos macrófagos que ejercen acción fagocitaria. Si bien estos radicales libres son beneficiosos, cuando están en exceso pueden causar daño histológico por dos mecanismos: directo (reaccionando con varias moléculas blanco, incluyendo proteínas, lípidos y ADN), e indirecto (induciendo la aparición de proteínas de estrés fenómeno relacionado con procesos inmunes25.
En la gastritis asociada a Helicobacter pylori se han encontrado grandes cantidades de células T gamma/delta y expresión del homólogo de la proteína de estrés groEL, en las células epiteliales. Las células T gamma/delta por ser cittóxicas podrían destruir las glándulas gástricas24.
Vitaminas antioxidantes (betacarotenos, retinol, vitamina A, vitamina C, vitamina E) comparten con otros micronutrientes (thioles no proteicos, enzimas como la superóxido dismutasa y la glutation peroxidasa), la capacidad de reducir los niveles de radicales libres en los tejidos. No llama la atención, por lo tanto, que se haya reconocido como un factor determinante de tipo nutricional de la gastritis crónica atrófica, la baja ingesta de vegetales y frutas frescas, alimentos ricos en vitaminas antioxidantes25.
En la gastritis crónica atrófica, por la hipocloridria se favorece la aparición de sobrepoblación bacteriana gástrica y altas concentraciones de nitritos en el lumen gástrico. Los nitritos en combinación con aminas y amidas originan N-nitroso compuesto, sustancias con gran potencialidad mutagénica y carcinogénica. Compuestos N-nitroso también pueden ser generados durante el proceso inflamatorio de la mucosa gástrica. En la inflamación, eosinófilos, monocitos, macrófagos y endotelios producen óxido nítrico (NO) a partir de levoarginina. El óxido nítrico (NO) en la presencia de óxigeno, aminas y amidas, da lugar a nitritos y nitroso compuesto, que igualmente son destruidos por vitaminas antioxidantes, cuya deficiencia puede contribuir también a un aumento de los N-nitroso compuesto25.
Es probable que esta conjunción de factores, alta ingesta de CINa y rápida renovación de celulas gástricas, causadas por la infección de Helicobacter pylori, puedan inducir la aparición de metaplasia intestinal, displasia y cáncer gástrico de tipo intestinal3,10,11,13,16,17,26. También hay que considerar los factores socioeconómicos, ya que se acepta que el cáncer gástrico es más frecuente en personas de menor nivel socioeconómico2.
Otros factores importantes
Los siguientes hechos demuestran que la carcinogénesis gástrica no puede ser sólo explicada por la infección por el H pylori:
-
Solo una pequeña proporción de infectados por esta bacteria, desarrollan cáncer gástrico.
-
La incidencia de cáncer gástrico varía geográficamente, pese a similares prevalencias de la infección por Helicobacter pylori en el mundo.
-
La incidencia de cáncer gástrico, en pacientes con úlcera duodenal, es baja, observación que no tiene una clara explicación. Puede haber para esto alguna explicación en el tipo de cepa, que los pacientes con úlcera duodenal tienen incrementados los niveles de ácido ascórbico y que los polimorfismos de citoquinas, asociados al cáncer producen una gastritis más difusa e hiporcloridria, fenómenos no presentes en pacientes con úlcera duodenal.
Historia familiar
La historia familiar se ha asociado con un riesgo 1.5 veces mayor para padecer de cáncer gástrico, lo que se puede explicar por diferencias hereditarias en los polimorfismos inflamatorios de citoquinas8.
Linfoma gástrico
Representa el 3% de las neoplasias gástricas y el 10% de los linfomas. El estómago es el órgano más frecuente de linfomas extranodales.
El linfoma se puede originar en los ganglios linfáticos o en áreas mucosas (mucosa Associated lymphoid tissue tumor: MALT oma, MALT type linfoma, hoy llamado linfoma extradonodal marginal de la zona de células B
El estómago normal no contiene tejido linfoide en cantidad significativa. La gastritis inducida por H pylori lleva a la agregación de linfocitos CD4 + células B a la lámina propia gástrica. La persistencia de antígeno ocurre siguiendo a la activación de células T, proliferación de células B y formación de folículos linfoides
Hipótesis: el antígeno celular interactua con el CD4 + T celular. La célula T activada se une a la célula B en forma aberrante8.
Múltiples estudios han demostrado la asociación entre el maltoma y el Helicobacter pylori. Como en el caso del cáncer se vincula esta relación con cierta cepas de Helicobacter pylori que expresa la proteina CagA8.
CONCLUSIONES
Múltiples estudios han demostrado una asociación entre la infección del estómago por H pylori y el Maltoma gástrico.
Aproximadamente 65 a 80% de casos de ADCA del estómago distal son atribuidos a la infección por H pylori. Sin embargo, la carcinogenesis gástrica no puede ser solo explicada por la infección por H pylori.
De los infectados por esta bacteria solo un mínimo porcentaje desarrollan cáncer gástrico (2-5%). La mayoría presentan lesiones benignas. Existe pues una marcada variación individual del resultado de esta infección en los pacientes.
La infección por H pylori se asocia a una compleja interacción de factores genéticos, del medio ambiente, bacterianos, alimentarios, nivel socio econóimico que explican los diferentes resultados a los que se llega con la infección.
BIBLIOGRAFÍA
1. Warren JR, Marshall B. Unidentified curved bacillus on gastric epithelium in active chronic gastritis (Letter). Lancet, 1983; 1:1273.
2. Ramírez-Ramos A, Gilman R. Helicobacter pylori en el Perú. Lima-Perú. 2004. Editorial Santa Ana S.A. 276 pp.
3. León-Barua R. Patología gastroduodenal asociada a infección por Helicobacter pylori: su génesis y modulación por factores geográficos y socioeconómicos. En: Avances en la Gastroenterología en las Américas. Asociación Interamericana de Gastroenterología. Lima 2003. pp: 24-32.
4. Burstein M, Monge E, León-Barúa R, et al. Low peptic ulcer and high gastric cancer prevalence rates in a developing country with high prevalence of infection by Helicobacter pylori. J Clin Gastroenterol, 1991; 13: 1 54-6.
5. Recavarren-Arce S, León-Barúa R, Cok, et al. Helicobacter pylori and progressive gastric pathology that predisposes to gastric cancer. Scand J Gastroenterol, 1991; 26 (Suppl 181):51-7.
6. León-Barúa R, Recavarren-Arce S, Gilman RH, Berendson R. Can eradication of Helicobacter pylori prevent gastric cancer? Drugs, 1993; 46(3):341-6.
7. León-Barúa R, Berendson-Seminario R, Recavarren-Arce S, Gilman RH. Geographic factors probably modulating alternative pathways in Helicobacter pylori-associated gastroduodenal pathology: A hypothesis. Clin Infect Dis. 1997; 25: 1013-6.
8. Han K, Peura D. Association between Helicobacter pylori infection and gastrointestinal malignancy. Up to Date 2008.
9. Leung WK, Chan MC, To KF, Man EP, Ng EK, Chu ES, Lau JY, Lin SR, Sung JJ. H. pylori genotypes and cytokine gene polymorphisms influence the development of gastric intestinal metaplasia in a Chinese population. Am J Gastroenterol. 2006; 101(4): 714-20.
10. Hsu Ping-I, Lai KH, Hsu PN, Lo GH, Yu HC, Chen WC, Tsay FW, Lin HC, Tseng HH, Ger LP, Chen HC. Helicobacter pylori infection and the risk of gastric malignancy. Am J Gastroenterol. 2007; 102(4): 725-30.
11. Peura D. Pathophysiology of and inmune response to Helicobacter pylori intection. Up to Date 2008.
12. Correa P. Pathology and molecular pathogenesis of gastric cancer. Up to Date 2008.
13. Talley NJ, Fock KM, Moayyedi P. Gastric Cancer Consensus conference recommends Helicobacter pylori screening and treatment in asymptomatic persons from high-risk populations to prevent gastric cancer. Am J Gastroenterology. 2008; 103 (3): 510-4.
14. Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper R. Helicobacter pylori infection and the development of gastric cancer. N England J Med 2001; 345(11): 784-789.
15. Tachiro J, Miwa J, Tomita T, Matsubara Y, Oota Y. Gastric cancer detected alter Helicobacter pylori eradication. Digestive Endoscopy. 2007; 19: 167-173.
16. An international association between Helicobacter pylori infection and gastric cancer. The EUROGAST Study Group. Lancet 1993; 341:1359.
17. Huang, JQ, Zheng, GF, Sumanac, K, et al. Metaanalysis of the relationship between CagA seropositivity and gastric cancer. Gastroenterology 2003; 125:1636.
18. Eslick, GD, Lim, LL, Byles, JE, et al. Association of Helicobacter pylori infection with gastric carcinoma: A meta-analysis. Am J Gastroenterol 1999; 94:2373.
19. Correa, P. Human gastric carcinogenesis: A multistep and multifactorial process. First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res 1992; 52:6735.
20. Mendoza D, Herrera P, Gilman RH, Lanfranco J, Tapia M, Bussalleu A, Tenorio JH, Guillén- Rodríguez CE, Arróspide MT, Piscoya A, Rosas-Aguirre A, Watanabe-Yamamoto J, Ferrufino JC, Scavino Y, Ramírez-Ramos A. Variation in the prevalence of gastric cancer in Perú. Int J Cancer. 2008; 123(2): 414-20.
21. Ramírez-Ramos A, watanabe-Yamamoto J, Takano-Morón J, et al. Decrease in prevalence of peptic ulcer and gastric adenocarcinoma at the Policlínico Peruanao Japonés, Lima, Perú, between the years 1985 and 2002. Analysis of 31,446 patients. Acta Gastroenterol Latinoam, 2006; 36(3):66-73.
22. Ramírez Ramos Alberto, Chinga A. Erick, Mendoza R. Daniel, Leey C. Julio, Segovia C. Maria Cristina, Otoya César. Variación de la prevalencia del H. Pylori en el Perú. Período (1985- 2002), en una población de nivel socioeconómico medio y alto. Revista De Gastroenterología Del Perú 2003; 23:92-98.
23. Kim CG, Song HJ, Kook MC, Hong EK, Park S, Lee JY, Lee JH, Ryu KW, Kim YW, Bae JM, Choi IJ. Preoperative versus postoperative Helicobacter pylori eradication therapy in gastric cancer patients: A randomized trial. Am J Gastroenterol. 2008; 103(1): 48-54.
24. Watanabe, T, Tada, M, Nagai, H, et al. Helicobacter pylori infection induces gastric cancer in mongolian gerbils. Gastroenterology 1998; 115:642.
25. León-Barúa R. Factores geográficos y socioeconómicos en la orientación de la patología gastroduodenal asociada a la infección por Helicobacter pylori. Acta Gastroent Latinoamer, 2000; 30:491-6.
26. WAye J, Armengol-Miro JR, Llorens P, Williams C, Zhang Q. Screening for GI cancer and payment mechanisms. Gastrointestinal Endoscopy 2002; 55(3): 453 (Perspective).
27. Goh KL, Cheah PL, Md N, Quek KF, Parasakthi N. Ethnicity and H. pylori as risk factors for gastric cancer in Malaysia: A prospective case control study. Am J Gastroenterol. 2007; 102(1):40-5.
28. Varro, A, Noble, PJ, Pritchard, DM, et al. Helicobacter pylori induces plasminogen activator inhibitor 2 in gastric epithelial cells through nuclear factor- kappaB and RhoA: implications for invasion and apoptosis. Cancer Res 2004; 64:1695.
29. Xia, HH, Talley, NJ. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: Implications in gastric carcinogenesis. Am J Gastroenterol 2001; 96:16.