INTRODUCCIÓN
La infecciones de transmisión sexual (ITS) son un problema de salud pública, con una incidencia estimada de 333 millones de casos/año alrededor del mundo (1.
Las manifestaciones gastrointestinales de las ITS son frecuentes, y no siempre se reconocen fácilmente. Las úlceras anales o perianales y la proctitis son las más comunes 2.
La proctitis, definida como la inflamación de la mucosa rectal, tiene causas infecciosas y no infecciosas. Tradicionalmente, ha sido asociada con la enfermedad inflamatoria intestinal (EII), sin embargo, es importante que los médicos recuerden que la proctitis no siempre tendrá esa etiología 3. La proctitis infecciosa (PI), resulta de la inoculación directa de los gérmenes durante las relaciones sexuales por contacto entre las mucosas genital - anal, o debido a la extensión por contigüidad desde el área genital 1,4. Neisseria gonorrhoeae, Chlamydia trachomatis, Treponema pallidum y el virus herpes simple (VHS) son las causas más comunes de proctitis transmitida sexualmente 5, a pesar de esto, en el 45% de los casos no se identifica una etiología 3. Los síntomas y hallazgos endoscópicos de la EEI y la PI pueden ser similares, lo cual repercute en un diagnóstico tardío, tratamiento inapropiado y aumento del riesgo de transmisión del patógeno al compañero sexual. Durante los últimos años, se ha observado un aumento de la incidencia de la PI, atribuido al incremento de la práctica sexual anal no protegida, que aunque tradicionalmente se ha relacionado con hombres que tienen sexo con hombres (HSH) con infección por el virus de inmunodeficiencia humana (VIH), por cambios en el comportamiento sexual, cada vez más se diagnóstica en heterosexuales, por lo que es de vital importancia realizar una historia clínica detallada en la que se interrogue por las conductas sexuales de los pacientes que se presentan con ésta entidad 1,6.
Esta revisión se centra en el enfoque diagnóstico y terapéutico de la proctitis en pacientes infectados por el virus de inmunodeficiencia humana (VIH) y en HSH.
MANIFESTACIONES CLÍNICAS
Los síntomas varían dependiendo del patógeno. El síntoma más común de la PI es la necesidad continua o urgente de defecar. El exudado purulento, mucoide o sanguinolento, sangrado rectal, dolor o molestia anorrectal y la sensación de defecación incompleta son otros síntomas. En algunos casos, estos síntomas se asocian con linfadenopatía inguinal 1,5.
En casos crónicos y en pacientes con VIH, las ITS suelen ser subdiagnosticadas debido a que, a menudo, son asintomáticas o se presentan con síntomas inespecíficos 1.
ETIOLOGÍA
Neisseria gonorrhoeae
Es la primera causa más común de PI (30%) y la segunda ITS más frecuente en los EU 2,3. Se diagnóstica, frecuentemente, en jóvenes sexualmente activos, entre los 15- 44 años. Es más frecuente en mujeres 2. Aproximadamente el 50% de los hombres y el 95% de las mujeres con PI gonocócica son asintomáticos, representando un grupo de portadores y transmisores de la enfermedad 2,5. Un alto porcentaje de mujeres con enfermedad gonocócica ginecológica podría tener compromiso rectal debido a propagación por contigüidad, sólo un 4% tienen compromiso exclusivo rectal, mientras que el 40-50% de los hombres tienen enfermedad gonocócica exclusivamente rectal 1,5.
Los síntomas típicos son el exudado mucopurulento y el tenesmo rectal. El hallazgo endoscópico clásico es la descarga mucopurulenta espontánea o estimulada con una presión en el área perianal, sin embargo, se puede encontrar edema, eritema y friabilidad de la mucosa 1,2,7.
La N. gonorrhoeae es un diplococo gram negativo. La coloración gram muestra diplococos en el citoplasma de los polimorfonucleares y, aunque la especificidad de éste hallazgo es elevada (90-95%), por su baja sensibilidad en exudado rectal, no se recomienda para el diagnóstico 8. Las técnicas de amplificación de ácidos nucleicos (NAATs) basadas en la reacción de cadena de la polimerasa (PCR) aunque no están aprobadas por la agencia de administración y regulación de medicamentos de los Estados Unidos (FDA) en muestra rectal 8, son avalados para su uso en Europa porque algunos laboratorios cumplen con los requisitos reglamentarios de Clinical Laboratory Improvement Amendments (CLIA) con respecto al rendimiento 4. El cultivo en agar Thayer Martin es la técnica de elección por su elevada sensibilidad y especificidad para múltiples tipos de muestra, y además porque permite el análisis de sensibilidad a los antibióticos 9.
La N. gonorrhoeaeha desarrollado resistencia a múltiples antibióticos. En la actualidad, el único tratamiento recomendado por el Centro para el control y prevención de enfermedades (CDC) es la ceftriaxona en dosis de 250 mg, vía intramuscular (IM), dosis única (DU) más azitromicina 1 gramo, por vía oral (VO) en DU ó doxiciclina 100 mg cada 12 horas, VO, durante 7 días 2,8. Se prefiere el uso de azitromicina porque el esquema en DU favorece la adherencia a la terapia, y se han reportado más casos de resistencia a tetraciclinas en N. gonorrhoeae 8. Esta terapia dual aumenta la eficacia del tratamiento y además es efectiva contra C. trachomatis 7. Dado la alta tasa de co-infección con C. trachomatis, se recomienda la terapia dual siempre que se diagnostique uno de los dos gérmenes 1,5,8. El CDC recomienda evitar la ceftriaxiona sólo en aquellos pacientes con historia de reacciones alérgicas severas a la penicilina 8, en quienes se recomienda la consulta con un especialista en Infectología para la elección del tratamiento 5. Los compañeros sexuales recientes (últimos 2 meses) o el último compañero sexual de pacientes con PI gonocócica deben ser tratados. Para evitar la reinfección, la abstinencia sexual, hasta 7 días después de haber completado el tratamiento, es primordial.
Chlamydia trachomatis
Es la ITS más prevalente en los EU y la segunda causa de PI (19%). Es más frecuente en jóvenes entre 14 y 24 años sexualmente activos. La mayoría de las proctitis por este germen ocurren en HSH 1,2. Se conocen 15 serotipos, los serotipos de la D a la K causan enfermedad genital, urológica y rectal no invasiva, siendo G, D y J los más frecuentemente aislados en HSH con PI 5,10.
La mayoría de las proctitis por C. trachomatis son asintomáticas 1,5,11. Cuando hay síntomas, el tenesmo, la proctalgia y el sangrado son los más frecuentes. La rectoscopia puede revelar edema y eritema inespecíficos 1,3 .
Linfogranuloma venéreo
El linfogranuloma venéreo (LGV) es una entidad clínica causada por los serotipos L1, L2 y L3 de C. trachomatis 2. Se transmite a través de las relaciones anales receptivas. La mayoría de las PI en HSH son causadas por el serotipo L2 5. Antes de 2003, el LGV se consideraba una enfermedad “tropical” endémica de países de África, Sur América y del Sur-este Asiático 6,rara en países occidentales industrializados, pero en ese año ocurrió un brote en los Países bajos que condujo al descubrimiento de múltiples casos en el mundo occidental y en el Reino Unido, especialmente en HSH con VIH 3.
A diferencia de las infecciones genito-rectales causadas por los serotipos D-K de Chlamydia trachomatis, el LGVes una ITS invasiva que puede causar un proceso inflamatorio severo con síntomas sistémicos y, tiene tropismo por los tejidos linfáticos 1,5. Típicamente, se presenta en varios estadios. Durante el primer estadio aparecen una o más úlceras o pápulas genitales o rectales no dolorosas que desaparecen espontáneamente. El segundo estadio, 2 a 6 semanas después de la infección, consiste en la aparición de bubones (linfadenopatías inguinales o femorales) dolorosos, típicamente unilaterales, dolor rectal, tenesmo y aftas o úlceras con exudado mucopurulento 12-14. Casi todos los HSH con LGV se presentan con proctitis ulcerada 15. Durante el tercer, y último estadío, se pueden presentar abscesos, granulomas, fístulas y estenosis 8,13. El 25% de los pacientes con LGV podrían no desarrollar linfadenopatías 3. El estudio histológico revela infiltrado linfohistiocítico, abscesos crípticos y granulomas 16. Esta entidad clínica podría confundirse con una enfermedad de Crohn debido a la presentación con diarrea y fistulas perianales 1, sin embargo, el exudado uretral o vaginal y las típicas linfadenopatías del LGV son una clave distintiva de la EII 17. La presencia de linfadenopatía más proctitis y/o ulceración genital deben aumentar la sospecha LGV.
La C. trachomatis es una bacteria intracelular obligada. Su confirmación diagnóstica es un reto. El cultivo se reserva para laboratorios de referencia porque requiere experticia técnica y tiene un costo elevado 2. La serología (fijación de complemento ≥ 1:64 o inmunofluorescencia directa> 1: 256) podría apoyar el diagnóstico, en un contexto clínico apropiado, aunque no ha sido validada para el diagnóstico de proctitis 2,8. La detección de antígeno en exudado rectal tiene una sensibilidad menor de 50% 2. Las NAATs en muestras rectales tienen un buen desempeño diagnóstico, varios estudios han demostrado que tienen mayor sensibilidad que el cultivo para la identificación de éste germen en muestra rectal 2 y, aunque no están avaladas por la FDA, muchos laboratorios han validado el test según los reglamentos de la CLIA en muestras rectales. En HSH con proctitis la búsqueda de C. trachomatis mediante NAAT en biopsia rectal es el gold standard 3,8. La genotipificación mediante PCR en muestras rectales se puede utilizar para diferenciar los serotipos productores de LGV, de los no productores, lo cual tiene implicaciones en la duración del tratamiento; sin embargo, éstas pruebas no están ampliamente disponibles 3,5,8.
El tratamiento para los serotipos D-K de C. trachomatis consiste en la administración de azitromicina 1 g, VO en DU ó doxiciclina 100 mg cada 12 horas, VO, durante 7 días 4,5,8. Ambos esquemas tienen una eficacia mayor del 97% para erradicar el germen después de 7 días. Se recomienda abstinencia sexual durante una semana después de la terapia y tratamiento a la pareja sexual con el objetivo de disminuir la transmisión de la enfermedad y la reinfección, respectivamente 2. Debido a la frecuente co-infección con N. gonorrhoeae (40%) se debe administrar tratamiento empírico para este germen 8.
En pacientes con linfadenopatía, proctitis y/o ulceración genital, el CDC recomienda tratamiento empírico para LGV. El esquema terapéutico recomendado consiste en doxiciclina 100 mg cada 12 horas, VO durante 21 días 8.
La prevalencia de VIH entre pacientes con LGV es del 68-100%, por tanto, se indica una búsqueda activa de co-infección.
Treponema pallidum
La sífilis es una enfermedad sistémica causada por la espiroqueta Treponema pallidum. El 75% de los casos se diagnóstica en HSH 5. La transmisión se produce por contacto directo con una úlcera sifilítica o mediante contacto con las mucosas de un paciente en estadio de latencia temprana. Representa el 2% de las PI 1.
La sífilis se divide en 3 estadios, teniendo en cuenta hallazgos clínicos que guían el tratamiento y el seguimiento clínico 1,5. Después de un período de incubación de 2 a 6 semanas, la sífilis primaria (SP) se manifiesta en anorrecto como cambios inflamatorios o úlcera dolorosa que, frecuentemente, es confundida con una fisura anal. Esta úlcera, típicamente, es de base limpia, con bordes elevados, se localiza en el canal anal y por fuera de la línea media. Se asocia con exudado, urgencia defecatoria y tenesmo 5. Desaparece espontáneamente después de 3-6 semanas. Sin tratamiento, aproximadamente un cuarto de los pacientes desarrollan sífilis secundaria (SC), en la que aparecen condilomaslata, que pueden confundirse con los generados por el virus del papiloma humano 2. El estadío terciario se presenta años después de la infección inicial y se asocia con gomas sifilíticas ulceradas y destrucción del tejido 1.
La microscopia de campo oscuro en el exudado de la lesión rectal es un método definitivo para el diagnóstico de SP, permite la visualización directa de la espiroqueta, sin embargo, es técnicamente difícil y no está disponible en la mayoría de los hospitales 2,18.
La PCR en biopsias rectales o en exudado de las úlceras es el segundo método directo con utilidad comprobada 1. Tiene una sensibilidad del 70 a 95% (mayor que la de la microscopia de campo oscuro) y especificidad de 92 - 98% 19.Debe ser validada para su uso en cada laboratorio. Un diagnóstico presuntivo de sífilis se realiza mediante métodos serológicos 1,5. Las pruebas no treponémicas (Venereal Disease Research Laboratory [VDRL] y Prueba de reagina plasmática [RPR]) son fáciles de realizar, tienen un bajo costo y no son específicas para sífilis, por tanto, ante su positividad requiere confirmación con una prueba treponémica. Las pruebas treponémicas (Prueba de anticuerpos treponémicos fluorescentes absorbidos [FTA ABS], hemaglutinación para anticuerpos de T. pallidum [HA-TP], microhemaglutinación para anticuerpos de TP [MHA-TP], aglutinación de partículas para TP [TP- PA], inmunoensayo enzimático para TP [EIA-TP] e inmunoensayos quimioluminescenses [CIA]) basadas en la detección de anticuerpos dirigidos contra antígenos específicos de la espiroqueta, se positivizan 6-14 días después de la aparición del chancro y por tanto son útiles para el diagnóstico de sífilis temprana cuando todavía son negativas las pruebas no treponémicas 18,20.El uso de un solo tipo de prueba serológica es inadecuado porque cada grupo tiene limitaciones, incluida la posibilidad de falsos positivos en las pruebas no treponémicas 5.
Existen una gran variedad de pruebas serológicas rápidas con buen rendimiento diagnóstico. Pueden ser utilizados como una guía inicial para decisión de tratamiento en pacientes que, probablemente, se pierdan en el seguimiento.
Para el diagnóstico serológico de la sífilis se pueden utilizar ambos tipos de pruebas como tamizaje inicial. Las pruebas treponémicas automatizados se han convertido en el test de tamizaje inicial (algoritmo reverso) 18,20 sobre todo en laboratorios en los que se realiza un alto volumen de pruebas, por su simplicidad y bajo costo. En pacientes con úlceras rectales u otras manifestaciones de un curso temprano de la enfermedad, el algoritmo reverso cumple un papel importante porque los tests no treponémicos podrían estar negativos. Si la prueba treponémica es positiva, se debe confirmar con una prueba no treponémica. Si la prueba treponémica es positiva y la prueba no treponémica es negativa (ocurre en casos de sífilis muy temprana, antecedente de sífilis tratada) y el paciente tiene alta sospecha de sífilis, basado en la historia de conductas sexuales de riesgo recientes y presencia de ulcera rectal, debe darse tratamiento y repetir la prueba no treponémica para evaluar la seroconversión 18,20. Si la PCR (en tejido o exudado) está disponible y validada es útil para el diagnóstico de la enfermedad temprana.
El tratamiento para la sífilis temprana (estadio primario, secundario y latente temprana) consiste en penicilina G benzatínicaa dosis de 2 400 000 unidades (U), administrada por vía IM en DU. Para pacientes con sífilis tardía, se requieren 3 dosis de penicilina G benzatínica separadas por un intervalo de una semana. Un régimen alternativo, para pacientes con alergia a la penicilina es la doxiciclina 100 mg cada 12 horas, VO durante 14 días. Si los síntomas persisten, recurren, o no se logra una disminución de más de 4 veces los títulos de las pruebas no treponémicas, se debe considerar una falla del tratamiento o reinfección 5,8.
A los pacientes con sífilis se les debe realizar una búsqueda de otras ITS, incluidas VIH, virus de la hepatitis C (VHC) y virus de la hepatitis B (VHB). El compañero sexual debe recibir tratamiento 1,5.
Virus herpes simple
La infección por el virus herpes simple (VHS) es de naturaleza crónica. Se manifiesta cerca de las uniones mucocutáneas. La PI por el VHS es resultado de la extensión de la enfermedad desde la región perianal hasta el canal anal y el recto. Ocurre, frecuentemente, en población inmunosuprimida que practica relaciones sexuales anales receptivas.
Con el aumento de la frecuencia del contacto sexual oro-genital, ambos serotipos (VHS-1 y VHS-2) pueden encontrarse en el área anogenital 5. Se ha observado un aumento de la proporción de infecciones herpéticas anogenitales por el VHS-1, especialmente en mujeres jóvenes y HSH 8.
Los pacientes con PI por VHS pueden presentar dolor anorrectal, tenesmo, exudado o sangrado rectal y parestesias sacras 1,2,5. El examen del área perianal es crítico para el diagnóstico, se observan lesiones vesiculares dolorosas que evolucionan a úlceras, y al tacto rectal los pacientes presentan un dolor exquisito. Adicionalmente se presentan adenopatías inguinales 2. La sigmoidoscopia revela edema y ulceraciones de la mucosa (Figuras 1 y 2).
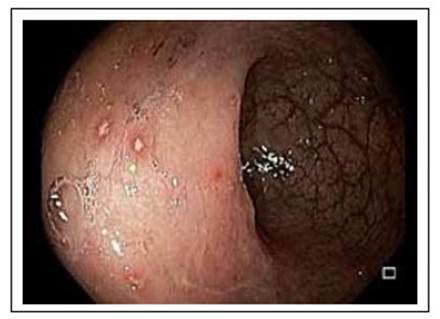
Figura 1 Proctitis por el virus herpes simple. Mucosa rectal con edema, eritema, pérdida del patrón vascular y úlceras superficiales con halo eritematoso.
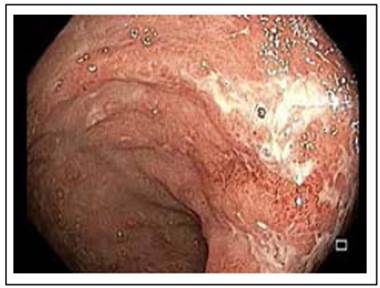
Figura 2 Proctitis por coinfección Neisseria gonorrhoeae - virus herpes simple. Mucosa rectal con edema, eritema, exudado mucopurulento y ulceraciones superficiales confluentes.
El gold standard para el diagnóstico es el cultivo viral en tejido rectal 2,8. Tiene baja sensibilidad (50%), especialmente en el caso de lesiones recurrentes y cuando las lesiones empiezan a sanar 5. La PCR en tejido rectal también es una posibilidad diagnóstica, tiene mayor sensibilidad comparada con el cultivo (8,17). La serología con anticuerpos específicos está ampliamente disponible. Indica infección presente o pasada 5,8. Permite determinar el serotipo del virus y debe realizarse porque el pronóstico de la enfermedad depende del tipo de VHS, la recurrencia es mucho más frecuente en los casos de infección por el VHS-2. La falla en la identificación del virus por cultivo o PCR, especialmente en ausencia de lesiones activas, no descarta la infección 8.
Tres medicamentos han demostrado efectividad clínica para tratar la PI por VHS: Aciclovir (400 mg cada 8 horas durante 7-10 días), valganciclovir (1 gramo cada 12 horas durante 7-10 días) y famciclovir (500 mg cada 8 horas durante 7-10 días) 8. Se administran por VO, aunque algunos pacientes con PI por VHS severa (enfermedad diseminada, neumonitis, hepatitis, meningoencefalitis) requieren tratamiento antiviral por vía intravenosa (IV). Sin tratamiento, los síntomas resuelven dentro de 1 a 2 semanas, pero el virus permanece en los ganglios linfáticos en estadío quiescente y las recurrencias son frecuentes 5,17. Los antivirales no erradican el virus latente, e idealmente, deben administrarse en las primeras 24 horas de la aparición de la lesión o durante el pródromo que la precede (sensación de ardor o dolor) para acortar el tiempo de duración de las lesiones. Los pacientes con VIH y aquellos con exacerbaciones frecuentes, deben ser considerados para terapia supresora 5,8. Consiste en la administración de un antiviral diariamente, inicialmente durante un año, momento en el cual se reevalúa la necesidad de continuidad de la terapia. El objetivo de esta terapia es disminuir la frecuencia de las recurrencias (70-80%), y disminuye el riesgo de transmisión genital del virus. El tratamiento prolongado ha demostrado ser seguro y eficaz 2,8.
Las personas con PI por VHS deben ser estudiadas den búsqueda de infección por el VIH 8.
En la Tabla 1 se describen los hallazgos endoscópicos de la proctitis infecciosa, discriminados por etiología.
ABORDAJE DIAGNÓSTICO Y TERAPÉUTICO DE LA PROCTITIS EN HSH Y PACIENTES VIH
En todo paciente VIH o HSH con proctitis, la etiología infecciosa debe ser descartada. Se deben realizar estudios para N. gonorrhoeae, C. trachomatis, T. pallidum y VHS. La PCR en tejido rectal es el gold standard para el diagnóstico de C. trachomatis y es útil para la identificación de N. gonorrhoeae. Aunque la coloración gram tiene baja sensibilidad para la identificación de N. gonorrhoeae, su especificidad es elevada, por tanto, apoya el inicio del tratamiento. El cultivo en agar Thayer Martin es la elección para la confirmación de N. gonorrhoeae. Las pruebas serológicas confirman el diagnóstico de T. pallidum, así como el de VHS. Para este último germen también está disponible la PCR en el tejido rectal.
Dada la alta incidencia de ITSs en esta población, en todo aquel que presente proctitis se recomienda administrar un tratamiento empírico basado en el diagnóstico presuntivo. Los resultados de los exámenes podrían tardar semanas y esto repercute en la demora del inicio del tratamiento y en complicaciones 8,21. En todos los pacientes con factores de riesgo para ITSs, con exudado rectal o en quienes la coloración gram detecta diplococos gram negativos intracelulares, el CDC recomienda tratamiento empírico para para N. gonorrhoeae y C. trachomatis. La presencia de ulceras rectales sugiere VHS, sífilis o LGV. Por tanto, adicionalmente, se debe administrar tratamiento para VHS si la PCR y/o serología son positivas; para T. pallidum si las pruebas serológicas son positivas; y para LGV si tienen VIH, linfadenopatías o una NAAT positiva para C. trachomatis.
Los compañeros sexuales de los pacientes con proctitis por N. gonorrhoeae, C. trachomatis y T. pallidum deben ser diagnosticados y tratados.
En casos confirmados de LGV, sífilis, HVS y gonorrea se debe buscar activamente otras ITSs, incluidas VIH, VHB y VHC.
Debido a que un gran porcentaje de las PI gonocócicas y por C. trachomatis son asintomáticas, es recomendable excluirlas mediante tamizaje cada 6-12 meses en HSH con contacto sexual anal receptivo en los últimos 6 meses 4,8,21 y en los que tienen múltiples parejas sexuales cada 3-6 meses 2.
Por último, cabe recordar que en HSH con sospecha de EII se debe considerar y descartar LGV 4.
CONCLUSIONES
La proctitis de etiología infecciosa, sexualmente transmitida, debe ser una consideración diagnóstica en pacientes con infección por el VIH y en HSH. La C. trachomatis y la N. gonorrhoeae son los principales gérmenes responsables de esta entidad. Los síntomas de la PI pueden ser similares a los de la EII por lo que una historia clínica completa, que incluya el interrogatorio de los hábitos sexuales, es primordial. Se recomienda la administración de un tratamiento empírico sindromático mientras se esperan los resultados de los estudios diagnósticos. Cuando se confirma una ITS como etiología de la PI se deben descartar otras ITSs, incluidas VIH, VHC y VHB.