Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. v.66 n.2 Lima abr./jun. 2005
Características patológicas asociadas al carcinoma de mama HER-2 positivo
Carlos González-Müller 1
1 Departamento de Anatomía Patológica, Hospital Nacional Edgardo Rebagliati Martins. Lima, Perú.
Resumen
Objetivos: Determinar la prevalencia y las características patológicas asociadas a la sobreexpresión del HER-2 en el cáncer de mama infiltrante primario. Materiales y Métodos: Se realizó una evaluación de 274 casos de carcinoma infiltrante de mama primario diagnosticados en el Departamento de Anatomía Patológica del Hospital Nacional Edgardo Rebagliati Martins en el periodo correspondiente a los meses de octubre de 2003 a mayo del 2004, correlacionando las características patológicas con la sobreexpresión 3+ del HER-2. Resultados: Se encontró la sobreexpresión 3+ en 64 (23,4%), 2+ en 9 (3,3%) y negativo (1+ ó 0) en 201 (73,4%) casos. El tipo histológico ductal infiltrante no especificado se presentó en 211 (77%) y el lobulillar infiltrante en 27 (9,9%). Los factores que al análisis estadístico aparecieron asociados a la sobreexpresión 3+ fueron: el tipo histológico carcinoma ductal infiltrante no especificado (p=0,0001), la enfermedad de Paget de pezón (p<0,0001) y la ausencia de expresión tumoral de receptores de estrógenos (p<0,0001). Sólo la ausencia de expresión de receptores de estrógenos resultó una característica asociada independientemente (p<0,0001). Conclusiones: La prevalencia de sobreexpresión 3+ fue de 23,4% y sus características asociadas fueron el tipo histológico ductal infiltrante no especificado, la presencia de enfermedad de Paget de pezón y la ausencia de expresión de receptores de estrógenos.
Palabras clave: Neoplasmas de la mama; enfermedad de Paget mamaria; proteínas de protooncogeno HER-2.
HER-2 positive breast carcinoma associated pathological characteristics
Abstract
Objective: To determine the prevalence and associated characteristics of HER-2 overexpression in infiltrative primary breast cancer. Materials and Methods: From October through December 2003 and from May through December 2004, 274 cases of infiltrative primary breast carcinoma were studied and pathological characteristics correlation with HER-2 overexpression 3+ was determined at Edgardo Rebagliati Martins National Hospitals Pathological Anatomy Department. Results: Three plus HER-2 overexpression was found in 64 (23,4%) cases, 2+ in 9 (3,3%) and negative (1+ or 0) in 201 (73,4%) cases. The non-specified infiltrative ductal histology type was present in 211 (77%) cases, and the infiltrative lobulillar in 27 (9,9%). We determined associated 3+ overexpression in non-specified infiltrative ductal carcinoma (p=0,0001), nipple Pagets disease (p <0,0001), and when estrogen receptors tumor expression was absent (p <0,0001). Only the absence of estrogen receptors expression was an independent associated characteristic (p <0,0001). Conclusions: The prevalence of 3+ overexpression occurred in 23,4% of the cases, and the associated characteristics were the non-specified infiltrative ductal histology type, nipple Pagets disease, and the absence of estrogen receptors expression.
Keywords: Breast neoplasms; Paget's disease mammary; protooncogene proteins HER-2.
INTRODUCCIÓN
La amplificación y sobreexpresión del HER-2 en el carcinoma de mama están asociadas a un curso clínico adverso (1-3), un menor tiempo de sobrevida libre de enfermedad y de sobrevida total (1,4,5); pero una mejor respuesta al tratamiento con el anticuerpo específico contra el HER-2 o trastuzumab (1,6). HER-2 es un acrónimo de receptor del factor de crecimiento epidérmico humano tipo 2 (2,4). Éste activa una tirosina quinasa que modula la respuesta celular de proliferación, resistencia a la apoptosis y aumento de la angiogénesis (2,7,8). El protooncogén del HER-2 se localiza en el cromosoma 17q21 (2,9,10), el cual produce un receptor de membrana de 185Kd (9). En la transformación maligna, aumenta el número de copias del gen HER-2 por célula (amplificación), con un aumento de la trascripción de ARNm y un aumento de diez a cien veces del número de receptores HER-2 expresados en la membrana celular por célula (sobreexpresión) (2,11). El 90% de la sobreexpresión es causada por una amplificación genómica; sin embargo, puede ocurrir una discordancia entre la expresión y amplificación en 3 a 15% (11). La hibridización in situ detectada por fluorescencia (FISH, de sus siglas en inglés fluorescence in situ hybridization) es la prueba estándar de referencia para determinar la amplificación del gen HER-2 con una sensibilidad de 96,5% y una especificidad de 100% (12). La sobreexpresión de la proteína HER-2 es determinada por inmunohistoquímica. No obstante, existen en el mercado muchos anticuerpos para determinar la sobreexpresión del HER-2, que difieren en su sensibilidad y están sujetos a variación por el procesamiento. La principal ventaja de la inmunohistoquímica sobre el FISH es que es más rápida, más económica y puede ser hecha de rutina en cualquier laboratorio de patología. Sin embargo, su precisión está sujeta a la sensibilidad de la prueba y el método de evaluación utilizado para interpretar los resultados (13). En el año 2000, mil casos en los Estados Unidos fueron erróneamente calificados como positivos por la variabilidad de interpretación de los resultados de amplificación/sobreexpresión de HER-2 (13). Al evaluar 94 laboratorios, se encontró una concordancia interobservador de 86% para la sobreexpresión del HER-2 cuando se utilizó la prueba de inmunohistoquímica HercepTest (14). La cantidad de receptores expresados en las células tumorales se refleja en el patrón y la intensidad de marcación en la membrana celular (10,15). Los criterios de HercepTest, Dako Cytomation considera 0 cuando no se observa marcación o está presente en menos de un 10% de las células tumorales, 1+ cuando se observa una marcación parcial de membrana débil en más de 10% de las células tumorales, 2+ si se observa una marcación completa de membrana débil o moderada en más de 10% de las células tumorales, y 3+ cuando se observa una marcación completa de membrana fuerte en más de 10% de las células tumorales (15).
La sobreexpresión del HER-2 varía entre 20 y 30% de los carcinomas de mama (4,5,16,17), con un rango de 9 y 39% (4,8). La mayor concordancia entre la inmunohistoquímica con el HercepTest y el FISH se da en los casos negativo y positivo 3+ (1). Un 15% de los casos positivos 2+ no muestra amplificación genómica (6). La sobreexpresión del HER-2 está asociada a la premenopausia (45% vs. 39%) (18,19), el grado histológico 3 (59% vs. 33%), la mitosis (79% vs. 55%), infiltración linfoide (27% vs. 13%), tumores mayores de 2 cm (68% vs. 55%) (4,16,18) e inversamente asociada a la expresión de receptores de progesterona (69% vs. 32%) (18). Son factores predictivos de sobreexpresión del HER-2 el grado del tumor, el compromiso ganglionar y el estado de los receptores hormonales estrógenos y progesterona (2). Sin embargo, algunos estudios muestran resultados contradictorios de la relación de estos factores al compromiso ganglionar (4).
MATERIALES Y MÉTODOS
Entre los meses de octubre de 2003 y diciembre de 2004, en el Departamento de Anatomía Patológica del Hospital Nacional Edgardo Rebagliati Martins (HNERM) de ESSALUD, se diagnosticó 429 casos de carcinoma infiltrante de mama primario. Sólo se realizó de forma rutinaria la determinación de la sobreexpresión del HER-2 por el HercepTest (Dako Corporation, Glostrup, Dinamarca), entre los meses de octubre a diciembre de 2003 y mayo a diciembre de 2004; resultando un total de 274 casos. Se consideró 0 cuando no se observó marcación o estuvo presente en menos de 10% de las células tumorales, 1+ cuando se observó una marcación parcial de membrana débil en más de 10% de las células tumorales, 2+ si se observó una marcación completa de membrana débil o moderada en más de 10% de las células tumorales, y 3+ cuando se observó una marcación completa de membrana fuerte en más de 10% de las células tumorales. Un caso fue negativo si la marcación fue 0 ó 1+, débilmente positivo si fue 2+ o fuertemente positivo si fue 3+ (15).
El análisis estadístico se realizó utilizando programa de ordenador SPSS® versión 10,0. Las características evaluadas fueron descritas en frecuencia y porcentaje si fueron categóricas; o en media, desviación estándar y mediana si fueron numéricas. La sobreexpresión del HER-2 fue considerada variable dependiente, clasificándola en 3+ o negativo, según los criterios de HercepTest, DakoCytomation, antes descritos (15). Se estudió la relación entre la sobreexpresión del HER-2 con un conjunto de posibles factores asociados expresados en forma categórica, mediante un análisis bivariado para determinar su asociación; se utilizó la prueba de Fisher, si tuvieron dos categorías, o Chi cuadrado, si tuvieron más de dos categorías. El grupo control en cada factor fue la categoría con menor riesgo de sobreexpresión 3+ del HER-2, según lo descrito en la literatura; o aquella con menor prevalencia de sobreexpresión 3+ del HER-2. En el análisis bivariado de las variables numéricas, se determinó inicialmente su distribución normal y homogeneidad de varianza. Aquellas variables con distribución normal y con varianza homogénea fueron analizadas evaluando la diferencia de medias con la t de student para muestras independientes. Mientras que, aquellas variables numéricas no normales o sin homogeneidad de varianza fueron analizadas evaluando la diferencia de medianas con la prueba U de Mann-Whitney. Las variables que resultaron asociadas a la sobreexpresión del HER-2 en el análisis bivariado fueron incluidas posteriormente para el análisis multivariado utilizando el modelo de regresión logística, para determinar las variables independientemente asociadas a la sobreexpresión del HER-2. En todos los casos se tomó como significativo un valor de p £ 0,05.
RESULTADOS
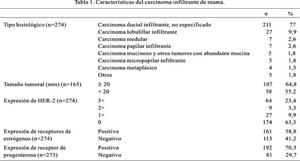
La edad promedio de los casos descritos fue 56,8 años (desviación estándar [DE] 13,1 años; mediana 56 años). En 271 casos se tuvo conocimiento del procedimiento de obtención de espécimen; la mayoría de pacientes fue sometida a mastectomía (47,2%) y tumorectomía (21,4%); otras sólo a biopsia (15,5%) o procedieron de revisión de casos (15,9%). La mama afectada fue la derecha en 125 de 251 (49,8%) casos e izquierda en 126 de 251 (50,2%). La localización mamaria (126 casos) más afectada fue el cuadrante superoexterno (47,6%), seguido por el superointerno (14,3%), inferoexterno (12,7%), retroareolar (12,7%), inferointerno (9,5%) y otras localizaciones (3,2%). El tamaño tumoral (165 casos) fue 24,7 mm (DE 12,6 mm; mediana 22 mm) y la mayoría consistió en tumores de 20 mm o más (64,8%). Los tipos histológicos más frecuentes fueron el carcinoma ductal infiltrante no especificado (77%) y el lobulillar infiltrante (9,9%). El número de ganglios comprometidos (184 casos) en promedio fue 3,5 (DE 7,4; mediana 0). La mayoría de casos (104 de 129, 80,6%) no mostró compromiso del pezón; se encontró compromiso periductal en 12 de 129 (9,3%), compromiso del conducto principal en 6 de 129 (4,7%) y enfermedad de Paget en 7 de 129 (5,4%). Se evaluó el estadiaje patológico en 170 casos, encontrándose pT1 en 45,9% y pT2 en 50%. La minoría fue pT3 (1,8%) y pT4 (2,4%). El compromiso ganglionar linfático fue evaluado en 184 casos. El estadio pN1 se halló en 30,4%, el pN2 en 6,5% y el pN3 en 12,5%. Hubo sobreexpresión 3+ del HER-2 en 23,4%, 2+ en 3,3%, mientras en los casos negativos se la observó en 73,4%; se halló expresión de receptores de estrógenos en 161 de 274 (58,8%) casos, mientras la de receptor de progesterona en 192 de 273 (70,3%) (Tabla 1).
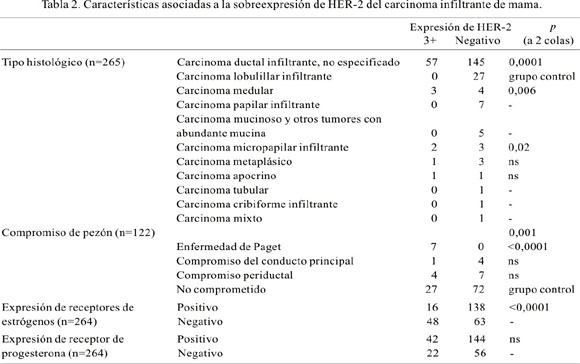
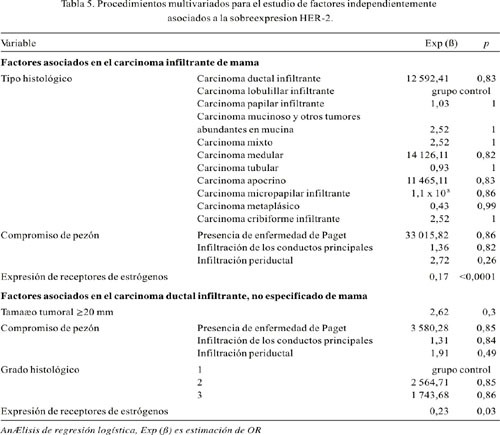
Con relación a la sobreexpresión 3+ del HER-2 en el carcinoma infiltrante de mama, la edad al momento del diagnóstico fue menor en los pacientes con dicha sobreexpresión 3+ (55,5 ± 12,4 años, mediana 54,5 años; 64 casos) que en los negativos (57,4 ± 13,3 años, mediana 57 años; 201 casos); sin embargo, esta diferencia no fue significativa. El tamaño tumoral promedio fue mayor en los pacientes con sobreexpresión 3+ (40 casos) que en aquellos sin expresión (117 casos): 26,4 ± 14,5 mm (mediana 25 mm) versus 23,6 ± 11,6 mm (mediana 20 mm). No obstante, esta diferencia tampoco resultó estadísticamente significativa. Tanto la presencia como el número de ganglios linfáticos comprometidos fueron similares para aquellos con sobreexpresión 3+ (3,3±6,5; mediana 0,5; 50 casos) y para aquellos sin expresión (3,6 ± 7,8; mediana 0; 127 casos). Se encontró asociación con el tipo histológico con el carcinoma ductal infiltrante no especificado (p=0,0001), la presencia de enfermedad de Paget (p<0,0001) y de forma inversa la expresión de receptores estrogénicos (p<0,0001) (Tabla 2). No se encontró asociación con los estadios patológicos pT ni pN, como tampoco con la expresión de receptor de progesterona. Al análisis multivariado, sólo la expresión de receptores de estrógenos resultó estar asociada de forma independiente (ver más adelante).
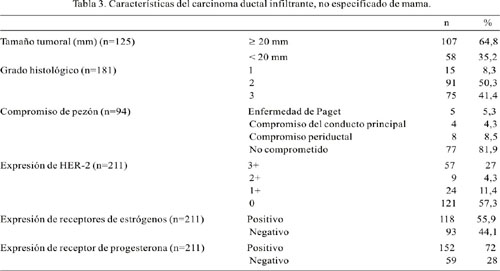
Entre las pacientes con carcinoma ductal infiltrante no especificado (211 casos), la edad fue 55,2±13 años (mediana 54 años). El procedimiento de obtención de espécimen fue descrito en 209 casos: 93 casos fueron sometidos a mastectomía (44,5%), 47 casos a tumorectomía (22,5%), 32 sólo tuvieron biopsia (15,3%), mientras 37 casos procedieron de revisión de casos (17,7%). No hubo diferencia en cuanto a la mama afectada de 194 casos: 94 correspondieron a la mama derecha y 100 a la izquierda. La localización mamaria (94 casos) más afectada fue el cuadrante superoexterno, con 50% de casos, seguido de los cuadrantes inferoexterno y superoexterno, con 12,8% cada uno, el cuadrante inferointerno con 11,7% y la localización retroareolar con 8,5%. Se dispuso de información del tamaño tumoral en 125 casos, que fue 24,7 ± 13,2 mm (mediana 22 mm); 64,8% de los tumores fue mayor de 20 mm. El grado histológico fue evaluado en 181 casos, encontrándose G3 en 41,4%, G2 en 50,3% y G1 en 8,3%. El compromiso ganglionar linfático, evaluado en 139 casos, se observó en 51,1%, presentando afectación de uno a tres ganglios linfáticos en 30,9% de los casos, de cuatro a nueve en 7,9% y de diez a más ganglios en 12,2%. El número de ganglios linfáticos comprometidos fue 3,4 ± 6,9 (mediana 1). Entre 94 casos evaluados hubo compromiso del pezón en 18,1%: la enfermedad de Paget en 5,3%, compromiso del conducto principal en 4,3% y compromiso de la dermis de pezón en 8,5%. En 130 casos incluidos, el estadio patológico pT1 se presentó en 45,4% y el pT2 en 50%, mientras pocos casos fueron pT3 y pT4; 2,3% en cada uno. Como se mencionó antes, la mayoría de casos no tuvo compromiso ganglionar linfático; pero, entre aquellos con ganglios linfáticos positivos, fue más frecuente el compromiso de uno a tres (pN1 en 30,9%). La sobreexpresión 3+ del HER-2 se presentó en 27% de los casos diagnosticados como carcinoma ductal infiltrante no especificado. La sobreexpresión 2+ ocurrió en 4,3%. Los casos negativos representaron 68,7%. La expresión de receptores estrogénicos se presentó en 55,9% y la de receptor de progesterona en 72% (Tabla 3).
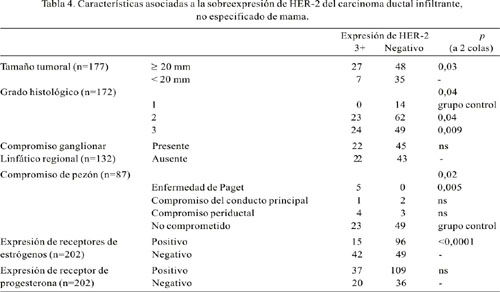
La edad al momento del diagnóstico, evaluada en 202 casos, fue similar en los casos con sobreexpresión 3+ del HER-2, 55,7 ± 12,6 años (mediana 55 años; 57 casos), y los negativos: 55,2 ± 13,1 años (mediana 54 años; 145 casos). Se evaluó el tamaño tumoral promedio en 117 casos, siendo mayor en los tumores que sobreexpresaron 3+ (27,8 ± 14,5 mm; mediana 25 mm; 34 casos) que en los negativos (22,8 ± 12,2 mm; mediana 20 mm; 83 casos), pero quedando en el límite de la significancia estadística (p=0,05). En 177 casos, los tumores ³20 mm sobreexpresaron HER-2 más frecuentemente que los tumores < 20 mm (Tabla 4). En cuanto al grado histológico (172 casos), tomando como referencia al grado 1, la sobreexpresión 3+ del HER-2 fue más frecuente en el grado histológico 3 (p=0,009) y en el grado histológico 2 (p=0,04) (Tabla 4). No se encontró mayor frecuencia de sobreexpresión 3+ del HER-2 al comparar la presencia del compromiso ganglionar linfático (132 casos); así, entre los tumores con sobreexpresión 3+ del HER-2 (44 casos) hubo 3,3 ± 6,4 (mediana 0,5) ganglios linfáticos comprometidos, mientras entre los tumores negativos (88 casos) hubo 3,4 ± 7,1 (mediana 1) ganglios linfáticos comprometidos. En cuanto al compromiso de pezón, los cinco casos con enfermedad de Paget mostraron una fuerte asociación (p=0,005). Cuando el compromiso fue del conducto principal o de la dermis, no hubo asociación (Tabla 4). No hubo asociación entre los estadios tumorales (pT) y el compromiso ganglionar linfático (pN). En el presente estudio, la expresión de receptores de estrógenos se asoció inversamente con la sobreexpresión del HER-2 (p<0,0001). Sin embargo, no hubo asociación cuando se evaluó la expresión de receptor de progesterona (Tabla 4). Al análisis multivariado, sólo la expresión de receptores de estrógenos fue un factor asociado en forma independiente (Tabla 5).
DISCUSIÓN
La edad promedio en la población estudiada fue 56,8 años; en las pacientes que sobreexpresaron 3+, fue 55,5 años, mientras en aquellas sin sobreexpresión fue 57,4 años. Un estudio previo realizado en nuestro medio refiere una edad promedio de 53,9 años, y 48,2 años en las pacientes que tuvieron sobreexpresión de HER-2 (20). Rafael realizó un estudio en el HNERM, encontrando que 11,8% de los casos fue mayor de 40 años (19). En otros estudios nacionales, la edad de presentación fue, según Guevara, 50,6 años (21) y según Rozas, 49 años, con un rango de 11 a 89 años (22). Sin embargo, en el presente estudio, cuando se tomó sólo los casos del tipo histológico carcinoma ductal infiltrante no especificado, no hubo variación entre la edad y la sobreexpresión del HER-2. Diversos estudios sitúan la edad de presentación entre los 50 a 60 años. Birner describió un promedio de 51,8 años (16). En 2003, un estudio multicéntrico australiano que reunió trece laboratorios encontró una edad promedio de 58 años (23). También, se ha encontrado mayor cantidad de mujeres premenopáusicas que posmenopáusicas que expresan HER-2 (18). Birner encontró entre las mujeres con tumor mamario con sobreexpresión del HER-2 que 49,5% fueron pacientes posmenopáusicas y 45,2% premenopáusicas (16).
El tipo histológico más prevalente fue el ductal infiltrante no especificado (77%), seguido del lobulillar infiltrante (9,9%). Rafael describió una proporción de carcinoma ductal infiltrante de 70,8% (19) mientras Rozas refirió un porcentaje de 74,5% (22). Observación similar fue informada por Bilous, siendo el 81,5% de tipo ductal infiltrante no especificado y 10% de tipo lobulillar infiltrante (23). El tipo histológico, independientemente de la expresión de HER-2, es un factor pronóstico y es más favorable si es tubular, mucinoso o medular (24). En el presente estudio, estos tipos histológicos alcanzaron una frecuencia de 0,4%; 1,8% y 2,6%, respectivamente. La asociación con la sobreexpresión 3+ del HER-2, en nuestro estudio, resultó alta con el tipo ductal infiltrante no especificado, mientras por el contrario la ausencia de expresión de HER-2 fue significativa en el tipo lobulillar infiltrante. Usualmente, el carcinoma lobulillar infiltrante no muestra amplificación del HER-2, a menos que sea la variante pleomórfica (25), lo cual concuerda con los presentes resultados. Bilous describió entre los casos con sobreexpresión 3+ del HER-2 que 95,5% presentó carcinoma ductal infiltrante no especificado y sólo 0,8% carcinoma lobulillar infiltrante (23), observación que está de acuerdo con los hallazgos del presente estudio.
El tamaño tumoral promedio encontrado en el estudio fue 24,7 mm: 26,1 mm en los tumores con sobreexpresión 3+ del HER-2 y 23,6 mm en los tumores negativos. Los tumores mayores de 20 mm representaron 64,8%, mientras los menores de 20 mm 35,2%. Respecto a estudios similares, Rozas encontró 63% de tumores mayores de 20 mm (22). En los casos de tipo histológico ductal infiltrante no especificado, hubo una diferencia significativa en el tamaño descrito: 27,8 mm en aquellos con sobreexpresión 3+ del HER-2 y 22,8 mm en los negativos. En ese sentido, Bilous describió un tamaño tumoral de 21,7 mm (23). El tamaño tumoral se correlaciona con la presencia y número de los ganglios linfáticos comprometidos (factor pronóstico más utilizado para utilizar terapia adyuvante). La tasa de recurrencia a distancia es superior de 20% en tumores mayores de 20 mm (24). Swede encontró asociación entre el tamaño tumoral y la sobreexpresión del HER-2; cuando hubo sobreexpresión, el tamaño fue 38 mm y cuando ésta estuvo ausente, 26 mm. Los tumores de un tamaño menor de 20 mm HER-2 positivos tuvieron catorce veces mayor riesgo de recurrencia que los negativos; por otro lado, no hubo mayor riesgo de recurrencia entre los tumores mayores de 20 mm (26). Aziz refirió asociación entre el tamaño tumoral y la sobreexpresión del HER-2 y, a diferencia del presente estudio, hubo una mayor frecuencia de tumores menores de 20 mm (53,8%) (4). Ménard encontró que 68% de los tumores HER-2 positivos fue mayor de 20 mm, mientras 55% de los tumores HER-2 negativos fue mayor de 20 mm (18).
Los tumores con grado histológico 3 tienen un riesgo 4,4 veces mayor de recurrencia que aquellos con grado 1. En ese sentido, el grado histológico puede ser utilizado como factor decisivo para instaurar terapia adyuvante frente a un tumor de tamaño límite y ausencia de compromiso ganglionar (24). En el presente estudio, se encontró asociación entre la sobreexpresión del HER-2 con los grados 2 y 3, pero no resultaron ser variables independientemente asociadas. De forma similar, el estudio australiano encontró asociación con la sobreexpresión del HER-2 en el análisis univariado, pero no en el multivariado (23). Birner describió resultados similares al presente estudio: grado 1 en 6,6%, grado 2 en 58,1% y grado 3 en 35,3%; también encontró asociación significativa entre la sobreexpresión 3+ del HER-2 y el grado histológico 3. En el análisis multivariado, sólo el grado histológico influenció la sobrevida libre de enfermedad (16). Hay una leve diferencia con lo descrito por Rozas, quien encuentra el grado 1 en 27,6%, el 2 en 41,4% y el 3 en 31% (22). Aziz encontró al grado histológico, junto con el tamaño tumoral y el compromiso ganglionar linfático, como factores asociados a la sobreexpresión del HER-2 (16).
Existe una relación directa entre el número de ganglios linfáticos comprometidos y el riesgo de recurrencia a distancia. La sobrevida a cinco años en casos sin compromiso ganglionar es de 82,8%, mientras si tienen de 1 a 3, de 4 a 12 ó de 13 a más ganglios linfáticos, es de 73%, 45,7% y 28,4%, respectivamente (24). En el presente estudio, 49,5% tuvo compromiso ganglionar linfático y no se encontró asociación con la sobreexpresión del HER-2. Schmidt encontró sobreexpresión 3+ del HER-2 en 20% en casos con ganglios linfáticos negativos (27). La enfermedad de Paget consiste de una infiltración de células epiteliales malignas balonadas, grandes y claras en la epidermis del pezón y la areola, la cual causa una erupción eczematoide. Se presenta en 2% de todos los carcinomas de mama (28) y es considerada como un signo de enfermedad local avanzada en pacientes con cáncer de mama. Comúnmente, hay amplificación del HER-2 en más de 80% de los casos con enfermedad de Paget (25). En el presente estudio, se encontró una frecuencia de 5,4%, siendo la sobreexpresión del HER-2 del 100%. Kothari describió una sobreexpresión del HER-2 en 83%, la cual se asoció a una peor sobrevida. Sin embargo, al separar a los pacientes con enfermedad de Paget con presencia o ausencia de expresión del HER-2, no hubo diferencias en las tasas de sobrevida total (28).
La determinación de factores pronósticos resulta últimamente de importancia. Rafael describió el tamaño tumoral, el estadio clínico, el número de ganglios linfáticos comprometidos y el grado histológico como factores negativos a la sobrevida a diez años (19). La sobreexpresión del HER-2 está asociada con un aumento de la agresividad, tasa de recurrencia, mortalidad en pacientes con ganglios linfáticos comprometidos (24). En los últimos años, su determinación ha adquirido importancia para el pronóstico y el tratamiento de esta enfermedad. En ese sentido, el trastuzumab es un anticuerpo monoclonal humanizado capaz de localizar el HER-2 expresado en la superficie celular e inducir la muerte celular (25). La amplificación, sobreexpresión o ambas se encuentra en 20 a 30% (16). En el presente estudio, se encontró sobreexpresión 3+ del HER-2 en 23,4% y 2+ en 3,3%. Estos resultados son distintos de los encontrados en el estudio australiano, en el que la sobreexpresión 3+ fue de 12% y la expresión 2+ 13%. Birner describió una sobreexpresión 3+ en 8,9% (16). Por su parte, Aziz describió una frecuencia de sobreexpresión de HER-2 en 39,4% (4). En estudios anteriores realizados en el Perú, se encontró 11,4% de sobreexpresión de HER-2 (20). Sin embargo, los resultados del presente estudio difieren significativamente de lo descrito por Córdova, quien encuentra una sobreexpresión de 54,4% (29). En el presente estudio, tanto al evaluar la expresión de los receptores estrogénicos en la población total de estudio como en los casos del tipo histológico carcinoma ductal infiltrante no especificado, hubo una asociación negativa con la sobreexpresión 3+. Este último resultó ser el único factor asociado de forma independiente. Por su parte, Córdova no encontró asociación con la expresión de receptores de estrógenos ni de progesterona (29). Se sabe que los tumores con expresión de receptores de estrógenos están asociados a una mejor sobrevida libre de enfermedad (74% vs. 66%) y mejor sobrevida total (92% vs. 82%). En tal sentido, Birner encontró una disminución significativa en la densidad de receptores estrogénicos al comparar los casos con sobreexpresión 3+ (55,8 ± 96,7 fm/l), con 2+ (117,3 ± 138,7 fm/l) y los casos negativos (85,2 ± 112,8 fm/l) evaluados con el HercepTest (16). Si bien, el presente estudio comunicó una positividad menos frecuente para el receptor de progesterona en los casos con sobreexpresión del HER-2 (4,18,20), esta observación no fue estadísticamente significativa.
REFERENCIAS BIBLIOGRÁFICAS
1. Zarbo RJ, Hammond EH. Conference summary, strategic science symposium. Her-2/neu testing of breast cancer patients in clinical practice. Arch Pathol Lab Med. 2002;127:549-53. [ Links ]
2. Uhlenhopp MB. HER2 in breast cancer-what does it mean? Medscape CME activity [publicación periódica en línea] 2000 enero [Acceso 13 enero 2000]. Disponible en: http://www.medscape.com/viewprogram/681[ [ Links ]STANDARDIZEDENDPARAG]
3. el-Ahmady O, el-Salahy E, Mahmoud M, Wahab MA, Eissa S, Khalifa A. Multivariate analysis of bcl-2, apoptosis, p53, and HER-2/neu in breast cancer: a short-term follow-up. Anticancer Res. 2002;22:2493-9. [ Links ]
4. Aziz SA, Pervez S, Khan S, Kayani N, Azam SI, Rahbar MH. Significance of immunohistochemical c-ErbB-2 product localisation pattern for prognosis in human breast cancer. Pathol Oncol Res. 2001;7:190-6. [ Links ]
5. Ho GH, Calvano JE, Bisogna M, Borgen PI, Rosen PP, Tan LK, et al. In microdissected ductal carcinoma in situ, HER-2/neu amplification, but not p53 mutation, is associated with high nuclear grade and comedo histology. Cancer. 2000;89:2153-60. [ Links ]
6. Hanna WM, Kahn HJ, Pienkowska M, Blondal J, Seth A, Marks A. Defining a test for HER-2/neu evaluation in breast cancer in the diagnostic setting. Mod Pathol. 2001;14:677-85. [ Links ]
7. Esteva FJ, Hortobagyi GN, Sahin AA, Smith TL, Chin DM, Liang SY, et al. Expression of erbB/HER receptors, heregulin, and p38 in primary breast cancer using quantitative immunohistochemistry. Pathol Oncol Res. 2001;7:171-7. [ Links ]
8. Houck W, Miller KD, Schneider BP. Targeting HER2, EGFR, and VEGF in breast cancer: therapeutic potential and current results. Medscape Clinical Update [publicación periódica en línea] 2003 Enero [Acceso 27 enero 2003] Disponible en: http://www.medscape.com/viewprogram/2208[ [ Links ]STANDARDIZEDENDPARAG]
9. Bhargava R, Naeem R, Marconi S, Luszcz J, Garb J, Gasparini R, et al. Tyrosine kinase activation in breast carcinoma with correlation to Her-2/neu gene amplification and receptor overexpression. Hum Pathol. 2001;32:1344-50. [ Links ]
10. Ross JS, Fletcher JA, Linette GP, Stec J, Clark E, Ayers M, et al. The HER-2/neu gene and protein in breast cancer 2003: biomarker and target of therapy. Oncologist. 2003;8:307-25. [ Links ]
11. Kaya H, Ragazzini T, Aribal E, Guney I, Kotiloglu E. Her-2/neu gene amplification compared with HER-2/neu protein overexpression on ultrasound guided core-needle biopsy specimens of breast carcinoma. Pathol Oncol Res. 2001;7:279-83. [ Links ]
12. Gupta D, Middleton LP, Whitaker MJ, Abrams J. Comparison of flourescence and chromogenic in situ hybridization for detection of HER-2/neu oncogene in breast cancer. Am J Clin Pathol. 2003;119:381-87. [ Links ]
13. College of American Pathologists. Clinical laboratory assays for HER-2/neu amplification and overexpression. quality assurance, standardization, and proficiency testing. Arch Pathol Lab Med. 2002;126:803-8. [ Links ]
14. Rhodes A, Jasani B, Anderson E, Dodson AR, Balaton AJ. Evaluation of HER-2/neu immunohistochemical assay sensitivity and scoring on formalin-fixed and paraffin-processed cell lines and breast tumors: a comparative study involving results from laboratories in 21 countries. Am J Clin Pathol. 2002;118:408-17. [ Links ]
15. Dako. DAKO HercepTest: A Manual for Interpretation. [monografía en Internet]. Glostrup: Dako; 2002 [Accesado 15 junio 2005]. Disponible en: http://pri.dakocytomation. com/herceptestmanual.pdf[ [ Links ]STANDARDIZEDENDPARAG]
16. Birner P, Oberhuber G, Stani J, Reithofer C, Samonigg H, Hausmaninger H, et al. Evaluation of the United States food and drug administration-approved scoring and test system of HER-2 protein expression in breast cancer. Clin Cancer Res. 2001;7:1669-75. [ Links ]
17. Diaz NM. Laboratory testing for HER2/neu in breast carcinoma: an evolving strategy to predict response to targeted therapy. Cancer Control. 2001;8:399-406. [ Links ]
18. Menard S, Balsari A, Casalini P, Tagliabue E, Campiglio M, Bufalino R, et al. HER-2-positive breast carcinomas as a particular subset with peculiar clinical behaviors. Clin Cancer Res. 2002;8:520-5. [ Links ]
19. Rafael GP. Características epidemiológicas, clínicas y factores pronósticos en cáncer de mama en mujeres premenopáusicas. [Tesis para optar el título profesional de especialista en Ginecología y Obstetricia]. Lima, Perú: Universidad Nacional Mayor de San Marcos; 2003. [ Links ]
20. González-Müller CA, Yabar-Berrocal A, Chacón-Yupanqui P. Características demográficas e histopatológicas del cáncer de mama HER-2 positivo. XXIV Congreso Latinoamericano de Patología; realizado del 20 al 24 de octubre de 2003; Quito, Ecuador. Quito: Sociedad Latinoamericana de Patología; 2003. p. 12. [ Links ]
21. Guevara G, Chacaltana A. Aspectos epidemiológicos del cáncer de mama en el hospital regional de Ica. Rev Soc Per Med Inter 2003;16:64-8. [ Links ]
22. Rozas R, Rivas L, Carayhua D. Cáncer de mama en el hospital nacional Daniel A. Carrión-Callao Aspectos anatomopatológicos y epidemiológicos. Acta Cancer. 2002;31:22-30. [ Links ]
23. Bilous M, Ades C, Armes J, Bishop J, Brown R, Cooke B, et al. Predicting the HER2 status of breast cancer from basic histopathology data: an analysis of 1500 breast cancers as part of the HER2000 International study. Breast. 2003;12:92-8. [ Links ]
24. Cianfrocca M, Goldstein LJ. Prognostic and predictive factors in early-stage breast cancer. The Oncologist. 2004;9:606-16. [ Links ]
25. Lewis F, Jackson P, Lane S, Coast G, Hanby AM. Testing for HER2 in breast cancer. Histopathology. 2004;45:207-17. [ Links ]
26. Swede H, Moysich KB, Winston JS, Hurd TC, Edge SB, Romero-Gutierrez M, et al. Variation of prognostic significance of HER-2 expression in breast cancer according to tumor size. Breast J. 2003;9:98-105. [ Links ]
27. Schmidt M, Lewark B, Kohlschmidt N, Glawatz C, Steiner E, Tanner B, et al. Long-term prognostic significance of HER-2/neu in untreated node-negative breast cancer depends on the method of testing. Breast Cancer Res. 2005;7:R256-R266. [ Links ]
28. Kothari AS, Beechey-Newman N, Hamed H, Fentiman IS, DArrigo C, Hanby AM, et al. Paget disease of the nipple. A multifocal manifestation of higher-risk disease. Cancer. 2002;95:1-7. [ Links ]
29. Córdova S, Salazar LW, Arias Stella CJ, Arias Stella J. Identificación de la sobreexpresión del oncogen c-erb B2 o HER-2/neu en cáncer de mama. Acta Cancerol. 2003;32:43-9. [ Links ]
Manuscrito recibido el 10 de junio de 2005 y aceptado para publicación el 30 junio de 2005.
Correspondencia:
Dr. Carlos Alberto González-Müller
Calle el Prado 129 Urb. Las Viñas de la Molina.
Lima 12, Perú.
Correo-e: gonzalezmuller@yahoo.com