Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. v.67 n.3 Lima jul.- sep. 2006
El timerosal y las enfermedades del neurodesarrollo infantil
Luis Maya 1,2, Flora Luna 2
1 Departamento de Medicina Interna, Hospital Nacional Arzobispo Loayza.
2 Facultad de Medicina, Universidad Nacional Mayor de San Marcos (UNMSM). Lima, Perú.
Resumen
Se evalúa la relación causal entre el timerosal (etilmercurio), como preservante en las vacunas pediátricas, y el incremento de casos de enfermedades del neurodesarrollo infantil, como consecuencia de la ampliación de los esquemas de inmunización. Se revisó la información científica, relacionando el timerosal y las evidencias que permitan evaluar una posible asociación causal, con estudios epidemiológicos, ecológicos, biomoleculares y toxicológicos, de bioseguridad, toxicológicos fetales y sobre salud reproductiva. Se encontró múltiples asociaciones entre la exposición a timerosal y las enfermedades del neurodesarrollo infantil. Tal neurotoxicidad ocurre en los infantes y fetos de gestantes vacunadas por dosis acumulativa de mercurio. Las diversas evidencias implican al timerosal como el agente causante, agravante o disparador de las enfermedades del neurodesarrollo infantil. La toxicidad del mercurio obligó al retiro progresivo del timerosal de los medicamentos. Lamentablemente, en las vacunas, ha habido una sustancial demora en la demostración de su impacto negativo. Actualmente, existen vacunas sin timerosal, cuyo uso está ocasionando la disminución de la incidencia de las enfermedades del neurodesarrollo infantil.
Palabras clave: Timerosal; autismo; enfermedades del sistema nervioso; desarrollo infantil; vacunas.
Thimerosal and childrens neurodevelopmental disorders
Abstract
The causal relation of thimerosal (ethylmercury), preservative in pediatric vaccines, and the increase of childrens neurodevelopmental disorders as a result of the increase in immunization schemes is determined. The scientific information on thimerosal and its influence on the childs neurodevelopmental disorders is reviewed. Evidences found in epidemiological, ecological, biomolecular, toxicology, biosecurity, fetal toxicology and reproductive health studies signal the possible causal association of thimerosal exposition and neurodevelopmental disorders of the child. Such neurotoxicity occurs in infants and fetuses of vaccinated pregnant women, due to mercury cumulative doses. The various evidences imply thimerosal as the causal agent, aggravating or triggering neurodevelopmental disorders of the child. The mercury toxicity forced progressive thimerosal withdrawal. Unfortunately, there was a delay in demonstrating thimerosal negative impact. Currently vaccines without thimerosal are causing less incidence of childrens neurodevelopmental disorders.
Key words: Thimerosal; autism; nervous system diseases; child development; vaccines.
INTRODUCCIÓN
En el año 2004, la American Academy of Pediatrics (AAP) y el Department of Health and Human Services de los Estados Unidos de Norteamérica (EE.UU.) lanzaron una alerta epidémica, impresionados por el número cada vez más alarmante de casos de autismo y otros desórdenes difusos del neurodesarrollo infantil, señalando que para entonces 1 de cada 6 niños norteamericanos tenía una trastorno del desarrollo o de la conducta y que 1 de cada 166 niños tenía un desorden del espectro autista (DEA).
Tales entidades conforman actualmente un grupo heterogéneo de enfermedades, donde se incluye, además del autismo propiamente dicho, el síndrome de Rett, el síndrome de Asperger y el desorden generalizado del desarrollo (1,2).
Múltiples trabajos han mostrado un extraordinario aumento de casos de DEA desde mediados de la década de los 80 (3-15). De acuerdo a una investigación llevada a cabo por la Casa de Representantes del Congreso de los EE.UU., en dicho país la epidemia mostró un ritmo de crecimiento anual de 10 a 17%, hasta el año 2003 (16).
Los datos estadísticos del US Department of Education 2002 muestran que, a fines de los años 60 tan solo se había comunicado sobre 919 casos nuevos de autismo en todo el territorio de los EE.UU.; sin embargo, desde la década de los 80, el crecimiento fue continuo y adoptó una curva exponencial, de modo que para los comienzos de los años 90 el número de casos nuevos había ascendido a 6 785 y llegó a casi 100 000 en el año 2002, lo cual representaba un aumento de 700% en apenas 10 años (17). En lo que se refiere a los estimados de prevalencia, durante los años 40 en dicho país se había registrado una tasa de autismo de 1 por cada 10 000 niños; en el año 1977 fue de 1 por cada 2 500; en 1985, aumentó a 1 cada 1 133; en 1998, se incrementó a 1 por cada 323 y, el año 2004, alcanzó la impresionante cifra de 1 por cada 166 niños (15,18).
Dichas estadísticas convertían a los DEA en la mayor epidemia de enfermedades mentales jamás observada en la historia de los EE.UU., significando más casos que enfermedades, tales como el síndrome de Down, la diabetes mellitus tipo 1 y el cáncer pediátrico (8).
Si bien en nuestro medio aún no disponemos de datos estadísticos que estimen la magnitud de este problema, varios países en todo el mundo simultáneamente han notificado incrementos similares. En la China, por ejemplo, donde los DEA eran prácticamente desconocidos, coincidiendo con la introducción de las compañías norteamericanas productoras de vacunas a partir del año 1999, se ha informado sobre 1,8 millones de niños autistas recientemente diagnosticados; asimismo, los DEA también se han incrementado significativamente en la India, Nicaragua, Argentina y en otros países en vías de desarrollo, durante los últimos años (19).
El hecho de observar tan impresionante aumento de casos, como el descrito, descartaba definitivamente la hipótesis de que estas enfermedades fueran debidas exclusivamente a un trastorno genético, pues dichas condiciones tardan muchos años en desarrollarse y nunca alcanzan cifras epidémicas, salvo exposiciones ionizantes o catástrofes nucleares.
Algunos investigadores adujeron que tal fenómeno podría deberse a cambios y mejoras en los criterios de diagnóstico. Sin embargo, a pesar que desde el año 1994 se comenzó a aplicar en los EE.UU. y en todo el mundo los criterios del DSM IV (Diagnostic and Statistical Manual 4th Ed.), como fuente obligatoria para el diagnóstico de las enfermedades mentales, el número de casos nuevos identificados como DEA continuó aumentando significativamente, hasta el año 2001 (6); asimismo, múltiples trabajos han encontrado que factores, como fenómenos migratorios o mejoras en las herramientas de diagnóstico, no explican el incremento de los casos y que la epidemia es genuina (8,11,13,15,16,20,21).
ROL DE LAS VACUNAS SOBRE LA EPIDEMIA
Históricamente, hasta antes del año 1980, al menos las dos terceras partes de los niños autistas mostraban serios problemas neurológicos poco después de su nacimiento. No obstante, durante el periodo 1980-1985, mientras la incidencia de los DEA claramente aumentaba en todo el mundo, simultáneamente comenzó a describirse una nueva forma de autismo, denominada tardía o de regresión, en donde los niños afectados mostraban notables cambios en la pérdida de sus relaciones sociales, lenguaje y comportamiento, entre el primer y segundo año de vida. Para 1985, la ocurrencia de autismo de regresión había ya igualado a la del autismo desde el nacimiento, sugiriendo que esta variante adquirida de la enfermedad sobrepasaba los tipos debidos a problemas genéticos o errores innatos del metabolismo (22).
Desde aquellos años, los padres de los niños autistas (y eventualmente sus médicos) comenzaron a comunicar a las autoridades de salud de los EE.UU., que el inicio de los síntomas autísticos de sus hijos coincidía o aparecía poco después de la aplicación de sus vacunas. Para entonces, el Autism Research Institute (ARI) de San Diego, California, había observado también un cambio significativo: la mayor parte de los niños mostraba cambios conductuales a la edad promedio de 18 meses, al terminar de recibir el mayor número de sus inmunizaciones, a diferencia de lo que había venido ocurriendo clásicamente durante las décadas pasadas, en donde los síntomas de la enfermedad aparecían desde los primeros meses de vida de los niños afectados (18).
Aún más, una investigación reciente documenta a través de la evaluación de cintas de video caseras, que los cambios patológicos en la comunicación, afectividad, relaciones sociales, conductas repetitivas y las formas de juego infantil, claramente se manifiestan entre los 12 y 24 meses de edad en los niños que posteriormente son diagnosticados dentro de los DEA (23).
De acuerdo a los estudios del ARI, para el año 1997, el autismo de inicio tardío o de regresión había alcanzado por lo menos el 80% del total de casos. A pesar de los cambios en los criterios de diagnóstico antes señalados, el crecimiento exponencial de la enfermedad sugiere que este fenómeno no es debido a errores innatos del metabolismo, sino más bien a una condición adquirida (24).
Asimismo, diversos estudios notaron que la curvas de incremento de los casos de DEA coincidían con el aumento del número de vacunas pediátricas y sus respectivos refuerzos, estando directamente relacionadas a las dosis de exposición total al timerosal, un preservante y antiséptico compuesto en un 49,6% por una forma de mercurio (Hg) orgánico, denominado etilmercurio, contenido en la mayoría de ellas (25-27).
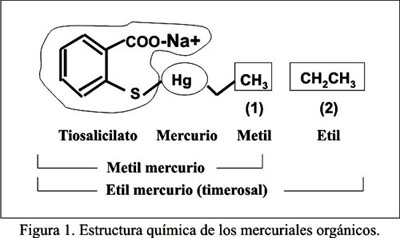
El timerosal o [(etilmercuri)tio] 2 benzoato de sodio (ácido etilmercuritiosalicílico), cuya fórmula molecular es C9H9HgNaO2S (Figura 1), se disocia en el organismo en etilmercurio y tiosalicilato, siendo un compuesto químico altamente inestable. Debido a su gran liposolubilidad, puede atravesar fácilmente la barrera hematoencefálica y la placentaria, exhibiendo un corto tiempo de vida media en la sangre. Puede depositarse en el sistema nervioso central, donde posteriormente se transforma en Hg inorgánico, el cual se acumula en el cerebro humano y animal, mostrando un tiempo de vida media entre 227 y 540 días. El Hg orgánico puede también unirse al glutatión y a otras proteínas plasmáticas, como la metalotioneína, proteínas que tienen un papel protector, evitando el transporte de Hg fuera de las células. Sobre la base de la limitada información disponible, se ha concluido que los efectos nocivos del etilmercurio pueden ser similares (o incluso peores) a los del metilmercurio, otro mercurial orgánico de documentada neurotoxicidad.
Se ha estimado que, si un niño nacido en los EE.UU. recibía todas las dosis establecidas de vacunación dentro de sus primeros 6 meses de edad, los valores de exposición a Hg habían aumentado de manera significativa con el correr del tiempo (28):
Nacidos 1950 – 1970: 50 mg de Hg.
Nacidos 1971 – 1975: 75 mg de Hg.
Nacidos desde 1992: 187,5 mg de Hg.
En otras palabras, las dosis de Hg recibidas tan solo en los primeros seis meses de vida se habían elevado más de tres veces en menos de 20 años, debido al aumento del número de inmunizaciones aprobadas por la AAP y aceptadas tanto por el US Centers for Disease Control and Prevention (CDC), como la US Food and Drug Administration (FDA) de los EE.UU. Aún más, a los 18 meses de edad, la exposición mercurial ascendía a 237,5 microgramos (mg) y, si adicionalmente se aplicaba tres vacunas contra la influenza hasta el año y medio de vida, tal como era sugerido en algunos grupos poblacionales, entonces la exposición total a Hg podría haber sido tan alta como 275 mg (29,30).
Dado que los estudios observacionales mostraban una correlación directa entre las tasas de incidencia de DEA y la exposición mercurial de las vacunaciones, así como también múltiples evidencias clínicas y de laboratorio similares fueron encontradas entre estas enfermedades y la intoxicación por Hg, Bernard S. y col. (31) fueron los primeros en establecer formalmente una relación causal.
Por otro lado, se ha señalado que los elevados rangos de frecuencia de DEA en zonas urbanas, en relación a las rurales, también son consistentes con una asociación ambiental geográfica (32,33); más aún considerándose que, concomitantemente a la mayor exposición al timerosal de las vacunas, mundialmente se ha reportado una mayor exposición ambiental a diversos metales pesados, especialmente al Hg (34,35). En el Perú, dicha contaminación ambiental podría ser mayor en zonas rurales mineras ubicadas en la sierra del país; en tanto que, en los niños de la costa, la mayor exposición mercurial estaría asociada a las vacunas conteniendo etilmercurio.
Actualmente, si bien se acepta que pueden presentarse casos de sobreposición entre ambos, dos tipos principales de autismo han sido descritos (24):
Tipo I (clásico o desde el nacimiento): ocasionado por un desorden metabólico severo, debido a un error innato del metabolismo, con asociaciones genéticas. En los niños afectados, las características autísticas aparecen prontamente en la vida, acompañadas muchas veces de otras alteraciones clínicas, que incluso pueden ser más dramáticas. Se ha mencionado al menos dos docenas de condiciones asociadas en la literatura: síndrome de Le cri-du-chat, síndrome de Prader-Willi, síndrome de Angelman, síndrome de Rubenstein-Taybi, síndrome de Smith-Magenis, síndrome de Rett, histidinemia, enfermedad de Lesch-Nyhan, síndrome de fragilidad del cromosoma X, esclerosis tuberosa, neurofibromatosis tipo 1, fenilcetonuria, entre otros (36-38).
Tipo II (adquirido o de regresión): forma relativamente nueva, responsable primaria del aumento exponencial de casos de autismo en el mundo. Esta variante supone una predisposición genética, pero es determinada por exposiciones tóxicas (metales pesados) e inmunológicas (vacunaciones con virus vivos atenuados). Si bien es cierto que, siempre estuvo presente en alguna medida, se ha convertido en la forma más prevalente, debido al aumento y severidad de dichos factores de exposición (39).
Se ha señalado que estas dos clasificaciones podrían ser arbitrarias, cuando los desórdenes metabólicos de origen genético son casi de igual severidad que los efectos de las injurias adquiridas. Pero, está muy claro que los casos de autismo tipo I constituyen ahora una pequeña minoría y que la mayor parte de casos, incluso 19 de cada 20, no hubieran mostrado manifestaciones de autismo si no hubieran sido expuestos a uno o más factores disparadores. De acuerdo a este concepto, a mayor exposición tóxica y/o inmunológica, mayores fallas se observará en el neurodesarrollo, habiéndose comprobado variaciones individuales determinadas por diferencias genéticas, el estado inmunológico, condiciones psicológicas y el estado nutricional (24).
Basados en más de 30 años de investigación, el ARI ha determinado que tales injurias condicionantes de las enfermedades del neurodesarrollo infantil son (24):
1. El uso de Hg orgánico (timerosal) como preservante en las vacunas pediátricas, las cuales se incrementaron en número y frecuencia durante la aparición de la epidemia de DEA y otras enfermedades del neurodesarrollo infantil en los EE.UU., así como su interacción con otras toxinas contenidas en las vacunas, como el aluminio y el formaldehído.
2. El incremento del número de vacunaciones y sus respectivos refuerzos, vía las dosis multivalentes, especialmente la vacuna contra el sarampión contenida en la combinación triple viral sarampión-rubéola-paperas (40-53).
3. Las múltiples inmunizaciones dadas tempranamente en la infancia a los recién nacidos y lactantes menores de seis meses (tal como la vacuna contra la hepatitis viral B), administradas antes de que se adquiera suficiente maduración metabólica y capacidad inmunológica (54).
4. El aumento de la contaminación ambiental, dado por la presencia de metales pesados, pesticidas, herbicidas, fungicidas, percloratos, químicos de uso militar, etc.; condicionando mayor exposición a metales pesados y sustancias químicas tóxicas (55-60).
5. El uso de antimonio como agente no inflamable en las ropas infantiles en algunas zonas de los EE.UU. donde las casas son de madera y la ley americana obligaba a la utilización de pijamas con dicho material.
6. La disminución de la calidad de la nutrición durante el embarazo y la primera infancia, especialmente por la disminución de la lactancia materna y su sustitución por fórmulas lácteas artificiales.
7. El uso de sustancias de abuso antes o durante la gestación (61,62).
CONTENIDO DE MERCURIO ORGÁNICO EN LOS ESQUEMAS DE VACUNACIÓN PERUANOS
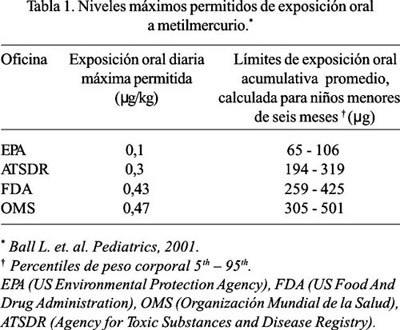
Varias agencias de salud internacionales han desarrollado guías para establecer los niveles de máxima exposición permitidos a metilmercurio (otra forma de Hg orgánico contenido básicamente en el agua y los alimentos, previamente mejor y más extensamente estudiado y que históricamente ha servido de comparación con el etilmercurio del timerosal). Éstas incluyen a la US Environmental Protection Agency (EPA 1997), la US Agency for Toxic Substances and Disease Registry (ATSDR 1999), la US FDA (Federal Register 1979) y la Organización Mundial de la Salud (OMS 1996). Dichos niveles de máxima exposición varían desde 0,1 microgramos por kilogramo de peso diarios (mg/kg/día) de la EPA, hasta 0,47 mg/kg/día establecidos por la OMS (28,63), según se muestra en la Tabla 1.
El rango amplio recomendado se debe a márgenes de seguridad variantes, diferencias en los énfasis puestos en las fuentes de los datos, los diferentes objetivos de las agencias y el tipo de población a la cual la guía está dirigida a proteger. Todas las guías, sin embargo, caen en el mismo orden de magnitud. Si bien es cierto estas guías pueden ser usadas como referencias para evaluar la máxima exposición permitida a Hg orgánico, no necesariamente son valores límites sobre los cuales se presentará toxicidad (28). Sin embargo, si los niveles de exposición sobrepasan los límites de varias de estas guías, existe consenso por parte de las organizaciones de salud pública antes citadas, de que pueden ocurrir consecuencias adversas contra la salud (63).
Para aclarar las discrepancias entre las diferentes guías de exposición, el Congreso de los EE.UU. encargó a la National Academy of Sciences de ese país, la realización de un estudio sobre los efectos toxicológicos del metilmercurio, con el objeto de que ofrezca recomendaciones en el establecimiento de la dosis de referencia científicamente más apropiada (64). Dicho reporte concluyó que la actual dosis de referencia de la EPA era el nivel científicamente justificable más adecuado para la protección de la salud humana, es decir 0,1 mg/kg/día. Debido a que, a pesar de más de 70 años de vacunaciones con timerosal, no se cuenta en la actualidad con datos definitivos que comparen la toxicidad del etilmercurio vs. la del metilmercurio; la US FDA considera a ambos como equivalentes en la evaluación del riesgo (28).
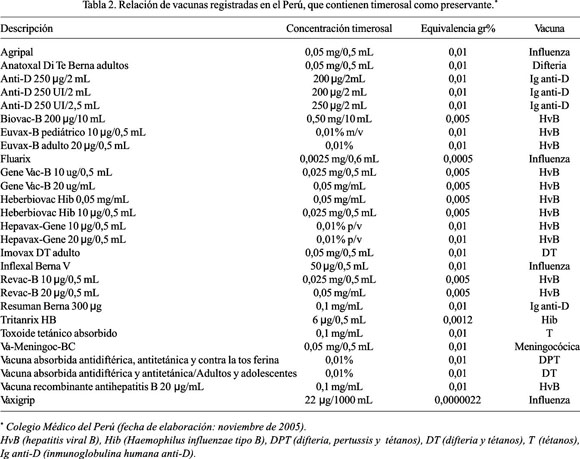
Las vacunas para seres humanos contienen concentraciones de timerosal desde 0,001% (1 parte en 100 000) hasta 0,01% (1 parte en 10 000). El timerosal es un compuesto constituido prácticamente en 50% por etilmercurio; por lo tanto, aquella vacuna conteniendo 0,01% de timerosal como preservante, tiene 50 mg de timerosal por dosis de 0,5 mililitros (mL) o aproximadamente 25 mg de etilmercurio por dosis de 0,5 mL (28). El contenido de Hg orgánico, bajo la forma de etilmercurio, en las vacunas disponibles actualmente en el Perú se muestra en la Tabla 2.
La gran mayoría de las vacunas pediátricas empleadas en nuestro medio utilizan las dosis más altas permitidas de etilmercurio (25 mg en cada una de ellas). Dichas inmunizaciones son: la vacuna contra la difteria-pertussis-tétanos (DPT), la del Haemophilus influenzae tipo B (Hib), la de la hepatitis viral B (HvB), la de la influenza y la vacuna contra el meningococo.
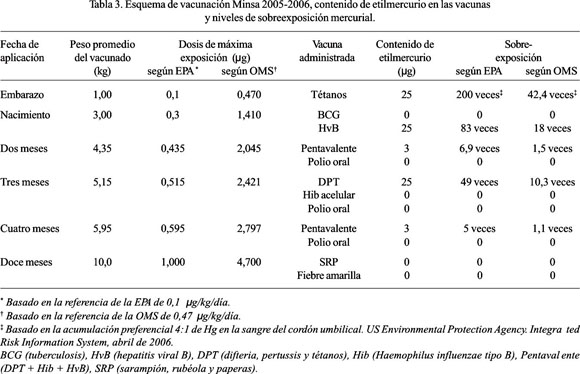
La Tabla 3 muestra el esquema actual de vacunaciones establecido por el Ministerio de Salud del Perú (Minsa), el peso promedio de un niño peruano en las diferentes edades en las que es inmunizado, los niveles de máxima exposición mercurial permitidos según la EPA y la OMS en los cuales es vacunado y los niveles de sobreexposición correspondientes a los que es sometido empleándose vacunas que contienen 25 mg de etilmercurio. Nótese que las inmunizaciones administradas durante el embarazo, al nacimiento y a los tres meses de edad superan largamente todos los niveles de máxima exposición establecidos, mientras que a los 2 y 4 meses de edad, sobrepasan los niveles de referencia de la EPA.
Es de notar que el Minsa incluye solo a la Hib acelular en sus esquemas de vacunación, la misma que carece de Hg. Recientemente, retiró las dos dosis de DPT, antes empleadas a los dos y cuatro meses de edad, por una vacuna pentavalente (DPT + Hib + HvB), que se prepara a partir de la combinación de dos vacunas: la Tritanrix HB (DPT + HvB) que contiene tan solo trazas de Hg (aproximadamente 3 mg, de acuerdo al productor) y la Hiberix (Hib acelular), que no contiene Hg. Gracias a estos cambios, la dosis total de etilmercurio recibida en los primeros cuatro meses de vida de un niño peruano se ha reducido a 56 mg, de acuerdo al calendario actual de vacunaciones del Minsa.
Sin embargo, en centros de vacunación privados se continúa empleando múltiples inmunizaciones, con vacunas que contienen dosis altas de Hg. Por ejemplo, si se aplicara simultáneamente las vacunas DPT, Hib y HvB el mismo día, sumarían una exposición total de 75 mg de Hg; por lo tanto, según la EPA el niño debería pesar 750 kg y de acuerdo a la OMS el niño debería pesar 159 kg, para no exceder los mayores márgenes permitidos correspondientes.
Asimismo, se aplica dos tipos de vacunas a las gestantes peruanas, conteniendo grandes cantidades de etilmercurio. Eventualmente, se requiere emplear las inmunoglobulinas humanas anti-D, para prevenir la hemólisis por incompatibilidad sanguínea en el recién nacido de las madres portadoras del factor sanguíneo Rh negativo. Sin embargo, rutinariamente se administra la vacuna antitetánica (toxoide tetánico absorbido) en dos dosis, a partir del cuarto mes del embarazo; cada dosis contiene 25 mg de etilmercurio adicionales, los mismos que se inyecta en un periodo muy susceptible de la vida fetal. Dado que, las concentraciones mercuriales en la sangre fetal han resultado ser 4,3 veces mayores que las encontradas en la sangre materna (65), la exposición fetal a Hg de estas vacunas supera 200 y 42 veces las referencias máximas permitidas, de acuerdo a la EPA y la OMS, respectivamente (Tabla 3). Cabe resaltar que, tales inmunizaciones se aplica sobretodo a población urbana, cuyos partos ocurren en centros médicos que reúnen condiciones óptimas de esterilidad, lo cual limita significativamente el riesgo de tétanos neonatal a niveles prácticamente inexistentes.
A pesar de los impresionantes niveles de sobreexposición observados y para mayor preocupación, se debe considerar adicionalmente los siguientes puntos:
1. Los niveles de exposición antes mencionados están dados únicamente por el contenido de Hg en las vacunas y no considera otras fuentes de exposición mercurial, tales como los alimentos (en especial, el pescado), la leche materna, el agua u otras fuentes de contaminación del ambiente. La European Medical Evaluation Agency (EMEA) ha estimado que dichas fuentes, fuera de las vacunas, representan entre 80 y 100 mg adicionales de Hg por año (66). Asimismo, estudios hechos en el Canadá han estimado que las vacunas conteniendo timerosal representan solamente el 50% de la exposición mercurial a la que los niños son sometidos tan solo durante su primer año de vida (67).
2. Los niveles de máxima exposición recomendados fueron establecidos para la exposición oral a mercuriales orgánicos; es de esperar que, si éstos se administran por vía parenteral (como es el caso de las vacunas), la exposición sea incluso mayor, pues los niveles pico sanguíneos aparecen mucho más rápidamente.
3. Dichos rangos de máxima exposición permitidos han sido establecidos para adultos con un peso promedio de 70 kg; se sabe que los fetos en desarrollo y los niños pequeños son mucho más susceptibles a la toxicidad mercurial con respecto a los adultos, en proporción al peso o la superficie corporal (68).
4. Últimamente, se dispone de datos que muestran que el etilmercurio del timerosal tiene menor tiempo de vida en la sangre, pues su mayor liposolubilidad le otorga mayor capacidad para atravesar la barrera hemato-encefálica en relación al metilmercurio, depositándose siete veces más en el sistema nervioso central, como Hg inorgánico (considerado la forma mercurial más toxica de todas) (69).
EVIDENCIAS
1. Estudios epidemiológicos
En los EE.UU., se ha conducido seis grandes estudios epidemiológicos poblacionales en forma retrospectiva, que evaluaron la asociación entre el timerosal contenido en las vacunas pediátricas y los DEA. De ellos, cinco investigaciones encontraron que sí existía relación causal entre la exposición a timerosal y las enfermedades del neurodesarrollo infantil (25-27,70,71), mientras que uno concluyó finalmente que no podía aceptar ni rechazar dicha hipótesis (72).
Otros estudios epidemiológicos (73-77) conducidos fuera de los EE.UU. no han mostrado una asociación aparente. Sin embargo, en todos ellos se evalúa menores cantidades de exposición mercurial en las vacunas, siendo éstas la tercera parte de las cantidades administradas en los EE.UU. En efecto, las dosis totales de exposición al etilmercurio en las vacunas pediátricas en el Reino Unido, Suecia y Dinamarca de 75 mg, 75 mg y 125 mg, respectivamente, distan bastante de los 237,5 mg de potencial máxima exposición, de acuerdo al calendario de inmunizaciones norteamericano. Precisamente, se ha señalado este punto como una de sus principales limitaciones (78). Asimismo, dado que al parecer es muy importante considerar el momento exacto de ocurrida la exposición en relación a la maduración cerebral, los expertos también han notado que, en los países donde se ha efectuado estos estudios, los esquemas de vacunación difieren grandemente de los calendarios de inmunización establecidos en los EE.UU., por lo que sus conclusiones no pueden extrapolarse a otros países (71). Finalmente, se ha hecho notar que el poder estadístico de todos ellos no ha sido validado adecuadamente, por lo que su capacidad para detectar condiciones poco comunes, como las estudiadas en estas largas cohortes poblacionales, es bastante limitada. Ninguno de los estudios referenciados ha estimado dicho poder estadístico ni definió la forma cómo establecieron el tamaño de sus muestras (78-81).
Los DEA en los EE.UU., con 60 por 10 000 niños (1 por cada 166) actualmente afectados, son mucho más prevalentes que en los países del norte de Europa, como Dinamarca, uno de los países donde el US CDC decidió realizar varios de sus estudios epidemiológicos (74,75) que no han mostrado asociación. En dicho país, el timerosal fue retirado de las vacunas en 1992 y en la actualidad reporta 7,7 autistas por 10 000 niños (1 por cada 1 300). A pesar de ello, los autores no han sabido justificar tan importantes diferencias epidemiológicas. Otros investigadores también han observado que, dadas las grandes diferencias entre el esquema de vacunación pediátrico danés y el norteamericano, las conclusiones de tales investigaciones, incluso si fueran relevantes para Dinamarca, ciertamente no son aplicables en los EE.UU. (82).
El primer (y lastimosamente único) gran estudio oficial realizado por el US CDC en más de 70 años de historia de las vacunaciones, fue conducido por Verstraeten T. y col., utilizando la Vaccine Safety Datalink (VSD), el registro más grande de datos relacionados a la salud y las inmunizaciones en los EE.UU. (72). La investigación se inició el año 1997, siendo sus resultados iniciales presentados tres años después en forma reservada y confidencial, en junio del 2000, en el Centro Simpsonwood, de Georgia. De acuerdo a las transcripciones obtenidas gracias a una solicitud apelando al Acta por la Libertad de Información de los EE.UU. (83), a dicha conferencia asistieron únicamente 52 personas: autoridades de la OMS, del US CDC, de la US FDA, expertos en vacunación de entonces y representantes de las cuatro compañías fabricantes de vacunas de los EE.UU. (GlaxoSmithKline, Merck, Wyeth y Aventis Pasteur). Tales resultados nunca fueron publicados oficialmente. No obstante, de acuerdo a las transcripciones de la conferencia, los autores encontraron relación causal estadísticamente significativa entre la exposición mercurial contenida en las vacunas a los tres meses de edad, tanto con el autismo como con el síndrome de déficit de la atención, entre otras enfermedades del neurodesarrollo infantil. El CDC decidió mantener en reserva tal información y ordenó a los autores continuar trabajando con los datos de la VSD. Después de tres años adicionales y luego de múltiples cambios en el diseño y la metodología del estudio, los resultados fueron publicados finalmente en la revista Pediatrics, órgano oficial de la AAP, rectificándose de sus conclusiones iniciales y rechazando la relación causal.
La publicación de este estudio ha recibido el mayor número de críticas y sospechas de falta de independencia, por diferentes organizaciones americanas de lucha contra el autismo y la comunidad autista en general, de los EE.UU. Curiosamente, el autor principal de la investigación (Verstraeten) fue contratado por una de las compañías farmacéuticas norteamericanas antes citadas, mucho antes de la publicación final de su investigación, y conducido fuera de los EE.UU., a Bélgica. Asimismo, en una Carta al Editor, aparecida en Pediatrics un año después de publicado su estudio (84), Verstraeten contradice las conclusiones de su propia investigación; afirmando que, en realidad, su estudio finalmente concluyó en un resultado neutro, es decir, que no pudo aceptar pero tampoco pudo rechazar la asociación causal.
Desde el año 2000, el US CDC había encriptado la data de la VSD, restringiendo su análisis por investigadores independientes. Se requirió de la intervención de un Comité de la Casa de Representantes del Congreso de los EE.UU. (16) para permitir por primera vez el acceso a dicha fuente de datos a investigadores que no se encuentren relacionados a ninguna oficina federal norteamericana ni a las compañías farmacéuticas. Ello ocurrió en forma limitada el año 2004 y, hace pocos meses, el resultado de dicho estudio fue publicado. La investigación concluye que la exposición a Hg, a través de las vacunas conteniendo timerosal administradas en los EE.UU., fue un factor de riesgo significativo para la aparición de desórdenes del neurodesarrollo (71).
2. Estudios ecológicos
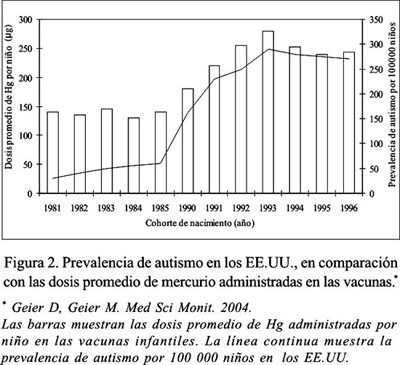
Un reciente estudio, que evaluó la relación entre las dosis promedio de Hg recibidas a través de las vacunas conteniendo timerosal y la prevalencia de autismo en los EE.UU., encontró que las cohortes de nacidos desde mediados de los 80 hasta finales de los 90 mostraron una línea de correlación positiva ascendente estadísticamente significativa entre la exposición mercurial de las vacunas y la prevalencia de la enfermedad (85). En dicho trabajo, los autores hallaron también que, al reducir la dosis de exposición al Hg, se observó una disminución correspondiente en la prevalencia del trastorno (Figura 2).
Asimismo, una última investigación conducida en los EE.UU., utilizando dos fuentes de data diferentes, el Sistema de Reportes de Eventos Adversos a las Vacunas (VAERS) y los Servicios del Departamento del Desarrollo de California (CDDS), señala que ambos registros han coincidido en demostrar incrementos significativos en las curvas de reportes de casos nuevos de autismo y trastornos del lenguaje, desde el año 1994 hasta mediados del año 2002, observándose correlación directa con el contenido de timerosal en las vacunas infantiles. No obstante, y luego del progresivo retiro del etilmercurio de las inmunizaciones pediátricas en los EEUU. a partir del año 1999, ambos registros muestran también un significativo descenso de las mismas curvas, desde mediados del 2002 hasta el año 2005. Los autores concluyen que tales resultados indican claramente que las curvas de reportes de casos nuevos de ambas enfermedades están directamente relacionadas primero al incremento y subsecuentemente a la disminución de las dosis acumulativas de Hg en los niños expuestos a las vacunas conteniendo timerosal, en los esquemas de inmunización norteamericanos (86).
Aún más, los datos provisionales del US Department of Education muestran una reciente disminución del número de casos nuevos de autismo diagnosticados entre niños de 3 a 5 años de edad, los mismos que han sido inmunizados con vacunas libres de timerosal. Después de un incremento anual sostenido, observado desde los inicios de la década pasada, se informó de 1 451 casos nuevos en el período 2001-2002, 1 981 en el período 2002-2003; 3 707 entre 2003-2004 y 3 178 en el período 2004-2005, lo cual representa 529 casos menos (87).
Otro estudio muy reciente ofrece también evidencia epidemiológica que demuestra que, tras la remoción del timerosal de las vacunas pediátricas, el número de casos nuevos de enfermedades del neurodesarrollo infantil ha disminuido significativamente en los EE.UU. (88). En dicha investigación, Geier y col. llevaron a cabo un estudio ecológico, monitoreando el VAERS desde el año 1991 hasta el 2004, evaluando tanto la fecha de recepción de los reportes de daños atribuidos a las vacunas, así como la fecha de administración de las inmunizaciones. Las enfermedades estudiadas fueron autismo, retardo mental y desórdenes del lenguaje. Encontraron que, el pico de reportes recibidos en el VAERS ocurrió en el periodo 2001-2002, correspondiendo a la administración de las vacunas con timerosal del año 1998. No obstante, observaron también una reducción significativa del reporte de casos nuevos de dichas enfermedades desde que el preservante comenzó a ser retirado de las vacunas pediátricas en los EE.UU., en el año 1999 y en adelante.
Adicionalmente, dos estudios recientes han documentado cómo la contaminación ambiental, particularmente la exposición a metales pesados (en especial al Hg) incide significativamente como factor de riesgo en el desarrollo de los DEA. Palmer y col. (89) estudiaron la asociación entre la prevalencia de autismo y la contaminación ambiental por Hg y otras toxinas en Texas, uno de los estados de la unión americana con mayores recursos petrolíferos. Los investigadores compararon los incrementos de casos de autismo, desde 1990 hasta el año 2000, en 31 distritos de Texas, con las tasas de liberación ambiental de Hg. Encontraron que, en promedio, por cada 1 000 libras de Hg liberadas al medio ambiente, se observó un 43% de aumento en las necesidades de servicios de educación especial y un 61% de incremento en la prevalencia de autismo. Asimismo, en un estudio que acaba de ser publicado, conducido por Windham y col., del National Institute of Environmental Health Sciences (90), los autores compararon la exposición ambiental a 19 sustancias químicas identificadas como potenciales neurotóxicos, toxinas del desarrollo y/o perturbadores del sistema endocrino, en 284 niños con DEA y 657 niños sanos de control, en la Bahía de San Francisco, EE.UU. Luego de los ajustes estadísticos correspondientes, los autores encontraron asociación entre el riesgo de desarrollar autismo y la exposición en el aire ambiental alrededor del lugar de residencia a metales pesados (Hg, cadmio y níquel), tricloroetileno y cloruro de vinilo, tanto en la etapa prenatal como en los primeros años de vida de los niños con DEA.
3. Estudios biomoleculares y toxicológicos
Debemos señalar que, la ciencia en general acepta que los estudios de corte epidemiológico pueden aportar tan solo una parte de la evidencia científica, indicando que un área de investigación requiere mayores estudios clínicos y moleculares, a fin de esclarecer un determinado fenómeno. En el caso del timerosal, a pesar de los problemas éticos y médico-legales que supondría realizar estudios de experimentación con etilmercurio en niños, últimamente se ha publicado extensas investigaciones clínicas, tanto en seres humanos como en animales de experimentación, in vivo e in vitro, así como numerosos estudios biomoleculares, que describen la capacidad del timerosal para ocasionar desórdenes neurológicos y que lo vinculan como el agente causal de diversas enfermedades del neurodesarrollo infantil (91).
Las siguientes evidencias han establecido plenamente que, todas las formas de Hg (incluyendo el etilmercurio) son neurotóxicas, especialmente durante las fases tempranas del desarrollo cerebral.
3.1 Estudios en niños con DEA
A la fecha, están a disposición trabajos de investigación hechos en niños con DEA, en los que se demuestra la poca capacidad que tienen éstos para excretar Hg y otros metales pesados en la orina y el cabello (92-96) y cómo dicha capacidad aumenta significativamente luego de que se les administra compuestos quelantes (sustancias capaces de eliminar metales pesados del organismo). Dichos trabajos concluyen que, los niños afectados por los DEA tienen significativamente mayor cantidad de Hg acumulada en sus cuerpos, en comparación con niños sanos control, como resultado de una capacidad disminuida para la excreción de Hg.
El exceso de la excreción urinaria de porfirinas (porfirinuria) es un hallazgo descrito en diversas entidades (deficiencias genéticas, enfermedades hematológicas, hepatopatías, nefropatías, etc.); pero, también ha sido descrito como un marcador biológico de la intoxicación crónica por metales pesados, tanto en animales como en seres humanos (97-100). Más aún, una patrón alterado singular de porfirinas en orina, con elevaciones de la precoproporfirina (keto-isocoproporfirina) y de la pentacarboxiporfirina, ha sido caracterizado como específico de la intoxicación por Hg (101-105). Nataf y col., en una innovadora investigación por publicarse en la revista Toxicol Appl Pharmacol, han estudiado por primera vez los niveles urinarios de porfirinas en 269 niños con DEA, en una clínica de París, comparándolos con los valores de niños sanos control. Los autores encontraron valores 2,6 veces mayores de porfirinuria en los niños con DEA, especialmente en el grupo de autistas. Las determinaciones de precoproporfirina y de pentacarboxiporfirina también resultaron aumentadas significativamente. Adicionalmente, un subgrupo de niños autistas que había mostrado valores anormales de porfirinuria, fue tratado con ácido dimercaptosuccínico (DMSA), un quelante de metales pesados, observándose la normalización de la excreción urinaria de porfirinas. Los investigadores concluyen que estos hallazgos sugieren que los metales pesados, particularmente el Hg, están implicados en la causalidad de los DEA. Señalan también que la porfirinuria, además de ser un biomarcador de toxicidad, podría tener un papel en las manifestaciones conductuales del autismo, dado que estos metabolitos anormales se unen a receptores benzodiazepínicos cerebrales (106-108) y han sido asociados a disturbios neurológicos, epilepsia y autismo (109-113).
El ARI viene utilizando de manera protocolizada diversos quelantes, en el tratamiento de desintoxicación de las enfermedades del neurodesarrollo infantil, desde hace algunos años, encontrándose mejorías significativas (y en numerosos casos la pérdida del diagnóstico de DEA), en los niños afectados por este grupo de enfermedades (114,115).
Se ha descrito también menor capacidad de sulfatación en los niños con DEA. Dicho déficit bioquímico parece contribuir a la acumulación de Hg observada en estos pacientes, dado que el proceso fisiológico de desintoxicación de Hg en el cuerpo humano incluye la unión de los compuestos mercuriales a grupos sulfhidrilos, para permitir su posterior excreción (116). Asimismo, se ha identificado que los niños afectados por los DEA tienen niveles plasmáticos significativamente menores de cisteína (19% de reducción) y de glutatión (46% de reducción), en comparación con niños sanos; ambas sustancias son cruciales para la excreción de Hg (117). Las personas con deficiencias genéticas en la síntesis de glutatión serán menos capaces de excretar Hg y, por lo tanto, más sensibles a sus efectos adversos (118,119).
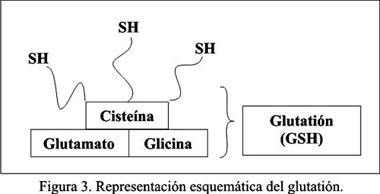
El glutatión (GSH) es un tripéptido producido a nivel hepático, a partir de los aminoácidos glicina, glutamato y cisteína (Figura 3). Actúa protegiendo al organismo humano de agentes tóxicos, tales como los metales pesados, mediante la unión de éstos a sus radicales sulfhidrilos. Es también un poderoso antioxidante, que previene la formación de radicales libres e inhibe el daño celular. Se ha documentado niveles significativamente disminuidos de GSH en los niños con DEA, aumentando de esta manera la susceptibilidad de estos pacientes al daño por metales pesados, en particular, al Hg.
Precisamente, se ha identificado polimorfismos genómicos específicos para enzimas en el ciclo de la metionina y la transulfatación, que explican la susceptibilidad genética aumentada a la intoxicación por metales pesados en la población autista, toda vez que dichas rutas metabólicas son precisamente las responsables de la eliminación de Hg y otros metales pesados (117-120). Adicionalmente, se sabe que el cerebro en desarrollo es único en su susceptibilidad a la neurotoxicidad inducida por agentes mercuriales; factores tales como la maduración cerebral, el metabolismo, el estado nutricional, el sexo y la inmunogenicidad influencian, además de la vulnerabilidad genética, en el pronóstico del daño cerebral (68). La Tabla 4 resume los factores genéticos asociados a mayor susceptibilidad a desarrollar DEA, de acuerdo al ARI.
Redwood y col. (121) han comunicado que, la exposición a Hg a través de las inmunizaciones debe ser motivo de preocupación, debido a que pequeñas cantidades de Hg, administrados durante periodos críticos del desarrollo, se han asociado a diversos desórdenes neurológicos infantiles, donde se incluyen el síndrome de déficit de la atención, dificultades para la lectura y trastornos del lenguaje.
3.2 Estudios in vitro sobre células humanas
Se ha comprobado fehacientemente la toxicidad del timerosal, incluso a concentraciones micromoleculares, sobre células nerviosas, fibroblastos y linfocitos T humanos, dañando sus mecanismos mitocondriales e induciendo estrés oxidativo y la depleción de glutatión, el principal agente desintoxicador fisiológico de metales pesados.
Los estudios hechos recientemente en el Departamento de Bioquímica de la Universidad de Kentucky por el profesor Boyd Haley son reveladores (122). Los investigadores han encontrado al timerosal incluso más neurotóxico que la forma iónica de mercurio (Hg2+), debido al enorme poder de penetración que posee en tejidos grasos, tales como el sistema nervioso central (mayor liposolubilidad). Asimismo, han observado que la toxicidad del etilmercurio no depende solo de sus niveles sanguíneos, sino también de otros numerosos factores asociados, tales como: enfermedad concomitante, exposición simultánea tanto a otros metales pesados (zinc iónico, cadmio, plomo, aluminio) como a antibióticos (tetraciclinas, ampicilina, neomicina), susceptibilidad genética, niveles de testosterona, los extremos de la vida, estrés oxidativo, etc., todos los cuales incrementan el daño en relación a un individuo sano. Sus estudios sobre células nerviosas humanas expuestas a pequeñísimas cantidades de timerosal (aún a concentraciones de 1:10 000, como en las vacunas), muestran cómo esta toxina destruye neuronas y/o afecta severamente su crecimiento. Han observado que una solución con 50 nanomoles de timerosal causa la muerte de 43% de las neuronas expuestas, en las primeras 24 horas, mientras que una solución con el doble de concentración ocasiona cerca de 83% de muerte celular en el mismo lapso, concluyendo que su uso medicinal es inadmisible, especialmente en el campo pediátrico. Los mismos autores han demostrado que, la toxicidad del timerosal es exacerbada cuando el preservante es empleado simultáneamente con otros metales pesados, tales como zinc iónico, cadmio, plomo o aluminio. Es de resaltar que, sus investigaciones han podido documentar que los mismos niveles de timerosal causantes del 50% de muerte neuronal, producen la muerte de cerca de 90% de las células nerviosas humanas, en presencia de niveles no tóxicos de cloruro de aluminio (122).
Este poder de toxicidad sinérgica es de gran preocupación, dado que muchas de las vacunas con timerosal contienen también aluminio, no habiéndose realizado estudio alguno sobre la bioseguridad de este punto. Cabe señalar que el aluminio es también una conocida neurotoxina, que comparte muchos mecanismos tóxicos comunes con el Hg. Por ejemplo, ambos son tóxicos sobre los neurotúbulos, interfieren con enzimas antioxidantes, dañan las enzimas de reparación del ADN, interfieren con la producción mitocondrial de energía, bloquean las proteínas recaptadoras de glutamato cerebrales (GLT-1 y GLAST), se unen al ADN y perturban las funciones de las membranas neuronales (123-128). El aluminio, utilizado como preservante en las vacunas, ha sido relacionado causalmente a la miofasceitis macrofágica, una condición que produce grave debilidad muscular y múltiples síndromes neurológicos. Gherardi y col. han resaltado que, incluso en ausencia de una enfermedad autoinmune sistémica obvia, en la mayoría de los casos diagnosticados de miofasceitis macrofágica han evidenciado una sobreestimulación inmunológica crónica causada por la inyección del aluminio (127). Tal fenómeno es muy importante, pues últimamente se ha señalado este mecanismo patológico como una de las principales causas del daño en numerosas enfermedades neurodegenerativas (esclerosis múltiple, enfermedad de Alzheimer, síndrome de Parkinson), los DEA y el síndrome de déficit de la atención (129-131). Asimismo, debe resaltarse que, desde hace décadas existen trabajos documentando la mayor toxicidad de ambos metales cuando se les usa en forma conjunta (132).
Baskin y col. (133) han estimado que las cantidades de timerosal contenidas en los esquemas de vacunación pediátricos alcanzan valores 4 veces mayores que las concentraciones más bajas, a las cuales dichos autores encontraron toxicidad neurológica en su estudio (201 mg/L). Concluyen que, la rápida aparición de daño ocasionado por timerosal en concentraciones micromolares bajas, observadas en periodos cortos de tiempo, es de suma preocupación, pues estiman que la exposición prolongada a timerosal en pequeñas cantidades (como sucede durante las vacunaciones) podría producir daño neurológico a dosis incluso menores.
Leong y col. examinaron el crecimiento neuronal in vitro luego de la exposición de células nerviosas humanas a concentraciones similares de Hg, aluminio, plomo, cadmio y manganeso. Demostraron que, concentraciones nanomolares de Hg marcadamente alteraban las estructuras de las membranas y las líneas de crecimiento de 77% de las neuronas expuestas, mientras que con los otros metales pesados tales daños no fueron observados (134). Similares resultados han sido descritos en numerosos trabajos adicionales, empleando timerosal (135-137).
James y col. (119) han demostrado que el timerosal induce estrés oxidativo y la apoptosis (muerte celular autoprogramada) de neuronas, astrocitos y células T humanas, activando vías metabólicas mitocondriales de muerte celular. Observaron que la muerte neuronal ocurría tan solo tres horas después de exponerlas a timerosal, mientras que las células de la glía (astrocitos) exhibían los mismos efectos citotóxicos a las 48 horas de haber sido expuestos a la misma concentración del preservante. Es de resaltar que, conocidos tóxicos como agentes antineoplásicos utilizados en quimioterapia, las radiaciones ultravioleta y las moléculas de estrés (oxígeno reactivo y especies de nitrógeno reactivo) actúan también a este mismo nivel celular (138). Asimismo, sus estudios han mostrado cómo dicha toxicidad mercurial está correlacionada a los niveles intracelulares del glutatión y la forma como esta última sustancia podría ser de utilidad terapéutica en los niños, ancianos y mujeres embarazadas que reciben vacunaciones o inmunoglobulinas con timerosal y en los individuos que consumen regularmente pescado conteniendo cantidades apreciables de Hg (119).
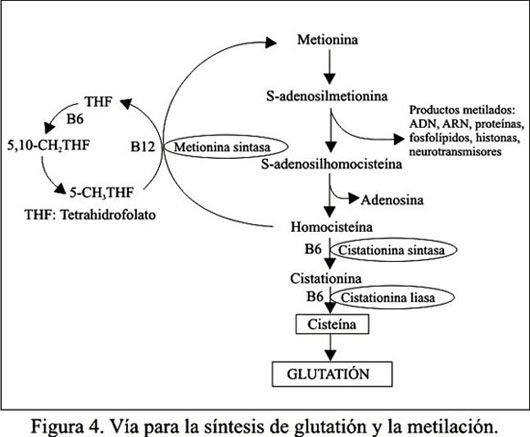
Recientemente, también se ha descrito que la metilación tiene un rol crítico en la habilidad de los factores de crecimiento tisulares para promover el desarrollo normal. En esta importante ruta metabólica, el hígado es capaz de completar la vía de síntesis de homocisteína a metionina y de cisteína a glutatión (Figura 4). Los astrocitos y las neuronas no poseen la enzima cistationina liasa. Por lo tanto, son incapaces de sintetizar cisteína. Como resultado, dichas células son dependientes de los niveles plasmáticos de cisteína derivados primariamente de la síntesis hepática de glutatión. Se ha comunicado que el timerosal en un poderoso antagonista de la enzima metionina sintasa, impidiendo la formación de metionina, la cual es imprescindible para la metilación de diversos estructuras, tales como el ADN, el ARN, diversas proteínas, fosfolípidos, histonas y neurotransmisores, todos los cuales han sido documentados alterados en los niños con DEA. Asimismo, el timerosal inhibe la síntesis de glutatión, el principal mecanismo fisiológico detoxificador de metales pesados. De esta manera ha demostrado ser un potente inhibidor de dicha función, otorgando una explicación molecular de cómo las vacunas conteniendo este preservante pueden incrementar la incidencia de las enfermedades del neurodesarrollo (117-119,134).
Waly y col., en un fascinante estudio (139), han mostrado cómo la exposición a metales pesados (incluyendo plomo, Hg y aluminio) puede contribuir a las enfermedades del neurodesarrollo, a través de la inhibición de las vías metabólicas de metilación -especialmente la metilación del ADN- y la disminución de diversos factores del desarrollo (factor de crecimiento neurotrópico, factor neurotrópico cerebral y el factor de crecimiento similar a la insulina tipo 1), todos los cuales son indispensables para la promoción del desarrollo neurológico y apoyan la función y la sobrevivencia del sistema nervioso (140,141).
Numerosos otros estudios in vitro sobre neuronas humanas han demostrado que concentraciones namolares a micromolares de timerosal son capaces de inducir muerte neuronal, neurodegeneración, daño a las membranas celulares y alteraciones sobre el ADN, en pocas horas de exposición (142-144). Últimamente, también se ha demostrado que pequeñísimas cantidades de timerosal son igualmente capaces de interrumpir críticamente las vías de comunicación interneuronales y los eventos bioquímicos necesarios para el adecuado desarrollo neurológico en el ser humano (145,146).
3.3 Estudios en modelos animales
El autismo ha podido ser reproducido en animales de experimentación satisfaciendo uno de los antiguos principios etiológicos de Pasteur. Efectivamente, Hornig y col. (147), utilizando cepas seleccionadas de ratones cuyos cerebros se encontraban en desarrollo y exponiéndolos a vacunas con timerosal (a dosis equivalentes al peso y la edad de los calendarios de inmunización humanos), han podido replicar diversas características similares a las de la enfermedad, tales como retardo del crecimiento, disminución de la locomoción, respuestas inapropiadas ante nuevos estímulos, incremento del tamaño cerebral, anormalidades significativas en la arquitectura de áreas cerebrales relacionadas a la emoción y la cognición y trastornos en las células del hipocampo, entre otros. Empleando el mismo modelo de investigación, también se ha observado la interacción dañina entre el timerosal y la testosterona (122,148), comprobándose la mayor susceptibilidad al daño mercurial entre los animales del género masculino. Es de notar que, los desórdenes del neurodesarrollo infantil son cuatro veces más frecuentes entre los varones que entre las niñas (5,8,15). Asimismo, en los fetos humanos y niños pequeños de sexo masculino se ha observado mayor sensibilidad al daño neurológico, luego de la exposición a mercuriales orgánicos (149).
Estudios conducidos en modelos animales han demostrado cantidades sustanciales de timerosal en sangre y en diferentes tejidos (especialmente, el cerebro); documentándose su pasaje a través de la barrera hematoencefálica y placentaria, determinándose que el tiempo de vida media del Hg en el cerebro animal es de 28 días después de administrado como timerosal (150-151).
Desde hace varios años, estudios in vivo hechos en roedores habían mostrado que el etilmercurio era capaz de atravesar las membranas celulares y luego ser convertido intracelularmente a Hg inorgánico, el mismo que se acumula preferentemente en el cerebro y los riñones. Dicha acumulación intracelular de Hg inorgánico demostró ser mayor para el etilmercurio (timerosal), en relación al metilmercurio empleando exposiciones equimolares, pese a que la velocidad de depuración sanguínea del etilmercurio es definitivamente más rápida que la del metilmercurio (152).
No obstante, se ha determinado que no existen mayores diferencias entre la toxicidad del metilmercurio y el timerosal. Pequeñas cantidades de timerosal, en el orden de microgramos en el cerebro de los animales de experimentación, fueron capaces de producir similar daño neurológico que con el primero, indicando que la presencia de Hg en cantidades apreciables no era necesaria para que tal neurotoxicidad ocurriera (152).
Un reciente estudio confirma estas mismas observaciones: los niveles sanguíneos de timerosal son significativamente más cortos que los mostrados por metilmercurio, 8,6 días vs. 21,5 días, respectivamente. No obstante, el primero atraviesa en mayor grado la barrera hematoencefálica, para depositarse en el cerebro, transformándose luego en Hg inorgánico (considerado la forma mercurial más tóxica de todas), siete veces más (71% vs. 10%), en comparación con el metilmercurio. Se sabe además que, el tiempo de vida media del Hg inorgánico intracerebral varía entre 227 y 540 días (69).
Múltiples trastornos inmunológicos han sido documentados en los pacientes con DEA. Recientemente, se ha identificado que el timerosal, a concentraciones namolares, altera dramáticamente las células dendríticas de ratones in vitro. Dichas células desempeñan un papel central en la respuesta inmunológica, pues actúan como presentadoras de antígenos y estimulan la activación de los linfocitos T. Goth y col. (153) han informado que el timerosal altera las propiedades de las células dendríticas, suprimiendo sus señales internas; a pequeñas dosis, el preservante indujo la liberación de cantidades anormales de interleuquinas, mientras que a dosis mayores les produjo la muerte. Tales efectos fueron observados incluso a muy pequeñas concentraciones y en pocos minutos de exposición, demostrando además que las células más inmaduras eran particularmente sensibles al timerosal. Los autores concluyen que sus hallazgos tienen implicancias en el uso comercial del timerosal en las vacunas, ya que el hecho de identificar a las células dendríticas como sensibles al daño inducido por el agente mercurial, conociendo el importante rol que éstas desempeñan sobre la inmunidad celular y la tolerancia inmunológica, constituye una explicación de la posible contribución al daño sobre las funciones del sistema inmune que ocasiona el preservante.
4. Estudios de bioseguridad
Aunque sea difícil de creer, según la investigación del Congreso norteamericano, ningún gran estudio de bioseguridad del timerosal fue realizado por las compañías farmacéuticas ni requerido por la US FDA o el US CDC en más de 70 años de la historia de las inmunizaciones humanas (16). Por el contrario, múltiples investigaciones han demostrado su toxicidad desde hace mucho tiempo.
Kravchenko y col. (154), trabajando con cultivos de células humanas, documentaron que el timerosal no solo era dañino por sus efectos tóxicos primarios, sino que además observaron que era capaz de cambiar las propiedades de las células. Dichos autores concluyeron que el uso de timerosal en las preparaciones médicas biológicas, especialmente las dirigidas a los niños, era inadmisible. Luego de dicha publicación, los países soviéticos retiraron el timerosal de sus vacunas infantiles, a principios de la década de los 80. Muchos otros estudios llegan a conclusiones similares, señalando la inconveniencia del timerosal en las vacunas, ya sea por su capacidad de inducir respuestas alérgicas (155,156), su pobre efectividad antiséptica (157) y/o su degradación en sustancias neurotóxicas (158).
Un estudio descriptivo publicado el año 2002 mostraba, aparentemente, buenas noticias: el timerosal, después de inoculado a través de las vacunas sobre niños recién nacidos, determinaba niveles sanguíneos significativamente menores y más cortos que el metilmercurio, excretándose en cantidades apreciables en las heces (159). No obstante, dicho trabajo no estudió otros compartimientos corporales (tales como el sistema nervioso); tampoco midió los niveles picos séricos de etilmercurio, luego de las primeras horas de inoculado, a pesar de que otras investigaciones han documentado elevaciones sustantivas de sus concentraciones sanguíneas en las primeras 24 a 72 horas, luego de ser administrado a través de las vacunas pediátricas (160). Asimismo, el estudio no fue diseñado para valorar el efecto biológico del preservante (tan solo medir variables farmacocinéticas) y fue realizado en una población extremadamente pequeña (33 niños). Es de resaltar que, ha sido plenamente determinado que el sistema nervioso toma preferentemente el Hg proveniente del timerosal, observándose concentraciones intracerebrales entre 5 y 7 veces más altas que los niveles medidos en la sangre (161-164).
En el Reporte de Información de Seguridad del timerosal, con fecha junio de 1991, hecho por la compañía farmacéutica que licenció el producto (165), consta que ...el componente mercurial ha causado efectos sistémicos en los animales de experimentación, incluyendo retardo mental de leve a severo y compromiso de la coordinación motora. Por dichas razones, el timerosal fue considerado tóxico y retirado de las vacunas para animales, en el año 1992, en los EE.UU. Pero, lo que nunca fue aclarado es que, en el mismo documento, en lo que se refiere a la exposición humana, dice: ...la exposición al Hg in útero y en los niños puede causar retardo mental de leve a severo y compromiso de la coordinación motora de leve a severo. Asimismo, los Reportes de Información de Seguridad, de los laboratorios Merck en Europa (166), informan también al timerosal como un producto extremadamente tóxico, peligroso para el medio ambiente y dañino en sus efectos acumulativos.
El National Toxicology Program de los EE.UU. declara al timerosal como
un veneno por vía oral, subcutánea, intravenosa y posiblemente otras rutas; lo clasifica como carcinógeno experimental y teratogénico, concluyendo que la exposición infantil puede resultar en
retardo mental, pérdida de la coordinación para la marcha, el lenguaje y la escritura; estupor, irritabilidad y trastornos severos de la personalidad y de la conducta (167).
Desde hace varios años, la AAP sabía de lo perjudicial de la exposición mercurial. En un reporte técnico del año 2001 (68) concluyen que:
el feto en desarrollo y los niños pequeños son desproporcionalmente afectados por la exposición al Hg, debido a que muchos aspectos del desarrollo, particularmente la maduración cerebral, pueden ser afectados por la presencia de Hg. Minimizar la exposición al Hg es, por lo tanto, esencial para optimizar la salud de los niños. Por estas razones, la AAP, desde el año 1999, reclamaba ya la reducción o eliminación urgente de las vacunas que contenían timerosal como preservante (168). Dos años después y hasta la fecha, todas las vacunas incluidas en el calendario de vacunación pediátrico dispuesto por la AAP no contienen timerosal (28), siendo tan solo la vacuna contra la influenza la única inmunización infantil empleada en los EE.UU. que aún posee cantidades elevadas de Hg.
Un reporte reciente del Environmental Working Group, tras una extensa investigación, ha develado las múltiples conexiones entre la exposición mercurial -especialmente la procedente de las vacunas infantiles- y los DEA, confirmando la posibilidad de que el Hg es el factor que causa o contribuye a dichas enfermedades (169).
5. Estudios toxicológicos fetales y sobre la salud reproductiva
El timerosal ha sido reconocido recientemente, por la California EPA, Office of Environmental Health Assessment, como una toxina del desarrollo, lo cual significa que puede causar defectos congénitos, peso bajo al nacer, disfunciones biológicas, psicológicas o trastornos del comportamiento, que se pueden manifestar en la primera infancia; asimismo, que la exposición materna durante el embarazo puede comprometer el desarrollo o incluso causar la muerte fetal (167). Un informe realizado por dicha organización, en respuesta a la petición de un laboratorio farmacéutico de declarar al timerosal como inocuo, concluyó:
La evidencia científica que demuestra que el timerosal causa toxicidad reproductiva es clara y voluminosa. El timerosal se disocia en el cuerpo en etilmercurio. La evidencia de su toxicidad reproductiva incluye retardo mental severo y malformaciones en los niños que fueron expuestos cuando sus madres recibieron etilmercurio o timerosal mientras se encontraban gestando. Los estudios en animales demuestran toxicidad sobre el desarrollo después de la exposición a etilmercurio o timerosal, y los datos muestran la interconversión a otras formas de Hg que también producen claramente toxicidad reproductiva (170).
Numerosos trabajos de investigación, tanto en modelos animales como en humanos, han demostrado que la exposición a timerosal en estadios específicos de la vida prenatal trae como consecuencia el pasaje de cantidades apreciables de Hg a través de la barrera placentaria, resultando en significativa letalidad fetal y teratogenicidad (171).
Las vacunas para prevenir el tétanos usadas en nuestro medio contienen 25 mg de etilmercurio por dosis; el feto en desarrollo puede, por lo tanto, potencialmente recibir dosis altísimas de Hg que exceden dramáticamente los límites establecidos por la EPA y la OMS (Tabla 3). Se sabe también que, la mayor proporción del etilmercurio inyectado se acumula en los tejidos fetales en relación a los órganos maternos, especialmente en el sistema nervioso central (172). Todas estas observaciones deben causar aún mayor preocupación, pues si bien en nuestro país no se ha estimado el promedio de la concentración de Hg en la sangre del cordón umbilical de los recién nacidos, en los EE.UU. se ha comunicado que 7,8 a 15,7% de los casos estudiados mostraron valores de Hg asociados con disminución de los coeficientes intelectuales (173).
Holmes y col. (93) determinaron que las madres de los niños autistas habían recibido aproximadamente seis veces más cantidades de timerosal, debido a la exposición contenida en las inmunoglobulinas humanas anti-D, en relación a las madres cuyos niños tuvieron un neurodesarrollo normal; dichos autores sugieren un importante rol de la exposición prenatal a Hg en la aparición posterior de DEA.
Los estudios hechos en animales no muestran resultados diferentes. Gasett y col. (174) observaron significativamente más muertes fetales después de la exposición materna a timerosal comparativamente con animales de control, indicando que, incluso tópicamente, el preservante mostraba propiedades abortivas. Estos hallazgos fueron replicados por Itoi y col. (175), quienes demostraron un rango cinco veces mayor de muerte fetal cuando una solución tópica de timerosal era aplicada a la conjuntiva de conejas preñadas. En este mismo estudio, las malformaciones congénitas ocurrieron solo en el grupo de animales expuestos al preservante (9,1% vs. 0,0%). Digar y col (176) encontraron cuatro veces mayor mortalidad cuando se inyectó 0,1 mg de timerosal en el saco vitelino de huevos de pollo. Observaron también graves malformaciones en 36% de los embriones expuestos, pero en ninguno de sus controles; dichas malformaciones animales incluyeron sindactilia, ptosis visceral, adelgazamiento de la pared abdominal y anormalidades del crecimiento de las alas y del cuerpo.
El timerosal también tiene el potencial de disminuir la fertilidad. Batts y col. (177) documentaron que dicha sustancia era tóxica para la función ciliar, cuando era aplicada tópicamente sobre la tráquea de ovejas, indicando un potencial mecanismo patológico para comprometer la capacidad reproductiva en las mujeres (trompas de Falopio) y los varones (motilidad espermática). De hecho, se ha planteado esta hipótesis para justificar la mayor incidencia de infertilidad entre los adultos que padecieron en su infancia de acrodinia, otra entidad causada por la exposición mercurial (178). Goncharuk (179) describió una tasa de letalidad dosis-dependiente en ratas expuestas a compuestos inhalados de etilmercurio. Asimismo, el investigador informó que, cuando se administraba dicha forma de Hg orgánico a ratas machos antes de ser cruzados, se observó una disminución de la fertilidad, no solo en aquellos que lo recibieron, sino también en dos de sus siguientes generaciones.
El Hg inorgánico, otro de los metabolitos del timerosal, también ha demostrado ser genotóxico y disminuir la capacidad reproductiva en varios animales de experimentación in vitro (180). Kahn y col. (181) observaron que la fertilidad y la sobrevivencia se reducían en ratones expuestos a cloruro de Hg. Dichos efectos, incluyendo atrofia ovárica, fueron vistos en ausencia de toxicidad sistémica manifiesta, subrayándose la necesidad de realizar estudios clínicos para evaluar el riesgo de exposición prenatal a timerosal.
También, se han realizado estudios sobre la toxicidad del timerosal sobre la salud reproductiva humana. Heinonen y col. (182) demostraron que la exposición tópica a timerosal durante el embarazo significativamente aumentaba los riesgos de defectos congénitos.
La toxicidad reproductiva y los daños sobre los fetos humanos del metilmercurio han sido ampliamente estudiados y aceptados. Algunas autoridades de salud proclaman que este último es más tóxico que el etilmercurio del timerosal; pero, dichas conclusiones no están basadas en la literatura científica (171). Un estudio experimental, hecho en cerdos, encontró al timerosal significativamente más tóxico que el metilmercurio (183); asimismo, Leonard y col. (184) hallaron que el etilmercurio cruza la placenta más fácilmente que el metilmercurio y era capaz de ocasionar cambios mutagénicos sobre las células estudiadas.
A pesar de estas múltiples investigaciones, la US FDA nunca se ha pronunciado de preferir las vacunas libres de timerosal sobre las que aún lo contienen; de hecho, si bien desde el año 1999 todas las sociedades científicas médicas y las autoridades gubernamentales de salud de los EE.UU. decidieron el pronto y urgente retiro de dicho preservante de sus vacunas (185,186), tal proceso nunca se llevó a cabo en forma adecuada, no completándose el consumo y/o retiro de las vacunas conteniendo timerosal sino hasta el año 2003, hecho que le ha significado duras críticas por parte del Congreso de los EE.UU (16).
En ese sentido, se ha comentado que la historia del autismo adquirido quizás termine como el caso de la acrodinia, donde el retiro de la sustancia causante (e.i. el Hg contenido en las pastas dentríficas) condujo a la desaparición de la enfermedad y a la ulterior identificación de la causa etiológica (122). Cabe mencionar que se ha estimado que solo 1 de cada 500 niños expuestos desarrollaba la enfermedad, lo cual reafirma el concepto de que, además de la exposición causal se necesita factores de vulnerabilidad específicos entre los niños susceptibles al daño ocasionado por el Hg. Se requirió más de 10 años después de la suspensión a esta forma de exposición mercurial, para que la medicina formalmente reconociera que éste había sido el agente responsable del trastorno. Es conveniente señalar que, muchos de los síntomas descritos en la acrodinia son similares a los observados actualmente en los niños identificados como autistas o con síndrome de déficit de la atención.
CONCLUSIONES Y RECOMENDACIONES
1. El mercurio (Hg) ha sido considerado el tercer elemento más tóxico sobre la tierra, superado tan solo por el plutonio y el uranio. A pesar de que, paradójicamente, se le ha empleado con fines medicinales desde hace mucho tiempo, la documentación de su toxicidad ha conducido a su paulatino retiro de prácticamente todos los medicamentos y agentes biológicos empleados en la actualidad.
2. Desde hace algunos años, ha sido demostrado su gran impacto negativo sobre la salud humana, especialmente en los grupos más susceptibles, como las gestantes y los niños, razón por la que diferentes expertos y agencias internacionales de salud se han pronunciado de acuerdo en que la reducción o eliminación de la exposición al Hg, ya sea procedente del timerosal de las inmunizaciones o de cualquier otra fuente, constituyen medidas de capital importancia para la salud pública.
3. Desde hace varios años atrás, las compañías farmacéuticas productoras de vacunas han desarrollado preservantes alternativos al timerosal, que han demostrado su eficacia y seguridad.
4. Paulatinamente, todos los países desarrollados (los EE.UU., la Unión Europea, los países soviéticos) han retirado el timerosal de sus vacunas para seres humanos. Aquellos que lo han hecho con anterioridad, muestran tasas de incidencia y prevalencia de enfermedades del neurodesarrollo infantil significativamente más bajas, en relación a los que lo han prohibido recientemente y también, evidentemente, sobre los países como el nuestro, en los que dicha toxina aún no ha sido suprimida.
5. Recientemente, se ha conducido numerosas investigaciones científicas que han aportado múltiples evidencias epidemiológicas, genéticas, metabólicas, bioquímicas, clínicas y terapéuticas, tanto en el ser humano como en modelos animales, que involucran al timerosal y a los virus vivos del sarampión, la rubéola y las paperas contenidos en las vacunas pediátricas, como los agentes causantes, disparadores o agravantes de las enfermedades del neurodesarrollo infantil.
6. Últimamente, se ha informado, a través de la utilización de diversas fuentes de datos, que el retiro y/o la disminución del timerosal de las vacunas pediátricas ha sido seguido de un descenso significativo en la incidencia de casos nuevos de enfermedades del neurodesarrollo infantil, incluyéndose al autismo y los trastornos del lenguaje.
7. Las cantidades de Hg orgánico, contenidas aún en algunas de las vacunas que se emplea en los esquemas de inmunización pediátricos en el Perú, superan larga y significativamente los márgenes de máxima exposición permitidos a mercuriales orgánicos de todas las agencias de salud pública del mundo, incluida la propia Organización Mundial de la Salud.
8. Expuestas las evidencias en relación al timerosal y las enfermedades del neurodesarrollo infantil, solicitamos establecer el marco legal y todas las condiciones financieras y sanitarias, a fin de retirar el timerosal contenido en algunas de las vacunas para seres humanos en el Perú, del modo más expeditivo y apremiante como sea posible; haciendo además todos los esfuerzos necesarios para minimizar la exposición ambiental a otras fuentes mercuriales y a agentes químicos tóxicos, dado el profundo significado sobre la salud de nuestros niños.
9. Solicitamos la urgente convocatoria a una reunión de expertos, presidida por el Minsa, a fin de reevaluar el Programa Ampliado de Vacunaciones del Perú, en el que, de acuerdo a nuestras necesidades epidemiológicas actuales, se discutan las políticas de vacunación más efectivas, pero a la vez más seguras, donde se considere la inmunización separadamente contra el sarampión, la rubéola y las paperas o, en todo caso, el empleo de vacunas acelulares para dichas enfermedades.
10. Los niños y las madres embarazadas constituyen los segmentos más expuestos a estas enfermedades. El Estado debe asumir su responsabilidad en el compromiso del cuidado de sus vidas y su salud, pues constituyen nuestro más preciado recurso humano, sobre el que depende el futuro de la nación.
REFERENCIAS BIBLIOGRÁFICAS
1. Wing L. Autistic spectrum disorders. Brit Med J. 1996;312:327-8. [ Links ]
2. Gillberg G, Coleman M. The Biology of the Autistic Syndromes. MacKeith, Cambridge: Cambridge University Press; 2000. [ Links ]
3. Ritvo E, et al. The UCLA-University of Utah epidemiologic survey of autism: Prevalence. Am J Psychiatry. 1989;146:194-9. [ Links ]
4. Burd L, et al. A prevalence study of pervasive developmental disorders in North Dakota. J Am Acad Child Adolesc Psychiatry. 1997;26:700-3. [ Links ]
5. Bertrand J, et al. Prevalence of autism in a United States population: the Brick Township, New Jersey, investigation. Pediatrics. 2001;108:1155-61. [ Links ]
6. Fiona J, et al. Brief report: Prevalence of autism spectrum conditions in children aged 5-11 years in Cambridgeshire, UK. Autism. 2002;6:231-7. [ Links ]
7. Yeargin-Allsopp M, et al. Prevalence of Autism in a US metropolitan area. JAMA. 2003;289:49-55. [ Links ]
8. California Department of Developmental Services. Autistic Spectrum Disorders - Changes in the California Caseload - An Updated: 1999 through 2002. Sacramento, CA: State of California; 2003. [ Links ]
9. Gerlai R, et al. Autism: a large unmet medical need and a complex research problem. Physol Behav. 2003;79:461-70. [ Links ]
10. Gurney J, et al. Analysis of prevalence trends of autism spectrum disorder in Minnesota. Arch Pediatr Adolesc Med. 2003;157:622-7. [ Links ]
11. Blaxill M, et al. Commentary: Blaxill, Baskin and Spitzer on Croen et al: (2002), the changing prevalence of autism in California. J Autism Dev Disord. 2003;33:223-6. [ Links ]
12. Munro N. Missing the Mercury Menace? National Journal, January 3, 2004.
13. Blaxill M. Whats going on? The question of time trends in autism. Public Health Rep. 2004;119:536-51. [ Links ]
14. Gerlai R, et al. Autism: a for pharmacotherapics? Drug Discov Today. 2004;9:366-74. [ Links ]
15. Newschaffer C, et al. National autism prevalence trends from United States Special Education Data. Pediatrics. 2005;115:277-82. [ Links ]
16. Mercury in Medicine: Taking Unnecessary Risks. A Report Prepared by The Staff of the Subcommittee on Human Rights and Wellness Committee on Government Reform. United States House of Representatives, May 2003.
17. Office of Special Education Programs, US Department of Education. Twenty-third Annual Report to Congress on the Implementation of the Individuals With Disabilities Education Act. Washington, D.C.: Office of Special Education Programs, US Department of Education; 2002. [ Links ]
18. Rimland B. The Autism epidemic, vaccinations, and mercury. J Nut Environ Med. 2000;10:261-6. [ Links ]
19. Kennedy RF Jr. Deadly Immunity. Available at http://rollingstone.com/politics/story. Accessed June 20, 2005.
20. Barberesi W, et al. The incidence of autism in Olmsted County, Minnesota, 1976-1997: results from a population-based study. Arch Pediatr Adolesc Med. 2005;159:37-44. [ Links ]
21. Byrd R, et al. Report to the Legislature on the Principal Findings from the Epidemiology of Autism in California: A Comprehensive Pilot Study. M.I.N.D. Institute. University of California, Davis. October 17, 2002. Available at http://www.ucdmc.ucdavis.edu/mindinstitute/newsroom/study_final.pdf
22. Autism Research Institute. Autism Research Review. 2000;4(1):ARI3-6.
23. Werner E, Dawson G. Validation of the phenomenon of autistic regression using home videotapes. Arch Gen Psychiatry. 2005;62:788-94. [ Links ]
24. Pangborn J, Baker S. Autism: effective biomedical treatments. Individuality in an epidemic. Autism Research Institute Publication, 2005.
25. Geier M, et al. Neurodevelopmental disorders after thimerosal-containing vaccines: a brief communication. Exp Biolo Med. 2003;228:660-4. [ Links ]
26. Geier M, et al. Thimerosal in childhood vaccines, neurodevelopmental disorders, and heart disease in the United States. J Am Phys Surg. 2003;8:6-11. [ Links ]
27. Geier D, et al. An assessment of the impact of thimerosal on neurodevelopmental disorders. Pediatr Rehabil. 2003;6:97-102. [ Links ]
28. US. Food and Drug Administration. Department of Health and Human Services. Center For Biologics Evaluation And Research. Thimerosal in Vaccines; http://www.fda.gov/cber/vaccine/thimerosal.htm.
29. Ball L, et al. An assessment of thimerosal use in childhood vaccines. Pediatrics. 2001;107:1147-54. [ Links ]
30. Redwood L, et al. Predicted mercury concentrations in hair from infant immunizations: cause of concern. Neurotoxicology. 2001;22:691-7. [ Links ]
31. Bernard S, et al. Autism: A novel form of mercury poisoning. Med Hypotheses. 2001;56:462-71. [ Links ]
32. Deb S, Prasad K. The prevalence of autistic disorder among children with a learning disability. Br J Psychiatry. 1994;165:395-9. [ Links ]
33. Williams J, et al. Systematic review of prevalence studies of autism spectrum disorders. Arch Dis Child. 2006;91:8-15. [ Links ]
34. Ozuah P, et al. Mercury exposure in an urban pediatric population. Ambul Pediatr. 2003;3:24-6. [ Links ]
35. UNEP Global Mercury Assessment Working Group. Global Mercury Assessment. United Nations Environment Program, Geneva, 2003.
36. Gillberg C, Coleman M. The Biology of the Autistic Syndromes 2nd Ed. London: MacKeith Press; 1992. [ Links ]
37. Sapienza C, Hall J. Genetic imprinting and human disease. In: Scriver Cr, Beaudet Al, Sly Ws, Valle D (eds). The metabolic and molecular bases of inherited disease. 8th Ed. New York: McGraw-Hill; 2001. p. 417-31. [ Links ]
38. Shaffer LG, Ledbetter DH, Lupski JR. Molecular cytogenetics of contiguous gene syndromes: mechanisms and consequences of gene dosage imbalance. In: Scriver CR, Beaudet AL, Sly WS, Valle D, Childs B, VogelsteinB (eds). Metabolic and molecular basis of inherited disease. 8th Ed. New York: McGraw-Hill; 2002. p.1291-324. [ Links ]
39. Lathe R. Autism, Brain and Environment. London: Jessica Kingsley Publishers; 2006. [ Links ]
40. Wakefield A, et al. Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. The Lancet. 1998;351:637-42. [ Links ]
41. Wakefield A. MMR vaccination and autism. The Lancet. 1999;354:949-50. [ Links ]
42. Singh V, et al. Elevated levels of measles antibodies in children with autism. Pediatr Neurol. 2003;28:292-4. [ Links ]
43. Singh V, et al. Serological association of measles virus and human herpesvirus-6 with brain autoantibodies in autism. Clin Immunol Immunopathol. 1998;89:105-8. [ Links ]
44. Singh V, et al. Abnormal measles-mumps-rubella antibodies and CNS autoimmunity in children with autism. J Biomed Sci. 2002;9(4):359-64. [ Links ]
45. Uhlmann V, et al. Potential virus pathogenic mechanism for new variant inflammatory bowel disease. Molecular Pathology. 2002;55:84-90. [ Links ]
46. Bradstreet J. et al. Detection of measles virus genomic RNA in cerebro-spinal fluid of children with regressive autism: a report of three cases. J Am Phys Surg. 2004;9:38-45. [ Links ]
47. Jyonouchi H, et al. Dysregulated innate immune responses in young children with autism spectrum disorders: their relationship to gastrointestinal symptoms and dietary intervention. Neuropshychobiology. 2005;51(2):77-85. [ Links ]
48. Kawashima H, et al. Detection and sequencing of measles virus from peripheral blood mononuclear cells from patients with inflammatory bowel disease and autism. Digest Dis Sci. 2000;45:723-9. [ Links ]
49. Vijendra K, et al. Elevated levels of measles antibodies in children with autism. Pediatric Neurology. 2003;28(4):63-6. [ Links ]
50. Horvath K, et al. Gastrointestinal abnormalities in children with autism. J Pediatr. 1999;135:559-63. [ Links ]
51. Wakefield A, et al. Enterocolitis in children with developmental disorder. Am J Gastroenterol. 2000;95:2285-95. [ Links ]
52. Sabra A, et al. Ileal-lymphoid-nodular hyperplasia, non-specific colitis and pervasive developmental disorder in children. Lancet. 1998;352:234-5. [ Links ]
53. Wakefield A, et al. Review article: concept of entero-colonic encephalopathy, autism, and opioid receptor ligands. Aliment Pharmacol Ther. 2002;16:663-74. [ Links ]
54. Cave S. What your doctor may not tell you about childrens vaccinations. Warner Books; 2001.
55. Laslo-Baker D, et al. Child neurodevelopmental outcome and maternal occupational exposure to solvents. Arch Pediatr Adolesc Med. 2004;158:956-61. [ Links ]
56. Allred M, Willbur S. Hazardous substance exposures and autism. In: De Rosa CT, Holler JS, Mehlman MA, eds. Impact of Hazardous Chemicals in Public Health, Policy, and Service. Advances in Modern Toxicology. Princeton NJ: International Toxicology Books, Inc. 2002:453-74. [ Links ]
57. Eppright T, et al. Attention deficit hyperactivity disorder, infantile autism and elevated blood-lead: a possible relationship. Mo Med. 1996;93(3):136-8. [ Links ]
58. London E, Etzel R. The environment as an etiologic factor in Autism: A new direction for research. Environ Health Perspect. 2000;108(3):401-4. [ Links ]
59. Mendola P et al. Environmental factors associated with a spectrum of neurodevelopmental deficits. Mental Retard Devel Disabil Res. 2002;8:188-197. [ Links ]
60. Rodier P, Hyman S. Early environmental factors in autism. Ment Retard Devel Disabil Res. 1998;4:121-8. [ Links ]
61. Davis E, et al. Autism and developmental abnormalities in children with perinatal cocaine exposure. J Natl Med Assoc. 1992;84(4):315-9. [ Links ]
62. Hultman C. et al. Perinatal risk factors for infantile autism. Epidemiology. 2002;13:417-23. [ Links ]
63. Agency for Toxic Substances and Disease Registry. Toxicological profile for mercury. Atlanta, GA: Agency for Toxic Substances and Disease Registry; 1999. [ Links ]
64. National Research Council 2000; http://www.nap.edu/catalog/9899.html.
65. US Environmental Protection Agency Integrated Risk Information System. Reference dose for chronic oral exposure (RfD). En: Methylmercury (MeHg) (CASRN 22967-92-6). Available at http://www.epa.gov/iris/subst/0073.htm. Accessed Apr 22, 2006.
66. Working Document, EMEA, Multidisciplinary Group on Thiomersal; June 23, 1999.
67. Bigham M, et al. Thiomersal in vaccines: balancing the risk of adverse effects with the risk if vaccine-preventable disease. Drug Saf. 2005;28:89-101. [ Links ]
68. Lynn R, et al. American Academy of Pediatrics. Technical Report: Mercury in the environment: implications for pediatricians. Pediatrics. 2001;108:197-205. [ Links ]
69. Burbacher T, et al. Comparison of blood and brain mercury levels in infant monkeys exposed to methylmercury or vaccines containing thimerosal. Environ Health Perspect. 2005;113:1015-21. [ Links ]
70. Geier D, Geier M. Neurodevelopmetal disorders following thimerosal-containing childhood immunizations: a follow-up analysis. Int J Toxicol. 2004;23:369-75. [ Links ]
71. Geier D, Geier M. A two-phased population epidemiological study of the safety of thimerosal containing vaccines: a follow-up analysis. Med Sci Monit. 2005;11(4):CR160-CR170. [ Links ]
72. Verstraeten T, et al. Safety of thimerosal-containing vaccines: a two-phased study of computerized health maintenance organization databases. Pediatrics. 2003;112:1039-48. [ Links ]
73. Stehr-Green P, et al. Autism and thimerosal-containing vaccines: lack of consistent evidence for an association. Am J Prev Med. 2003;25:101-6. [ Links ]
74. Hvidd A, et al. Association between thimerosal-containing vaccines and autism. JAMA. 2003;290:1763-76. [ Links ]
75. Madsen K, et al. Thimerosal and the occurrence of autism: negative ecological evidence from Danish population-based data. Pediatrics. 2003;112:604-6. [ Links ]
76. Andrews N, et al. Thimerosal exposure in infants and developmental disorders: a retrospective cohort study in the United Kingdom does not support a causal association. Pediatrics. 2004;114:584-91. [ Links ]
77. Heron J, et al. ALSPAC Study Team: Thimerosal exposure in infants and developmental disorders: a prospective cohort study in the United Kingdom does not support a causal association. Pediatrics. 2004;114:577-83. [ Links ]
78. Parker S, et al. Thimerosal-containing vaccines and autistic spectrum disorder: a critical review of published original data. Pediatrics. 2004;114(3):793-804. [ Links ]
79. Bernard S. Association between thimerosal-containing vaccine and autism. JAMA. 2004;291:180. [ Links ]
80. Blaxill M. Concerns continue over mercury and autism. Am J Prev Med. 2004;26:91. [ Links ]
81. Trelka J, Hooker B. More on Madsens analysis. J Am Phys Surg. 2004;9:101. [ Links ]
82. Yazbak F. Autism seems to be increasing worldwide, if not in London. BMJ Letter. 2004;328:226-7. [ Links ]
83. Proceedings of the Simpsonwood Meeting, Nacross, GA, June 7-8, 2000, obtained under the Freedom of Information Act. Full proceedings available at http://www.safeminds.org. Accessed July 21, 2004.
84. Verstraeten T. Thimerosal, the Centers for Disease Control and Prevention, and GlaxoSmithKline. Pediatrics. 2004;113:932. [ Links ]
85. Geier D, Geier M. A comparative evaluation of the effects of MMR immunization and mercury doses from thimerosal-containing childhood vaccines on the population prevalence of autism. Med Sci Monit. 2004;10(3):PI33-PI39. [ Links ]
86. Geier D, Geier M. Early downward trends in neurodevelopmental disorders following removal of thimerosal-containing vaccines. J Am Phys Surg. 2006;11(1):8-13. [ Links ]
87. The Autism Autoimmunity Proyect. One child in 166 has autism spectrum disorder. Available at http://www.taap.info/epidemic.asp Accessed Jan 12, 2006.
88. Geier D, Geier M. An assessment of downward trends in neurodevelopmental disorders in the United States following removal of thimerosal from childhood vaccines. Med Sci Monit. 2006;12(6):CR231-CR239. [ Links ]
89. Palmer R, et al. Environmental mercury release, special education rates, and autism disorder: an ecological study in Texas. Health Place. 2006;12:203-9. [ Links ]
90. Windham G, et al. Autism Spectrum Disorders in Relation to Distribution of Hazardous Air Pollutants in the San Francisco Bay Area. The National Institute of Environmental Health Sciences. National Institute of Health. US Department of Health and Human Services. Available at: http://www.ehponline.org/docs/2006/9120/abstract.pdf. Accessed on line June 21, 2006.
91. Mutter J, et al. Mercury and autism: accelerating evidence? Neuroendocrinol Lett. 2005;26:439-46. [ Links ]
92. Bradstreet J, et al. A case-control study of mercury burden in children with autistic spectrum disorders. J Am Phys Surg. 2003;8:76-9. [ Links ]
93. Holmes A, et al. Reduced levels of mercury in first baby haircuts of autistic children. Int J Toxicol. 2003;22:277-85. [ Links ]
94. Lonsdale D, et al. Treatment of autism spectrum children with thiamine tetrahydrofurfuryl disulfide: a pilot study. Neuro Endocrinol Lett. 2002;23:303-8. [ Links ]
95. Fido A, Al Saad S. Toxic trace elements in the hair of children with autism. Autism. 2005;9:290-8. [ Links ]
96. Hu L, et al. Neutron activation analysis of hair samples for the identification of autism. Trans Am Nuclear Soc. 2003;89:16-20. [ Links ]
97. Bowers M, et al. Quantitative determination of porphyrins in rats and human urine and evaluation of urinary porphyrin profiles during mercury and lead exposures. J Lab Clin Med. 1992;120:272-81. [ Links ]
98. Woods J. Porphyrin metabolism as indicator of metal exposure and toxicity. En: Goyer RA and Cherian MG, eds. Handbook of Experimental Pharmacology. Berlin: Sringer-Verlag; 1995. p. 19-52. [ Links ]
99. Woods J. Altered porphyrin metabolism as a biomarker of mercury exposure and toxicity. Can J Physiol Pharmacol. 1996;74:210-5. [ Links ]
100.Pingree S, et al. Quantitative evaluation of urinary porphyrins as a measure of kidney mercury content and mercury body burden during prolonged methylmercury exposure in rats. Toxicol Sci. 2001;61:234-40. [ Links ]
101.Woods J, et al. The association between genetic polymorphisms of coproporphyrinogen oxidase and an atypical porphyrinogenic response to mercury exposure in humans. Toxicol Appl Pharmacol. 2005;206:113-120. [ Links ]
102.Woods J, Fowler B. Metal alteration of uroporphyrinogen decarboxylase and coproporphyrinogen oxidase. Ann NY Acad Sci. 1987;514:55-64. [ Links ]
103.Woods J, et al. Urinary porphyrin profiles as a biomaker of mercury exposure: studies on dentist with occupational exposure to mercury vapour. J Toxicol Environ Health. 1993;40:235-46. [ Links ]
104.Woods J, Miller H. Quantitative measurement of porphyrins in biological tissues and evaluation of tissue porphyrins during toxicant exposures. Fundam Appl Toxicol. 1993;21:291-7. [ Links ]
105.Heyer N, et al. A cascade analysis of the interaction of mercury and coproporphyrinogen oxidase (CPOX) polymorphism on the heme biosynthetic pathway and porphyrin production. Toxicol Lett. 2006;161:159-66. [ Links ]
106.Brennan M, Cantrill R. The effect of delta-aminolevulinic acid on the uptake and efflux of (3H)GABA in rat brain synaptosomes. J Neurochem. 1979;32:1781-6. [ Links ]
107.Muller W, Snyder S. Delta-aminolevulinic acid: influences on synaptic GABA receptor binding may explain CNS symptoms of porphyria. Ann Neurol. 1977;2:340-2. [ Links ]
108.Verma A, et al. Porphyrins are endogenous ligands for the mitochondrial (peripheral-type) benzodiazepine receptor. Proc Natl Acad Sci USA. 1987;84:2256-60. [ Links ]
109.Ruscito B, Harrison N. Hemoglobin metabolites mimic benzodiazepines and are possible mediators of hepatic encephalopathy. Blood. 2003;102:1525-8. [ Links ]
110.Gordon N. The acute porphyrias. Brain Dev. 1999;21:373-7. [ Links ]
111.Millward L, et al. Self-rated psychosocial consequences and quality of life in the acute porphyrias. J Inherit Metab Dis. 2001;24:733-47. [ Links ]
112.Marion R. The girl who mewed: acute intermittent porphyria. Discover. 1995;16:38-40. [ Links ]
113.González-Ramírez D, et al. Sodium 2,3-dimercaptopropane-1-sulfonate challenge test for mercury in humans: II. Urinary mercury, porphyrins and neurobehavioral changes of dental workers in Monterrey, Mexico. J Pharmacol Exp Ther. 1995;272:264-74. [ Links ]
114.Autism Research Institute. Treatment Options for Mercury/Metal Toxicity in Autism and Related Developmental Disabilities: Consensus Position Paper. ARI Pub. February 16, 2005. Available at htpp://www.autismwebsite.com/ari/dan/mercurymetaldetox.htm.
115.Autism Research Institute. Parents ratings of behavioural effects of biomedical interventions. ARI Pub. August 34, 2004.
116.Alberti A, et al. Sulphation deficit in low-functioning autistic children: a pilot study. Bio Psychiatry. 1999;46:420-4. [ Links ]
117.James S, et al. Metabolic biomarkers of increased oxidative stress and impaired methylation capacity in children with autistic spectrum disorders. Am J Clin Nutr. 2004;80:1611-7. [ Links ]
118.Boris M, et al. Association of 5,10-methylenetetrathydrofolate reductase (MTHFR) gene polymorphisms with autistic spectrum disorders. J Am Phys Surg. 2004;9:106-8.
119.James S, et al. Thimerosal neurotoxicity is associated with glutathione depletion: protection with glutathione precursors. Neurotoxicology. 2005;26:1-8.
120.Godfrey M, et al. Apolipoptrotein E genotyping as a potencial biomarker for mercury neurotoxicity. J Alzheimers Dis. 2003;5:189-96.
121.Redwood L, et al. Predicted mercury concentrations in hair from infant immunizations: cause for concern. Neurotoxicology. 2001;22:691-7.
122.Haley B. Mercury toxicity: genetic susceptibility and synergistic effects. Med Ver. 2005;2:535-42.
123.Department of Health and Human Services National Vaccine Program Office Presents: Workshop on Aluminium in Vaccines. Caribe Hilton International Hotel, San Juan, Puerto Rico: Jointly sponsored by: Task Force for Child Survival and Development. May 12, 2000.
124.Lacson A, et al. Aluminium phagocytosis in quadriceps muscle following vaccination in children: relationship to macrophagic myofasciitis. Pediatr Dev Pathol. 2002;5:151-8.
125.Flarend R, et al. In vivo absorption of aluminium-containing vaccine adjuvants using 26 Al. Vaccine. 1997;15:1314-8.
126.Authier F, et al. Central nervous system disease in patients with macrophagic myofasciitis. Brain. 2001;124:974-83.
127.Gherardi R. Lessons from macrophagic myofasciitis: towards definition of a vaccine adjuvant-related syndrome. Rev Neurol (Paris). 2003;159:162-4.
128.Bergfors E, et al. Unexpectantly high incidence of persistent itching and delayed hypersensitivity to aluminium in children after the used of absorbed vaccines from a single manufacturer. Vaccine. 2003;22:64-9.
129.Blaylock R. Interactions of cytokines, excitotoxins, and reactive nitrogen and oxygen species in autism spectrum disorders. J Amer Nutr Assoc. 2003;6:21-35.
130.Blaylock R. The central role of excitotoxins in autism spectrum disorders. J Amer Nutr Assoc. 2003;6:7-19.
131.Blaylock R. Chronic microglial activation and excitotoxicity secondary to excessive immune stimulation: possible factors in Gulf War Syndrome and autism. J Am Phys Surg. 2004;9:46-51.
132.Jones H. Danger of skin burns from thiomersal. British Med J. 1972;2:504-5.
133.Baskin D, et al. Thimerosal induces DNA breaks, caspase-3 activation, membrane damage and cell death in cultured human neurons and fibroblasts. Toxicol Sc. 2003;74:361-8.
134.Leong C, et al. Retrograde degeneration of neurite membrane structural integrity of nerve growth cones following in vitro exposure to mercury. Neuro¨Report. 2001;12:733-7.
135.Parry J. An evaluation of the use of in vitro tubulin polymerisation, fungal and wheat assays to detect the activity of potencial chemical aneugens. Mutation Res. 1993;287:23-8.
136.Wallin M, et al. Effects of potencial aneuploidy inducing agents on microtubule assembly in vitro. Mutation Res. 1993;287:17-22.
137.Brunner M, et al. Effects of 10 known or suspected spindle poisons in the vitro porcine brain tubulin assembly assay. Mutagenesis. 1991;6:65-70.
138.Makani S. et al. Biochemical and molecular basis of thimerosal-induced apoptosis in T cells: a major role of mitochondrial pathway. Genes and Inmmunity. 2002;3:270-8.
139.Waly M, et al. Activation of methionine synthase by insulin-like growth factor-1 and dopamine: a target for neurodevelopmental toxins and Thimerosal. Mol Psychiatry. 2004;9:358-70.
140.Arsenijevic Y, et al. Insulin-like growth factor-1 is necessary for neural stem cell proliferation and demonstrates distinct actions of epidermal growth factor and fibroblast growth factor-2. J Neurosci. 2001;21:7194-202.
141.Riaz S, et al. The controlled conversion of human neural progenitor cells derived from fetal ventral mesencephalon into dopaminergic neurons in vitro. Brain Res Dev Brain Res. 2002;136:27-34.
142.Humphrey M, et al. Mitochondrial mediated thimerosal-induced apoptosis in a human neuroblastoma cell line (SK-N-SH). Neurotoxicology. 2005;26:407-16.
143.Yel L, et al. Thimerosal induces neuronal cell apoptosis by causing cytochrome c and apoptosis-inducing factor release from mitochondria. Int J Mol Med. 2005;16:971-7.
144.Brown L, et al. Thimerosal induces neuronal cells via changes in the mitochondrial environment. UCI Undergrad Res J. 2003;6:7-14.
145.Parran D, et al. Effects of thimerosal on NGF signal transduction and cell death in neuroblastoma cells. Toxicol Sci. 2005;86:132-40.
146.Mutkus L, et al. In vitro uptake of glutamate in GLAST- and GLT-1-transfected mutant CHO-K1 cells is inhibited by the ethylmercury-containing preservative thimerosal. Biol Trace Elem Res. 2005;105:71-86.
147.Hornig M, et al. Neurotoxic effects of postnatal thimerosal are mouse strain dependent. Mol Psychiatry. 2004;9:833-45.
148.Clarkson T, et al. Reproductive and developmental toxicity of metals. Scand J Work Environ Health. 1985;11:154-64.
149.Grandjean P, et al. Cognitive performance of children prenatally exposed to safe levels of methylmercury. Environ Res. 1998;77:165-72.
150.Gasset A, et al. Teratogenicities of ophthalmic drugs II. Teratogenicities and tissue accumulation of thimerosal. Arch Ophthalmol. 1975;93:52-5.
151.Slikker W. Developmental neurotoxicology of therapeutics: survey of novel recent findings. Neurotoxicology. 2000;21:250.
152.Magos L. Neurotoxic character of thimerosal and the allometric extrapolation of adult clearance half-time to infants. J Appl Toxicol. 2003;23:263-9.
153.Goth S, et al. Uncoupling of ATP-mediated calcium signaling and dysregulated interleukin-6 secretion in dendritic cells by nanomolar thimerosal. Environ Health Perspect. 2006;114:1083-91.
154.Kravchenko A, et al. Evaluation of the toxic action of prophylactic and therapeutic preparations on cell cultures. Communication III. Revealing the toxic properties of medical biological preparations from the degree of cell damage in continuous cell line L132. Zh Mikrobiol Epidemiol Immunobiol. 1983;3:87-92.
155.Cox N, Forsyth A. Thimerosal allergy and vaccination reactions. Contact Dermatitis. 1988;18:229-33.
156.Forstrom L, et al. Merthiolate hypersensitivity and vaccination. Contact Dermatitis. 1980;6:241-5.
157.Rohyans J, et al. Mercury toxicity following merthiolate ear irrigations. J Pediatr. 1984;104:311-3.
158.Seal D, et al. The case against thimerosal. The Lancet. 1991;338:315-6.
159.Pichichero M, et al. Mercury concentrations and metabolism in infants receiving vaccines containing tihmerosal: a descriptive study. The Lancet. 2002;360:1737-41.
160.Stajich G, et al. Iatrogenic exposure to mercury after hepatitis B vaccination in preterm infants. J Pediatr. 2000;136:679-81.
161.Clarkson T. The three faces of mercury. Environ Health Perspect. 2002;110(1):11-23.
162.Cernichiari E, et al. Monitoring methylmercury during pregnancy: maternal hair predicts fetal brain exposure. Neurotoxicology. 1995; 16:705-10.
163.Magos L, et al. The comparative toxicology of ethyl- and methylmercury. Arch Toxicol. 1985;57(4):260-7.
164.Carty A, et al. The chemistry of mercury in biological systems. En: Nriagu JO, eds. The Biogeochemistry of Mercury in the Environment. New York, NY: Elsevier/North Holland; 1979. p.433-59.
165.Material Safety Data Sheet: Ely Lilly And Company. Lilly Corporate Center. Indianapolis. Indiana 46265: Common Name: Thimerosal (Lilly Nos: QA041U, LSN-006739). Revised Date: June 13, 1991.
166.Merck. Material Safety Data Sheets. Product Info 817043 Thimerosal. http://www.chemdat.merck.de/pls/pi03/web2.search_page2?text=817043&lang=4. Visited at October 24, 2005.
167.National Institute of Environmental Health Science. Thimerosal (54-6-8). Nomination to the National Toxicology Program. Review of the Literature. Available at: http://www.ntp.niehs.nih.gov/ntp/htdocs/Chem_Backgroud/ExSumPDF/Thimerosal.pdf.Accessed March 1, 2006.
168.Thimerosal in vaccines – An Interim Report to Clinicians. American Academy of Pediatrics. Committee of Infectious Diseases and Committee on Environmental Health. Pediatrics. 1999;104(3):570-4.
169.Environmental Working Group: Overloaded? New science, New Insights about mercury and autism in susceptible children. Washington, DC: EWG Action Found; 2004.
170.Office of Environmental Health Hazard Assessment. Response to the Petition of Bayer Corporation for Clarification of the Proposition 65 Listing of Mercury and Mercury Compounds as Chemical Known to Cause Reproductive Toxicity; February 2004. Available at http://www.oehha.ca.gov/prop65/crnr_notices/hgbayer.html. Accessed Mar 1, 2006.
171.Ayoub D, Yazbak F. Influenza vaccination during pregnancy: A critical assessment of the recommendations of the Advisory Committee on Immunization Practices (ACIP). J Am Phys Surg. 2006;11:41-7.
172.Ukita T, et al. Distribution of 203Hg labelled mercury compounds in adults and pregnant mice determined by whole-body autoradiography. Radioisotopes. 1967;16:439-48.
173.Trasande L, et al. Public health and economic consequences of methylmercury toxicity to the developing brain. Environ Health Perspect. 2005;113:590-6.
174.Gasset A, et al. Teratogenicities of ophthalmic drugs II. Teratogenicities and tissue accumulation of thimerosal. Arch Opthalmol. 1975;93:52-5.
175.Itoi M, et al. Teratogenicities of antiviral opththalmics on experimental animals. Jpn J Clin Ophthal. 1972;26:631-40.
176.Digar A, et al. Lethality and teratogenicity of organic mercury (thimerosal) on the chick embryo. J Anat Soc India. 1987;36:153-6.
177.Batts A, et al. The effect of some preservatives used in nasal preparations on mucus and ciliary components of mucociliary clearance. J Pharm Pharmacol. 1990;42:145-51.
178.Dally A. The rise and fall of pink disease. Soc Hist Med. 1997;10:291-304.
179.Goncharuk G. Experimental investigation of the effect of organomercury pesticides on generative function and on progeny. Hyg Sanit. 1971;36:40-4.
180.Clement Associates. Toxicological Profile for Mercury. Atlanta, Ga.: Department of Health and Human Services, Agency for Toxic Substances and Disease Registry, US Public Health Services; 1989.
181.Kahn A, et al. Effects of inorganic mercury in reproductive performance of mice. Food Chem Toxicol. 2004;42:571-7.
182.Heinonen O, et al. Birth Defects and Drugs in Pregnancy. Littleton, Mass.: Publishing Sciences Group; 1976.
183.Tyrphonas L, Nielsen N. Pathology of chronic alkymercurial poisoning in swine. Am J Vet Research. 1973;34:379-92.
184.Leonard A, et al. Mutagenicity and teratogenicity of mercury compounds. Mutat Res. 1983;114:1-18.
185.Joint Statement of the American Academy of Pediatrics (AAP) and the US Public Health Service (PHS). Pediatrics. 1999;1049:568-9.
186.Joint Statement Concerning Removal Thimerosal from Vaccines: June 22, 2000: The American Academy of Family Physicians. The American Academy of Pediatrics. The Advisory Committee on Immunization Practices. The United States Public Health Service (PHS).
Manuscrito recibido el 02 de agosto de 2006 y aceptado para publicación el 01 setiembre de 2006.
Correspondencia:
Luis Alberto Maya Pérez.
Av. Javier Prado Este 3801, Santiago de Surco.
Lima 33, Perú.
Correo-e: mayapuy@qnet.com.pe