Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. vol.75 no.2 Lima abr. 2014
SECCIÓN DE MEDICINA TROPICAL
Epidemiología de las dermatomicosis en 30 años de estudio en el Instituto de Medicina Tropical Daniel A Carrión, Universidad Nacional Mayor de San Marcos, Lima, Perú
Epidemiology of dermatomycoses in 30 years of study at Daniel a Carrion Institute of Tropical Medicine, Universidad Nacional Mayor de San Marcos, Lima, Peru
Vilma Bejar1,2*; Freddy Villanueva2,3*; José María Guevara1,2,5; Sofía González1,2,6; Germán Vergaray4; Enma Abanto1; Kandy Napán7; Luis Velasque8; Silvana Vergaray9
1 Instituto de Medicina Tropical Daniel A. Carrión, Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
2 Departamento de Microbiología Médica, Facultad de Medicina, UNMSM, Lima, Perú.
3 Instituto Nacional de Enfermedades Neoplásicas, Lima, Perú.
4 Instituto de Ciencias Biológicas Antonio Raimondi, UNMSM, Lima, Perú.
5 Hospital Daniel A. Carrión, Lima, Perú.
6 Centro Médico Naval Cirujano Mayor Santiago Távara, Lima, Perú.
7 Facultad de Ciencias Naturales y Matemática, Universidad Nacional Federico Villareal, Lima, Perú.
8 Hospital Nacional Carlos Alberto Seguín Escobedo, EsSalud, Lima, Perú.
9 Hospital Santa Rosa, Lima, Perú.
* Autores que contribuyeron por igual en este trabajo.
Resumen
Objetivos: Determinar la evolución epidemiológica de las dermatomicosis en pacientes de consultorio externo durante el periodo 1976- 2005. Diseño: Estudio descriptivo, retrospectivo y analítico. Lugar: Instituto de Medicina Tropical Daniel Alcides Carrión, Universidad Nacional Mayor de San Marcos, Lima, Perú. Participantes: Pacientes positivos a dermatomicosis. Intervenciones: Se revisó las historias clínicas de 7 185 (55,3%) casos positivos a dermatomicosis. El instrumento de investigación empleado fue la ficha de levantamiento de información. Principales medidas de resultados: Agente etiológico, estación del año, sexo, edad y forma clínica. Resultados: El estudio demostró que los más afectados fueron del grupo etario de 16 a 30 años (42,7%) y sexo femenino (52,1%). La dermatomicosis más frecuente fue la onicomicosis (43,6%). Los agentes patógenos de mayor prevalencia fueron Trichophyton rubrum (33,2%), Cándida albicans (15,3%), Cándida no albicans (11,8%), Trichophyton mentagrophytes (9,4%), Malassezia spp (9,1%) y las infecciones mixtas (7,2%). Las micosis de cuero cabelludo muestran continuo aumento durante todo el estudio. El dermatofito Epidermophyton floccosum fue aislado por última vez en la década del 90. A partir de 1995 ha aumentado la prevalencia de Cándida no albicans y se encontró como especie re-emergente a la levadura Cándida tropicalis. Conclusiones: Entre los años 1976 y 2005 hubo importantes variaciones epidemiológicas en relación a las formas clínicas y a la etiología de las dermatomicosis.
Palabras clave: Dermatomicosis, evolución, epidemiología, onicomicosis, Cándida; Malassezia, dermatofitos.
Abstract
Objectives: To determine dermatomycoses epidemiological evolution in outpatients during the period 1976-2005. Design: Descriptive, retrospective, and analytical study. Setting: Daniel Alcides Carrion Institute of Tropical Medicine, Universidad Nacional Mayor de San Marcos, Lima, Peru. Participants: Patients positive to dermatomycoses. Interventions: Medical records of 7 185 (55.3%) dermatomycosespositive patients were reviewed. Main outcome measures: Etiologic agent, season, gender, age, and clinical forms. Results: Females (52.1%) and the 16 to 30 year-old group (42.7%) were the most affected. Most frequent dermatomycoses was onychomycosis (43.6%). Most prevalent pathogens were Trichophyton rubrum (33.2%), Candida albicans (15.3%), Candida non albicans (11.8%), Trichophyton mentagrophytes (9.4%), Malassezia spp. (9.1%), and mixed infections (7.2%). The fungal scalp infection showed steady increase during the period studied. Epidermophyton floccosum dermatophyte was isolated for the last time in the 1990s. Since 1995 prevalence of Candida non albicans has increased and Candida tropicalis yeast species are re-emerging. Conclusions: Epidemiological changes in dermatomycoses clinical forms and etiology were found between 1976 and 2005.
Keywords: Dermatomycoses, evolution, epidemiology, onychomycoses, Candida; Malassezia, dermatophytes.
INTRODUCCIÓN
En nuestro país, las dermatomicosis representan uno de los principales motivos de consulta dermatológica, constituyendo un verdadero problema de salud pública por su alta morbilidad.
Las dermatomicosis son un grupo de lesiones clínicas que se presentan en piel y sus anexos (pelos y uñas) y según el grado de profundidad anatómica que afecte el hongo, se las clasifica en superficiales y cutáneas.
Las micosis superficiales son aquellas en las que hay afección de la capa córnea de la piel y la porción suprafolicular del pelo. Estas se dividen en: piedras (Trichosporum beigelii y Piedraia hortai), pitiriasis y dermatitis seborreica (levaduras del género Malassezia) y tínea nigra (Phaeoannellomyces werneckii). Las micosis cutáneas afectan capas más profundas de la piel y sus anexos pelos y uñas; se dividen en: tineas o dermatofitosis (dermatofitos de los géneros Microsporum, Epidermophyton y Trichophyton) y candidiasis cutánea (levaduras del género Cándida). Ocasionalmente se encuentra hongos ambientales en estas lesiones.
La aparición de estas micosis y la frecuencia de sus agentes etiológicos depende de factores tales como áreas geográficas, sexo, edad, clima, localización de la lesión y otros.
El diagnóstico de las dermatomicosis se realiza mediante el estudio microscópico de las muestras obtenidas de las lesiones y su cultivo, para el posterior aislamiento e identificación del agente causante.
El presente estudio tiene por objetivo mostrar la evolución epidemiológica de las dermatomicosis y sus posibles variaciones en el periodo 1975 a 2005.
Métodos
Se realizó un estudio descriptivo, retrospectivo y analítico en una población constituida por 12 990 muestras de pacientes con sospecha clínica de dermatomicosis, procesadas en el Laboratorio de Micología del Instituto de Medicina Tropical Daniel Alcides Carrión, Universidad Nacional Mayor de San Marcos, correspondiente al periodo 1976-2005.
La muestra la constituyeron 7 185 casos que dieron positivo a dermatomicosis.
Para obtener los datos de las variables se utilizó como instrumento las fichas clínicas, de manera de observar los resultados de la evolución epidemiológica de la dermatomicosis.
La información fue procesada mediante el programa SPSS versión 13.0, dividida en 6 periodos de 5 años cada uno. Se aplicó la estadística descriptiva para conocer las frecuencias de los datos a través de los valores absolutos y los porcentajes. Se calculó el chi cuadrado como estadística inferencial para determinar la asociación de las variables; y para comparar cambios relevantes entre algunos períodos, empleamos la estimación de proporciones; el nivel de significancia fue 0,05 y las muestras eran independientes.
RESULTADOS
Trichophyton rubrum (33,2%), Cándida albicans (15,3%), Cándida no albicans (11,8%), Trichophyton mentagrophytes (9,4%), Malassezia spp (9,1%) y las infecciones mixtas (casos en donde hubieron dos patógenos responsables) (7,2%) fueron los principales agentes infecciosos encontrados (tabla 1).
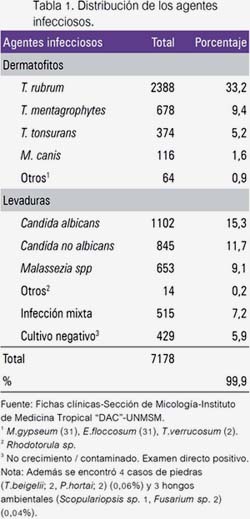
Para una mejor y completa observación de la evolución de los agentes etiológicos de las dermatomicosis, estas fueron agrupadas en: dermatofitos, hongos levaduriformes e infecciones mixtas.
En los 30 años de estudio, T. rubrum fue el dermatofito predominante, iniciando con 69,2% y descendió notoriamente en la década de 80 a 44,8% (P<0,0001), para luego ascender hasta 76,0% (P<0,0001). T. mentagrophytes fue el segundo dermatofito más encontrado; inició con 11,9%, aumentó a 39,3% (P<0,0001) durante la siguiente década, luego descendió hasta 7,8% (P<0,0001) en el último periodo, siendo superado por T. tonsurans, el cual alcanzó el segundo lugar. T. tonsurans, M. canis y M. gypseum mostraron regularidad en sus frecuencias. Al inicio del estudio E. floccosum presentó 3,4%; en las siguientes décadas disminuyó a 0,5% (P<0,0001) en el año 2000, cuando fue aislado por última vez (figura 1).
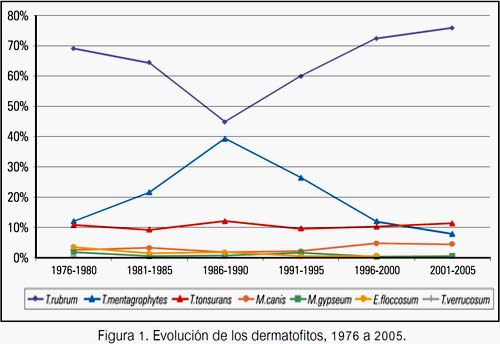
Cándida albicans y Cándida no albicans fueron las levaduras mayormente encontradas en el primer periodo, con 40,1% y 34,7%, respectivamente. En los siguientes 15 años, Cándida no albicans descendió a 23,5% (P<0,002) para luego ascender hasta 40,4% (P<0,0001); y C. albicans ascendió a 53,2% (P<0,002) para luego descender hasta 21,8% (P<0,0001) en el último periodo, en donde fue superado por Cándida no albicans y Malassezia spp. En los últimos 20 años, Malassezia spp aumentó de 15,8% a 37,8% (P<0,0001) (figura 2).
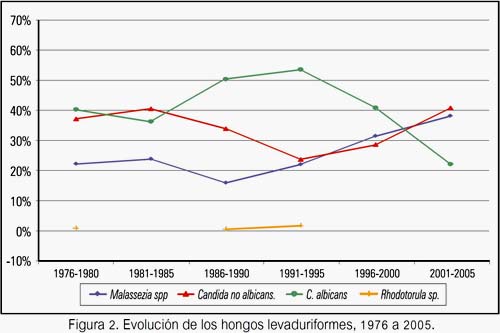
La diferenciación de especies del género Cándida realizada a partir de 1999 muestra una disminución significativa de C. albicans de 42,0% a 12,0% (P<0,0001) y el aumento de Cándida tropicalis, siendo esta la especie predominante desde 2002. C. krusei y C. famata aumentaron en los dos últimos años (figura 3).
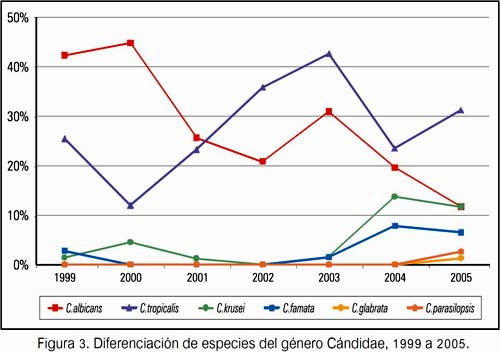
El conocimiento de las especies de Malassezia nos muestra que M. furfur fue la más encontrada a partir de 1996 y M. ovalis presentó tendencia creciente de 2,2% a 16,9% (P<0,002).
En relación a las principales infecciones mixtas, en el primer periodo T. rubrum/C. albicans y T. rubrum/C. no albicans fueron las infecciones mixtas más encontradas, con 48,1% y 37,0%, respectivamente. T. rubrum / C. albicans descendió hasta 24,6% (P<0,03) y T. rubrum/C. no albicans aumentó en la ultima década de 31,5% a 59,0% (P<0,0001). El conocimiento de las especies de Candida no albicans a partir de 1999 mostró que T. rubrum/C. tropicalis fue la infección mixta más frecuente en los últimos años.
Revisando la evolución de nuestras variables, observamos que durante los 30 años de estudio el verano fue la estación del año con más casos encontrados, aumento de 28,1% en el primer periodo a 36,4% en el último (P<0,0001). El grupo etario más afectado durante los primeros 25 años de estudio fue el de 16 a 30 años; sin embargo, disminuyó constantemente de 57,1% a 28,0% (P<0,0001), contrariamente al resto de grupos etarios, que aumentaron. Más aún, el de 46 años a más mostró incremento de 15,3% a 29,4%. (P<0,0001), superando al de 16 a 30 en el último periodo. El sexo femenino tuvo ligero predominio, presentando más casos durante los últimos 25 años.
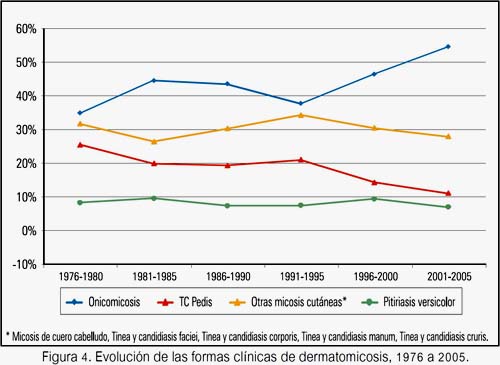
La onicomicosis (pies 70,7% y manos 29,3%) fue la forma clínica más encontrada durante todo el estudio, con 34,7% al inicio y aumentando hasta 54,3% (P<0,0001) al final del estudio. La segunda forma clínica más frecuente fue tínea y candidiasis pedis; esta inició con 25,3% y tendió a disminuir en las siguientes décadas, llegando a 11,0% (P<0,0001); mientras que pitiriasis versicolor se mantuvo entre 6,9% y 9,5% (figura 4). En relación a las otras micosis cutáneas, tínea y candidiasis manum inició con 6,9%, en la década del 80 aumentó a 11,8% (P<0,003), luego disminuyó de manera continua hasta 3,2% (P<0,0001). Tínea y candidiasis cruris disminuyó de 11,1% a 2,8% (P<0,0001) y las micosis de cuero cabelludo aumentaron constantemente de 2,9%, llegando a 9,8% (P<0,0001). Tínea y candidiasis faciei así como tínea y candidiasis corporis se mantuvieron entre 2,0% y 3,7% y 4,8% y 9,8%, respectivamente.
DISCUSIÓN
En nuestra población, las dermatomicosis tuvieron como principal agente infeccioso a T. rubrum (33,2%) en los treinta años de estudio, esto debido a que es un hongo antropofílico, cosmopolita, que posee ciertos factores de patogenicidad (1-3) y tiene la propiedad de desarrollar resistencia a antifúngicos (4). T rubrum fue también el agente más encontrado en otros estudios en América (5-11). En nuestro estudio, T. rubrum descendió notoriamente en la década del 80, coincidiendo con la producción e ingreso al mercado de nuevos antifúngicos azólicos. El primero y el más usado fue ketoconazol, en 1981 (12). Sin embargo, a inicios de la siguiente década, T. rubrum mostró recuperación y posteriormente acentuó su predominio, suponiendo desarrollo de resistencia a dichos fármacos.
Cándida albicans fue el segundo agente etiológico más encontrado (15,3%) y el hongo levaduriforme más frecuente, al igual que en otros estudios (5,8). C. albicans es comensal de la piel (13); sin embargo, sus factores de patogenicidad y la alteración de los mecanismos de inmunidad (14) y factores predisponentes del huésped pueden originar enfermedad. El predominio mostrado por C. albicans, en 1986 a 1990, en la etiología de las dermatomicosis pudo deberse a la resistencia adquirida contra los antifúngicos azólicos (15) debido al incumplimiento del tiempo necesario de tratamiento e inadecuada respuesta en onicomicosis de pie (16). C. albicans sufrió una marcada disminución en la últimas dos décadas, coincidiendo con el aumento de T. rubrum y C. tropicalis.
El grupo Cándida no albicans fue el tercero más importante, encontrándose en otros estudios incluso por encima de C. albicans (6,7). Sin embargo, el conocimiento de las especies de este género nos muestra la importancia epidemiológica y el papel que tiene en la etiología de las dermatomicosis, más aún cuando no se ha informado hasta ahora a C. tropicalis como agente importante en las micosis cutáneas.
C. tropicalis casi siempre es asociado con el desarrollo de infecciones fúngicas (17). En nuestro estudio, C. tropicalis se mostró como un patógeno re-emergente. Ello explica el aumento de Cándida no albicans a partir de la década del 90, llegando a ser desde 2002 el hongo levaduriforme más prevalente y el segundo agente causante de dermatomicosis. Este aumento se debería al desarrollo de mecanismos de resistencia a los antifúngicos comúnmente usados (18-20).
Trichophyton mentagrophytes fue el segundo dermatofito y el cuarto agente infeccioso en dermatomicosis, y particularmente el encontrado en pies (piel y uñas). Algunos estudios también lo encontraron como segundo dermatofito (8,9,21) y otros como el más importante (22).
Malassezia spp fue otro de los agentes infecciosos hallados. Tiene particulares características morfológicas (levaduriforme y micelial, asociadas a procesos patológicos) y fisiológicas (carácter lipofílico, comensal en áreas del cuerpo con glándulas sebáceas) y que ante la influencia de ciertos factores pueden volverse patógenas (23). Diferentes estudios encontraron a Malassezia spp en la etiología de las dermatomicosis, entre 5,2% (8) y 14,9 % (7); nosotros encontramos 9,1%. En nuestro estudio, Malassezia spp aumentó en los últimos 20 años, esto debido a su comportamiento oportunista relacionado con el incremento de pacientes inmunocomprometidos (24). Este aumento se acentúo en la última década debido al incremento en la frecuencia de M. ovalis.
Otro hallazgo importante en nuestro estudio es la presencia de infecciones mixtas. Se ha establecido que una misma infección micótica puede ser producida por más de una especie (25). En nuestra población, en 7 de cada 100 dermatomicosis existió co-infección, predominando la asociación dermatofito– levadura, siendo los más frecuentes T. rubrum - C. albicans, T. rubrum - Cándida no albicans y, en los últimos años, T. rubrum - C. tropicalis. Otros estudios encontraron 6,0% de etiología mixta, prevaleciendo la asociación levaduralevadura y siendo prevalente Candida spp (8). El conocimiento de la presencia de estas asociaciones infecciosas y las decisiones terapéuticas correctas evitarán la cronicidad de las lesiones mediante el tratamiento adecuado y la pronta resolución de la infección.
El hongo dermatofito E. floccosum se encuentra en Europa, Asia y África (26-28) con mayor frecuencia que en América, en donde está por debajo de 7,0% (9,21,22). Desde el inicio de nuestro estudio tuvo tendencia a disminuir, aislándosele por última vez en la segunda mitad de la década del 90. E. floccosum debió haber llegado a nuestro país debido al movimiento poblacional propio de nuestra época. Sin embargo, nuestras condiciones ambientales, hábitos y formas de vida, la susceptibilidad al tratamiento y otros, pudieron cambiar el hábitat de este patógeno y como consecuencia de ello provocar su extinción.
La mayor prevalencia de casos se dio en la estación de verano y su tendencia a aumentar se explica por el incremento de la temperatura promedio en nuestra capital en las últimas décadas (29).
El grupo etario más afectado fue el de 16 a 30 años, debido a que realiza más actividad física (mayor sudoración), siendo desplazada luego por la de 46 años a más, probablemente debido a la automedicación, disponibilidad de fármacos usados en el tratamiento empírico y disminución de la capacidad del sistema inmune frente a procesos infecciosos.
El ligero predominio del sexo femenino se debería a su frecuente consulta dermatológica, debido al mayor interés en la apariencia física.
La onicomicosis ha experimentado un aumento en su prevalencia en las últimas décadas, como ocurre a nivel mundial (30), debido a factores como el aumento de deficiencias inmunitarias (infecciosas, terapéuticas o fisiológicas), alto grado de recidiva, falla terapéutica, uso frecuente de establecimientos públicos (saunas, gimnasios, piscinas, duchas). La frecuencia aumenta con la edad, probablemente por el tiempo de exposición al foco infeccioso y/o por el hipoestrogenismo. La onicomicosis de pie fue la más prevalente, esto debido a que presenta características óptimas para el establecimiento de las formas resistentes de los hongos, por tener una gruesa capa de queratina y presentar factores ambientales condicionantes. Así mismo, es resaltante el aumento de las micosis del cuero cabelludo. Otras formas clínicas disminuyeron significativamente: tínea y candidiasis pedis, tínea y candidiasis manum y tínea y candidiasis cruris.
REFERENCIAS BIBLIOGRÁFICAS
1. Weitzman I, Summerbell, RC. The dermatophytes. Clin Microbiol Rev. 1995;8(2):240-59.
2. Monod M, Capoccia S, Léchenne B, Zaugg C, Holdom M, Jousson O. Secreted proteases from pathogenic fungi. Int J Med Microbiol. 2002;292(5):405-19. doi: doi: http://dx.doi.org/10.1078/1438-4221-00223
3. Dahl MV, Grando SA. Chronic dermatophytosis: what is special about Trichophyton rubrum? Adv Dermatol. 1994;(9):97-111.
4. Gay PJ. Dermatología. 7 ed. Barcelona: Ed. Científico Médica; 1971: 251 pp.
5. Nardin ME, Pelegri DG, Manias VG, Méndez E. Agentes etiológicos de micosis superficiales aislados en un Hospital de Santa Fe: Argentina. Rev argentina microbiol. 2006;38(1):25-7.
6. Mejia A, De Sierra O, De Navarro F. Micosis superficiales en el Hospital Escuela. Rev méd hondur. 1991;59(1):8-13.
7. Baboza N. Frecuencia y etiología de las dermatomicosis en pacientes atendidos en Hospital Giselda Triguera [tesis magister]. Natal /RN: Post Grado en Ciencias de la salud, Universidad Federal de Rio Grande del Norte. 2005.
8. Escobar M, Ortega M. Dermatomicosis. Análisis de 1.004 lesiones diagnosticadas en 1988-1989. IATREIA. 1990;3(2):80-4.
9. Pérez BM, Rivera FN. Agentes etiológicos de dermatomicosis aislados en pacientes de la ciudad de Concepción y comunas circunvecinas: Chile 1998- 1999. Rev chil tecnol méd. 2001;21(2):939-44.
10. Sosa BM, Villegas N, Mendoza L. Aislamiento e identificación de dermatofitos, agentes causales de dermatomicosis en el estado Trujillo, Venezuela. Rev Soc Ven Microbiol. 2004;24(1-2):68-70.
11. Arenas R. Dermatofitosis en México. Rev Iberoam Micol. 2002;19:63-7.
12. Sheehan DJ, Hitchcock CA, Sibley CM. Current and emerging azole antifungal agents. Clin Microbiol Rev. 1999;12(1):40-79.
13. Ingraham JL, Ingraham CA. Introducción a la Microbiología. Reverté. Cap. 14. 1998: 341 pp.
14. Odds FC. Pathogenesis of Candida infections. J Am Acad Dermatol. 1994;31(3):S2-S5. doi: doi: http://dx.doi.org/10.1016/S0190-9622(08)81257-1
15. Sanglard D. Importancia clínica de los mecanismos de resistencia a los antifúngicos en levaduras. Enferm Infecc Microbiol Clin. 2002;20(5):225-34.
16. Roberts DT. Oral therapeutic agents in fungal nail disease. J Am Acad Dermatol. 1994;31(3):S78- S81. doi: http://dx.doi.org/10.1016/S0190-9622-(08)81274-1
17. Wingard JR, William GM, Saral R. Candida tropicalis: A major pathogen in immunocompromised patients. An Int Med. 1979;91(4):539-43. doi: http://dx.doi.org/10.7326/0003-4819-91-4-539
18. Al-Fattani MA, Douglas LJ. Biofilm matrix of Candida albicans and Candida tropicalis: chemical composition and role in drug resistance. J Med Microbiol. 2006;55(8):999-1008. doi: http://dx.doi.org/10.1099/jmm.0.46569-0
19. Barchiesi F, Calabrese D, Sanglard D, Falconi L, Caselli F, Giannini D, et al. Experimental induction of fluconazole resistance in Candida tropicalis ATCC 750. Antimicrob Agents Chemother. 2000;44(6):1578-84. doi: http://dx.doi.org/10.1128/AAC.44.6.1578-1584.2000
20. Graybill JR, Najvar LK, Holmberg JD, Luther MF. Fluconazole, D0870, and flucytosine treatment of disseminated Candida tropicalis infections in mice. Antimicrob Agents Chemother. 1995;39 (4):924-9. doi: http://dx.doi.org/10.1128/AAC.39.4.924
21. Ballesté R, Fernández N, Mousqués N, Xavier B, Arteta Z, Mernes M, et al. Dermatofitosis en población asistida en el Instituto de Higiene. Rev Med Uruguay. 2000;16:232-42.
22. Callisaya J, Conde D, Choque H. Frecuencia de gérmenes causantes de micosis superficiales. Biofarbo. 2007;15(1):21-8.
23. Gupta A, Batra R, Bluhm R, Boekhout T, Dawson T. Skin diseases associated with Malassezia species. J Am Acad Dermatol. 2004;51:785-98. doi: http://dx.doi.org/10.1016/j.jaad.2003.12.034
24. Groll AH, Walsh TJ. Uncommon opportunistic fungi: new nosocomial threats. Clin Microbiol Infect. 2001;7:8-24. doi: http://dx.doi.org/10.1111/j.1469-0691.2001.tb00005.x
25. Hay R. Dermatofitosis y otras micosis superficiales. En: Mandell GL, Bennet JE, Dolin R. Eds. Principios y práctica. 3a Ed. Buenos Aires: Panamericana. 1991:2137-49.
26. Del Palacio A, Soledad M, Valle A, González A, Almondarain I, Ramos M, et al. Cambios epidemiológicos observados en un decenio en las dermatofitosis del hospital universitario "12 de Octubre" de Madrid: nuevas especies emergentes. Rev Iberoam Micol. 1999;16:101-6.
27. Pakshir K, Hashemi J. Dermatophytosis in Karaj, Iran. Indian J Dermatol. 2006;51(4):262-4. doi: http://dx.doi.org/10.4103/0019-5154.30290
28. Vismer HF, Findlay GH. Superficial fungal infections in Transvaal. S Afr Med J. 1988;73:587-92.
29. Fuente: Servicio Nacional de Hidrología y Meteorología del Perú (SENAHMI).
30. Midgley G, Moore M. Onychomycosis. Rev Iberoam Micol. 1998;15:113-7.
Financiamiento:
Autofinanciado.
No aplica conflicto de intereses.
Correspondencia:
Vilma Ruth Béjar Castillo
Sección de Micología, Instituto de Medicina Tropical Daniel A. Carrión, Facultad de Medicina, UNMSM
José Santos Chocano Nº 199, Bellavista–Callao.
Teléfono: 619 7000-4410
Correo electrónico: vbejarc@unmsm.edu.pe; vilmabejar@hotmail.com













