Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. vol.79 no.2 Lima abr./jun. 2018
http://dx.doi.org/10.15381/anales.v79i2.14943
REPORTE DE CASO
Tumor de glándula lacrimal bilateral como manifestación de desorden linfoproliferativo post-trasplante renal. Reporte de un caso
Bilateral lacrimal gland tumor as a manifestation of renal posttransplant lymphoproliferative disorder. Case report
Dora Aranda Villalobos1, Neylin Velásquez Puquio1, Jesenia Ramírez Dextre2, Eduardo Santiani Armijo1, Alexi Chávez Echevarría 3
1 Médico Asistente. Servicio de Cirugía de Cabeza Cuello y Maxilofacial. Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
2 Médico Asistente. Servicio de Oncología Médica. Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
3 Médico Residente. Servicio de Cirugía de Cabeza Cuello y Maxilofacial. Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
RESUMEN
El desorden linfoproliferativo post-trasplante (DLPT) es una complicación poco común de los trasplantes de órganos sólidos y alogénicos de médula ósea, asociadas al empleo de inmunosupresores. La presentación en la glándula lacrimal es rara. Reportamos el caso de una paciente mujer de 27 años sometida a trasplante renal que recibió tratamiento inmunosupresor (tacrolimus, micofenolato de mofetilo y everolimus); presentó un tumor en ángulo supero-externo de la órbita izquierda, en relación con la glándula lacrimal de acuerdo a la tomografía de órbita. Se realizó resección quirúrgica del tumor. El informe de anatomía patológica fue de hiperplasia plasmocítica. Posteriormente presentó tumor en ambas órbitas. Se indicó rituximab, con remisión total del tumor que se confirma con estudio de tomografía de órbitas.
Palabras clave: Trasplante; Inmunosupresores; Aparato lagrimal.
ABSTRACT
Posttransplant lymphoproliferative disorder (PTLD) is an uncommon complications of solid organs and allogeneic bone marrow transplants associated with the use of immunosuppressive agents. The presentation in the lacrimal gland is rare. We report the case of a 27 year old female patient undergoing renal transplantation receiving immunosuppressive treatment (tacrolimus, mycophenolate mofetil and everolimus); she presents a supero-external angle tumor of the left orbit, in relation to the lacrimal gland according to the orbit tomography. Surgical resection of the tumor was performed, the pathology report was: plasmocytic hyperplasia. Later it presents tumor in both orbits, it is indicated rituximab, with total remission of the tumor that is confirmed with tomography study of orbits.
Keywords: Transplantation; Inmunosuppressive Agents; Lacrimal Apparatus.
INTRODUCCIÓN
El desorden linfoproliferativo post-trasplante (DLPT) es una rara complicación potencialmente fatal, de los trasplantes de órganos sólidos y los de médula ósea; incluye un grupo heterogéneo de neoplasias linfoides, caracterizadas sobretodo por la proliferación de linfocitos B asociada a la infección por el virus de Epstein Barr (VEB) como resultado de la terapia inmunosupresora1,2. El DLPT ocurre en aproximadamente 2-10% de todos los receptores de trasplante de órganos; la incidencia varía de acuerdo al tipo de órgano trasplantado, llegando al 1% en trasplante renal1. Se puede presentar con una amplia gama de manifestaciones patológicas y clínicas3,4,5; la presentación a nivel de la glándula lacrimal es excepcional6,7,8. En nuestro país, este es es el primer caso reportado. Cheung et al.6 reportaron en el año 2005 un caso de compromiso bilateral de la glándula lacrimal por DLPT en el Hospital Leicester Royal Infirmary del Reino Unido. Gold K.7 reportó en el año 2008 un caso de compromiso unilateral de la glándula lacrimal por DLPT en Wills Eye Institute de Filadelfia, E.E.U.U.). El diagnóstico se realiza sobre la base del estudio anátomopatológico con el empleo de marcadores de inmunohistoquímica e inmunofenotipo y evaluación del virus de Epstein Barr (VEB). El plan de trabajo incluye exámenes auxiliares: hemograma completo, pruebas de función renal y hepática, serología para virus de hepatitis B, deshidrogenasa láctica sérica, test de embarazo, aspirado de médula ósea, evaluación cardiaca; y de imágenes: tomografía axial computarizada, resonancia magnética nuclear y PETScan9. En el tratamiento se han empleado medidas terapéuticas solas o combinadas: reducción de la inmunosupresión10, tratamiento con agente-único (rituximab), quimioterapia y/o regímenes con quimio-inmunoterapia; los enfoques de tratamiento son dependientes del subtipo de DLPT. En general, la reducción de la inmunosupresión sigue siendo el paso inicial para el manejo de casi todos los casos de DLPT, siendo la respuesta variable; además, se debe monitorear la carga viral de VEB y el estado del órgano trasplantado.
REPORTE DEL CASO
Paciente mujer de 27 años de edad con antecedente de trasplante renal hace 7 años por diagnóstico de glomerulonefritis rápidamente progresiva. Recibió tratamiento inmunosupresor con tacrolimus que posteriormente es cambiado a everolimus y micofenolato de mofetilo. Hace un mes y medio presentó dolor orbitario izquierdo tipo punzada, posteriormente ptosis palpebral y aumento de volumen a nivel de techo de órbita ipsilateral asociado a signos de flogosis. En el examen físico se observó proptosis ocular izquierda, agudeza visual conservada, movimientos oculares sin alteraciones, reflejos foto-motor y consensual conservados; masa palpable a nivel de ángulo súpero externo de la órbita izquierda. Los resultados de los exámenes auxiliares fueron los siguientes: Ig G VEB positivo; deshidrogenasa láctica sérica, perfil hepático, y perfil renal dentro de límites normales; hemograma completo con anemia microcítica e hipocromía, recuento leucocitario y plaquetario dentro de lo normal; serología para hepatitis B negativa; sub-unidad beta de hormona gonadotrofina coriónica negativa. El aspirado de médula ósea no mostró infiltración.
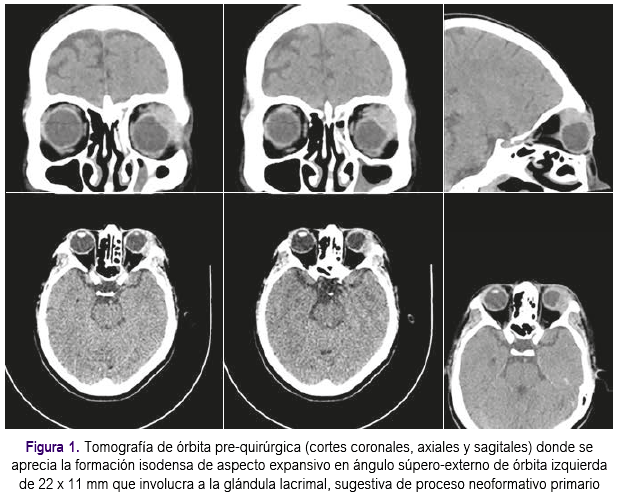
La tomografía de órbitas informó la presencia de formación isodensa de aspecto expansivo en ángulo súpero-externo de órbita izquierda de 22 x 11 mm., de localización extraconal que involucra a la glándula lacrimal, sugestiva de proceso neoformativo primario (Figura 1). Las tomografías de tórax, abdomen y pelvis no evidenciaron presencia de tumores.
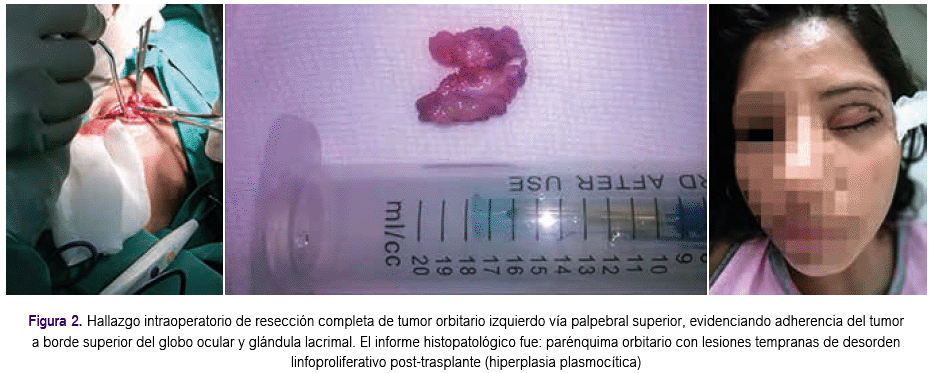
Se realizó resección completa de tumor orbitario izquierdo evidenciando fuerte adherencia del tumor a borde superior del globo ocular y glándula lacrimal; el informe histopatológico fue: parénquima orbitario con lesiones tempranas de desorden linfoproliferativo post-trasplante (hiperplasia plasmocítica) con células plasmáticas 2+, linfocitos 2+ pequeños, y que a la inmunohistoquímica mostró CD 20 y CD 3 positivos, p53 positivo débil y Ki67 positivo 20% (Figura 2). Con este resultado y de acuerdo al subtipo histológico se disminuyó la dosis de inmunosupresión.
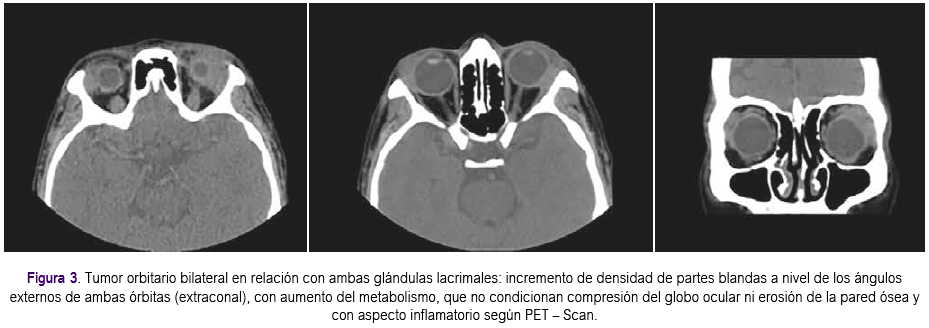
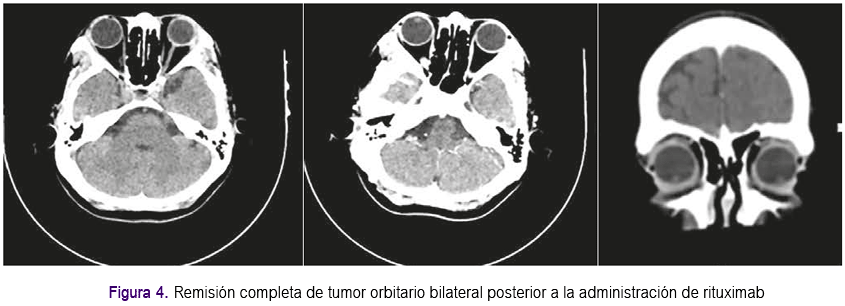
Aproximadamente un mes después presentó enfermedad progresiva en órbita contralateral que se confirmó con 4: PET-Scan, el cual informó incremento de densidad de partes blandas a nivel de los ángulos externos de ambas órbitas (extraconal), con aumento del metabolismo, que no condicionan compresión del globo ocular ni erosión de la pared ósea y con aspecto inflamatorio (Figura 3). Se inició tratamiento con rituximab a dosis de 375 mg x m2 de superficie corporal cada semana por 4 semanas, presentando evolución clínica favorable, lográndose respuesta completa que se confirmó con estudio de imágenes. De acuerdo a último control con tomografía de órbitas, no se evidenciaron masas ni aumento de volumen de partes blandas en ambas órbitas (Figura 4). Actualmente la paciente permanece con tratamiento inmunosupresor a bajas dosis. Se han realizado exámenes posteriores para evaluar VEB, siendo el Ig G negativo; pruebas de función renal y hepática dentro de lo normal. La paciente continúa en controles periódicos por el Servicio de Oncologia y Trasplante y seguimiento con estudios de PET-Scan y tomografías, continuando con respuesta favorable hasta la actualidad.
DISCUSIÓN
Con el transcurso de los años el DLPT ha comenzado a incrementarse conforme el trasplante de órganos sólidos se hace más común1 . Existen factores de riesgo que modifican esta incidencia como: a) Edad menor de 18 años, posiblemente por la mayor proporción de niños seronegativos para VEB y, por tanto, de primoinfección2; b) tipo de órgano trasplantado, es menos frecuente en trasplante renal (< 1%); c) agentes infecciosos, la primoinfección por VEB es el factor de riesgo individual más importante, la incidencia del DLPT en receptores seronegativos varía entre 23-50%, comparado con 0,71% en receptores seropositivos2,3; d) estado de inmunosupresión, prácticamente todos los agentes inmunosupresores utilizados (anticuerpos monoclonales y anticuerpos policlonales anti-linfocitos, inhibidores de la calcineurina y los agentes anti-proliferativos) presentan efectos inmunosupresores y pro-neoplásicos4. Recientemente se ha señalado que el riesgo depende más de la carga total de inmunosupresión que de un agente inmunosupresor en particular. La patogénesis del DLPT está íntimamente ligada al VEB. La presentación clínica es variable, incluye un síndrome parecido a la mononucleosis infecciosa con o sin linfadenopaas generalizadas, una forma tumoral con tumores ganglionares o extra-ganglionares, y una presentación diseminada y fulminante con sepsis5. La presentación a nivel de la glándula lacrimal es excepcional6.
Histopatológicamente, la OMS clasifica los desordenes linfoproliferativos posttrasplante en cuatro categorías: lesiones tempranas que incluye la hiperplasia plasmocítica e infección por mononucleosis; tipo polimórfico; tipo monomórfico con los subtipos de estirpe B (linfoma B difuso de células grandes, linfoma de Burkitt/Burkitt like, mieloma) y de estirpe T/NK; y finalmente, el tipo linfoma de Hodgkin clásico7.
Para realizar el diagnóstico es esencial el estudio anatomopatológico de la biopsia quirúrgica (estudio histológico e inmunofenotipo)5,8; el inmunofenotipo debe incluir marcadores asociados a células B y a células T porque se trata de un desorden policlonal. El panel recomendado para inmunohistoquímica incluye los siguientes marcadores: CD3, CD5, CD10, BCL6, BCL2, IRF4/MUM1, CD20, CD79a, PAX5, Ki67, canales kappa y lambda light. Los marcadores de superficie celular CD3, CD5, CD7, CD4, CD8, CD19, CD20, CD10 y kappa, lambda son recomendados para análisis de citometría de flujo8. La evaluación de la infección por VEB es otro componente esencial para el diagnóstico. El plan de trabajo consiste en: examen físico y evaluación ECOG que evalúa la calidad de vida del paciente oncológico; pruebas de laboratorio (hemograma completo, seshidrogenasa láctica sérica y panel metabólico: albúmina, electrolitos, úrea y creatinina). La evaluación de la médula ósea se emplea para estadiaje y pronóstico. Debe valorarse la historia previa de terapia de inmunosupresión. Se emplean también pruebas de imágenes: tomografías de tórax, abdomen y pelvis; resonancia magnética nuclear sólo en casos seleccionados y PET-Scan5,9. MUGA (radio-nucleido ventriculografía) y Scan/Ecocardiograma se emplean en casos donde se considera el tratamiento con antraciclinas por se considerada una droga cardiotóxica. El test para hepatitis B debe ser realizado previo al inicio del tratamiento con inmunoterapia (con o sin quimioterapia) debido al riesgo potencial de reactivación viral, básicamente con el uso de rituximab. La evaluación de la carga viral de VEB por PCR cuantitativo puede ayudar con el monitoreo de la respuesta al tratamiento. Es indispensable la serología VEB para evaluar primoinfección versus reactivación.
En el tratamiento se han utilizado medidas terapéuticas solas o en combinación que incluyen: reducción de la inmunosupresión10-13, tratamiento con agente-único (rituximab: anticuerpo antiCD20)14, quimioterapia y/o regímenes con quimio-inmunoterapia14,15; los enfoques de tratamiento son dependientes del subtipo de DLPT y de acuerdo a la respuesta al tratamiento inicial. En general, la reducción de la inmunosupresión sigue siendo el paso inicial para el manejo de casi todos los casos de DLPT, siendo la respuesta variable, y los pacientes deben ser estrechamente monitoreados. Es importante que la reducción de la inmunosupresión sea manejada en conjunto con el equipo de trasplante con la finalidad de minimizar los riesgos de rechazo del injerto. El rol de la terapia antiviral12 es controversial desde que la mayoría de los casos de DLPT son asociados con VEB latente. Los fármacos antivirales que se dirigen a la replicación del VEB pueden ser beneficiosos en el subgrupo de pacientes con DLPT temprana o polimórfica. Para los pacientes con lesiones tempranas, la primera línea de tratamiento podría tomar en cuenta sólo reducción de la inmunosupresión, ya que el objetivo del tratamiento es el control de la enfermedad neoplásica y preservar el órgano trasplantado. Para pacientes con respuesta completa a este tratamiento la re-escalación de inmunosupresión debe ser individualizada, tomando en cuenta la extensión de la inmunosupresión inicial y la naturaleza del órgano trasplantado. La carga viral de VEB debe ser monitoreada por PCR. Los pacientes con lesiones tempranas que fueron tratados sólo con reducción de la inmunosupresión y que presenten enfermedad persistente o progresiva, deben ser manejados con la segunda línea de tratamiento, empleándose rituximab con monitoreo de la carga viral de VEB. En el caso de respuesta completa se indica manejo de la inmunosupresión, monitoreo de carga de VEB, y del órgano trasplantado16 así como controles periódicos con imágenes (tomografía axial computarizada y PET Scan). Cabe mencionar que han sido reportados otras alternativas terapéuticas como: radioterapia11, interferón, y otras citoquinas12,13 e inmunoglobulinas intravenosas13.
En relación al presente caso, el diagnóstico se determinó con el estudio anátomo-patológico de la pieza operatoria (tumor de glándula lacrimal) consistente en lesión temprana de desorden linfoproliferativo post-trasplante (hiperplasia plasmocítica) CD3 y CD20 positivos. El dosaje de Ig G para VEB fue negativo. De acuerdo al sub-tipo histológico se disminuyó la dosis de inmunosupresión; sin embargo, al presentar enfermedad progresiva en órbita contralateral se dio tratamiento con rituximab, presentando evolución clínica favorable y lográndose respuesta completa que se confirmó con estudios de imágenes.
REFERENCIAS BIBLIOGRÁFICAS
1. Burney K, Bradley M, Buckley A, Lyburn I, Rye A, Hopkins R. Post transplant lymph proliferative disorder: A pictorial review. Australasian Radiology. 2006; 50 (5): 412-418. DOI: https://doi.org/10.1111/j.1440-1673.2006.01618.x. [ Links ]
2. Dharnidharka V, Green M, Webber M. Post-Transplant Lymph proliferative Disorders. Berlin: Springer Verlag, 2010. [ Links ]
3. Gross T, Savoldo B. et al. Enfermedad linfoproliferativa post-trasplante. Revista de Enfermedades Infecciosas en Pediatría. 2011; 24(96): 136-138. [ Links ]
4. Walker R, Paya C, Marshall W. et al. Pretransplantation seronegative Epstein-Barr virus status is the primary risk factor for post transplantation lympho proliferative disorder in adult heart, lung, and other solid organ transplantations. J HeartLung Transplant. 1995; 14(2): 214-221. [ Links ]
5. Penn I. Post-transplant malignancy: the role of immunosuppression. Drug Saf. 2000; 23(2):101-113. [ Links ]
6. Cheung D, Prabhakaran V, Brown L, Stitson RMN, Sampath R. Bilateral lacrimal gland enlargement due to post-transplant lymphoproliferative disorder. Eye. 2006; 20: 972 – 974. [ Links ]
7. Gold K. Wills Eye Resident Case Series. Review of Oftalmology. 2008 April. [ Links ]
8. La Casce A. Post-transplant lympho proliferative disorders. The Oncologist. 2006;11(6): 674–680. DOI: 10.1634/theoncologist.11-6-674. [ Links ]
9. Bakker NA, Pruim J, de Graaf W, van Son WJ, van der Jagt EJ, van Imhoff GW. PTLD visualization by FDG-PET: improved detection of extranodal localizations. Am J Transplant. 2006;6(8): 1984-5. DOI: 10.1111/j.1600-6143.2006.01459.x. [ Links ]
10. Tsai D, Hardy C, Tomaszewski JE. et al. Reduction in immunosuppression as initial therapy for post transplant lymphoproliferative disorder: analysis of prognostic variables and long-term follow-up of 42 adult patients. Transplantation. 2001;71(8): 1076-88. [ Links ]
11. Koffman BH, Kennedy AS, Heyman M, Colonna J, Howell C. Use of radiation therapy in post transplant lymphoproliferative disorder (PTLD) after liver transplantation. Int J Cancer. 2000;90(2): 104-9. [ Links ]
12. Zutter, M., Martin, P., Sale, G. et al. Epstein-Barr virus lymphoproliferation after bone marrow transplantation. Blood. 1988;72(2): 520-9. [ Links ]
13. Shapiro RS, Chauvenet A, McGuire W, Pearson A, Craft AW, McGlave P, Filipovich A. Treatment of B-cell lymphoproliferative disorders with interferon alfa and intravenous gamma globulin. N Engl J Med. 1988;318(20):1334. DOI: 10.1056/NEJM198805193182013. [ Links ]
14. The American Society of Transplantation Infectious Diseases Guidelines. Am J Transplant. 2009;9 (Suppl 4): S92. [ Links ]
15. Elstrom RL, Andreadis C, Aqui NA et al. Treatment of PTLD with rituximab or chemotherapy. Am J Transplant. 2006;6(3): 569-576. DOI: 10.1111/j.16006143.2005.01211.x. [ Links ]
16. NCCN Clinical Practice Guidelines in Oncology. Version 4.2018. B-Cell Lymphomas. Washington: National Comprehensive Cancer Network; 2018. [Fecha de acceso 15 de mayo de 2018]. Disponible en: https://www.nccn.org/professionals/physician_gls/recently_updated.aspx. [ Links ]
Conflictos de interés: Los autores declaran no tener conflictos de interés.
Fuentes de financiamiento: Autofinanciado.
Correspondencia:
Dora Aranda Villalobos
dora_aranda@yahoo.es
Teléfono: 51-999122651
Recibido: 26 de enero 2018
Aprobado: 31 de mayo 2018














