INTRODUCCIÓN
El deterioro cognitivo asociado a quimioterapia se define como una alteración en la función cognitiva del individuo y constituye un efecto adverso del tratamiento antineoplásico que, según reportes, se manifiesta por medio de cambios cognitivos agudos que no llegan a constituir algún grado de demencia para el paciente 1. El deterioro cognitivo asociado a quimioterapia presenta una incidencia variable entre poblaciones, con una frecuencia entre el 16% al 75% 2. La sintomatología se manifiesta principalmente a través de cambios en las funciones ejecutivas (disfunción ejecutiva) como problemas de atención, concentración, función motora, entre otros 3,4. Esta condición se desarrolla durante el tratamiento de quimioterapia y persiste desde algunos meses hasta 3 años después de finalizarla 5,6, lo cual genera un impacto significativo en la calidad de vida de los pacientes tratados y los que ya se consideran curados.
El proceso biológico que subyace a esta condición aún no está dilucidado, sin embargo, se ha descrito la presencia de alteraciones en la barrera hematoencefálica en aquellos pacientes que reciben quimioterapia, la cual permitiría el ingreso de agentes citotóxicos, que generan daño neuronal y cambios en la corteza frontal, y que afectan principalmente las funciones ejecutivas como la toma de decisiones, iniciativa, planificación, previsión y reflexión 7-10. Además de esto, el componente genético puede predisponer a las pacientes a desarrollar deterioro cognitivo, ya que se han reportado variaciones puntuales en la secuencia codificante o promotora de ciertos genes que podrían estar asociados a la predisposición para el desarrollo del deterioro cognitivo, como el gen "Brain derived neurotrophic factor" (BDNF).
El gen BDNF codifica una proteína neurotrofina, la cual es fundamental en la reparación y supervivencia neuronal 11,12, lo señalado podría ser potencialmente usado como base para una terapia para la enfermedad de Alzheimer 13-14 y daño cerebral traumático 15. Uno de los polimorfismos más estudiados, Val66Met (196G>A), rs6265, provoca una alteración en la proteína expresada causando una translocación subcelular deficiente, por lo que se le ha asociado a la alteración en la función neurocognitiva en adultos sanos, y a problemas neurodegenerativos como enfermedad de Alzheimer y Parkinson 16. También se ha propuesto que pudiera tener un rol en la predisposición de pacientes con cáncer para desarrollar deterioro cognitivo asociado a la quimioterapia 17.
El presente estudio tuvo como objetivo determinar la asociación entre el polimorfismo Val66Met en el gen BDNF y el desarrollo de disfunción ejecutiva en pacientes mujeres diagnosticadas con cáncer de mama bajo tratamiento con quimioterapia adyuvante en el Instituto Nacional de Enfermedades Neoplásicas (INEN).
MÉTODOS
Diseño y población de estudio
El diseño del estudio fue prospectivo analítico, longitudinal. La cohorte de pacientes reclutadas perteneció a la población de mujeres con cáncer de mamas diagnosticadas y tratadas en el Instituto Nacional de Enfermedades Neoplásicas en Lima, Perú. Todas las mujeres con diagnóstico de cáncer de mama confirmado por la institución fueron contactadas para solicitar su participación entre enero a diciembre de 2019.
Criterios de inclusión y exclusión
Los criterios de inclusión fueron: mujeres mayores de 18 años con diagnóstico confirmado de cáncer de mama por anatomía patológica; tener valores normales de hormona estimulante de la tiroides (TSH), tiroxina (T4), triyodotironina (T3) y vitamina B12; y tener adecuada función hepática, renal y cardiaca.
Los criterios de exclusión fueron la presencia de metástasis; la presencia de algún desorden neurológico o de alguna enfermedad autoinmune; y estar gestando.
Variables
Evaluación de la disfunción ejecutiva
La prueba cognitiva breve INECO Frontal Screening (IFS) evalúa funciones ejecutivas e incluye 8 subpruebas: programación motora (3 puntos), control motor inhibitorio (3 puntos), instrucciones conflictivas (3 puntos), recuento de dígitos en orden inverso (6 puntos), memoria de trabajo espacial (4 puntos), memoria de trabajo verbal (2 puntos), capacidad de abstracción (3 puntos) y control inhibitorio verbal (6 puntos). La IFS tiene un puntaje total de 30 puntos y puede tomar 10 minutos para ser administrado y puntuado.
Se considera alteraciones ejecutivas y de cognición social a un puntaje de 23 o menor. La versión peruana de la IFS tuvo una sensibilidad de 94,1 % y especificidad de 94,2 %, demostrando una capacidad discriminatoria significativamente superior al Frontal Assessment Batery (FAB) 18. La prueba IFS fue aplicada por una psicóloga capacitada en el Instituto Peruano de Neurociencias (IPN), antes y al finalizar la quimioterapia. La disfunción ejecutiva se definió como la disminución del puntaje IFS en la evaluación tomada al finalizar el tratamiento quimioterapéutico comparado con la evaluacion previa.
Genotipificación del polimorfismo Val66Met
La extracción de ADN se realizó a partir de 200 µL de sangre total de cada paciente haciendo uso del kit comercial High Pure PCR Template Preparation Kit (Roche Molecular Systems) siguiendo las indicaciones del proveedor.
Para las reacciones de PCR se utilizó el primer forward: 5'-ACTCTGGAGAGCGTGAATGG-3' y el primer reverse: 5'-ACTACTGAGCATCACCCTGGA-3'. El mix de reacción de PCR se preparó usando 12,5 µL de Q5(r) High-Fidelity 2X Master Mix (New England Biolabs), 1,25 µL de Primer Forward, 1,25 µL de Primer Reverse, 8 µL de agua libre de nucleasas y 2 µL de ADN genómico (50 ng/µL) para un volumen total de 25 µL. La amplificación se realizó en un termociclador automatizado Mastercycler Nexus Gradient, Eppendorf(tm) bajo las siguientes condiciones: denaturación inicial a 98°C por 30 segundos, 30 ciclos a 98 °C (10 segundos), 62 °C (10 segundos), 72 °C (10 segundos), seguido de una extensión final de 2 minutos a 72 °C. Los productos de PCR fueron visualizados mediante electroforesis en geles de agarosa al 2%, con un voltaje de 90 V por 40 minutos en buffer TAE 1X. Se cargó 8 µL de cada muestra combinada con 1 µL de buffer de carga (BlueJuice Gel Loading Buffer 10X, Invitrogen(tm)) y 1 µL de SafeGreen (Abm). Los productos fueron visualizados en un transluminador de luz azul.
Los productos de PCR obtenidos fueron procesados mediante secuenciamiento automático tipo Sanger en ambos sentidos. Las secuencias resultantes fueron editadas haciendo uso del programa BioEdit v.7.1 y alineadas con la secuencia de referencia del gen BDNF (número de accesión NG_011794.1) de la base de datos del National Center for Biotechnology Information (NCBI).
Análisis estadístico
Se realizó el análisis descriptivo de la muestra y la prueba de equilibrio de Hardy-Weinberg (HWE) haciendo uso del programa R v.4.0.2. Se agrupó a las pacientes según: a) disminución del puntaje de la prueba IFS comparado con la primera evaluación (disfunción ejecutiva) y b) puntaje de la prueba IFS sin variación. Se realizó un análisis de regresión logística binaria para controlar variables asociadas al rendimiento cognitivo. Las variables de ajuste fueron la edad de las pacientes (categoría de referencia: menos de 60 años) y el nivel de instrucción (categoría de referencia: menos de 11 años).
La intención de este estudio no fue evaluar el rendimiento cognitivo asociado a tratamiento, por lo que se decidió no incluir los esquemas de quimioterapia en el modelo. Sin embargo, debido a que se asume que todas las pacientes recibieron diferentes ciclos de quimioterapia durante el estudio, determinamos el fenotipo con el método de "Diferencia Mínima Clínicamente Importante" (MCID), el cual es usado para determinar cambios en el rendimiento cognitivo en pacientes que reciben terapia contra el cáncer 19.
Se categorizó como disfunción ejecutiva si la paciente presentaba una reducción de 2 puntos o más con respecto al puntaje obtenido antes de la quimioterapia y utilizando como referencia el score igual a 23, el cual es el punto sugerido de corte para la prueba IFS.
Se calculó el odds ratio (OR) para determinar la asociación entre el genotipo silvestre (GG) y genotipos con al menos un alelo A (GA, AA) del polimorfismo Val66Met, y la presencia de disfunción ejecutiva de las pacientes. El nivel de significancia fue establecido en 0,05.
Aspectos éticos
El presente estudio fue aprobado por el Comité de Ética y Consejo Científico del INEN (número de protocolo: INEN 1779), dentro del proyecto FONDECYT 102-2018. El proyecto siguió los principios de confidencialidad y anonimato, según la Declaración de Helsinki y sus posteriores revisiones. Todas las participantes firmaron el consentimiento informado.
RESULTADOS
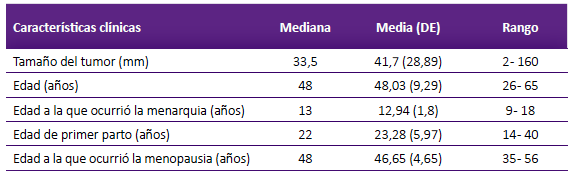
De las pacientes reclutadas, 73 completaron ambas evaluaciones e ingresaron al estudio, las características clínicas se muestran a la tabla 1. El rango de edad de las pacientes fue entre 26 a 65 años, con un promedio de 48,03 y desviación estándar (DE) de 9,29 años. El tamaño promedio del tumor fue 41,7 (DE = 28,89) milímetros. La edad promedio de la menarquia, primer parto y menopausia fue 12,94 (DE = 1,8), 23,28 (DE = 5,97) y 46,65 (DE = 4,65) años, respectivamente.
La figura 1 muestra amplificados por PCR en gel de agarosa al 2% teñido con colorante para ácidos nucleicos Nancy-520. El tamaño del amplificado es de 159 pb. La figura 2 muestra secuencias con genotipo heterocigoto GA (A) y homocigoto normal GG (B).
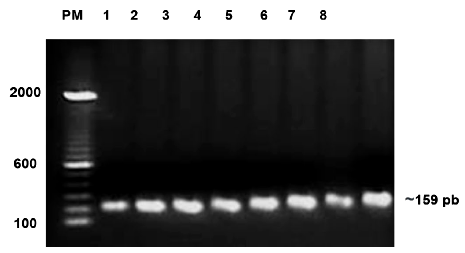
Figura 1 Amplificados para el polimorfismo Val66Met en el gen BDNF de las pacientes mujeres con cáncer de mama. Marcador PM 100 pb.
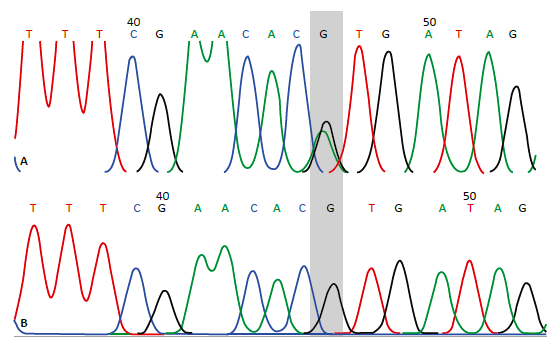
Figura 2 Electroferograma de dos secuencias del polimorfismo Val66Met en el gen BDNF. A. Genotipo heterocigoto (A/G). B. Genotipo homocigoto normal (G/G).
Se calcularon las frecuencias genotípicas del polimorfismo Val66Met, se encontró que la frecuencia de homocigotos normales GG (Val/Val) fue del 86,3%, la de heterocigotos GA (Val/Met) de 12,3% y la de homocigotos AA (Met/Met) de 1,4%. Asimismo, se reporta que la frecuencia de los alelos G (Val) y A (Met) fueron 92,5% y 7,5%, respectivamente. Se calculó el equilibrio de Hardy-Weinberg a partir de las frecuencias genotípicas obtenidas para la población estudiada y se obtuvo como resultado que la distribución de genotipos del polimorfismo es consistente con la hipótesis de equilibrio (p = 0,334).
Se realizó una gráfica de distribución de puntajes para observar si existe diferencia entre los puntajes obtenidos por las pacientes con genotipo normal GG y con al menos un alelo A (GA/AA). Las pacientes portadoras del alelo A obtuvieron un puntaje significativamente menor al grupo homocigoto normal (p < 0,05) (Figura 3).
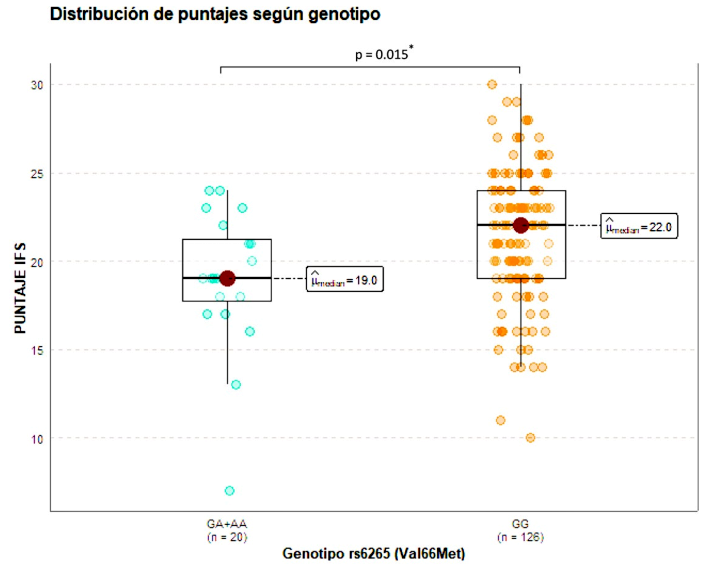
Figura 3 Distribución de puntajes obtenidos por las pacientes para la prueba INECO Frontal Screening según genotipo
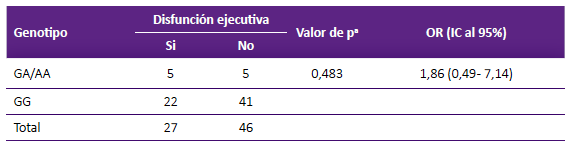
Se estimó el OR para determinar si la presencia del alelo A (Met) en el gen BDNF se relaciona con la probabilidad de que una paciente con cáncer de mama presente disfunción ejecutiva posquimioterapia (Tabla 2). No encontramos asociación significativa, el OR fue de 1,86 (IC95%: 0,49 a 7,14, p = 0,483). El modelo de regresión logística no mostró asociación, sin embargo, se encontró que el nivel de educación si estuvo asociada a rendimiento cognitivo (p = 0,012), las pacientes con mayor nivel respondieron mejor a las evaluaciones (Tabla 3).
Tabla 3 Análisis de regresión logística para analizar los factores asociados a la disfunción cognitiva en pacientes con cáncer de mama en quimioterapia
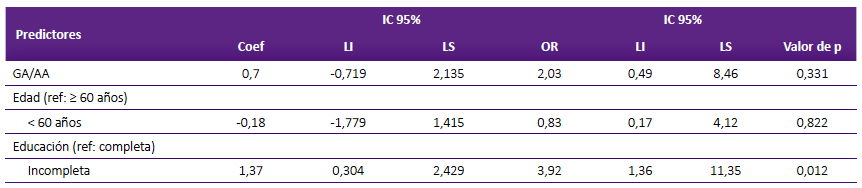
Prueba chi-cuadrado (χ2 ) p = 0,059; R2 = 0,08. IC 95%: Intervalo de confianza al 95%; OR: Odds Ratio, Ref: referencia, LI: límite inferior, LS: límite superior. Diagnóstico de colinealidad en base al factor de inflación de varianza: BDNF (VIF = 1,01), edad (VIF = 1,02), educación (VIF = 1,00).
DISCUSIÓN
Se encontró el alelo A (Met) del polimorfismo rs6265 (Val66Met) del gen BDNF en el 13,7% de las pacientes, asimismo se encontró la presencia de disfunción ejecutiva en 28 de las 73 pacientes (38,4%). Este gen codifica un factor regulatorio importante para la supervivencia, migración neuronal, e inducción del crecimiento axonal y dendrítico. Además, ejerce un efecto neuroprotector 20,21, expresándose principalmente en la región de la corteza prefrontal y el hipocampo 22. El polimorfismo Val66Met conlleva a una sustitución aminoacídica en el codón 66 (Val66Met) del gen BDNF, alterando la pro región de la proteína que regula su interacción con moléculas de control de tráfico intracelular, lo que reduce su secreción en alrededor de 18 y 29% en portadores de uno o dos alelos A (Met), respectivamente23,24.
El análisis comparativo de puntajes en la prueba IFS entre ambos grupos genotípicos mostró que las pacientes con algún alelo A (Met) obtuvieron puntajes significativamente menores comparados con el grupo homocigoto normal GG (Val/ Val). Para el análisis de la función cognitiva no se consideraron puntos de corte. También se debe considerar que la prueba cognitiva fue validada en el Perú en pacientes con escolaridad mínima de secundaria completa 25, mientras que este estudio la escolaridad fue heterogénea.
Se ha reportado que los individuos portadores del alelo A (Met) poseen diferencias en la morfología cortical e hipocampal, y muestran una disminución en el volumen hipocampal comparado con los controles homocigotos Val/Val 26,27. Además, estos portadores presentan un menor desempeño en tareas que involucran la memoria, ya que esta depende del hipocampo 28. Con la aplicación de baterías neuropsicológicas, los individuos portadores del alelo A (Met) tienen un rendimiento significativamente menor en la realización de tareas que involucran recuerdos de lugares y eventos comparado con los controles, a diferencia de tareas que involucran menos la actividad hipocampal como aprendizaje de palabras o planeación 29. Estos resultados estarían en concordancia a lo encontrado en el presente estudio, ya que individuos portadores del alelo polimórfico tiene un menor desempeño en la prueba IFS, la cual evalúa memoria de trabajo verbal y espacial, áreas que dependen del hipocampo para su ejecución.
El análisis de asociación mostró que el polimorfismo no se encontró significativamente asociado al desarrollo de disfunción ejecutiva. Estudios previos reportan que la presencia de este polimorfismo se asocia con el deterioro cognitivo en la enfermedad de Parkinson 30, con incremento de su severidad cuando están presentes ambos alelos A 31. Estos hallazgos sugieren que una alta expresión de este gen actúa como factor protector de la disminución del rendimiento cognitivo en adultos mayores 32. Además, se reporta que esta asociación puede ser influenciada por el origen étnico 33, y que la presencia del polimorfismo en combinación con otros dentro del mismo gen, presentaría un efecto aditivo para el desarrollo de disfunción cognitiva en pacientes con epilepsia 34. El gen TNFA también tendrían un efecto similar, ya que el polimorfismo rs1799964, en combinación con rs6265 del gen BDNF aumentan el riesgo de disfunción cognitiva y esquizofrenia 35, por lo que evaluar la presencia de otros polimorfismos sería relevante.
Entre las limitaciones se encuentra la complejidad para determinar el déficit de rendimiento cognitivo en pacientes que reciben quimioterapia, múltiples factores pueden influenciar esta situación como la edad, los polimorfismos genéticos y los componentes psicosociales, lo cual se trató de minimizar al usar la metodología MCID. Además, la aplicación de pruebas adicionales para evaluar otras áreas funcionales sería de utilidad para obtener un panorama más amplio del estado cognitivo de las pacientes. Finalmente, sería relevante realizar un seguimiento a las pacientes para determinar si meses después de terminada la quimioterapia la disfunción ejecutiva se mantiene como los señalado por algunos autores.
En conclusión, en el presente estudio no se encontró asociación entre el polimorfismo Val66Met (196G>A) en el gen BDNF y la ocurrencia de disfunción ejecutiva en pacientes con cáncer de mama con quimioterapia adyuvante, sin embargo, las portadoras de al menos un alelo A (Met) presentaron puntajes menores en la evaluación cognitiva.