Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú v.12 n.2 Lima jul./dic. 2001
Micotoxicosis1
Oscar R. Perusia2 y Roberto Rodríguez A.3
1 Del Cuaderno de Divulgación Técnica Nº 4: Plantas Tóxicas y Micotoxinas (Perusia O.R. y Rodríguez Armesto R.) 3º Edición 2/97.
2 Profesor Asociado de la Cátedra Enfermedades de los Rumiantes.
3 Director del Hospital de Grandes Animales
Facultad de Ciencias Veterinarias-Universidad Nacional del Litoral-Esperanza-Provincia de Santa Fe-República Argentina.
GENERALIDADES
Las micotoxicosis son enfermedades que se presentan en animales y el hombre, producidas por micotoxinas, elementos tóxicos elaborados por distintos tipos de hongos que crecen en plantas, henos, silos, granos, subproductos y otros alimentos almacenados.
Son características generales de las micotoxicosis:
- El veterinario interviene con frecuencia sin que identifique rápidamente la causa del problema.
- Los trastornos no son transmisibles entre animales.
- No dan resultados los tratamientos con antibióticos y la enfermedad es poco antigénica.
- Los brotes de micotoxicosis de pastos son estacionales y están asociados con características climáticas especiales.
- La enfermedad está relacionada con un alimento en particular.
- El examen cuidadoso del alimento sospechoso puede revelar signos de desarrollo fúngico.
- No son tóxicos acumulativos.
TIPOS DE HONGOS
a) Hongos de campo:
Fusarium
F. moniliforme
F. roseum
F. tricinctum
F. nivale
Alternaria sp.
Helminthosporium sp.
Cladosporium sp.
Penicilium
P. oxalicum
P. Funiculosum
P. oylopium
P. variables
P. oydrinum
b) Hongos de almacenaje:
Aspergillus
A. flavus
A. parasiticus
Penicillium
c) Hongos del deterioro avanzado:
Chaetomiun sp.
Aspergillus
A. clavatus
A. fumigatus
Scopulariopsis sp.
Rhizopus sp.
Mucor sp.
Absidia sp.
Los hongos de los alimentos almacenados necesitan de las siguientes condiciones:
- Substrato fácilmente utilizable (carbohidratos).
- Humedad en los granos (10-18%) y humedad relativa ambiente del 70% o más.
- Adecuada temperatura. Esta varía con el hongo (Ej.: Aspergillus flavus puede elaborar toxinas entre 12 y 47ºC, y algunos Fusarium pueden producirla a temperaturas de congelación, pudiendo ser entonces meso-termo-psicrófilos).
- Suficiente 02 (no indispensable) y CO2
- La acidez es un elemento negativo para el desarrollo micótico y formación de esporas. Es necesario un pH alcalino.
- El tiempo de almacenamiento es importante ya que a mayor tiempo se tiene mayor posibilidad de condiciones adversas o favorables para su desarrollo.
- Puntos calientes en la masa de alimentos producidos por el desarrollo de microorganismos.
- Los insectos alteran los granos y abren el camino para el desarrollo fúngico.
En general hay una detoxificación de las micotoxinas por los microorganismos ruminales. A menudo este proceso altera la hidrosolubilidad y la polaridad de las micotoxinas los cuales van a influir sobre la depuración intestinal. Este metabolismo ruminal puede potencialmente aumentar o disminuir la toxicidad para el hospedador.
Son claras las diferencias biológicas entre el rumen bovino y el rumen ovino. A modo de ejemplo sabemos que las bacterias y los protozoarios ruminales de ovejas son capaces de degradar las aflatoxinas B1 y G1 y la toxina T-2, con una marcada disminución de las actividades metabólicas de la microflora y microfauna endorrumial, pero consiguiendo la detoxificación de las micotoxinas mencionadas.
EFECTOS DE LAS MICOTOXINAS
Las micotoxinas pueden causar efectos agudos y crónicos en una gran variedad de especies animales en sus distintos órganos, aparatos y/o sistemas. Dichos efectos los resumimos así:
- Hepatotoxinas: producen degeneración grasa, hemorragia y necrosis del parénquima hepático.
En algunos casos hay tamaño anormal del hepatocito y su núcleo (megalocitosis: pérdida de la relación tamaño del citoplasma-tamaño del núcleo).
Hiperplasia de conductos biliares puede ocurrir en algunas micotoxinas y pueden inducir al hepatoma.
En las toxicosis agudas hay ictericia, anemia hemolítica y elevación de los niveles plasmáticos de las enzimas hepáticas; fotosensibilización secundaria.
En las toxicosis crónicas hay hipoproteinemia, hipoprotrombinemia, fibrosis hepática y cirrosis. Puede haber fotosensibilización secundaria (rara).
- Nefrotoxinas: el ácido oxálico y otros agentes nefrotóxicos pueden ser producto de Aspergillus y Penicillium. Producen daños tubulares y ocasionan signos y lesiones características de nefrosis tóxica tubular.
- Cambios en médula ósea, eritrocitos y endotelio vascular. Los signos clínicos vistos incluyen hemorragias difusas, hematomas, debilitamiento, anemia, leucopenia y aumento de la susceptibilidad a las infecciones. También aquí se incluyen los alcaloides del Claviceps purpurea y los de la Festuca que provocan gangrena de las extremidades.
- Irritación directa: efectos dermonecróticos con ulceración y necrosis oral. Las hemorragias gastroentéricas son signos característicos. Muchas de estas toxinas son producidas por Fusarium.
- Disturbios reproductivos y endocrinos: se produce un hiperestrogenismo, preferentemente en la hembra porcina y descenso de la fertilidad y la libido en el macho de la misma especie. Hipo o agalactia, abortos, partos prematuros, etc. Se puede reproducir la enfermedad con la aplicación de estrógenos.
- Función respiratoria: por la acción del hongo Fusarium solani se produce en las batatas dañadas la transformación de una de sus sustancias en la toxina Ipomerona, la cual ha sido asociada a la formación de membrana hialina y producción de adenomatosis pulmonar.
- Sistema nervioso central: efectos agudos de tembladeras han producido los hongos Penicillium y Claviceps a través de sus toxinas que afectan el sistema nervioso central; las mismas contienen ácido lisérgico (LSD).
Otros casos de toxinas que actúan sobre el sistema nervioso central producen hiperexcitabilidad, incoordinación y/o temblores.
En equinos la intoxicación con granos parasitados con Fusarium produce leucoencefalomalacia, lesión destructiva que cursa con somnolencia y muerte.
- Sistema inmunitario: hay aflatoxinas y rubratoxinas que disminuyen la eficacia del sistema inmunitario, produciendo así gran susceptibilidad a las enfermedades infecciosas.
- Teratogénesis: Aflatoxina, Ochratoxina y citochalosina B.
DIAGNÓSTICO DE LAS MICOTOXICOSIS
- Es importante hacer un análisis detallado y meticuloso de los alimentos sospechosos. Los efectos tóxicos con bajos niveles de contaminación puede tardar varias semanas en aparecer.
- El curso de la enfermedad y el tipo de lesiones puede estar relacionado con la clase de micotoxinas y la predisposición de cada animal.
- La muestra a analizar debe ser representativa ya que sólo una parte del alimento puede estar contaminado.
- Los alimentos enmohecidos por lo general son parcialmente rechazados por los animales y, esta disminución de la ingesta, también contribuye a la pérdida de peso que ocurre en algunos casos de mico-toxicosis.
- El calor en exceso, cambios químicos (acidez) y la luz solar son los elementos que pueden alterar la estructura y actividad de dichos hongos.
- El laboratorio es sumamente dependiente de una muestra representativa bien conservada y de una exacta y detallada historia clínica.
- El número de toxinas existentes son mayores que las pruebas rutinariamente empleadas.
- La presencia de hongos en el alimento no necesariamente indica presencia de micotoxinas, ya que la producción de éstas depende de la temperatura, humedad, tipo de substrato, cantidad de alimento contaminado, etc.
- Algunos componentes naturales de alimentos y forrajes pueden producir resultados falsos positivos en el análisis químico del laboratorio.
- Las mezclas alimenticias (raciones, pellet) son complejas y dificultan el análisis.
- Ensayos biológicos de los alimentos problemas sobre grandes especies (bovinos, equinos) no son aplicables por ser muy costosos, aunque la utilización de especies menores similares es adecuada. Efectos crónicos (a los 2 ó 3 meses) pueden ocurrir y son muy difíciles de diagnosticar.
- Un método químico muy empleado para la detección de micotoxinas es la cromatografía en capa fina. Para llevar a cabo esta prueba primero se debe realizar una extracción química del alimento problema. Para la mayoría de las toxinas se debe observar la cromatografía en capa fina con luz ultravioleta, las cuales reflejan distintas fluorescencia según cual micotoxina se trate. Posteriormente sobre la misma placa se realizan pruebas confirmatorias para asegurar el diagnóstico.
AFLATOXINAS
Las aflatoxinas son un grupo de metabolitos tóxicos producidos por Aspergillus flavus, Aspergillus parasiticus y Penicillium puberulum. Las mismas se hallan contaminando los granos almacenados, sobre todo cuando éstos están en área de excesiva humedad durante un largo tiempo. Los granos más frecuentemente contaminados son el sorgo, maíz, algodón y maní.
Otros substratos donde han sido aislados estas micotoxinas son el arroz, mijo, soja, girasol, sésamo, olivo, nueces, almendras, avellanas, legumbres, café, cocoa, leche, pescados, subproductos derivados de ellos (harina, expeller, afrecho, afrechillos), trigo.
En nuestra zona han sido detectadas en fardos y rollos de alfalfa y en malta de cervecería.
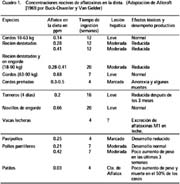
Estas micotoxinas se caracterizan por ser: mutagénicas, teratogénicas, carcinogénicas e inmunodepresoras. El Cuadro 1 nos muestra los niveles tóxicos de aflatoxinas en algunas especies (Wodan, 1968)
Los efectos tóxicos de las aflatoxinas dependen de las dosis y del tiempo de ingestión. También la especie y la edad son importantes. Está establecida la dosis letal 50 (DL 50) en la intoxicación aguda para patos y perros que es, aproximadamente, 1 mg/kg.
En general las aves son más sensibles a las aflatoxinas que los mamíferos. El orden de susceptibilidad en aves es patos, pavos, pollitos y pollos; y en mamíferos es perros, cerditos, cerdas, terneros, cerdos de engorde, bovinos adultos, ovejas; también los caballos son sensibles.
La DL 50 en el cerdo varía de 0.3-0.6 mg/kg de aflatoxina B1 por vía oral en una sola toma. Interesante es que la DL 50 para el conejo es semejante a la anterior.
Dosis de 4 mg/kg en bovinos producen la muerte en 15 horas por insuficiencia hepática aguda.
No hay explicación exacta de la gran resistencia en ovejas (500 mg/kg), pero se piensa que los microorganismos ruminales de esta especie modificarían las aflatoxinas haciéndoles perder gran parte de su toxicidad.
Se admiten los siguientes niveles en los respectivos productos (F.D.A.):
- Comida para aves 20-200 p.p.b.
- Comida para bovinos 20 p.p.b.
- Leche entera para consumo 0.5 p.p.b.
Patogenia
Las aflatoxinas actualmente reconocidas son B1, B2, G1, G2, M1, M2, B2a, G2a y P1. Las letras B y G refieren a que dichas toxinas tienen fluorescencia azul (B: Blue) o verde (G: Green) en la cromatografía en capa fina irradiándolas con luz ultravioleta. La letra M indica leche (Milk), refiriendo al lugar de eliminación de esta toxina.
Químicamente las aflatoxinas son derivados difuranocumarínicos. Son estables al calor por lo que se las puede encontrar en alimentos completamente procesados.
La más común en la contaminación natural es la B1. Las aflatoxinas suprimen el mensaje de síntesis del RNA. También como efecto adicional, inhibe la síntesis de DNA.
En forma esquemática, las aflatoxinas interfieren en el metabolismo de:
a) Síntesis de las proteínas y ácidos nucleicos: la acción ejercida sobre las primeras es debida a la modificación que ocurre tanto en el ADN patrón y RNA polimerasa en la fase de translación. Ello determina que se inhiba la síntesis proteica a nivel del hepatocito con su cortejo patológico habitual.
Referido a los ácido nucleicos existen dos tipos de interacción: no covalente, débil y reversible; el otro, en cambio, es covalente, irreversible y requiere ser activado metabólicamente por un sistema enzimático. Muchos de los efectos carcinogénicos y mutagénicos de las aflatoxinas y otros estructuralmente similares, han sido relacionados con micotoxinas activadas metabólicamente.
La unión covalente en el enlace C2-C3 (el cual es insaturado) es lo que determina que las aflatoxinas B1 y G1 sean más activas que las B2 y G2. Es precisamente en este punto donde sucede la activación de las aflatoxinas B1 y G1 por un sistema enzimático de tipo oxidativo, llevado a cabo en el sistema retículo endoplasmático de los hepatocitos, catalizando la formación de 2,3 epóxido de aflatoxina B1.
Este epóxido formado puede unirse con los ácidos nucleicos y proteínas haciéndolos biológicamente inactivos. La guanina del DNA es el blanco principal atacado por las aflatoxinas activadas. Esta unión covalente induce mutaciones que a la larga terminan en neoplasias.
b) Hidratos de carbono: las aflatoxinas disminuyen los niveles de glucógeno hepático debido a la inhibición de enzimas biosintéticas como la glucógeno-sintetitasa; además producen un aumento de la actividad de las enzimas metabólicas de los precursores del glucógeno, como por ejemplo la NADP que reduce la enzima 6-fosfato deshidrogenasa.
c) Lípidos: las aflatoxinas causan un aumento citosólico de los niveles NADPE, necesarios para la síntesis de ácidos grasos, pero al inhibir el transporte de triglicéridos, causan el hígado graso, como así también afectan el transporte de fosfolípidos y colesterol. A nivel de las mitocondrias la aflatoxina B1 inhibe el transporte de electrones entre citocromo b-citocromo c. También lo hace a nivel de la citocromo oxidasa. Además impide que se complete la fosforilación oxidativa.
El daño en la síntesis proteica y la disminución de facilidad del organismo para movilizar las grasas está relacionada aparentemente con la lesión hepática (necrosis y cambios grasos) que presentan los animales afectados de aflatoxicosis en forma precoz.
En el interior de los hepatocitos, las aflatoxinas se unen a macromoléculas tales como DNA, puntos endoplasmáticos para fijación de esteroides, y diversas enzimas.
El primer cambio producido por la aflatoxina B1 es la modificación de la estructura del nucleolo del hepatocito (por lo menos en la rata); la lesión en éste es compatible con la unión observada de las aflatoxinas al DNA nuclear. Entre los cambios ultraestructurales posteriores se incluyen la disgregación y reducción en el número de ribosomas, la proliferación del retículo endoplasmático liso, la pérdida del glucógeno y la degeneración de las mitocondrias.
Las Aflatoxinas también reducen la resistencia orgánica a ciertas enfermedades infecciosas. Está demostrado que alimentos con 0.25-0.50 ppm reducen en pollos la resistencia a algunas bacterias, protozoarios y hongos (Salmonella, coccidios, candidiasis). Hay reducción de la resistencia de los pavos (vacunados) a Pasteurella multocida con un no aparente descenso de sus anticuerpos; pero la exposición a la aflatoxina debe ser simultánea o anterior a la vacunación. Este efecto inmunológico de las aflatoxinas parece ser una depresión humoral no específica y en parte produce una alteración en los anticuerpos tisulares.
En el cobayo las aflatoxinas producen un aumento de las gamma-globulinas y un descenso de las Alfa-2-globulinas, y un descenso de la concentración total de las proteínas. En ratas y cerdos las aflatoxinas inducen al carcinoma hepático y al hepatoma. También hay otras micotoxinas tumorígenas y cancerígenas. Por trabajos experimentales se determinó que las aflatoxinas incrementan los requerimientos de vitamina D en pollos.
Las aflatoxinas atraviesan la barrera placentaria provocando cirrosis hepática; esto se ha comprobado en terneros nacidos de vacas que consumían durante su gestación silo de maíz contaminado. También, las aflatoxinas producen cambios en la coagulación sanguínea por alteraciones de la protrombina, Factor VII y X, y posiblemente también el Factor IX.
Las aflatoxinas ingeridas son transformadas en conjugados hidrosolubles por la flora ruminal del bovino, evitando así su degradación. Estos conjugados son luego hidrolizados a nivel del cuajar, regenerando las toxinas originales, absorbiéndose en el intestino delgado y siendo transportados al hígado por una albúmina plasmática donde se metabolizan.
Los metabolitos pueden ser conjugados hidrosolubles o formas liposolubles y son excretados en algunos casos por la bilis y se produce un ciclo entero-hepático de excreción-absorción de algunos metabolitos.
Las aflatoxinas son eliminadas por la leche, orina y materia fecal. Su eliminación completa puede precisar de varios días, no obstante que estas micotoxinas no se almacenan en ningún tejido en particular.
Signología Clínica
Aguda: puede sobrevenir la muerte sin signos clínicos después de una situación de estrés (partos, viajes, etc.). Otras veces se presenta anafagia, depresión, ataxia, disnea, anemia, epistasis y melena. Ocasionalmente, se pueden presentar convulsiones. Esto se ha visto en terneros donde el cuadro clínico nervioso se presentó con ceguera, ambulación en círculos, caídas frecuentes, contracturas espasmódicas de las orejas y odontoforesis. En vacas se produjo aborto.
Subaguda: estos animales presentan ictericia, hipoprotrombinemia, hematomas (principalmente subserosos y subcutáneos), enteritis hemorrágicas con prolapso rectal y ascitis. Puede sobrevenir fotosensibilización secundaria. La fotosensibilización en bovinos puede llegar a dominar el cuadro signológico con alteración en ojos, ollares y punta de la lengua.
Crónica: esta forma posiblemente es la que más importancia tiene en la economía de los animales de granja. El comienzo de la aflatoxicosis crónica es insidiosa. Puede haber reducción del consumo de alimentos, disminución de la producción láctea, pelo áspero, anemia, abdomen abultado, ictericia leve y eventualmente depresión y anafagia.
En este estado de la enfermedad es muy difícil su diagnóstico. Animales con dietas deficientes en proteínas pueden ser más severamente afectados. Alimentación continuada con bajos niveles de aflatoxinas pueden causar desarrollo de hepatomas benignos, carcinoma de conductos biliares y carcinoma hepatocelular.
Otros signos de aflatoxicosis crónica es la susceptibilidad aumentada a varias enfermedades infecciosas. La aflatoxina M se elimina por la leche y puede provocar la enfermedad en los terneros lactantes. Esto también representa un peligro para la salud pública, pues se han detectado concentraciones en leche de 0.33 mg/L. También se han observado lesiones características de cirrosis hepática en terneros recién nacidos y se debe al paso de la toxina a través de la placenta. En cerdos la forma crónica produce menor conversión alimenticia. Los signos en esta especie son bastantes indefinidos. Puede haber diarrea, ictericia, ascitis y depresión inmunitaria. Los perros son muy sensibles a las aflatoxinas y el hígado es el órgano más atacado. La toxicosis crónica produce disminución del apetito y heces blandas. A medida que avanza la enfermedad hay evidencias de insuficiencia hepática.
Las ovejas son muy resistentes a las aflatoxinas y necesitan recibir 2 ppm durante años para desarrollar carcinomas y tumores nasales. Pollos y particularmente pollitos pueden intoxicarse recibiendo 1-1.5 ppm de aflatoxinas B1. Los efectos en pollos son similares a los ocurridos en mamíferos con fibrosis hepática y proliferación de conductos biliares. También en las aves pueden aumentar notablemente el tiempo de protrombina y el tiempo de coagulación.
También hemos visto en casos de campo referido al ganado porcino dos brotes muy significativos:
- Grano de maíz partido, severamente contaminado por Aspergillus fumigatus fue ingerido por 6 cerdas en engorde (>150 kg.p.v.). La muerte ocurrió en menos de 12 horas postingestión de todas ellas con clara signología respiratoria (disnea mixta, de tipo inspiratoria y espiratoria; arrojamiento sero-espumoso por nariz; decúbito lateral abandonado y permanente). A la necropsia se observaba un evidente edema intersticial pulmonar con leve enfisema alveolar (trastorno también descripto en bovinos).
- Malta de cervecería contaminada con Aspergillus clavatus fue ofrecida para su ingestión a vacas lecheras, las que rechazaron el alimento. Por esta razón fue ofrecida a una piara en engorde (>80 kg.p.v.). Luego de 24 horas postingestión los cerdos demostraron una signología muy llamativa: caminar en círculos, parestesia en forma de prurito idiopático, paresia del tren posterior, caídas, hiperestesia al tacto, polaquiuria, anafagia, constipación y muerte brusca.
A la necropsia se constató degeneración grasa de hígado e inflamación de las mucosas gástricas y del intestino delgado (trastornos también descriptos en bovinos por este hongo).
Los hongos del género Aspergillus son capaces de formar, también, micotoxinas tremorgénicas, por ejemplo, A. clavatus: Cytochalisin E, Trytoquivaline, Tryptoquivalone, Nortryptoquivaline, deoxitrytoquivaline, deoxinortryptoquivaline, nortrytoquivalone, deoxinortryptoquivalone, Patulina, y A. flavus: aflatrem y aflavinina.
Pruebas complementarias de diagnóstico
Los animales afectados están anémicos y tienen bajos valores de proteínas séricas. Hay aumento de la transaminasa glutámico oxalacética, fosfatasa alcalina, láctico deshidrogenasa, deshidrogenasa glutámica, gamma-glutamil transpeptidasa, elevación del índice ictérico, descenso del tiempo de excreción de la bromosulftaleína, elevación de bilirrubina directa e indirecta, disminución de la deshidrogenasa isocítrica. Todo ésto evidencia enfermedad aguda o crónica del hígado.
En bovinos afectados se han observado alteraciones urinarias como proteinuria, cetonuria, glucosuria y hematuria. Así también anemia microcítica y relativa neutrofilia (30-40%).
Lesiones
Los cambios patológicos incluyen ictericia, petequias y equimosis difusas, gastroenteritis hemorrágica o catarral, edema de mesenterio. También se observan hemorragias subcutáneas y subserosas.
Hígado: macroscópicamente se observa necrosis hemorrágica focal y cambios grasos. En la forma aguda hay hepatomegalia. En la crónica, cirrosis con hígado pálido y duro, ascitis, hidrotórax y edema de la pared de la vesícula biliar.
Las alteraciones microscópicas están centradas en el hígado: Necrosis hemorrágica hepática. Cambios grasos son comunes en casos agudos. Hiperplasia de los conductos biliares con mínima necrosis de hepatocitos es característica en la subaguda o crónica (cuadro muy semejante al producido por alcaloides pirrolizidínicos).
Una lesión constante para el caso de la aflatoxina B1 es la proliferación de los pequeños conductillos biliares hacia la periferia del lobulillo hepático. En casos prolongados hay extensas fibrosis interlobular y esto puede progresar hasta cirrosis.
Los riñones de los bovinos afectados de aflatoxicosis son amarillentos, con su grasa perirrenal muy blanda (degeneración nutricional de la grasa). En los casos de aflatoxicosis equina comunicados (S. Angsubhakorn et al.,1981) se menciona cambios degenerativos difusos en las fibras miocárdicas y malacia focal en hemisferios cerebrales; también aumento del colesterol plasmático.
Diagnóstico
Una historia de contaminación por hongos de los alimentos puede ser una valiosa ayuda. Muchas veces bajos niveles de contaminación micótica no son observados. En el caso de la aflatoxina M, si la ingestión es reciente se la puede detectar en orina y leche.
Bioanálisis del alimentos con patitos o análisis químicos de los mismos se utilizan para determinar la presencia de aflatoxinas.
La presentación de fluorescencia azul o verde-azulado del alimento bajo luz ultravioleta es presuntivo pero no confirmatorio de aflatoxinas.
Diagnóstico diferencial
Seneciosis: tener en cuenta historia clínica.
Intoxicación por Cu: hemoglobinuria y hematuria.
Leptospirosis: hemoglobinuria.
Dicumarina: Signos y lesiones hemorragíparas más intensas.
Salmonelosis aguda en terneros: cultivos a partir de bilis.
Síndrome por muerte brusca: lesiones específicas.
Tratamiento
No hay tratamiento específico. Se deben administrar dietas bajas en grasas y ricas en proteínas. Agentes lipotrópicos. Evitar el estrés.
Según trabajos experimentales en cabras pretratadas con cisteína, metionina y tiosulfato de sodio (solos o combinados) resistieron bastante bien las descargas de aflatoxinas. Según trabajos experimentales en conejos, la administración de oxitetraciclina en dieta con aflatoxinas tendría una acción hepatoprotectora a través de un mecanismo de competencia.
Hay técnicas comerciales para detoxicar los granos contaminados a través de su tratamiento con amoníaco.
ZEARALENONA (Vulvovaginitis porcina)
La toxina producida por Fusarium graminearum, roseum y otros, es denominada Zearalenona o F-2, de actividad estrogénica, causando en cerdas y otras especies, aumento de la actividad y del peso uterino. Al actuar sobre la glucosa de los granos determina la formación de una beta lactona del ácido resorcílico, con marcada afinidad para los receptores celulares estrogénicos (igual hecho ocurre con D.D.T., H.P.T.E., clordane, etc.). Entonces se puede afirmar que actúa con una clara afinidad estrogénica por su comportamiento físico-químico, pero no biológico. En las cerdas produce una enfermedad conocida como vulvo vaginitis porcina.
Este hongo puede crecer en granos almacenados durante largo tiempo, principalmente en el maíz. También hay casos comunicados con granos de avena, sorgo, cebada y trigo. Este hongo también se desarrolla en la hojarasca.
En reiteradas oportunidades se ha constatado su presencia, aunque en proporciones vestigiales, en fardos y rollos de alfalfa. Para la producción de toxina se necesita humedad en el grano superior al 25%, un período inicial de temperatura elevada, seguido por una temperatura baja constante o intermitente.
Patogenia
Es conocida que la actividad de las hormonas esteroideas es medida por la unión no covalente de éstas al receptor específico que poseen las células en su interior. Esta unión (zearelenona + receptor) es transportada a los núcleos celulares en donde interactúan con receptores reservados para la cromatina e inducir la transcripción selectiva del ARN. Esta hipótesis es la base para las demás interpretaciones de la acción de la zearalenona. La unión de la zearalenona a los receptores específicos de estrógenos, está relacionado a la estructura química de éstos.
Esta unión permite la formación de derivados (6cetonas y 6' hidroxil) que compiten con los receptores del 17 betaestradiol; en otras palabras, existe una inhibición competitiva entre la zearalenona y el 17-betaestradiol por los receptores específicos, estos receptores se hallan localizados en los núcleos de las células uterinas y hepáticas. Esto determina una acción mimética de la micotoxina con respecto a los estrógenos dentro del organismo animal.
Signología clínica
Afecta más frecuentemente al ganado porcino, particularmente a hembras de 6 a 7 meses de edad. Los signos se notan luego de 3 a 6 días postingestión del grano contaminado.
En cerdas, el cuadro típico de la vulvovaginitis incluye una clara tumefacción de la vulva, aumento del tamaño de las glándulas mamarias y crecimiento y aumento del tamaño del útero. La lesión básica es la ingurgitación de la mucosa genital. Algunas veces está abierto al cervix y entonces se puede observar la existencia de un exudado catarral por los labios vulvares; metrorragias copiosas.
En muchos casos la vagina sufre un prolapso parcial (>30%) y en algunos también es dable observar prolapso de recto (> 10%). Esta especie es particularmente susceptible al prolapso de este último órgano por la falta de tejido de sostén adecuado para el mismo en la región pélvica. Algunas veces se manifiesta con estros persistentes.
En cerdas preñadas puede ocurrir la reabsorción de los fetos y entrada ulterior en celo. Pueden llegar a parir una lechigada escasa pero normal o bien con algunos lechones muertos; otras veces el número de animales paridos es normal pero todos muertos; en otros casos existen malformaciones fetales, «patas abiertas», paresia de los miembros posteriores; alta mortalidad neonatal.
Algunas veces la tasa de mortalidad puede ser elevada debida a cistitis secundaria, síndrome urémico y septicemia. Esta micotoxina se elimina por la leche siendo capaz de producir fenómenos de feminización en lechones machos (con cambios degenerativos en los tubos seminíferos) e hiperestrogenismo en lechones hembras (igual fenómeno es descrito en vacas y ovejas lactantes).
En cerdos machos se puede observar aumento del tamaño del prepucio e incremento de la irrigación de los pezones y las glándulas mamarias primitivas.
En vaquillonas alimentadas con altas cantidades de esta micotoxina se presenta pérdida de peso, exudado vaginal, ninfomanía, hipertrofia uterina con hiperplasia endometrial, desarrollo mamario exuberante, falta de concepción, muertes embrionarias y abortos.
Lesiones
Las lesiones están confinadas al aparato reproductor. Edema e hiperplasia del útero con el endometrio engrosado y atrofia de ovario. Hay hiperplasia de los conductos de la glándula mamaria. También hay metaplasia escamosa del cérvix.
Pruebas complementarias de diagnóstico
Se puede utilizar bioanálisis (alimentación en ratas) y método químico para detectar la zearalenona F-2 en alimentos.
Diagnóstico diferencial
Fitoestrógenos (Flavonas o isoflavonas) naturales. Plantas atacadas por hongos o virus forman más fito-estrógenos.
Tratamiento
Supresión de la ingesta. Sintomático.
TRICHOTECENOS
Los trichotecenos son toxinas producidas por muchas especies de Fusarium especialmente Fusarium tricintum, siendo la más conocida de ellas la toxina T-2. Esta micotoxina ha sido aislada de granos de maíz, trigo, cebada, arroz, avena y subproductos de ellos, pastos en pie y heno.
Otras micotoxinas reconocidas son:
- DON (desoxinivalenol o vomitoxina) en trigo, maíz, cebada, centeno y sub productos de ellos. También en el arroz, papa y diversos alimentos.
- NIV (nivalenol) junto con la DON en trigo, cebada, centeno, avena, arroz y varios subproductos derivados.
- DAS (diacetoxiescirpenol) en maíz, trigo, cebada, avena, mijo, arroz y subproductos de ellos.
Dichas toxinas son estables por largo tiempo en almacenamiento, no destruyéndose por los procedimientos normales de cocción.
Estos son hongos muy comunes en los granos y pastos, que bajo determinadas condiciones elaboran sus toxinas. Así muchos trichotecenos son producidos a temperatura altas o bajas; Fusaritoxina T-2 puede ser producida a 8-15ºC y en algunos casos se puede producir a temperatura bajo OºC.
El crecimiento miceliar óptimo se tiene entre 20 a 24ºC para F. moniliforme y entre 25 a 30ºC para F. solani.
Para incrementar la producción al máximo de sus micotoxinas es necesario oscuridad total. El grado de esporulación máxima se realiza a los 8ºC.
El Fusarium es un contaminante común de pastos en pie y almacenados. El trichoteceno T-2 o fusariotoxina T-2 causa toxicosis en aves, bovinos y porcinos. Varios géneros de hongos imperfectos son productores de estas micotoxinas; entre ellos figuran los géneros Trichoderma, Trichotecium, Fusarium, Stachibotrys, Gliocadium, Myrothecium, Nigrospora, Epicoccum, Alternaria, Penicillium, Caphalos porium y Calonectria.
La DL 50 en porcinos y ratas de T-2 es aproximadamente 4 mg/kg. Dietas con niveles de 16 ppm de T-2 causa retardo del crecimiento en pollos parrilleros y producción de lesiones en cavidad oral con aumento del tiempo de protrombina. Ratas albinas son severamente afectadas con dietas de 5-15 ppm.
Vacas lecheras bajo alimentación de campo con pastos que contienen 2 ppm de T-2 sufren toxicosis subaguda o crónica con un 20% de muertes. Los bovinos son los más sensibles a la micotoxina T-2 y dosis de 0.1 mg/kg son letales después de 65 días. Aunque no son completos los datos de esta micotoxicosis, en su forma crónica se ha visto que no tienen efectos carcinógenos en animales de experimentación.
También son micotoxinas producidas por Fusarium el Factor Emético (deoxynivalenol) y el diacetoxycirpenol. (D.A.S.). La primera provoca vómitos y la segunda diarrea, dermatonecrosis y hemorragias.
Patogenia
Su acción tóxica es producida por varios mecanismos:
a) Tienen acción sobre la síntesis proteica, actuando en forma directa sobre la fase de transcripción y translación. Esta inhibición de la síntesis proteica se produce a través de una potente acción inhibitoria de la peptil-transferasa que impide la incorporación de los aminoácidos al comienzo de la cadena polipeptídica.
b) Acción citotóxica ejerciéndola, principal-mente, en aquellos tejidos de rápido crecimiento y con un muy rápido recambio, como por ejemplo médula ósea, epitelio intestinal, gónadas y tejidos linfático.
La toxina T-2 actúa sobre las células linfoideas a nivel del ADN (ésto ocurre en menor proporción en las células hepáticas puesto que ellas tienen en su interior la glutation-transferasa, la cual es capaz de catalizar la conjugación de los trichotecenos); por otra parte, la proliferación de lisosomas aumenta la actividad de las enzimas hidrolíticas (ADNasas) en las células linfoides, aumentándose la sensibilidad de éstas a la micotoxina, por lo tanto actúan como agentes inmunosupresores.
c) Son teratógenas y embriotóxicas y en los animales de laboratorio, inmunosupresoras. Los efectos patológicos son similares en muchas especies.
Hay alteración dérmica con inflamación y necrosis. Comúnmente hay alteraciones
digestivas como vómitos, ulceración, necrosis oral y diarrea sanguinolenta. Hay también un efecto radiomético con granulacitopenia, anemia y descenso de las proteínas inmunitarias.
Signología clínica
Los signos son variables pero predominan sobre el tracto digestivo, el sistema vascular y de coagulación.
En la forma aguda presentan gran depresión e intensos vómitos. Esto puede progresar a diarreas, en muchos casos sanguinolentas. Los efectos necróticos epiteliales de la T-2 son salivación, estomatitis, úlceras y necrosis de boca y esófago.
La elevación del tiempo de protrombina se traduce con hemorragias como hematemesis, melenas, hematomas subcutáneos e intraarticulares. Fiebre, anemia e incremento de las enfermedades infecciosas son el resultado de los efectos radiomiméticos de la T-2.
Lesiones
Las lesiones del contacto directo de la toxina con la boca y el esófago son inflamación, exudación y necrosis. Se forman úlceras orales, sobre todo en las aves. Hay también gastritis, enteritis, contenido intestinal sanguinolento y hemorragias de la subserosa intestinal. Puede haber hemorragias en varios órganos incluidos pulmón, corazón, vejiga urinaria, riñones, subcutáneo y articulaciones.
Pruebas complementarias de diagnóstico
- Tiempo de protrombina aumentado.
- Aumento del ácido láctico en sangre.
- Disminución del tiempo de excreción de la bromo sulftaleína.
- Aumento de la láctico deshidrogenasa.
- Aumento de triglicéridos totales y colesterolemia.
- Aumento de actividad de aspartico
- Aminotransferasa, Alanina-amino-transferasa.
- Aumento de fosfatasa-alcalina.
El diagnóstico exacto se hace por cromatografía.
El bioanálisis también es muy sensible con pequeñas cantidades de toxina T-2 (0.05 ug). Así el Test para los trichotecenos consiste en lo siguiente.
- Se hace la extracción química de la toxina sobre el alimento sospechoso.
- Se depila el dorso de un conejo, cobayo o rata.
- Con una micropipeta se depositan 10 ug de la muestra extraída en un lugar del dorso previamente marcado.
Esta operación se debe repetir a las 24 hs.
- Se realiza la lectura 5 días después. Si hay trichotecenos se llega a la descamación, eritema o necrosis de la piel. Hay moléculas vegetales que pueden enrojecer la piel; en general estas inflamaciones son pasajeras. La inyección intradérmica puede dar falsos positivos.
Diagnóstico diferencial
Bovinos:
-Dicamarol: signología y lesiones hemorra-gíparas más intensas.
- Diarrea viral bovina: Típicas lesiones erosivas circunscriptas a aparato digestivo.
- Intoxicación por helechos (Pteridium aquilinun): restringida a la región geográfica de éstos.
- Salmonellosis aguda en terneros.
Porcinos:
-Dicumarol y anticoagulantes similares.
- Salmonellosis aguda.
Lesiones orales en pollos:
- Candidiasis
- New Castle
- Viruela
Tratamiento
Sintomático. Transfusiones y vitamina K. Antibióticos.
OCHRATOXINA A - CITRININA Y ÁCIDO OXÁLICO
La ochratoxina A y citrinina son producidas por Aspergilus ochraceus y Penicillium viridicatum respectivamente. Crecen en granos y alimentos comerciales y la Ochratoxina A también puede estar en leguminosas.
Entre los substratos más corrientemente afectados, podemos citar: maíz, cebada, centeno, trigo, avena, arroz, soja, legumbres y productos elaborados con estas materias primas. En nuestra región ha sido detectada en rollos y fardos de alfalfa en cantidades vestigiales o importantes (hasta 1.000 microgramos por kg de alimento problema).
La Ocratoxina A a concentraciones moderadas es nefrotóxica, pero a altas concentraciones, es también, hepatóxica. La primera afecta especialmente a porcinos y ratas. Muchos casos de estas nefrotoxinas fueron registrados en Dinamarca, Suecia, USA e Irlanda.
La citrinina afecta a porcinos, equinos y ovinos. También se han descripto casos en bovinos con ambas toxinas y en pollos. El hongo Fusarium niger produce ácido oxálico en henos y granos afectando básicamente a porcinos.
Patogenia
La ocratoxina A es capaz de actuar mediante:
- Alteración de las actividades fundamentales de las mitocondrias, particularmente del tubo contorneado proximal del riñón, lo cual es capaz de desencadenar cambios ultraestructurales y fisiopatológicos, desembocando en severas y mortales nefropatías.
- Inhibición de la glucógenolisis hepática lo cual acarrea acumulación de glucógeno. También a través de su acción sobre las mitocondrias del hepatocito.
- Inhibición de la respuesta inmune humoral y celular.
- Es teratogénica y mutagénica y, posiblemente embriotóxica.
En forma análoga a las aflatoxinas, la ocratoxina A tiene un efecto inhibitorio sobre la síntesis proteica, actuando en la fase de translación. Este se puede ver en las células renales principalmente, mientras que en caso de las aflatoxinas se observa a nivel hepático.
La ocratoxina A actúa sobre la enzima fosfoenolpiruvatocarboxiquinasa a nivel renal, degradando el mRNA codificado; de igual manera la ocratoxina A inhibe en forma competitiva a la fenil-alanil-tRNA sintetitasa, impidiendo la formación de la fenil-alanil-tRNA (compuesto vital para todos los organismos vivientes en la síntesis proteica a nivel celular).
Sobre el metabolismo de los hidratos de carbono la ocratoxina A se tiene:
- Efecto inhibidor en la formación de glucógeno hepático.
- Inhibición a nivel renal de la fosfoenol-piruvatocarboxiquinasa, produciendo una disminución de la gluconeogénesis.
Sobre el metabolismo de los lípidos su acción es semejante a las aflatoxinas. También actúa en el estado III de la cadena respiratoria (fosforilación), mediante un mecanismo competitivo de la ocratoxina A por la captación del ácido dicarbónico, para el funcionamiento mitocondrial.
Es bien sabido que la ocratoxina A es nefrotóxica y muy poco hepatotóxica puesto que el riñón posee un mayor número de linfocitos que el hígado, siendo éstos considerados más sensibles a la micotoxina en relación a la inhibición de la síntesis proteica. Además el hepatocito tiene la capacidad de metabolizar a la Ocratoxina A, convirtiéndola en compuestos menos tóxicos.
Signología clínica
Altos niveles de ochratoxina A y citrinina son primariamente nefrotóxicas. Clínicamente cursa con diarrea, polidipsia y poliurea para terminar con anuria.
La ochratoxina A es eliminada por heces y orina. En esta última, las concentraciones son máximas a las 6-8 hs. después de la ingesta y descienden luego de 72 hs. También podemos agregar que el hongo Fusarium niger produce ácido oxálico en fardos y granos produciendo en porcinos signos semejantes a los descritos.
Lesiones
Riñones amarillos-grisáceos, con o sin edema perrirenal. Puede ocurrir descamación de las células tubulares que cursa con proteinuria.
Los cambios incluyen rápida degeneración hialina, principalmente en los túbulos contorneados proximales. Puede llegar a presentarse un edema perirrenal.
También hay deshidratación, edema generalizado, enteritis, necrosis y atrofia del epitelio tubular, fibrosis intersticial, esclerosis y fibrosis glomerular. Hay inhibición de la glucógenolisis hepática y también puede llegar a necrosis y degeneración del mismo órgano. Algunas limitadas experiencias indican que la ochratoxina A puede ser embriotóxica, provocando abortos en vacas lecheras.
Pruebas complementarias de diagnóstico
- Someter a cromatografía el alimento sospechoso.
- La uremia se halla elevada en los enfermos (normal 20-40 mgr/100ml).
- También está elevada la creatinina (normal 1-2 mgr/100 ml).
Diagnóstico diferencial
- Intoxicación por Yuyo colorado (Amaranthus quitensis).
- Vegetales que contienen oxalatos.
- Bloqueos urinarios por otras causas.
ESLAFRAMINA
La Eslaframina o Factor de Salivación es una toxina producida por el hongo Rhizotocnia leguminícola, que crece en los tallos y hojas del trébol, sobre todo el rojo (Trifolium pratense), en pie y henificado, en forma de manchitas negras. El mismo necesita para su desarrollo humedad ambiente elevada y temperatura entre 25-29 ºC.
Su principio tóxico, la eslaframina, es un indol-alcaloide, que es convertible por la acción enzimática de las células hepáticas en un compuesto activo, similar farmacoló-gicamente a la acetilcolina. Esta molécula activa (indol sustituido) ejerce efectos histaminérgicos:
a) directos, o
b) liberador de histamina.
Su singular signología clínica está determinada por la existencia de receptores colinérgicos en las glándulas salivales y los músculos lisos del rumen del bovino.
Signología Clínica
Ha sido descrita en bovinos. Presentan salivación abundante como primer signo, sobreviene también lagrimeo, anafagia, diarrea, poliuria; pueden producirse tumefacciones de párpados y otras zonas de la cara. Produce espasmo de la musculatura lisa del esófago y, consecuentemente, timpanismo gaseoso, no grave.
Los signos aparecen 5 ó 6 horas después de ingerido el alimento problema, desapareciendo unas 24 h más tarde.
En cobayos los signos aparecen rápidamente, 30 minutos después de administrada la toxina; posiblemente su sistema enzimático hepático la active más rápidamente. En el leucograma se encontró un aumento marcado de eosinófilos (15-30%).
Lesiones
No han sido descritas.
Diagnóstico
- Es fundamental observar las manchitas negras en las hojas y/o tallos del trébol.
- Aislamiento del hongo.
- El cobayo es muy sensible a la eslaframina por lo tanto la reproducción experimental en él es importante.
Diagnóstico diferencial
- Intoxicación por compuesto órganos-fosforados:signos parasimpaticomiméticos.
- Aftosa: vesículas en boca, ubre y espacio interdigital.
- BO-CO-PA: lesiones gangrenosas en extremidades.
Tratamiento
Atropina y antihistamínicos. Aplicación farmacológica: se la utiliza actualmente en los novillos de feed-lot en dosis de 10, 15 ó 20 microgramos/kg.p.v., en dietas con más del 60% de concentrados como un estimulante de salivación.
Nota: Trifolium sp. nos puede ocasionar:
- babeo (eslaframina)
- Hiperestrogenismo (fitoestrógenos).
- Meteorismo, particularmente espumoso.
- Ácido cianihídrico en bajas proporciones.
CLAVICEPS PASPALIS
Concepto
Esta intoxicación produce un síndrome nervioso denominado en la Argentina Tembleque o Chucho, caracterizado por producir trastornos de la locomoción y mioclonías.
Etiología
El Claviceps paspalis es un hongo que parasita los vegetales del género Paspalum, entre ellos el Paspalum notatum (Gramillón, Gramilla dulce o Pasto miel), Paspalum dilatatum (Pasto de Dallas en EEUU) y Paspalum distichum (sp. africana).
La esclerotia de Cl. paspalis es mucho más pequeña que la del Cl. purpurea; el tamaño es semejante a la semilla del Pasto miel (2-4 mm), es esférico, duro y oscuro. Tiene también al igual que el Cl. purpurea un ciclo asexual durante el cual segrega su miel y los insectos favorecen la dispersión a otras flores. Tiene también un ciclo sexual dentro de la esclerotia. Esta pasa el invierno en el suelo esperando la floración de Paspalum.
El ciclo es el siguiente: La esclerotia pasa todo el invierno en la superficie de la tierra y a fines de noviembre o principio de diciembre germina en el suelo y fructifica dando peritecios que encierran esporos sexuados (ascosporos); éstos son llevados por el viento o insectos (escarabajos) hasta las flores. Los esporos germinan en las flores dando un micelio filamentoso que fructifica a su vez en esporos asexuados (conidios), se forma la miel y los insectos diseminan los conidios.
De los conidios germina un micelio filamentoso que en determinados momentos forman los órganos de resistencia o esclerotios. Hay veces que la esclerotia está contaminada en su superficie con hongos del género Fusarium dándole los mismos un color rosado naranja. El Claviceps paspalis contiene como agente tóxico un alcaloide, el LSD y derivados químicos de éste.
A estas micotoxinas tremorgénicas se las ha denominado: paspalis y paspalitrenos. Las altas temperaturas y humedad favorecen el desarrollo del hongo. El LSD (alfa oxietilamida) lo contiene la esclerotia y en mayor cantidad, cuando está el hongo en estado de micelio con toda su miel.
Especies afectadas
El bovino es la especie más afectada. Más resistentes pero también sensibles son los ovinos y equinos.
Patogenia
Las manifestaciones clínicas dependen de los índoles y de los derivados del LSD, los cuales estimulan el S.N.C. al interferir la función neurotransmisora en el encéfalo, particularmente cerebelo.
La serotonina es el transmisor más afectado por su semejanza en la estructura química con los estimulantes tipo indol, aunque otras aminas (dopamina, norepinefrina) pueden también verse afectadas en el desequilibrio central. Algunas de estas micotoxinas disminuyen selectivamente los niveles encefálicos del GABA.
Signología Clínica
El tiempo de ingestión para la presentación clínica depende de la carga de Claviceps paspalis que posee el Paspalum, pero por lo general tardan 10-15 días en aparecer los signos. La morbilidad es de un 5-35%. La mortalidad es ínfima y sólo se produce por accidentes secundarios debido a la signología nerviosa (fracturas, caídas en bebederos, timpanismo gaseoso por decúbitos laterales prolongados, etc).
Los signos comienzan con movimientos pendulares de la cabeza, leves temblores de los músculos del cuello, tronco y extremidades. Acercándose a los animales se observa hiperexcitabilidad al ruido (hiperacusia) y movimiento, pero no al contacto, caracterizada por orejas erguidas y aumento de los temblores. Incluso cuando la signología es muy leve los temblores sólo aparecen al excitar al animal.
Animales más afectados presentan marcha rígida, con sus miembros separados y al excitarlos corren en forma característica, cayendo a raíz de la rigidez de sus miembros, quedando los posteriores extendidos hacia atrás. Hay entonces astasia y ataxia cerebelosa con dismetría, hipermetría, etc.. En la marcha los miembros anteriores se elevan más de lo normal manteniéndose en extensión haciendo el paso de ganso. En el decúbito los animales presentan convulsiones tónicas con sus miembros rígidos y con movimientos de pedaleo y natatorios. Dejando tranquilo a los animales a los pocos minutos se levantan persistiendo los temblores.
Algunas veces aparecen leves períodos diarreicos, salivación, nistagmus y lagrimeo en el transcurso de la enfermedad. El apetito no se modifica.
Lesiones
Lo único más o menos constante es el aumento de la cantidad del líquido cefalo-rraquídeo.
Diagnóstico diferencial
- Tétano: hipertonicidad muscular continua. Signos más graves.
- Tetania hipomagnesémica: convulsiones tónico-clónices graves.
- Intoxicación por compuestos organofosfo rados: signos parasimpaticomiméticos.
- Tembladeras por otras micotoxinas.
Tratamiento
En casos muy severos se pueden utilizar los derivados de las promacinas como tranquilizantes, pero a la sola retirada de los animales del pasto problema, sobreviene la recuperación en pocos días.
CLAVICEPS PURPUREA (Cornezuelo del centeno). Ergotismo
Concepto
Es una enfermedad que puede manifestarse con gangrena seca de las extremidades y estimulación a nivel central del sistema nervioso.
Etiología
El ergotismo como enfermedad del hombre y de los animales es conocido desde hace siglos. Es producido por un hongo, Claviceps purpurea, que contiene alcaloides causantes de la intoxicación.
Dichos alcaloides se denominan ergoalcaloides por prevenir del ergot, nombre común con que se denominan las esclerotias del hongo. Los ergoalcaloides tienen como características una estructura tetracíclica llamada ergolina, derivada del indol. De esta estructura general provienen los dos grandes grupos de ergoalcaloides: los derivados del LSD y los derivados de la clavina.
Es de tener en cuenta que la actividad biológica está relacionada con la presencia del LSD en la molécula del ergoalcaloide, aunque éste no se encuentre nunca libre en grandes cantidades. Los tres grupos de alcaloides se denominan: ergotoxina, ergotamina y ergonovina.
Los derivados del LSD pueden sufrir un cambio en la ubicación del tomo de H del Carbono 8 de la molécula por diversas causas, cambio que recibe el nombre de epimerización. Es decir que normalmente el átomo de H del C.8 que se ubica hacia atrás del plano de la molécula, pasaría adelante, produciendo el llamado epímero de la molécula que se denomina con el sufijo imina en vez de ina. Ej: Ergotamina->Epimerización->Ergotaminina.La epimerización produce la pérdida casi total de la actividad biológica de estos alcaloides.
La mayor actividad del Claviceps purpurea se debe a los derivados del LSD.
Cereales que parasita
Centeno, de allí su denominación cornezuelo de centeno, pero también puede parasitar trigo, avena, cebada, moha, pasto ovillo, Ray grass, mijo. La enfermedad no solo se da en pastoreo sino en animales alimentados con raciones compuestas por granos contaminados.
Especies susceptibles
La enfermedad se puede presentar en cualquier especie, pero es en bovinos donde aparece con más frecuencia.
Ciclo de Claviceps purpurea
En la época de floración de las gramíneas susceptibles germinan las esclerotias que han permanecido durante el invierno en el suelo. Esta germinación produce estromas oscuros en las cuales se produce el ciclo sexual del hongo. Allí se forman peritecios que contienen ascos en forma de cilindros alargados que contienen ascosporas, las cuales son expulsadas al exterior y pueden llegar a las flores de los huéspedes donde invaden el ovario, destruyendo sus tejidos. Estos son reemplazados por un micelio que produce una secreción siruposa mezclada con conidias originadas también en el micelio.
Los insectos son atraídos por esta secreción y se transforman en agentes de dispersión a otras flores sanas. El micelio continúa su desarrollo transformándose en un esclerotio duro de color rosado o purpúrea oscuro, de forma curvada que puede medir de 0.5 hasta 3 cm de longitud y que ocupa el lugar donde se hubiera desarrollado el grano.
Patogenia
Estos alcaloides ingeridos en grandes cantidades son estimulantes del sistema nervioso central. Son las ergotoxinas las que predominan en esta acción. Absorbido en pequeñas cantidades durante un período prudencial, sobre todo la ergotamina, produce vasoconstricción de las arteriolas y lesión del endotelio capilar con la consecuencia de gangrena seca.
La ergonovina es la causante del efecto oxitócico de los alcaloides, pero en la práctica este efecto se ve poco. Posiblemente se deba a que la ergonovina se produce en poca cantidad o se epimeriza fácilmente.
Signología Clínica
- Ergotismo agudo o convulsivo: afecta principalmente a carnívoros, caballos, ovejas y en menor frecuencia a bovinos.
En ovinos se han observado que los animales inician violentas corridas, muy rápidas, dando saltos hasta caer extenuados, con los miembros rígidos y con opistótono.
En bovinos comienza con temblores musculares, vértigo, incoordinación, envaramiento e hipersensibilidad, seguido de períodos de depresión.
Los signos aparecen 24 h después de ingerir el tóxico.
- Ergotismo crónico o gangrenoso:
En bovinos: se manifiesta este síndrome 10-30 días después de comenzado a ingerir el tóxico. La acción de estos alcaloides afecta principalmente las extremidades de cola, oreja y miembros, especialmente los posteriores. En éstas hay aumento leve de la temperatura, y alopecia. Lo primero en llamar la atención son las rengueras. Al principio hay inflamación con enrojecimiento y tumefacción de las partes afectadas luego sobreviene frialdad, sequedad, insensibilidad y color azulado de la zona que luego se esfacela (necrosis por gangrena seca). La lesión por lo general nunca supera la línea metatarsiana o metacarpiana.
En cerdos: se produce necrosis de la punta de las orejas y cola pero lo más interesante y grave es la hipogalactia en cerdas lactantes, con muertes secundaria de cerditos lactantes, nacimiento de crías pequeñas y/o muertas; y gran mortalidad neonatal. Si algunos de los lechones sobreviven, sufren posteriormente gangrena de los bordes de los pabellones auriculares y punta de la cola.
En ovinos además de las lesiones en miembros, cola y orejas se producen úlceras y necrosis en lengua, faringe, rumen, abomaso e intestino delgado.
Lesiones
Las ya descritas.
Diagnóstico diferencial
- La forma aguda es difícil diferenciarla de otros episodios convulsivos; debemos confirmar la presencia de la esclerotia para hacer el diagnóstico.
- En la forma crónica puede darse algo semejante en las zonas frías o de nieve (gangrena por congelación).
- Pie de Festuca: relacionada con la ingesta de festuca.
- BO-CO-PA (Enfermedad de los eucaliptos): presencia del hongo Clavaria en bosques de eucaliptos.
- Enfermedad de Deg-Nala: relacionada a la paja de arroz.
- Infecciones podales crónicas: lesiones limitadas a pezuñas y espacio interdigital.
- Laminitis: afección aguda.
- Selenosis crónica: deformaciones exage-radas de pezuñas.
- Leptospirosis y salmonelosis crónicas: ambas pueden llegar a provocar lesiones gangrenosas muy semejantes.
- Fotosensibilización: afecta piel blanca.
Tratamiento
Consiste en retirar los animales de la ingestión del tóxico. La forma aguda cede en 48 h al igual que la crónica siempre y cuando no se haya instalado la gangrena.
FESTUCA ARUNDINACEA (Festuca alta)
La primera referencia con respecto a la toxicidad de la Festuca proviene de Nueva Zelanda en 1949 donde se reprodujo la enfermedad en bovinos y ovinos a lo que se la llamó pie de festuca o renguera de la festuca. En nuestro país es en el INTA de Balcarce en 1972 donde se describieron por primera vez casos de esta intoxicación.
Etiología
Se ha trabajado en la Festuca buscando alcaloides del grupo de los ergoalcaloides pero no se los había detectado en un principio. Se encontró un alcaloide denominado lolina, del grupo pirrolizidínico pero que no tenía acción hepatotóxica como, por ejemplo, los alcaloides del senecio.
Se encontró también otro alcaloide diazofenantrénico denominado perlolina que tiene la particularidad de inhibir la digestibilidad de la celulosa in vitro y, también, in vivo por destrucción de parte de la flora ruminal, factor éste importante si se tiene en cuenta la pérdida de peso que sufren algunas veces los animales que pastan en Festuca. También se encontró en la misma, muchas especies de hongos: Stemphylum, Claviceps purpurea, Fusarium tricintum, Aspergillus terreus y sus toxinas, Acremonium coenophialum y sus toxinas.
Fueron descubiertos posteriormente en la Festuca hongos sistémicos como Balansia epichae y elementos tóxicos denominados tetraenos; Epichoe styplina.
En la actualidad se utiliza la cantidad detectada de ergovalina como una medida de la contaminación endofítica de la semilla de festuca.
Especies afectadas
Bovinos, ovinos y equinos. No se han producidos efectos tóxicos en porcinos que han permanecido largo tiempo en Festuca tóxica para bovinos.
Signología clínica
Después de un período que puede ir de 6-14 días (hubo casos en que se necesitó 6 meses de ingestión) aparecen los mismos signos del ergotismo crónico (Ver Claviceps purpurea). Esta enfermedad llamada pie de Festuca o cojera por Festuca afecta particularmente a la extremidad distal de los 4 miembros, algo por encima de la articulación del menudillo.
Es más frecuente en el bípedo posterior, especialmente el miembro derecho. Puede afectar, también, la punta de la cola y extremo de las orejas.
Histológicamente es posible constatar la reducción de la luz de las arteriolas de pequeño calibre por el aumento en el espesor de la pared del vaso sanguíneo a causa de la hipertrofia muscular de tipo concéntrica, con ulterior reducción de la luz vascular (orejas, punta de la cola, partes distales de los miembros, riñón, etc.) En esta enfermedad es importante la disminución de peso que sufren los animales. Hay un incorrecto aprovechamiento endorrumial de la celulosa (perlolina?), como así también una falta adecuada del aprovechamiento de Cu, lo cual no puede ser mitigado por su mayor ingestión per os.
A condiciones toxicológicas iguales, la enfermedad aparece más fácilmente en invierno. La mortalidad es aproximadamente de un 10% aunque puede ser mayor. La recuperación es rápida si se retiran los animales del tóxico.
Además de este síndrome clásico puede aparecer otro conjunto de signos correspondientes a distermia, caracterizada por una alta temperatura corporal que obliga a los animales a su permanencia en sombras, lagunas y barro.
El pelo es largo (hipertricosis), hirsuto y se presenta bastante erecto (asoleado). Esto es bastante característico. Además, hay disminución notable de peso, de la producción de leche y bajos tenores de prolactina en sangre.
Sialorrea y disnea
Este síndrome es más frecuente en verano. Ocurre una vaso-constricción general que impide la eliminación de calor por piel; esta disipación calórica se agravaría por la erección de pelos (fenómeno posiblemente reflejo por la vasoconstricción).
El organismo respondería a esta primera retención del calor con aumento de la frecuencia respiratoria, aumento de la temperatura corporal y ritmo cardíaco normal o inferior al normal. A excepción del ritmo cardíaco los demás signos son semejantes al estrés calórico. Histopatológicamente se puede constatar la lesión descrita precedentemente, pero en este caso afecta a las arterias de mediano calibre (riñón, piel, pulmón).
Se ha determinado en los animales afectados una gran cantidad de metabolitos DOPAminérgicos y SEROTOminérgicos en los tejidos de la hipófisis; y metabolitos del 5-hidroxi-triptofano en los tejidos de la epífisis (o pineal) relacionando estos cambios detectados en el cerebro con producción animal disminuida y niveles de prolactina en suero sanguíneo disminuidos.
Yeguas preñadas alimentadas con Festuca sufren involución de la glándula mamaria y partos distócicos, muerte perinatal y abortos. Esto debido a que la placenta sufre una alteración en su constitución histológica aumentando notablemente su grosor y resistencia (semejante a cuero) de allí que la misma impide el nacimiento del potrillo por su inelasticidad y dureza. También los partos son incompletos (no largan el potrillo) y cuando los mismo nacen las yeguas no lo suelen tomar. Menores niveles de prolactina en sangre (agalactia). También hay yeguas con incoordinación del tren posterior.
Profilaxis
Dejar pastorear el potrero problema sólo por 1-2 semanas. Luego retirarlos durante unos 10-15 días. Rotación contínua con alta carga animal.
Toques medicamentosos: dosis orales de metoclopramida (antagonista de la dopamina) aumentó los niveles séricos de la prolactina en novillos pastoreando Festuca con infestación micótica endofítica.
Se deduce que procesos dopaminérgicos pueden estar involucrados en la intoxicación por festuca. En cambio, en ovejas afectadas por el síndrome asoleamiento se redujeron sus signos clínicos con cimetidina, un bloqueador de las funciones oxidativas.
Diagnóstico diferencial
- Ergotismo: relacionado con el hongo Claviceps purpurea.
- BO-CO-PA: relacionado con el hongo Clavaria en bosques de eucaliptos.
- Intoxicación crónica por As: grietas y fisuras en piel (actualmente poco frecuente)
- Aftosa: vesículas en boca, pezones y espacios interdigitales.
RAMARIA-FLAVO-BRUNESCENS. MAL DE LOS EUCALIPTOS (BO-CO-PA)
Es una enfermedad gangrenosa que afecta bovinos y ovinos. Fue comunicada en Brasil, Uruguay y Argentina.
La enfermedad es producida por la ingestión de macrohongos del género Clavaria (Ramaria-flavo-brunescens) que crecen en la sombra de los Eucaliptos (mal de los eucaliptos). Se sospecha que los macrohongos Clavaria serían colonizados por microhongos productores de ergotoxinas. El macrohongo tiene forma de coliflor, y puede alcanzar 8-10 cm de alto por 6-8 cm de ancho. Es de color amarillo-ocre. Tiene una vida media de 5-10 días dependiendo de las condiciones climáticas ambientales, cuando envejece se va secando y tomando un color marrón. Según trabajos experimentales la administración diaria de 20 gr/kg de peso de hongos durante 18 días produce la muerte y dosis de 36 gr/kg puede causar muerte con una sola dosis en un bovino adulto.
Signología clínica
Hay estomatitis y sialorrea hasta llegar a disfagia. Las úlceras están en el dorso de la lengua, encías y labios (preferentemente en la comisura). Todas estas lesiones provocan una marcada anorexia y rápida pérdida de peso. También sobrevienen costras en morro y ollares.
Hay conjuntivitis y hasta hemorragias en la cámara anterior y posterior del ojo con ceguera. Pueden llegar a la queratitis.
Se produce necrosis de la punta de la cola con la caída de sus pelos. A los 7-8 días (según la cantidad ingerida) se produce el desprendimiento de cuernos y más tarde de pezuñas lo que va precedido de claudicaciones.
Lesiones
Además de las mencionadas en boca, cola y pezuñas se presentan abomaso congestivo y con úlceras pequeñas. Los pulmones pueden presentarse congestivos de aspecto marmolado y enfisematoso. Los cobayos son interesantes para reproducir la enfermedad ya que ocurren las úlceras en boca.
FUSARIUM MONILIFORME (LEUCOEN- CEFALOMALACIA EQUINA)
Concepto
La ingesta de granos de maíz enmohecido por Fusarium moniliforme (F. verticiloides) provoca en caballos una enfermedad con signos nerviosos denominada leucoencefalomalacia.
Etiología
Bajo adecuada condiciones de temperatura y humedad, crece sobre los granos de maíz (en planta o almacenada). El mismo produce una toxina con acción dañina sobre la sustancia blanca del cerebro. También se describen casos donde junto con las alteraciones nerviosas ocurre daño hepático e ictericia. El bicho taladrador del maíz, con los daños que provoca sobre éste, ayudaría al desarrollo del hongo.
Son los caballos y mulos la especies donde se produce la enfermedad; también son sensibles los conejos.
Signología clínica
Pueden producirse muertes bruscas, pero por lo general va precedida de los siguientes signos: Aparente ceguera, con corridas de los animales en el potrero. Parálisis facial con caída del labio, protusión lingual y, no siempre, parálisis faringea con disfagia.
Algunas veces gran somnoliencia e indiferencia al medio. Otras veces los animales se presentan hipersensibles, realizando rotaciones en círculos, con temblores musculares de los muslos, ataxia y pueden caer en decúbito lateral con movimientos de pedaleo y natatorio. Al último sobreviene depresión.
Se describen algunos casos en que a los signos nerviosos lo acompañan un síndrome hepatotóxico con ictericia, edema subcutáneo y patológicamente cirrosis hepática.
Lesiones
Macroscópicas: hay áreas focales de leucoencefalomalacia que se sitúan frecuentemente en los polos frontales de los hemisferios cerebrales.
Hay cavitaciones de unos pocos cm de diámetro hasta de gran tamaño, con sus bordes irregulares y áreas de reblandecimiento. Numerosas hemorragias rodean a las lesiones de encefalomalacia.
Médula espinal: poliomalacia.
Microscópicas: hay desintegración marcada de la sustancia blanca del cerebro, desapareciendo los elementos tisulares y quedando residuos celulares en las cavitaciones vacías. Estas cavitaciones están rodeadas por edema y hemorragias. Estas mismas lesiones se observan en la sustancias gris medular.
Los vasos sanguíneos vecinos a la lesión tienen infiltraciones perivasculares, consistentes en eosinófilos y células plasmáticas.
Diagnóstico diferencial
- Leucoencefalomalacia con lesión nigropalidal (Cordy) (cerebro-globo pálido-substancia negra). Se presentan en equinos alimentados con Cardo estrellado o abrepuño (Centaura solstitialis).
También hay descritos casos de intoxicaciones por Helechos (Pteridium aquilinum) el que produciría una carencia secundaria de vitamina B1, con su consiguiente encefalomalacia.
- Encefalomielitis equina, forma letárgica.
- Botulismo.
- Rabia paresiante.
Tratamiento
Las lesiones son irreversibles por lo tanto no existe tratamiento específico.
IPOMERONA
Es una toxina producida por Fusarium solani, hongo que parasita las batatas. Afecta a los bovinos.
Dicho hongo produce la transformación de una sustancia de las batatas que termina en ipomerona, sustancia que tiene toxicidad pulmonar produciendo edema pulmonar, membrana hialina, neumonitis, etc.
DICUMARINA. INTOXICACIÓN POR TRÉBOL BLANCO (MELILLOTUS ALBA)
Concepto
Se caracteriza esta intoxicación por producir una alteración en el sistema de coagulación (hemostasia) con la consecuencia de hemorragias generalizadas internas y externas, determinando un síndrome purpúrico.
Etiología
El trébol blanco o dulce (Melillotus alba) y en menor cantidad el trébol amarillo (Melillotus officinalis) poseen como constituyente normal una sustancia denominada cumarina o cumarol. La misma bajo la acción de ciertos hongos que desarrollan por efecto de la humedad se transforma en dicumarina o dicumarol, sustancia con acción anticoagulante y altamente tóxica; tal es así que un derivado de la misma, la warfarina, se utiliza como rodenticida.
Esta transformación de cumarina en dicumarina tiene lugar en el trébol henificado húmedo, ya que esta condición predispone al ataque de mohos de los géneros: Mucor, Penicillium, Fusarium y Aspergillus (todos requieren O2 para el desarrollo); por esta razón se la considera una micotoxina. En el trébol en planta puede producirse una ínfima transformación que no llega a producir alteraciones en el animal. Las diversas variedades del trébol blanco difieren en su contenido en cumarina, así la variedad cumino posee poca y la ártica es muy rica en el mismo.
La frecuencia de esta enfermedad está en aumento en nuestro país debido al auge que ha tenido el trébol en los últimos años, sobre todo en las zonas marginales donde se lo henifica en forma de rollos de gran tamaño lo que favorece el desarrollo fúngico. También es difícil obtener heno bien seco de este vegetal debido a la suculencia de sus hojas y tallos.
Especies susceptibles
La enfermedad se da más frecuentemente en bovinos y dentro de éstos en los jóvenes. Además de ser sensibles, es la especie que más en contacto está con este tipo de forraje. También son sensibles los ovinos, porcinos y conejos (como animales de experimentación). Los equinos son bastante resistentes.
Patogenia
La dicumarina realiza su acción tóxica impidiendo la formación de protrombina o Factor II en el hígado; esta acción se debe a su competencia con la vitamina K la cual interviene en la síntesis de la protrombina. La falta de ésta, hace que no se realice normalmente la coagulación sanguínea, además, se produce una depresión de los factores VII, IX y X, disminuye la capacidad conglomerante de las plaquetas y ocasiona dilatación de los capilares con aumento de su permeabilidad. Todo ésto hace que ante cualquier traumatismo por simple que sea, se produzcan hemorragias que en algunos casos llegan a ser fatales.
Esta micotoxina se elimina por la leche y posee la capacidad de atravesar la placenta. Los terneros recién nacidos provenientes de una madre con una gestación normal adolecen de una hipoprotrombinemia natural y transitoria clínicamente no manifiesta. Esta circunstancia normal es agravada en estos casos particulares de micotoxicosis.
La interferencia en la síntesis de los factores de coagulación resulta de la acumulación de un metabolito natural inhibidor de la vit. K (una naftoquinona -vit.K- 2,3 epóxido). Normalmente este epóxido es reducido a vit. K, pero en presencia de dicumarol, este inhibe la reductasa y por ende su reducción.

Signología clínica
Los signos son muy variados ya que dependen del lugar de asentamiento de las lesiones. Para la aparición de los primeros signos debe pasar un tiempo que va de 7 a 30 días desde el comienzo de la ingestión del tóxico. Esto depende del porcentaje de dicumarina contenido en el forraje y la cantidad que ingieren los animales. En el heno la cantidad de 0.0026% ya es nocivo, al igual que la ingestión de 2 mg/kg/día.
Las manifestaciones más comunes, sobre todo en terneros, son pérdida del estado general, melenas en materia fecal, rengueras y manqueras, éstas últimas por la ubicación de los hematomas en los miembros. Las muertes sin signos premonitorios son muy frecuentes. Pueden aparecer rinorragia y/o epistaxis, hemoptisis, hematuria, gastrorragia y enterorragia, con aparición de melena y/o disentería. La temperatura rectal está dentro de los límites normales.
Hay taquicardia y polipnea debido a la intensa anemia. A causa de ésto las mucosas presentan un color blanco porcelana. Se producen hemorragias copiosas en tejido subcutáneo y planos intermusculares, sobre todo en los lugares más expuestos a golpes. Estos hematomas producen dolores y molestias que en caso de estar ubicados en los miembros producen claudicaciones. Estos por lo general son visibles de forma tal que aumenta el tamaño del lugar que toman, a la palpación son fríos, casi indoloros y hay ausencia de crepitación.
En terneros que se alimentan a través de enrejados los hematomas aparecen en cabeza y cuello. En vacas de ordeñe suelen ser comunes los hematomas en tarsos (por efecto del maneado) y costillares (roces con bretes de ordeñe). Si dichos hematomas son superficiales se pueden hacer una punción exploratoria de la que fluirá sangre muy pálida, de este modo se confirmaría su diagnóstico.
Se pueden producir hemorragias alrededor de las vísceras provocando compresión y timpanismo. Las hemorragias también pueden producirse en cerebro con la consecuencia de signos nerviosos como paresia, ataxias, convulsiones y muertes. Las heridas accidentales o quirúrgicas producen hemorragias que pueden ser mortales. En vacas en lactancia la leche puede ser sanguinolenta (hemolactia por lactorragia).
La dicumarina atraviesa la barrera placentaria, presentándose nacimientos de animales con hemorragias fatales en encías y ombligos. Los terneros pueden morir asintomáticamente en los primeros días de vida o pueden presentar cualquiera de los variados signos descritos. Se ha comprobado que los recién nacidos son los más sensibles a la enfermedad y la misma puede ser causa importante de muertes perinatales.
Lesiones
Olor dulzón del cadáver. Intensa anemia, sangre muy acuosa, pálida que no coagula. Se comprueban hemorragias en cualquier parte del cuerpo, sobre todo en tejido subcutáneo, intermusculares, peritoneo, pericardio, cerebro, contenido intestinal, subcapsular en riñones.
Los órganos que no están afectados por hemorragias se presentan sumamente pálidos y exangües, especialmente los pulmones. El hígado tiene color ocre pálido.
Los terneros de pocos días pueden presentar cualquiera de las lesiones mencionadas; además en el ombligo muchas veces hay un hematoma globoso de 7-8 cm de diámetro.
Pruebas complementarias de diagnóstico
El recuento de glóbulos rojos suele llegar a 1.2 mill/ml. Son útiles la determinación de los tiempos de sangría, de coagulación y de protrombina los que se hallan aumentados.
- Tiempo de sangría normal: 2-4 minutos.
- Tiempo de coagulación normal: 3-10 minutos a 20ºC.
El tiempo de protrombina precede al de coagulación por lo tanto es una buena prueba pronóstica; el mismo se mide en segundos y los normales son: 28 en bovinos, 18 en equinos 16 en cerdos, gatos, ovinos y 10 en perros.
El tiempo de protrombina está dado por el tiempo de coagulación del plasma oxalatado tras agregarle una cantidad óptima de calcio (recalcificación) y trombo-quinasa. Cuanto menos protrombina hay en el plasma más lenta es la coagulación. La sangre para esta prueba debe ser recolectada en tubos que contengan 1 parte de citrato de sodio y 9 partes de sangre. La prueba debe hacerse rápidamente o bien guardarse la sangre refrigerada. El tiempo de protrombina está aumentado antes que aparezcan los signos clínicos.
Es bueno utilizar conejos para probar la inocuidad o no de un heno, alimentándolos exclusivamente con éste e ir verificando diariamente el tiempo de sangría (normal 2-4 minutos).
Diagnóstico diferencial
- Mancha en terneros: Esta cursa con hipertermia al comienzo, las tumefacciones son calientes, crepitantes; hay intensa toxemia. Lesiones oscuras con gas.
- Parasitosis gastrointestinales y coccidiosis en terneros: se pueden descartar por análisis coprológico, pero la mayoría de las veces suelen coexistir noxas y debemos evaluar quién es la causante de enfermedad.
- Lesiones traumáticas primarias se deben descartar cuando ocurren en un solo animal.
- Aflatoxinas, rubratoxinas, trichotecenos y stachybotris pueden producir síndromes hemorragíparos pero nunca de tanta magnitud.
- Intoxicación por rodenticidas a base de anticoagulantes (warfarinas y pindonas).
- Seneciosis en bovinos excepcionalmente puede provocar alteraciones hemorra-gíparas leves.
- Síndrome purpúrico trombopático.
- Síndrome purpúrico capilariopático.
Tratamiento
Como primera medida se debe suspender el heno tóxico. Los animales se deben manejar suavemente, sin golpes y evitando los traumatismos. El tratamiento adecuado es la administración de vitamina K en dosis masivas; no se justifica la administración de otro tipo de coagulantes debido a la falta de protrombina. La administración de vitamina K se debe realizar en dosis única de 400 mg en terneros, preferentemente por vía intravenosa y con aguja muy fina evitando traumas.
La vitamina K1 es superior a la menadiona (vitamina K3 sintética). La vitamina K comienza a invertir la hipoprotrombinemia rápidamente. Además se deben realizar transfusiones de sangre entera a razón de 10 ml/kg.p.v., debiendo repetirse si fueran necesario. Las transfusiones tienen un resultado espectacular no sólo en la reversión de los signos sino también en la reabsorción de los hematomas; las mismas son prioritarias en el tratamiento ya que reponen protrombina en forma inmediata y directa.
Profilaxis
El heno de trébol debe ser preparado en perfecto estado de desecación y bien conservado. Según algunas pruebas experimentales el trébol henificado tóxico administrado en 1 parte y 3 partes de otro heno no provocaría alteraciones; no obstante todas estas posibilidades varían según la cantidad de dicumarina presente.
ESPORIDESMINA (ECZEMA FACIAL)
Sinonimia
Intoxicación por Pithomices char-tarum. Intoxicación por el hongo de la pradera. Dermatitis facial.
Concepto
Es una dermatitis fotodinámica secundaria que ocurre bajo condiciones naturales en ovinos y bovinos, causada por un agente hepatotóxico, la esporidesmina, micotoxina presente en las esporas del hongo Pithomices chartarum, el cual aparece en otoños húmedos y cálidos en la cama de la pradera.
La enfermedad corresponde a una fotosensibilización secundaria o hepatógena, debido a que el agente fotodinámico (filoeritrina) llega a la sangre periférica a consecuencia de cambios patológicos que ocurren en el hígado.
Etiología
La esporidesmina es la micotoxina contenida en los esporos del hongo Pithomices chartarum. Este se halla formando colonias que pueden manifestarse macrocópicamente como polvo negruzco o manchas negras en las hojas de los vegetales, pero esta característica no siempre se ve y tampoco es exclusiva de este hongo.
Las especies vegetales que preferentemente son colonizadas son: Ray grass perenne (Lolium perenne), Trébol blanco (Trifolium repens), Trébol rojo (Trifolium indicus), diversas especies de Lotus, Paspalum y centeno; pero también pueden intervenir otros vegetales.
Epizootiología
Los esporos del hongo se encuentran entremezclados con el material vegetal muerto que se halla formando la cama de la pradera. El período de incubación desde la contaminación de la pastura hasta la esporulación, son generalmente, cuatro a cinco días.
El eczema facial ocurre en gran escala solamente cuando en el pasto abundan plantas y hojas recién muertas, durante tiempo húmedo y cálido, el cual favorece la invasión masiva por parte del hongo. Suele plantearse este problema en otoños, después de veranos cálidos y secos, con pastos prácticamente consumidos, cuando caen lluvias copiosas, sobre un terreno aún caliente.
Patogenia
La esporidesmina produce hepatitis tóxica aguda y obstrucción biliar con insuficiencia hepática grave que se manifiesta por pérdida del estado general, ictericia intra y posthepática y fotosensibilización secundaria o hepatógena.
Específicamente se produce una colangitis obstructiva que resulta de una hiperplasia de los conductos biliares, fibrosis y atrofia de las células hepáticas, causando un deterioro en la excreción de la filoeritrina y la bilirrubina. Por lo tanto esta inflamación resultante de los conductos biliares y la colangiolitis obliterante progresiva disminuye lentamente la velocidad del flujo biliar hasta niveles prácticamente despreciables al términos de 14 días.
La esporidesmina es excretada sin modificaciones en elevadas concentraciones por bilis y orina, produciéndose edema y hemorragia en la mucosa vesical y uretral. El agente fotodinámico es la filoeritrina, producto metabólico normal de la clorofila, que es retenida por los tejidos, debido a la dificultad de su excreción a través de los conductos biliares lesionados.
La frecuente observación de que tan sólo la parte izquierda del hígado se halla involucrada en el proceso se explica porque la toxina se deposita solamente en ciertas partes del hígado a favor del flujo laminar por el sistema porta. En el caso particular de los bovinos se sabe que la vena porta lleva sangre procedente del estómago, duodeno anterior, bazo y de la mayor parte del colon menor a su mitad izquierda, mientras que a la mitad derecha arriba sangre procedente de yeyuno e íleon (no sucede lo mismo en ovinos).
Signología clínica
La morbilidad es alta y la mortalidad puede llegar al 10%. La incidencia es mayor en vacas lecheras en producción ya que dichos animales ingieren mayor cantidad de alimento diariamente y lógicamente mayor cantidad de toxina.
Los animales afectados desarrollan toxicidad rápidamente. Los fenómenos fotosensibles aparecen unos diez días después de iniciada la ingestión. La enfermedad se caracteriza inicialmente por epíforas, irritabilidad, descarga nasal e intensa ictericia. Suele haber edema de párpados, papada y patas. La temperatura está aumentada. Hay taquicardia y disnea leve. Puede llegar a haber signos nerviosos que se manifiestan por excitación y agresividad.
El animal sacude la cabeza violentamente, hay repetidos signos de prurito y tenesmo urinario. La excitación se magnifica también por el intenso ardor cutáneo, a causa del cual los animales se tiran sobre alambrados, cocean objetos, se introducen en bebederos o charcos y mueven enérgicamente la cola. La vulva se presenta edematizada, con su mucosa de color naranja. La caquexia es frecuentemente observada debido a la insuficiencia hepática, seguida por la muerte en unos pocos días.
Cuando las afectadas son las vacas lecheras, ellas muestran primariamente una merma de su producción láctea; bajo una exposición moderada al sol los pezones y la ubre se tornan enrojecidos y pruriginosos, frecuentemente terminan con mastitis.
En su comienzo los animales se muestran excitados, se echan y se levantan, caminan trechos cortos y se echan nuevamente; realizan movimientos enérgicos de colas y orejas. Al segundo día se presenta un babeo considerable (ptialismo con sialorrea), presencia de mucus en los ollares y secreción seropurulenta en la conjuntiva; al tercer día aparece la inflamación de párpados y abundante secreción seropurulenta. El morro se presenta hiperstésico y muy congestivo, el animal se torna apático y con anafagia. La orina es oscura, Las mucosas están congestivas, edematosas e ictéricas, presentándose de color anaranjado. Las partes de piel despigmentadas son gravemente afectadas manifestándose con eritema, exudación (pelos aglutinados por un líquido seroso amarillento) y necrosis; al tacto se presenta engrosada, áspera y sin flexibilidad, luego comienza a desprenderse dejando cruentas zonas sangrantes. Se presenta a veces claudicaciones con infosura en animales muy afectados.
En ovinos los signos preliminares son rápidamente seguidos (24 horas después) por edema de orejas, párpado y cara, frecuentemente también hay edema de corona, parte medial de miembros posteriores y vulva. La dermatitis puede desarrollarse sobre áreas dérmicas no protegidas por lana, con formación de vesículas y exudación de suero. A los pocos días las áreas afectadas se vuelven necróticas y costrosas, también se desarrolla ictericia. La eliminación de la toxina por orina puede ser causa de cistitis y uretritis que se manifiesta con polaquiuria, signo que va a preceder a la fotosensibilización. Así también puede ocurrir diarrea.
La toxina no se elimina por leche. Importante son también los efectos que producen bajos niveles de esporidesmina que no alcanzan para producir fotosensibilización, pero la hepatotoxicidad leve es causa de descenso en la producción láctea, infertilidad, abortos y mastitis. Incluso estas alteraciones la pueden sufrir los animales luego de pasado el período agudo de la enfermedad, debido a las lesiones hepáticas residuales. Estos hígados recuperan en gran parte su funcionamiento con la formación de nuevas células hepáticas, pero frente a estrés como por ejemplo el parto, pueden estas vacas sufrir graves alteraciones y hasta muerte por insuficiencia hepática aguda.
Lesiones
Macroscópicamente se presenta una dermatitis de aspecto hemorrágico en morro, párpados, pliegue ano caudal, glándula mamaria y borde de pezuñas; termina con descamación y grandes zonas de necrosis de piel en la partes blancas de la misma. Son más severamente afectadas las razas Holando y Hereford, mientras que las razas de pelaje colorado o negro (Shorton y A. Angus) se afectan con menos intensidad y sólo se pueden presentar lesiones en ollares, párpados, orejas y vulva, como así también algunos casos en la periferia de la marca a fuego. Hay ictericia en cavidad abdominal.
El hígado se presenta hipertrofiado, con sus bordes redondeados, finamente moteado, con la coloración amarilla verdosa por retención de los pigmentos biliares. Se halla afectada preferentemente la parte izquierda. La vesícula biliar presenta congestión de mucosa y edema de submucosa; puede estar distendida por bilis normal o mezclada con mucina (blanquecina).
Los riñones están oscuros y con lesiones graves, hay inflamación de tipo necrotizante en uréteres y vejiga. La orina es de color amarillo oscuro. Es frecuente observar esplecnomegalia.
Microscópicamente en hígado hay lesiones de colangiolitis y colangiohepatitis aguda con mínima reacción leucocitaria; los tractos portales se hallan engrosados por tejidos fibrosos y por la activa hiperplasia de los conductos neoformados que siguen el proceso para la recanalización de los conductos ocluidos. Hay cierto grado de necrosis de los hepatocitos, con fibrosis perilobulillar, obliteración de los conductos biliares y atrofia de las células hepáticas por presión. Hay hiperplasia cortical de las adrenales y aparición de placas escleróticas en la íntima de las arterias, venas y linfáticos del hilio hepático. Se observa bilis en los túbulos renales. Vacuolización esponjosa del tejido encefálico.
Pruebas complementarias de diagnóstico
La bilirrubina total esta aumentada a 1-2 mgr/100 ml (Normal 0.30 mgr/100 ml). También se produce elevación de las enzimas hepáticas: sorbitol deshidrogenasa (SD) (normal 0-5 U.I./ml), arginasa (normal 0.1-1.8 U.I./ml) y ornitina de carbamiltransferasa (OCT) (normal 1.1 U.I./ml). También la transaminasa glutamioxalacética (GOT) o AST pueden estar elevadas. Pero sumamente específica de los conductos biliares es la elevación de la gama glutamil tranpeptidasa (GGT) (normal 5 U.I./100 ml) cuya elevación nos indica en forma bastante certera una coléstasis intrahepática.
Frente a la sospecha de Pithomices chartarum debemos buscar esporas en los tallos y hojas muertas que constituyen la cama de la pastura que es donde suelen desarrollarse. Se debe recolectar este material para investigarlo en el laboratorio de la siguiente manera:
- A una pequeña porción del mismo colocada en un tubo de ensayo se le agrega agua y una gota de detergente, luego se agita, se filtra (con colador) y se centrifuga.
- Se observa el centrifugado con 400 aumentos. Las esporas tienen forma de barril o granada de mano con septas transversales y longitudinales; miden entre 15-45 micras de longitud por 8-18 micras de ancho. Las septas transversales suelen ser 1-3 y las longitudinales 0-2. Hay esporas semejantes como la Alternaria con forma de pera y estriaciones transversales y longitudinales; y otras en forma de barril pero sin estas tabicaciones.
El método para contar esporas modificado por F. Riet Alvariza consta de lo siguiente:
- 1 gr de pasto seco al que se le agrega 50 ml de agua destilada y una gota de detergente. Se agita y se filtra.
- Se centrifuga 10 minutos a 2,500 r.p.m.
- Se quita el sobrenadante hasta que quedan 10 ml.
- Se agitan estos 10 ml y con el mismo se carga una cámara cuenta glóbulos blancos.
- Se comienza el conteo, cada espora encontrada en el cuadrado compuesto por 16 cuadraditos corresponde a 100,000 esporas por gr de pasto seco.
- En cada llenada de cámara se cuentan los cuatro grandes cuadrados (compuestos cada uno por 16 cuadraditos) y se anota el número de esporas encontradas en cada uno de los grandes cuadrados. Esta operación se realiza tres veces (llenado de cámara) por lo tanto al final de la misma habremos contado 12 grandes cuadrados. Sumamos el número de esporas encontradas en los mismos y dividimos por 12 (número de cuadrados contados y luego lo multiplicamos por 100,000 (1 espora es igual a 100,000 esporas por gr de pasto).
Cifras superiores a 100,000 esporas por gr de pasto son peligrosas y debe evitarse que los animales pastoreen en ese potrero.
Diagnóstico diferencial
- Fotosensibilización por otras etiologías que si es primaria no habrá ictericia, compromiso hepático, ni serán tan graves los signos y lesiones.
- Quemaduras.
- Sarna, piojos, dermatomicosis, dermato-fitosis, dermatofilosis, e hiperqueratosis (todas de evolución crónica).
- Aftosa: las vesículas en pezones y espacio interdigital son importantes.
- Bo-co-pa: hay lesiones gangrenosas en extremidades.
Pronóstico
Reservado.
Tratamiento
El tratamiento sobre hígado no tiene muchas posibilidades de éxito debido a la intensa lesión que se produce. La aplicación de glucosa y metionina ayudan a la evolución favorable.
Para las lesiones dérmicas ver fotosensibilización.
Profilaxis
Se han utilizado las fumigaciones de los potreros con tiabendazoles destruyendo los esporos de Pithomices chartarum con éxito, pero resulta muy caro este procedimiento.
En ovinos se realizaron ensayos con la administración de sales de zinc en dosis bastante elevadas, las que protegieron a los tejidos de los efectos de la hepatotoxina, pero dichas dosis de zinc estuvieron muy cerca de llento) y necrosis; al tacto se presenta engrosada, áspera y sin flexibilidad, luego comienza a desprenderse dejando cruentas zonas sangrantes. Se presenta a veces claudicaciones con infosura en animales muy afectados.
En ovinos los signos preliminares son rápidamente seguidos (24 horas después) por edema de orejas, párpado y cara, frecuentemente también hay edema de corona, parte medial de miembros posteriores y vulva. La dermatitis puede desarrollarse sobre áreas dérmicas no protegidas por lana, con formación de vesículas y exudación de suero. A los pocos días las áreas afectadas se vuelven necróticas y costrosas, también se desarrolla ictericia. La eliminación de la toxina por orina puede ser causa de cistitis y uretritis que se manifiesta con polaquiuria, signo que va a preceder a la fotosensibilización. Así también puede ocurrir diarrea.
La toxina no se elimina por leche. Importante son también los efectos que producen bajos niveles de esporidesmina que no alcanzan para producir fotosensibilización, pero la hepatotoxicidad leve es causa de descenso en la producción láctea, infertilidad, abortos y mastitis. Incluso estas alteraciones la pueden sufrir los animales luego de pasado el período agudo de la enfermedad, debido a las lesiones hepáticas residuales. Estos hígados recuperan en gran parte su funcionamiento con la formación de nuevas células hepáticas, pero frente a estrés como por ejemplo el parto, pueden estas vacas sufrir graves alteraciones y hasta muerte por insuficiencia hepática aguda.
Lesiones
Macroscópicamente se presenta una dermatitis de aspecto hemorrágico en morro, párpados, pliegue ano caudal, glándula mamaria y borde de pezuñas; termina con descamación y grandes zonas de necrosis de piel en la partes blancas de la misma. Son más severamente afectadas las razas Holando y Hereford, mientras que las razas de pelaje colorado o negro (Shorton y A. Angus) se afectan con menos intensidad y sólo se pueden presentar lesiones en ollares, párpados, orejas y vulva, como así también algunos casos en la periferia de la marca a fuego. Hay ictericia en cavidad abdominal.
El hígado se presenta hipertrofiado, con sus bordes redondeados, finamente moteado, con la coloración amarilla verdosa por retención de los pigmentos biliares. Se halla afectada preferentemente la parte izquierda. La vesícula biliar presenta congestión de mucosa y edema de submucosa; puede estar distendida por bilis normal o mezclada con mucina (blanquecina).
Los riñones están oscuros y con lesiones graves, hay inflamación de tipo necrotizante en uréteres y vejiga. La orina es de color amarillo oscuro. Es frecuente observar esplecnomegalia.
Microscópicamente en hígado hay lesiones de colangiolitis y colangiohepatitis aguda con mínima reacción leucocitaria; los tractos portales se hallan engrosados por tejidos fibrosos y por la activa hiperplasia de los conductos neoformados que siguen el proceso para la recanalización de los conductos ocluidos. Hay cierto grado de necrosis de los hepatocitos, con fibrosis perilobulillar, obliteración de los conductos biliares y atrofia de las células hepáticas por presión. Hay hiperplasia cortical de las adrenales y aparición de placas escleróticas en la íntima de las arterias, venas y linfáticos del hilio hepático. Se observa bilis en los túbulos renales. Vacuolización esponjosa del tejido encefálico.
Pruebas complementarias de diagnóstico
La bilirrubina total esta aumentada a 1-2 mgr/100 ml (Normal 0.30 mgr/100 ml). También se produce elevación de las enzimas hepáticas: sorbitol deshidrogenasa (SD) (normal 0-5 U.I./ml), arginasa (normal 0.1-1.8 U.I./ml) y ornitina de carbamiltransferasa (OCT) (normal 1.1 U.I./ml). También la transaminasa glutamioxalacética (GOT) o AST pueden estar elevadas. Pero sumamente específica de los conductos biliares es la elevación de la gama glutamil tranpeptidasa (GGT) (normal 5 U.I./100 ml) cuya elevación nos indica en forma bastante certera una coléstasis intrahepática.
Frente a la sospecha de Pithomices chartarum debemos buscar esporas en los tallos y hojas muertas que constituyen la cama de la pastura que es donde suelen desarrollarse. Se debe recolectar este material para investigarlo en el laboratorio de la siguiente manera:
- A una pequeña porción del mismo colocada en un tubo de ensayo se le agrega agua y una gota de detergente, luego se agita, se filtra (con colador) y se centrifuga.
- Se observa el centrifugado con 400 aumentos. Las esporas tienen forma de barril o granada de mano con septas transversales y longitudinales; miden entre 15-45 micras de longitud por 8-18 micras de ancho. Las septas transversales suelen ser 1-3 y las longitudinales 0-2. Hay esporas semejantes como la Alternaria con forma de pera y estriaciones transversales y longitudinales; y otras en forma de barril pero sin estas tabicaciones.
El método para contar esporas modificado por F. Riet Alvariza consta de lo siguiente:
- 1 gr de pasto seco al que se le agrega 50 ml de agua destilada y una gota de detergente. Se agita y se filtra.
- Se centrifuga 10 minutos a 2,500 r.p.m.
- Se quita el sobrenadante hasta que quedan 10 ml.
- Se agitan estos 10 ml y con el mismo se carga una cámara cuenta glóbulos blancos.
- Se comienza el conteo, cada espora encontrada en el cuadrado compuesto por 16 cuadraditos corresponde a 100,000 esporas por gr de pasto seco.
- En cada llenada de cámara se cuentan los cuatro grandes cuadrados (compuestos cada uno por 16 cuadraditos) y se anota el número de esporas encontradas en cada uno de los grandes cuadrados. Esta operación se realiza tres veces (llenado de cámara) por lo tanto al final de la misma habremos contado 12 grandes cuadrados. Sumamos el número de esporas encontradas en los mismos y dividimos por 12 (número de cuadrados contados y luego lo multiplicamos por 100,000 (1 espora es igual a 100,000 esporas por gr de pasto).
Cifras superiores a 100,000 esporas por gr de pasto son peligrosas y debe evitarse que los animales pastoreen en ese potrero.
Diagnóstico diferencial
- Fotosensibilización por otras etiologías que si es primaria no habrá ictericia, compromiso hepático, ni serán tan graves los signos y lesiones.
- Quemaduras.
- Sarna, piojos, dermatomicosis, dermato-fitosis, dermatofilosis, e hiperqueratosis (todas de evolución crónica).
- Aftosa: las vesículas en pezones y espacio interdigital son importantes.
- Bo-co-pa: hay lesiones gangrenosas en extremidades.
Pronóstico
Reservado.
Tratamiento
El tratamiento sobre hígado no tiene muchas posibilidades de éxito debido a la intensa lesión que se produce. La aplicación de glucosa y metionina ayudan a la evolución favorable.
Para las lesiones dérmicas ver fotosensibilización.
Profilaxis
Se han utilizado las fumigaciones de los potreros con tiabendazoles destruyendo los esporos de Pithomices chartarum con éxito, pero resulta muy caro este procedimiento.
En ovinos se realizaron ensayos con la administración de sales de zinc en dosis bastante elevadas, las que protegieron a los tejidos de los efectos de la hepatotoxina, pero dichas dosis de zinc estuvieron muy cerca de la dosis tóxica, razón por la cual es motivo de mayores estudios.
Muy práctico sería el recuento de esporas en épocas peligrosas. También el manejo de los potreros contaminados es un tema muy importante, ya que los esporos de Pithomices se hallan en la cama de la pradera, por lo tanto hay que manejar la misma de tal manera que los animales coman la parte superior de la pastura evitando de este modo la ingestión de esporas.
LITERATURA CITADA
1. Blood-Radostits. 1992. Medicina Veterinaria. 7º edición. Editorial Interamericana. México DF.
2. Booth-Mc. Donald. 1987. Farmacología y terapeútica veterinaria. 1º edición. Editorial Acribia. Zaragoza.
3. Crump. 1973. Slafranine Toxicosis (Slobber factor). Journal of the Americ Veterinary Medicine. Col. 163. Nº 11.
4. Jones-Hunt. 1983. Patología Veterinaria. Editorial Hemisferio Sur. Buenos Aires.
5. Riet Alvariza et al., 1977. Fotosen-sibilización hepatógena producida por el hongo de la pradera Pithomices chartarum. Actas V Jornadas Uruguayas de Buiatría. Paysandú. Uruguay.
6. Riet Alvariza et al., 1986. Cuadro tremorígeno en bovinos producido por hongos del género Aspergillus y Penicillum productores de Patulina aislados en un polvo de deshecho de molienda de malta. Actas XIV Jornadas Uruguayas de Buiatría. Paysandú. Uruguay.
7. Riet Alvariza et al., 1987. Micotoxicosis asociada a tallarín de remolacha. Actas XV Jornadas Uruguayas de Buiatría. Paysandú. Uruguay.
8. Rodríguez Armesto. 1989. Intoxicación por Amaranthus quitensis en vaquillonas Holando Argentino. Veterinaria Argentina nº 60.
9. Rosemberger et al., 1983. Enfermedades de los bovinos. Editorial Hemisferio Sur. Buenos Aires.
10. Sigmund et al. 1981. El Manual Merck de veterinaria. Editorial Merck.
11. Smith-Moss. 1985. Micotoxins, formation, analysis and significance. Greant Britain.
12. Towers. 1994. Micotoxinas del Fusarium en la explotación pastoril; zearalenona e infertilidad en ovinos y bovinos. XXII Jornadas Uruguayas de Buiatría. Paysandú. Uruguay.