Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.1 Lima ene./mar. 2019
http://dx.doi.org/10.15381/rivep.v30i1.15688
COMUNICACIÓN
Evaluación ultrasonográfica en ganado Brown Swiss sometido a un protocolo de sincronización de celo en el altiplano peruano
Ultrasonographic evaluation in Brown Swiss cattle subjected to a heat synchronization protocol in the Peruvian highlands
Uri Pérez G.1, Yesenia Quispe B.1, Natalio Luque M.2, Rolando Rojas E.2, Eloy Condori C.2, Alfredo Delgado C.3, Manuel Pérez D.4
1 Estación El Mantaro, Centro de Investigación IVITA, Universidad Nacional Mayor de San Marcos, Huancayo, Perú
2 Laboratorio de Sanidad Animal, CIP Chuquibambilla, Universidad Nacional del Altiplano, Puno, Perú
3 Clínica de Animales Mayores, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
4 Laboratorio de Reproducción Animal, Universidad Nacional del Altiplano, Puno, Perú
5 E-mail: harguer19@hotmail.com
RESUMEN
Se evaluó la dinámica folicular mediante ultrasonografía en animales Brown Swiss sometidos a un protocolo de sincronización de celo con progestágenos en el altiplano peruano. Se utilizaron 27 hembras Brown Swiss distribuidas en tres grupos de nueve animales, según su estado fisiológico: vacas en producción (<120 y >260 días de lactancia) y vaquillas. Para la sincronización, en el día 0 se aplicó el dispositivo intravaginal a base de progesterona y se inyectó 2 mg benzoato de estradiol, en el día 8 se extrajo el dispositivo y se aplicó 0.15 mg cloprostenol y 400 UI eCG, y en el día 10 se aplicó 1.05 mg GnRH. La inseminación artificial a tiempo fijo se hizo 12 h después de la aplicación del GnRH. La evaluación ecográfica se hizo los días 8 y 10 para determinar la tasa de crecimiento y diámetro máximo del folículo dominante en los tres grupos. La tasa de crecimiento folicular fue de 2.3 ± 1.5, 2.4 ± 1.8 y 2.3 ± 1.8 mm/día para los grupos de vacas en producción (<120 y >260 días de lactancia) y vaquillas, sin diferencia significativa entre grupos. El diámetro del folículo dominante fue de 14.5 ± 2.1 mm en vacas con <120 días de lactancia, 16.6 ± 3.1 mm en vacas con >260 días de lactancia y 12.1 ± 2.0 mm en vaquillas, siendo significativamente menor en vaquillas (p<0.05). La tasa de preñez fue de 44.4, 33.3 y 66.7% para vacas en <120 días y >260 días de lactancia y vaquillas, respectivamente, sin diferencia significativa entre grupos.
Palabras clave: folículo; preñez; anestro; estradiol; ultrasonografía
ABSTRACT
The follicular dynamics was evaluated by ultrasonography in Brown Swiss cattle subjected to a protocol of synchronization of estrus with progestogens in the Peruvian highlands. Three groups of Brown Swiss cattle of nine females each were evaluated. The groups were: lactating cows (<120 and >260 days in milk) and heifers. For synchronization, on day 0 a progesterone-based intravaginal device was applied, and 2 mg estradiol benzoate was injected, on day 8 the device was removed and 0.15 mg cloprostenol and 400 IU eCG were applied, and on day 10 1.05 mg GnRH was applied.Artificial insemination at fixed time was done 12 h after the application of GnRH. The ultrasound evaluation was done on days 8 and 10 to determine the growth rate and maximum diameter of the dominant follicle in the three groups. The follicular growth rate was 2.3 ± 1.5, 2.4 ± 1.8 and 2.3 ± 1.8 mm/day for the groups of lactating cows (<120 and >260 days in milk) and heifers, without significant difference between groups. The diameter of the dominant follicle was 14.5 ± 2.1 mm and 16.6 ± 3.1 mm in lactating cows (<120 and >260 days in milk, respectively) and 12.1 ± 2.0 mm in heifers, being significantly lower in heifers (p<0.05). The pregnancy rate was 44.4, 33.3 and 66.7% for lactating cows (<120 days, >260 days in milk) and heifers, respectively without significant difference between groups.
Key words: follicle; pregnancy; anestrus; estradiol; ultrasonography
INTRODUCCIÓN
La mayor población de ganado vacuno en el Perú se concentra en la Sierra, con un predominio de bovinos criollos, mayormente a nivel de comunidades y pequeños productores, seguidos por la raza Brown Swiss, en tenencia de pequeños y medianos productores y empresas. La zona de Puno se ubicó en 2014 en el cuarto lugar en producción de leche a nivel nacional con 7.5% por detrás de Arequipa, Cajamarca y Lima (MINAGRI, 2014).
Los protocolos de inseminación artificial a tiempo fijo (IATF) que sincronizan el crecimiento del folículo, regresión del cuerpo lúteo (CL) y la ovulación resultan en un mejor desempeño reproductivo, porque todos los animales son inseminados sin necesidad de detectar el celo (Colazo y Mapletoft, 2017). Por otro lado, el uso de la ultrasonografía como ayuda diagnóstica para el manejo reproductivo del ganado lechero se ha vuelto muy apreciada por los profesionales del ramo, ya que permite una mejor apreciación de la actividad ovárica, incluyendo la dinámica de las ondas foliculares y el desarrollo del cuerpo lúteo, así como un diagnóstico temprano de gestación, entre otros usos (Tamayo, 2002).
La altitud y el clima pueden influenciar la fisiología reproductiva de las vacas. La hipoxia induce la apoptosis en muchos tipos celulares, incluidas las células ováricas. Un ambiente hipóxico es directamente proporcional a la concentración de oxígeno en la arteria ovárica, por tanto, la exposición a un ambiente hipóxico conllevaría a hipoxemia ovárica (Lund et al., 1999; Nishimura et al., 2008) y, consecuentemente, se afectaría la dinámica folicular. El propósito del presente trabajo fue evaluar la dinámica folicular mediante ultrasonografía en hembras Brown Swiss sometidas a un protocolo de sincronización de celo con progestágenos en el altiplano peruano.
MATERIALES Y MÉTODOS
Lugar de Estudio y Animales
El estudio se realizó entre setiembre y noviembre de 2016 en el Centro de Investigación y Producción (CIP) Chuquibambilla de la Universidad Nacional delAltiplano, ubicado a una altitud de 3974 m. La zona presenta un clima templado-frío la mayor parte del año.
Se seleccionaron 27 hembras Brown Swiss vacías, evaluadas mediante examen ginecológico incluyendo ecografía reproductiva. Los animales fueron distribuidos en tres grupos de nueve animales según su estado fisiológico: a) vacas con menos de 120 días de lactancia (1.8 servicios registrados en promedio), b) vacas con más de 260 días de producción (producción láctea <3 kg/día y con problemas aparentes de fertilidad [más de tres servicios) y c) vaquillas (16-19 meses). Las vacas se encontraban entre 2 y 4 partos, con una condición corporal (CC) de 2.5 a 3 (escala 1-5). Todos los animales fueron mantenidos sobre pastos cultivados durante siete horas al día, suplementados con ensilado (excepto el grupo de vacas con más de 260 días de lactancia) durante la mañana y la tarde (aproximadamente 6 kg por animal), y con acceso libre al agua.
Protocolo de Sincronización de Celo
Se utilizó un protocolo de sincronización de celo con base a progestágenos y gonadotropina coriónica equina (eCG) (Bryan et al., 2010), el cual considera los siguientes pasos:
- Día 0: aplicación de benzoato de estradiol (BE: Estrovet®, Montana) 2 mg y colocación del dispositivo intravaginalbovino(DIB:DIB®, Syntex), que contiene 1 g de progesterona.
- Día 8: aplicación de un análogo de prostaglandina F2á (Cloprostenol [PG]: Prostal®, Over) 0.15 mg y eCG dosis de 400 UI (Novormon® 5000, Syntex), por vía intramuscular profunda. Remoción del DIB.
- Día 10: aplicación de un análogo de la hormona liberadora de gonadotropinas (acetato de buserelina [GnRH]: Gestar®, Over) 1.05 mg, por vía intramuscular profunda. La IA se hizo 12 horas después.
Se utilizó semen congelado importado (de una sola empresa y del mismo reproductor) para evitar la variabilidad en la calidad espermática y en la concentración de espermatozoides.
Evaluación Ultrasonográfica
Se utilizó un ecógrafo Chison D600 VET con un transductor rectal a una frecuencia de 7.0 MHz. Las actividades realizadas fueron:
- Día 0: Se determinó la funcionalidad ovárica, clasificando a los animales según el estado ovárico y se inició el protocolo de sincronización (Menchaca et al., 2013).
- Día 8: Se determinó el diámetro del folículo dominante (FD).
- Día 10: Se repitió la medición del FD para obtener su tasa de crecimiento (mm/día), por diferencia entre el tamaño del día 10 y día 8.
Se realizó una ecografía adicional a los 45 días del IATF para determinar la preñez observando la presencia o ausencia del feto.
Análisis Estadístico
Se hizo estadística descriptiva (promedio, desviación estándar). Los datos del estado ovárico y tasas de preñez según clase animal fueron sometidos a la prueba no paramétrica de Kruskal-Wallis. La comparación de variables respuestas (tasa de crecimiento, diámetro máximo del FD) fue sometida a un análisis de varianza y para determinar las diferencias de medias fue utilizada la prueba de Duncan. Todos los datos fueron procesados con un nivel de α=0.05, empleando el programa estadístico R 3.4.4.
RESULTADOS Y DISCUSIÓN
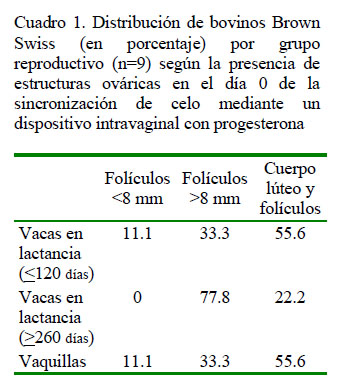
El Cuadro 1 muestra el porcentaje de vacas en producción (<120 y >260 días) y de vaquillas con presencia de folículos <8 mm (anestro profundo), folículos >8 mm (anestro superficial) y presencia de cuerpo lúteo (CL; vacas ciclando). No se observó diferencias significativas entre los tres grupos (p=0.5167).
La menor presencia de cuerpos lúteos en vacas con >260 días en lactanción pudo deberse a que no recibían el ensilado como suplemento alimenticio (Murphy et al., 1990). Armendano et al. (2015) reportan un mayor porcentaje de vacas con anestro superficial posiblemente debido a que su estudio fue con razas cárnicas (Hereford y Angus) con cría al pie, lo cual favorece un incremento del anestro posparto debido al efecto negativo en la liberación de LH, afectando la maduración y ovulación del folículo dominante (Bó y Cutaia, 2005). Por otro lado, Menchaca et al. (2005) encontró 63% de ciclicidad en vaquillas de razas lecheras.
El Cuadro 2 muestra la tasa de crecimiento del FD entre los días 8 y 10 de iniciado el protocolo de sincronización de celo, así como el diámetro folicular el día de la IATF (Día 10). Se observa un crecimiento positivo de los FD en los tres grupos debido, posiblemente, al aumento de receptores a FSH en las células de la granulosa, además de la secreción de la activina (hacia el propio FD) e inhibina (acción hacia los demás folículos de la cohorte) por parte de los FD (Ginther et al., 1996). El DIB produce una retroalimentación negativa que permite una sincronización adecuada de la onda folicular y de la ovulación (Vasconcelos et al., 2001).
Las tasas de crecimiento fueron similares a los valores de 2.19 ± 1.13 mm en vacas y de 1.93 ± 1.13 mm en vaquillas Brown Swiss reportados por Pérez et al. (2016).
El diámetro del FD fue menor en el grupo de vaquillas en comparación con los dos grupos de vacas en producción (Cuadro 2). Los FD de menor tamaño encontrados en vaquillas podrían estar relacionados a menores concentraciones de FSH (Wolfenson et al., 2004), como también por la mayor concentración de progesterona que estaría afectando la secreción pulsátil de LH (Kinder et al., 1996). Todos los FD deben tener capacidad ovulatoria, la cual se traduce en una mayor expresión del ARNm receptor de LH en células de la granulosa (Perry, 2017). El diámetro de los FD, tanto en vacas como en vaquillas, fue similar al obtenido por Quispe et al. (2013) con vacas Brown Swiss, así como con los resultados del estudio de Pérez et al. (2016).
La tasa de preñez fue de 44.4, 33.3 y 66.7% para vacas en producción (<120 días), vacas en producción (>260 días) y vaquillas, respectivamente. Mendoza et al. (2013) obtuvo, en forma similar, 37.6, 44.7 y 55.2% de preñez en hembras Holstein, Brown Swiss y criollas sincronizadas con progestágenos y eCG en zonas de 3500-3700 m de altitud.Así mismo. Gutiérrez-Reinoso et al. (2016) reportaron 40-60% de preñez en 40 vacas Holstein a una altitud de 3173 m, también sincronizadas con dispositivos intravaginales con progestágenos.
Agradecimientos
Al Laboratorio de Biotecnología de la Reproducción y al Instituto de Investigación de Bovinos y Ovinos de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional del Altiplano.
LITERATURA CITADA
1. Armendano JI, Gonzáles S, Uslenghi G, Cabodevila J, Callejas SS. 2015. Efecto de la sal de estradiol, estatus ovárico y condición corporal sobre el porcentaje de preñez en vacas con cría IATF. Rev Vet 26: 108-112. [ Links ]
2. Bó GA, Cutaia L. 2005. Estrategias para incrementar la preñez en vacas en anestro. En: González-Stagnaro C, Soto- Belloso E (eds). Manual de ganadería doble propósito. Maracaibo, Venezuela: Astro-Data. p 464-470. [ Links ]
3. Bryan MA, Bó GA, Heuer C, Emslie FR. 2010. Use of equine chorionic gonadotrophin in synchronised AI of seasonal-breeding, pasture-based, anoestrous dairy cattle. Reprod Fert Develop 22: 126-131. doi: 10.1071/ RD09225 [ Links ]
4. Colazo G, Mapletoft R. 2017. Programas de IA a tiempo fijo en ganado de carne y lechero en Canadá. En: XII Simposio Internacional de Reproducción Animal, IRAC. Córdoba, Argentina. [ Links ]
5. Ginther OJ, Wiltbank MC, Fricke PM, Gibbons JR, Kot K. 1996. Selection of the dominant follicle in cattle. Biol Reprod 55: 1187-1194. [ Links ]
6. Gutiérrez-Reinoso MA, Collaguazo- Gómez VM, García-Herreros M. 2016. Aplicación de GnRH exógenaa post IATF y su efecto en los niveles séricos de progesterona y tasa de gestación en vacas lechera primíparas en ambientes de altitud elevada. Spermova 6: 148-152. doi: 10.18548/aspe/0004.13 [ Links ]
7. Kinder JE, Kojima FN, Bergfeld EG, Wehrman ME, Fike KE. 1996. Progestin and estrogen regulation of pulsatile LH release and development of persistent ovarian follicles in cattle. J Anim Sci 74: 1424-1440. [ Links ]
8. Lund SA, Murdoch J, Van Kirk EA, Murdoch WJ. 1999. Mitogenic and antioxidant mechanisms of estradiol action in preovulatory ovine follicles: relevance to luteal function. Biol Reprod 61: 388-392. doi: 10.1095/biolreprod61.2.388 [ Links ]
9. Menchaca A, de Castro T, Chifflet N, Alvarez M. 2005. Uso combinado de IATF y destete precoz en vacas de cría en anestro postparto. En: XXXIII Jornadas de Buiatría. Paisandú, Uruguay. [ Links ]
10. Menchaca A, Nuñez R, Wijma R, García C, Fabini F, de Castro T. 2013. Como mejorar la fertilidad de los tratamientos de IATF en vacas Bos taurus. En: X Simposio Internacional de Reproducción Animal, IRAC. Córdoba, Argentina. [ Links ]
11. Mendoza J, Lanatta R, López J, Narvaez O, Sangay F, Rodriguez A, Cerquín G, et al. 2013. Eficacia de un protocolo de sincronización de celo en vacas criadas sobre los 3200 msnm en las provincias de Cajamarca, Celendín y Hualgayoc. Spermova 3: 49-50. [ Links ]
12. [MINAGRI] Ministerio de Agricultura y Riego. 2014. Valor bruto de la producción agropecuaria. Oficina de estudios económicos y estadísticos – OEE. [Internet]. Disponible en: http:// minagri.gob.pe/portal/download/pdf [ Links ]
13. Murphy MG, Boland MP, Roche JF. 1990. Patterns of follicular growth and resumption of ovarian activity in postpartum beef suckled cows. J Reprod Fertil 90: 523-533. doi: 10.1530/ jrf.0.0900523 [ Links ]
14. Nishimura R, Komiyama J, Tasaki Y, Acosta TJ, Okuda K. 2008. Hypoxia promotes luteal cell death in bovine corpus luteum. Biol Reprod 78: 529-536. doi: 10.1095/biolreprod.107.063370 [ Links ]
15. Pérez U, Pfuño M, Pérez, M, Zevallos J, Luque N, Alencastre R. 2016. Comparison ultrasonographic of dynamics follicular and corpus luteum in cows and heifers subjected to a estrus synchronization protocol. In: Proc VI Congress Animal Reproduction. Arequipa-Perú [ Links ].
16. Perry GA. 2017. Efecto de la madurez folicular sobre el establecimiento de la preñez en vacas. En: XII Simposio internacional de Reproducción Animal – IRAC. Córdoba, Argentina. [ Links ]
17. Quispe A, Quispe Y, Pérez U, Luque N, Pérez M. 2013. Estudio ultrasonográfico de la dinámica folicular en vacas Brown Swiss en el altiplano peruano. Spermova 3: 63-64. [ Links ]
18. Tamayo M. 2002. La ecografía como medio diagnóstico y evaluación de los procesos reproductivos en el bovino. La Habana, Cuba: Facultad de Medicina Veterinaria. Universidad Agraria de la Habana. 12 p. [ Links ]
19. Vasconcelos JL, Sartori R, Oliveira HN, Guenther JG, Wiltbank MC. 2001. Reduction in size of the ovulatory follicle reduces subsequent luteal size and pregnancy rate. Theriogenology 56: 307-314. doi: 10.1016/S0093-691X(01)00565-9 [ Links ]
20. Wolfenson D, Inbar G, Roth Z, Kaim M, Bloch A, Braw-Tal R. 2004. Follicular dynamics and concentrations of steroids and gonadotropins in lactating cows and nulliparous heifers. Theriogenology 62: 1042-1055. doi: 10.1016/ j.theriogenology.2003.12.020 [ Links ]
Recibido: 4 de junio de 2018
Aceptado para publicación: 5 de noviembre de 2018